首页 > 医疗资讯/ 正文
穿透性口皮瘘或口咽瘘(POFs)是口腔或口咽重建失败后出现的严重并发症,由于缺乏支持性组织、唾液和咀嚼食物的污染以及动态的口腔环境,这些瘘管的治疗仍然是复杂的临床挑战。在这里,同济大学王启刚、吴青&上海交通大学医学院秦兴军介绍了一种通过简便的表面酶引发聚合(SEIP)方法制造的具有不对称功能的Janus水凝胶粘合剂(JHA),它能够自捕获表面水和血液,在原位形成的水凝胶层(RL)中有效地桥接生物组织,并与支持性水凝胶(SL)一起,实现卓越的湿粘附和无缝伤口堵塞。坚韧的SL水凝胶与RL互锁,分散能量以承受连续口腔运动如咀嚼和吞咽的外部机械刺激,从而减少应力诱导的损伤。在雄性新西兰兔POF模型中,JHA显示出强大的粘附和密封性,并且在正常饮食下超过3天保持牢固的密封,没有任何减少的迹象。12天后,皮肤和粘膜伤口均实现了完全闭合,其机械强度与正常组织相当。在雄性比格犬POF模型中也确认了类似的治疗效果。因此,提出的JHA水凝胶在深层伤口密封和提供机械支持以协助穿透性瘘管和其他损伤的愈合方面显示出巨大的潜力。该研究以题为“Surface enzyme-polymerization endows Janus hydrogel tough adhesion and regenerative repair in penetrating orocutaneous fistulas”的论文发表在《Nature Communications》上。

图1展示了Janus水凝胶粘合剂(JHA)的制备过程、表面酶引发聚合(SEIP)形成机制以及在穿透性口皮瘘(POF)伤口修复中的应用。该图阐释了JHA如何在伤口表面通过SEIP方法原位形成一个新的水凝胶层(RL),与坚韧的支持层水凝胶(SL)互锁,以实现强大的湿粘附和密封效果。因此,JHA能够有效地桥接生物组织,通过在湿性环境中形成牢固的粘附,为POF伤口提供即时的密封和保护,从而促进伤口愈合。
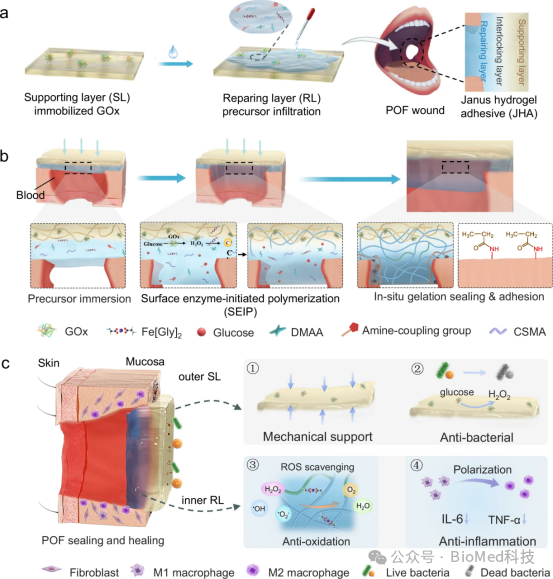
图1. JHA的集成和修复机制及其应用范围
【JHA的性能表征】
图2展示了Janus水凝胶粘合剂(JHA)的性能特征,包括支持层(SL)水凝胶的拉伸应力-应变曲线、不同伸长率下的加载-卸载循环曲线、穿刺应力-应变曲线,以及通过电子顺磁共振(EPR)谱图展示的碳自由基生成情况。此外,还呈现了RL水凝胶在37°C振荡时间扫描模式下的储能模量(G')和损耗模量(G'')曲线,以及不同GOx浓度下RL水凝胶的凝胶化时间和压缩模量。因此,SL水凝胶展现出超过2800%的断裂伸长率和优异的弹性及稳定性,穿刺强度超过1MPa,穿刺能量达到22.99 MJ/m³,表明SL水凝胶具有预期的机械稳定性和抵抗外部损伤的能力。RL水凝胶能够快速形成,并且在GOx浓度增加时凝胶化时间缩短,压缩模量增加,显示出可调的凝胶化速率和机械强度,证实了JHA的RL层能够在生理条件下快速成型,确保了对不规则POFs的无缝堵塞能力。
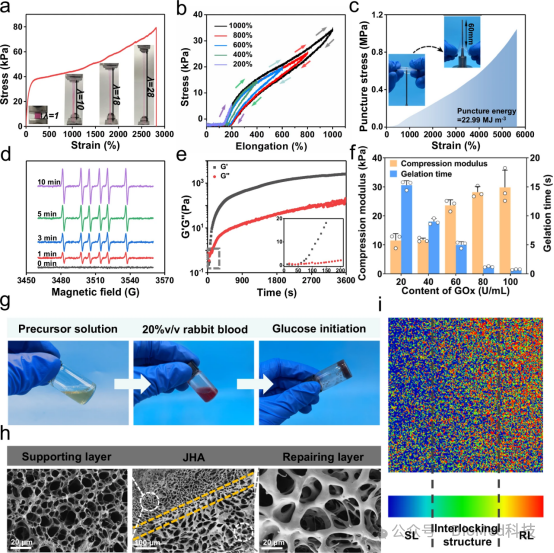
图2. JHA的性能表征
【JHA在湿性和动态环境中的粘附堵塞性能】
图3展示了Janus水凝胶粘合剂(JHA)在湿润和动态环境中的粘附堵塞性能,包括对不同生物组织的180°剥离测试和搭接剪切测试的曲线图,以及与市售医用组织粘合剂的粘附性能比较。实验结果表明,JHA对湿性猪皮具有强大的粘附和密封性能,界面韧性超过360 J/m²,剪切强度超过34 kPa,并且在短时间内即可形成稳定的共价粘附。此外,JHA在动态环境中展现出卓越的抗疲劳组织粘附能力,即使经过200次循环加载-卸载测试,其界面韧性没有显著下降。因此,JHA在湿润和动态环境中具有稳定且强大的粘附强度,能够有效地堵塞和修复穿透性伤口。
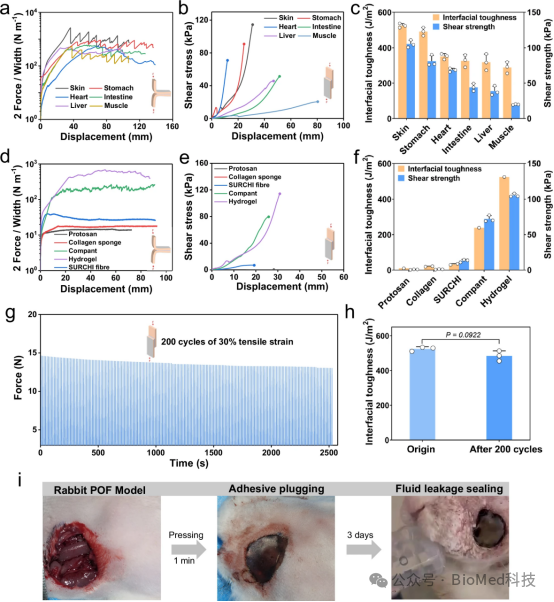
图3. JHA在湿性和动态环境中的粘附堵塞性能
【JHA的抗菌能力】
图4展示了Janus水凝胶粘合剂(JHA)的抗菌能力,包括其对金黄色葡萄球菌(S. aureus)、大肠杆菌(E. coli)和气单胞菌(E. aerogenes)的抑制效果。通过体外实验,JHA显示出明显的抑制区域,并能持续抑制细菌生长,其抗菌率对上述三种细菌均超过99%。在新西兰兔POF模型的体内实验中,JHA处理组未检测到有害菌株,而对照组中检测到了这些细菌。因此,JHA具有显著的抗菌效果,能够有效预防细菌生长,减少感染风险,促进伤口愈合。
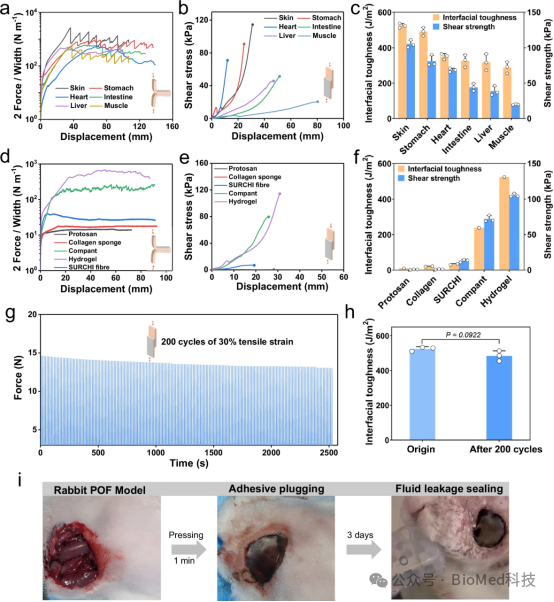
图4. JHA的抗菌能力
【水凝胶的抗氧化和抗炎能力】
图5探讨了水凝胶的抗氧化能力、抗炎作用以及对免疫反应的调节功能。通过DPPH自由基清除试验和ROS清除试验评估了RL水凝胶的体外抗氧化能力,结果显示水凝胶对DPPH自由基、羟基自由基和过氧化氢具有较高的清除率。此外,水凝胶在减轻L929细胞的氧化应激、抑制RAW264.7巨噬细胞释放炎症因子以及促进巨噬细胞从M1型向M2型极化方面表现出显著效果。因此,JHA不仅具有显著的抗氧化性能,能够有效减轻细胞内的氧化应激,还具有抗炎和免疫调节作用,这对于促进伤口愈合和组织修复具有重要意义。
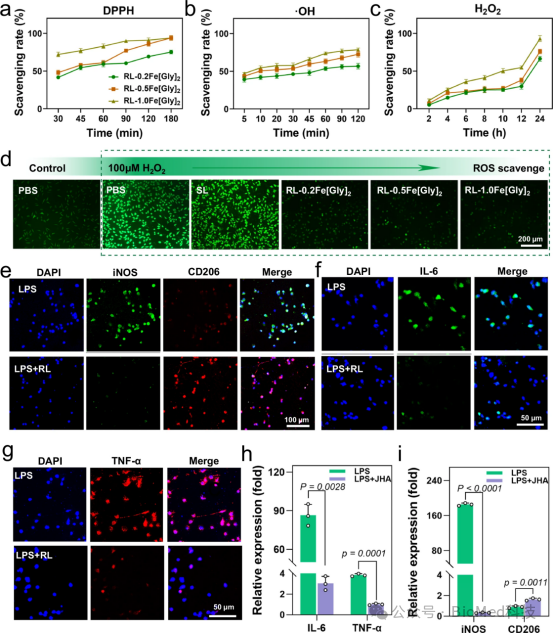
图5. 水凝胶的抗氧化和抗炎能力
【新西兰兔POF模型的愈合结果分析】
图6展示了Janus水凝胶粘合剂(JHA)在新西兰兔穿透性口皮瘘(POF)模型中的体内修复能力。通过对比JHA处理组与对照组的伤口愈合情况,包括伤口的宏观照片、组织再生的光学显微镜图像、不同时间点的愈合率以及炎症程度的评估,结果表明JHA处理组的伤口愈合速度明显快于对照组,显示出更好的组织再生和炎症控制效果。因此,JHA在体内对POF模型的伤口愈合具有显著的促进作用,能够有效加速伤口的闭合并提高愈合质量。
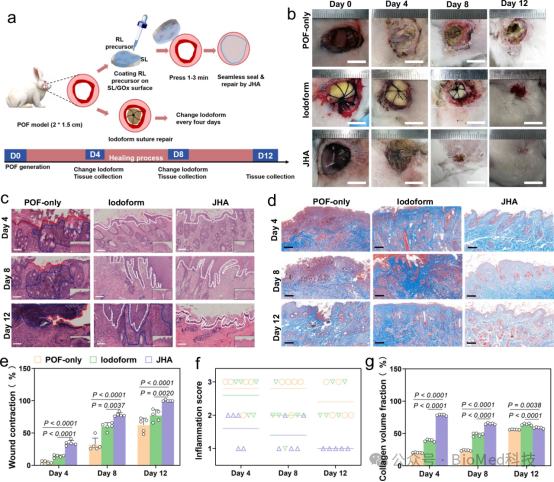
图6. 新西兰兔POF模型的愈合结果分析
【不同组别POF伤口的免疫荧光染色分析】
图7通过免疫荧光染色分析了不同治疗组别新西兰兔POF伤口中的炎症标志物IL-6、α-SMA、CD31和PCNA的表达情况。结果显示,与POF-only和Iodoform组相比,JHA处理组在治疗后4天IL-6表达显著降低,而α-SMA、CD31和PCNA的表达增加,表明JHA能有效地减轻炎症反应并促进血管生成和细胞增殖。此外,JHA处理组的伤口组织中氧化应激标志物4-HNE和8-OHdG的水平较低,表明JHA能减轻氧化应激。同时,JHA处理组中M1型巨噬细胞(iNOS阳性)数量减少,M2型巨噬细胞(CD206阳性)数量增加,证实了JHA不仅能够抑制炎症,还能促进巨噬细胞极化。因此,JHA通过抑制炎症、减轻氧化应激和调节巨噬细胞极化,显著促进了POF伤口的愈合过程。
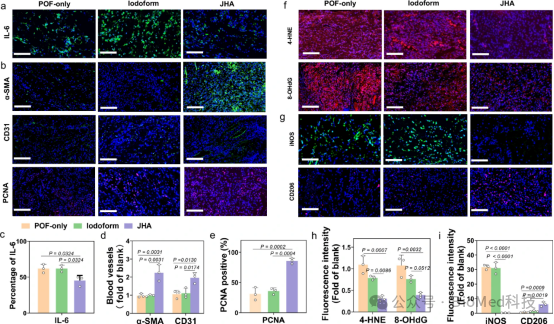
图7. 不同组别POF伤口的免疫荧光染色分析
【比格犬POF模型的愈合结果分析】
图8展示了Janus水凝胶粘合剂(JHA)在比格犬穿透性口皮瘘(POF)模型中的愈合效果,包括不同治疗组别下伤口的宏观照片、愈合率、H&E染色和Masson's Trichrome染色的组织学图像,以及IL-6、α-SMA、CD31和VEGF的免疫荧光分析结果。结果表明,JHA处理组的伤口愈合速度明显快于POF-only和Iodoform组,显示出更好的组织再生和炎症控制效果。因此,JHA在体内对比格犬POF模型的伤口愈合具有显著的促进作用,能够有效加速伤口的闭合并提高愈合质量,同时促进胶原蛋白沉积和血管生成,减少炎症反应,证实了JHA作为一种有效的密封和修复材料在临床治疗POFs中的潜力。
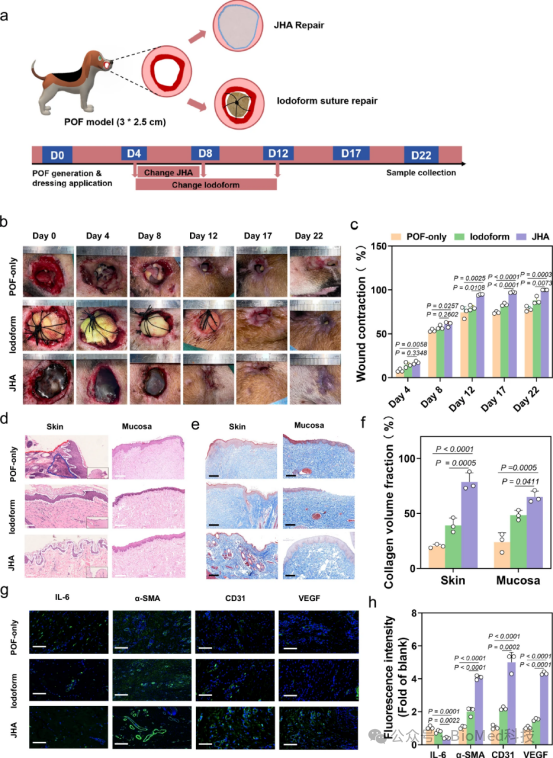
图8. 比格犬POF模型的愈合结果分析
【JHA处理对新西兰兔POF修复过程的转录组分析】
图9通过RNA测序分析比较了仅POF组和JHA处理组在新西兰兔POF模型中不同时间点的信使RNA(mRNA)差异,揭示了JHA促进POF愈合过程中涉及的潜在信号通路。热图显示了免疫(炎症)系统中不同基因表达的显著差异,特别是在JAK/STAT信号通路、Th-17信号通路和IL-17信号通路中。因此,JHA通过调节与炎症反应相关的信号通路,包括减少促炎细胞因子的表达和抑制M1型巨噬细胞的极化,从而促进了POF的快速愈合,这表明JHA不仅在物理上密封伤口,还可能通过影响局部免疫微环境来促进愈合。
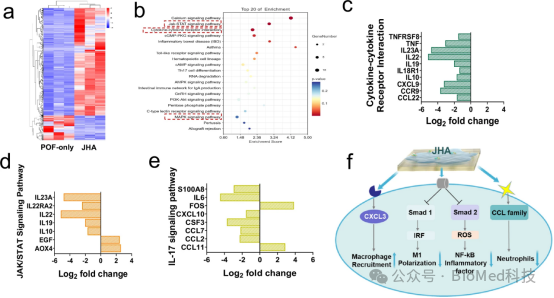
图9. JHA处理对新西兰兔POF修复过程的转录组分析
【小结】
该论文提出的Janus水凝胶粘合剂(JHA)通过表面酶引发聚合(SEIP)方法构建,具有不对称功能,能够有效桥接生物组织并实现卓越的湿粘附和无缝伤口堵塞。在新西兰兔和比格犬的穿透性口皮瘘(POF)模型中,JHA展现了强大的粘附和密封性能,促进了伤口的完全闭合,并且机械强度与正常组织相当,同时还能通过调节生化微环境减少细菌生长、降低氧化应激和炎症,促进巨噬细胞从M1型向M2型极化,从而加速细胞增殖和分化,表明JHA在临床治疗POFs及其他泄漏相关缺陷中具有巨大的潜力。
原文链接:
https://www.nature.com/articles/s41467-024-55303-w
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)