首页 > 医疗资讯/ 正文
胶质瘤是一组异质性的脑肿瘤,其中恶性程度最高的亚型是胶质母细胞瘤,在成人病例中占60%。现有的全身性治疗方案寥寥无几且效果不佳,因此对胶质母细胞瘤新的治疗方法有着很高的需求。总共对131例弥漫性胶质瘤患者进行了研究。配对的肿瘤-正常样本在Illumina平台上进行了测序;该检测 panel包含了812个与癌症发生发展相关的基因。对临床上不同分组的分子特征进行了研究。在低级别胶质瘤(LGG)患者(n = 18)中,最常见的突变是IDH1/2(78%)、ATRX(33%)、TP53(33%)、PIK3CA(17%)以及1p/19q共缺失(22%)。在高级别胶质瘤(HGG)患者(n = 113)中,更常受影响的基因有CDKN2A/B(33%)、TERTp(71%)、PTEN(60%)、TP53(27%)以及EGFR(40%)。预后较好的独立预测因素是肿瘤级别和IDH1/2突变。在IDH野生型胶质母细胞瘤患者中,既往有其他癌症病史与更差的总生存期(OS)相关,而再次手术和贝伐珠单抗治疗可延长OS。此外,在基因变异中,TERTp突变和PTEN缺失是预后不良的标志。有9名患者接受了分子靶向治疗,并对治疗结果进行了评估。寻找与肿瘤生长及进展相关的分子变化对于诊断和治疗方案的选择十分重要。
研究背景
胶质瘤是累及大脑结构的原发性弥漫性脑部病变,是中枢神经系统(CNS)最常见的肿瘤。胶质瘤可发生于任何年龄,但在老年人中最为常见。由于胶质瘤是一组异质性极强的肿瘤,准确分类十分重要,因为这在很大程度上决定着患者的预后及治疗方案。传统上,胶质瘤主要分为两大类:弥漫性胶质瘤和非弥漫性胶质瘤。弥漫性胶质瘤的特征是肿瘤细胞可远距离迁移至CNS实质内,这就排除了完全手术切除的可能性。与弥漫性胶质瘤相反,非弥漫性胶质瘤往往边界更清晰。通常认为弥漫性胶质瘤起源于神经胶质祖细胞,其组织学亚型(星形细胞瘤、少突胶质细胞瘤和胶质母细胞瘤)是依据与正常组织中发现的神经胶质细胞的形态相似性来区分的。恶性程度分级是根据是否存在明显的有丝分裂活动、坏死和/或丰富的微血管增生情况来确定的。Ⅰ级胶质瘤生长最为缓慢,通常被视为介于良性与恶性肿瘤之间的临界状态,而Ⅱ级、Ⅲ级和Ⅳ级胶质瘤则被归类为恶性肿瘤。最常见的具有高度侵袭性病程的恶性Ⅳ级胶质瘤是胶质母细胞瘤,占所有成人脑肿瘤的60%。胶质母细胞瘤预后最差,即便经过积极治疗,包括首次手术后进行放射治疗以及使用替莫唑胺进行化疗,复发或病情进展的风险仍然很高。复发性胶质母细胞瘤患者的全身性治疗标准尚不明确,现有的治疗选择少且效果不佳。70岁以下胶质母细胞瘤患者的中位预期寿命约为14.6个月,只有3 - 5%的患者在确诊后能存活超过三至五年。
2007年WHO分类完全基于形态学,并未利用基因特征对肿瘤进行分组。对肿瘤生物学的进一步研究使得识别关键的基因变异成为可能,这些基因变异能够确定肿瘤发展的分子模式,并发现可用于诊断、预后或治疗目的的靶点。在不同恶性程度的弥漫性胶质瘤中发现的异柠檬酸脱氢酶1和2(IDH1/IDH2)基因的点突变,已成为胶质瘤基于分子层面分类的主要因素。IDH突变携带者在生存期方面的显著差异体现了其对这些肿瘤较高的预后价值。胶质瘤分类所依据的第二个分子事件是1p19q共缺失,其主要发生在少突胶质细胞瘤中,发生率为75 - 80%,并且与该疾病良好的临床病程以及放疗和化疗的高疗效相关。作为癌症基因组图谱(TCGA)项目的一部分,胶质母细胞瘤也得到了全面的分子特征分析。已表明胶质母细胞瘤固有的基因损伤会影响端粒长度、染色质调控以及细胞内信号传导,涉及受体酪氨酸激酶(表皮生长因子受体(EGFR)、FGFR和BRAF)、丝裂原活化蛋白激酶以及磷脂酰肌醇-3-激酶(PI3K/AKT/mTOR),还有视网膜母细胞瘤/E2F以及p53肿瘤抑制通路。2016年世界卫生组织中枢神经系统肿瘤分类(2016 WHO CNS)是首个将肿瘤的形态学与基因特征相结合的分类。包括胶质母细胞瘤在内的弥漫性胶质瘤被分为三个亚型:IDH突变型、IDH野生型以及IDH NOS(非特指型)。所提出的胶质瘤诊断流程包含一个简单的逐步检测方案,即结合已确定的肿瘤形态学特征,依次检测IDH突变以及1p19q共缺失情况。与此同时,在肿瘤诊断中同时运用组织学和基因特征在某些病例中也引发了一些有争议的说法。
上一次修订形成了2021 WHO CNS第五版分类,该版优先考虑已知的分子参数以完善CNS肿瘤,尤其是弥漫性胶质瘤的诊断。成人弥漫性胶质瘤的关键诊断标准是异柠檬酸脱氢酶基因IDH1和IDH2的突变;其他主要的基因标志物包括1p/19q共缺失、ATRX基因突变、CDKN2A缺失、EGFR扩增、7号染色体(chr)获得合并10号染色体(chr)缺失(7+/10−)以及TERT启动子突变。成人型弥漫性胶质瘤分为三个亚型:(1)IDH突变型星形细胞瘤(2级、3级、4级);(2)IDH突变型且1p19q共缺失的少突胶质细胞瘤(2级、3级);(3)IDH野生型胶质母细胞瘤(4级)。此前被命名为“IDH突变型继发性胶质母细胞瘤”的已重新归类为IDH突变型4级星形细胞瘤,其生存率比IDH野生型胶质母细胞瘤至少高出两倍。在2021 WHO CNS分类中,胶质母细胞瘤被定义为一种必然具有IDH1/2野生型的肿瘤,其特征为弥漫性星形细胞组织学表现,且具备以下特征中的至少一项:坏死、微血管增生、7号染色体获得和10号染色体缺失、EGFR扩增或TERT突变。纳入分子标准使得即便未检测到高级别组织病理学特征、坏死或微血管增生,也能够对IDH野生型胶质母细胞瘤作出诊断。基因组学、转录组学和蛋白质组学的综合研究可以通过探索构成弥漫性胶质瘤组的病理多样性来进一步完善这种分类。
近来,下一代测序技术(NGS)在肿瘤临床实践中,尤其是在神经肿瘤学领域的应用日益增多。这种方法使得识别数百个癌症相关基因的变化以及确定可能对个性化靶向治疗有反应的患者亚群成为可能。尽管对胶质瘤生物学已有深入了解,但关于NGS在胶质母细胞瘤患者中的临床应用价值、靶向治疗的疗效及可行性方面的数据仍很有限。目前尚未确定或提供专门针对胶质瘤患者的全面基因检测panel,不过在这方面已进行了积极的尝试。已有几项研究通过NGS基因检测 panel来识别潜在的重要分子变异,并将结果转化为针对患者的个性化管理。研究分子标志物与患者临床特征之间的相互作用,以确定新的预后及治疗效果生物标志物也至关重要。寻找与肿瘤发生和进展相关的分子变异,对于进一步发展针对该疾病治疗的精准医学方法可能具有重要意义。
本研究旨在调查在一家医疗机构接受治疗的成人弥漫性胶质瘤不同亚组的基因组图谱,并了解其临床影响以及与临床特征的关联。本研究还将介绍研究者基于可干预分子变异的识别来应用靶向治疗的自身经验。
研究结果
胶质瘤患者的临床特征:
收集并研究了131名患者的成对血样和肿瘤样本。患者的临床特征见表1。在131名胶质瘤患者中,男性69例,女性62例,中位年龄为58岁(年龄范围从18岁到78岁)。依据2021年WHO分类标准进行诊断:131名患者中有21名(16%)患有2级或3级肿瘤(低级别胶质瘤(LGG),包括弥漫性星形细胞瘤和少突胶质细胞瘤),113名(84%)患有4级肿瘤(高级别肿瘤(HGG),弥漫性星形细胞瘤和胶质母细胞瘤)。
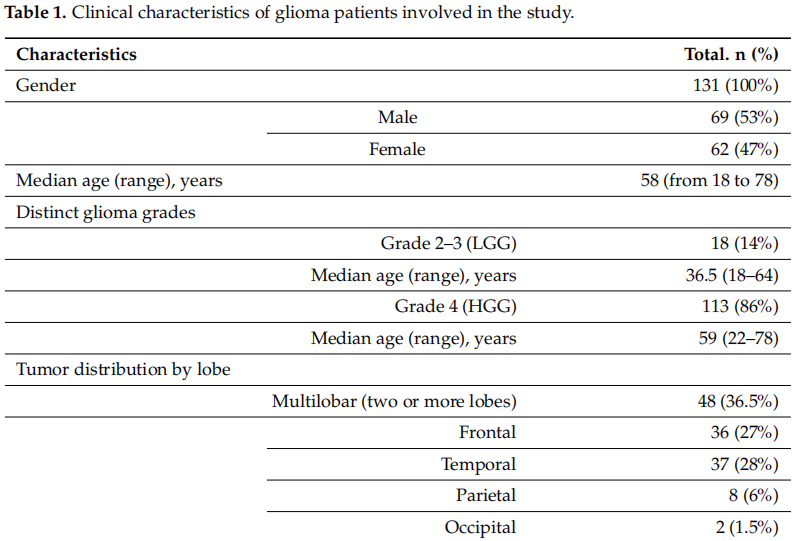
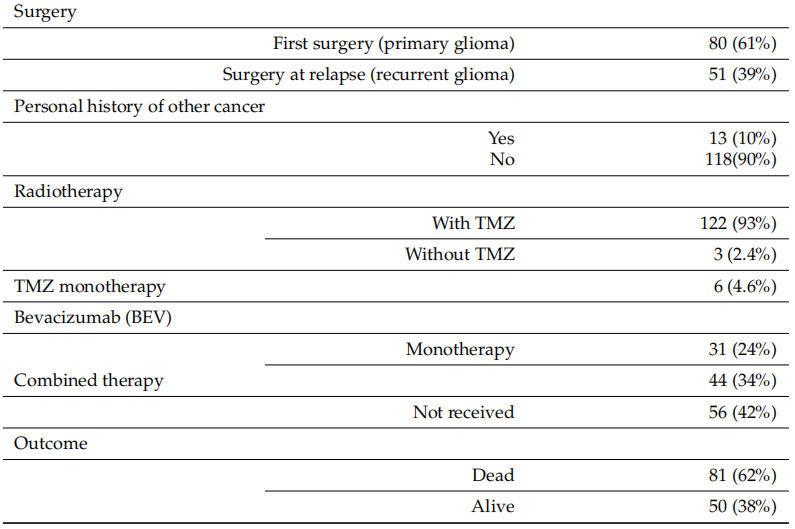
表1
在48/131名(36.5%)患者中,肿瘤病变累及大脑的两个或更多脑叶。在单侧肿瘤定位中,颞叶和额叶更常受影响,分别有37/131名(28%)和36/131名(27%)患者受到累及。总计83/131名(63%)患者患有原发性胶质瘤,49/131名患者(37%)因肿瘤生长迅速而接受了二次或三次手术。大多数患者(90%)仅有CNS肿瘤,而13/131名(10%)胶质母细胞瘤患者此前曾患有另一种非CNS肿瘤,因此胶质母细胞瘤是作为第二原发恶性肿瘤(继发性原发性胶质母细胞瘤,SPGB)发展而来的。
大多数患者(127/131或96.2%)在第一步治疗时接受了放化疗替莫唑胺联合治疗。贝伐珠单抗治疗(单药或与其他药物联合)给予75/131(58%)患者。到研究结束时(2024年8月),81/131(62%)的患者死亡,50/131(38%)的患者存活;131例患者中有33例(25%)患者总生存期超过36个月。
LGG和HGG患者组的基因组图谱:
为了分析胶质瘤中的体细胞突变,研究者对新鲜冷冻或FFPE肿瘤样本以及匹配的血液样本进行了测序。LGG和HGG患者的基因组图谱见图1。在131例患者的总样本中,CDKN2A/B缺失被发现在38例(29%)病例中,IDH1/2突变17例(13%), TERT基因启动子突变85例(65%)、PTEN位点缺失48例(37%),PTEN突变43例(33%),TP53突变39例(30%)、EGFR扩增43例(33%),EGFR突变15例(12%)、NF1突变14例(11%)、RB1突变13例(10%)、ATRX突变11例 (8%)、PIK3CA突变8例(6%)、PIK3R1突变6例(5%)、PTPN11突变5例(4%)、SPTA1突变4例(3%)、PIK3CB突变3例(2%)、ATM突变3例(2%)、CIC突变2例(2%)和MTOR突变2例(2%)。此外,在MRE11、BCOR、BDNF、STAT3、MLH1、MSH6、PMS2、FGFR1、PDGFRA、DNTM3A、NOTCH2、DAXX、REL、CREBBP、TSC1、FLT1和SETD2基因中发现了单个突变。
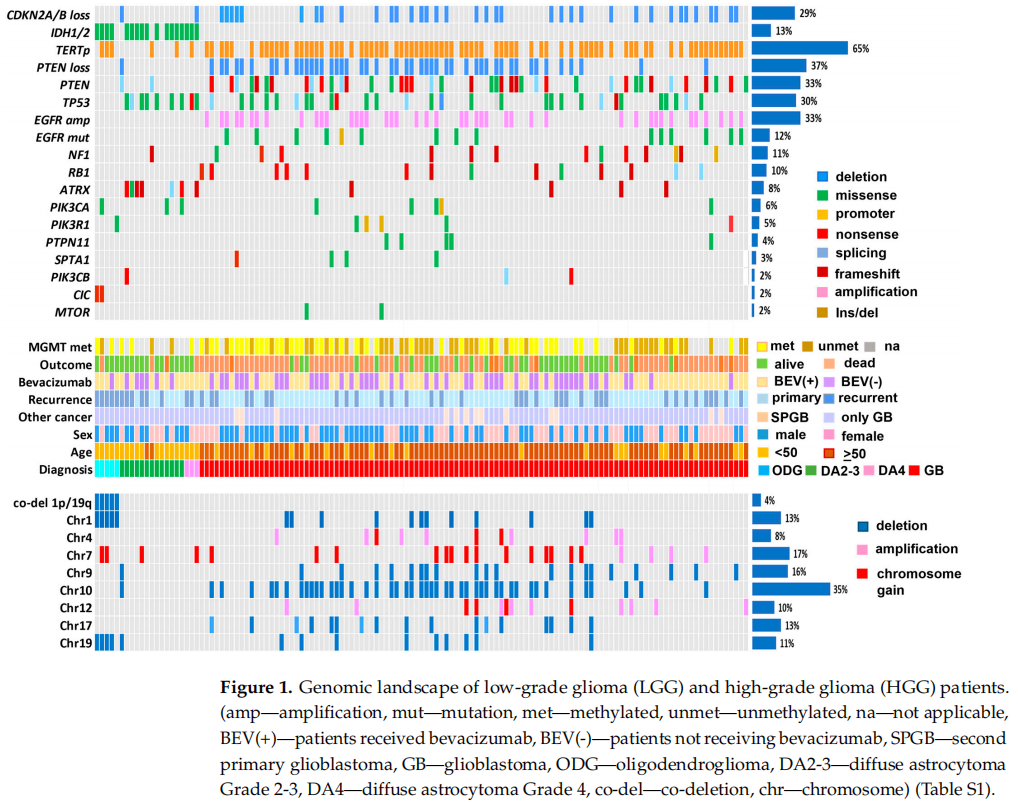
图1
研究者对比了本队列中LGG和HGG患者的突变图谱(图2)。这两组样本有大部分突变基因是相同的(CDKN2A缺失、IDH1/2、PTEN、TP53、NF1、PIK3CA、PIK3R1、ATRX、PIK3CB),但突变频率差异显著。与HGG样本相比,IDH1/2突变在LGG样本中更为常见(78% vs. 3%,p < 0.0001),ATRX突变也是如此(33% vs. 4%,p < 0.001),而TERTp突变以及CDKN2A/B缺失在HGG样本中比在LGG样本中更频繁(71% vs. 28%,p < 0.001;33% vs. 6%,p = 0.03)(图2)。EGFR突变以及EGFR扩增仅在HGG样本中被发现。
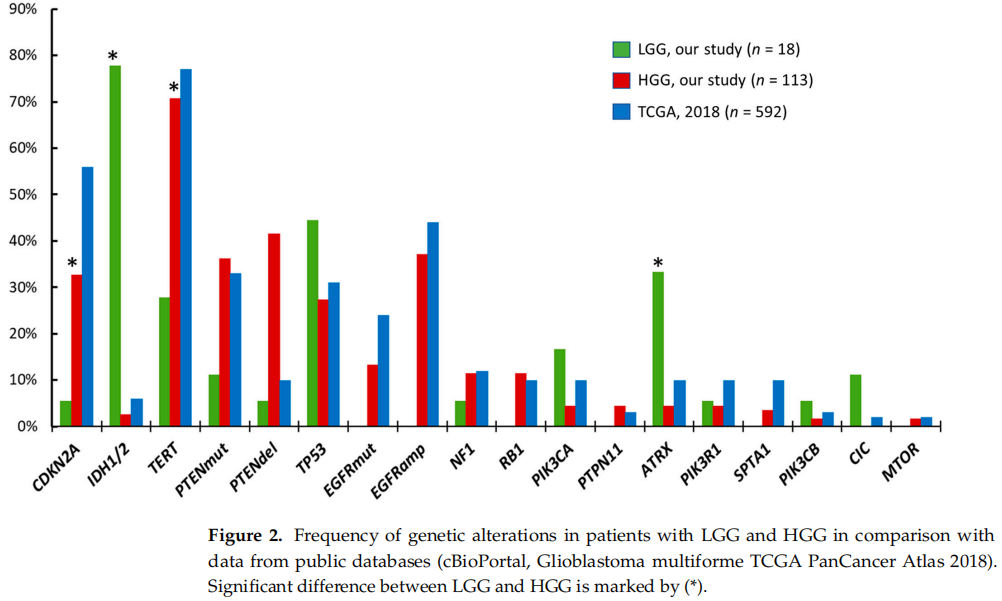
图2
LGG组包含被诊断为少突胶质细胞瘤(ODG)(n = 7)以及2 - 3级弥漫性星形细胞瘤(DA)(n = 11)的患者。在ODG患者中,7名患者中有5名(71%)存在1p/19q共缺失,7名患者中有6名(86%)存在IDH1基因的R132H突变。有1名患者无IDH1/2突变,但存在1p缺失以及PIK3R1基因的一个突变。7名ODG患者中有2名(29%)被发现存在CIC基因突变。在2 - 3级DA患者中,7/11名患者(64%)存在IDH1基因的R132H突变,有1名患者存在IDH2基因罕见的R172S突变。3名LGG患者为IDH野生型;1名患者携带TRIM33 - NTRK2融合;另外2名患者具有更偏向HGG肿瘤类型的基因型(其中1例存在CDKN2A缺失、PTEN突变以及PTEN缺失,另1例存在TERTp突变、PTEN突变以及NF1突变)。
HGG组中3例患者携带IDH1 R132H突变,诊断为DA,4级。其余110/113(97%)例HGG患者为IDH野生型胶质母细胞瘤。将本研究的HGG样本与592例多型胶质母细胞瘤TCGA PanCancer样本的现有数据(https://www.cbioportal.org)进行比较,主要受影响基因的突变频率没有显著差异(图2)。
此外,研究者利用配对肿瘤血液样本中的β等位基因频率(BAF)分析确定了反复发生的染色体重排。所有样本组均发现7号染色体(或包括p或q臂的大染色体区域)的扩增(LGG 3/18, 17%;HGG 19/113, 17%)。LGG患者以1号和19号染色体部分或全部缺失为主,其他重排均集中在HGG组。最常见的重排为10号染色体全部或部分缺失(45/113,40%)、9号染色体全部或部分缺失(20/113,18%)、1号染色体全部或部分缺失(12/113,11%)、17号染色体全部或部分缺失(13/113,12%)、19号染色体全部或部分缺失(10/113,9%)。此外,频繁的CNVs发生于以下区域:4q12扩增(11/113,10%)(KIT、PDGFA和KDR基因),12q13扩增(4/113,3.5%)(CDK4基因)和12q15扩增(5/113,4.4%)(MDM2基因),17p13缺失(3/113,3%)(TP53基因)(图2)。
肿瘤突变负荷(TMB)为0-18 muts/Mb;LGG样本的平均TMB为2.2 muts/Mb,HGG样本的平均TMB为4.5 muts/Mb。1例HGG样本存在2种MSH6突变(W50*和3647-1G>A),TMB为82 muts/Mb。与HGG样本相比,在LGG样本中,每例患者的临床相关基因的平均变异数量(图2,上部)略低(2.4个突变vs. 3.1个突变),但不显著。在整个样本中,有97/131(76%)例病例发现了PI3K-Akt-mTOR通路的基因变异(不包括EGFR突变或扩增),并且它们在HGG样本中比在LGG样本中更常见(90/113,79% vs. 7/18,38%,p = 0.0007)。尤其是在HGG IDH野生型胶质母细胞瘤中,在80%的样本中发现了PI3K-Akt-mTOR通路变异。
在PTEN基因具有临床相关性的变异(n = 43)中,错义突变在14例(32.5%)中被发现,无义突变在11例(25.5%)中被发现,移码突变和剪接位点突变总共在9例(21%)中被发现。在23/43例(53.4%)样本中,发现PTEN突变与PTEN缺失同时存在。TP53基因变异主要表现为错义突变(28/39,72%),而剪接位点突变(7/39,20%)和无义突变(2/39,5%)则较为少见。EGFR突变绝大多数为错义突变(14/15,93%),仅有1例为框内插入(1/15,7%),并且在80%的病例中伴有EGFR基因扩增。
原发性和复发性胶质母细胞瘤的突变谱:
在分析的110例胶质母细胞瘤样本中,71例(65%)来自第一次手术切除(原发性胶质母细胞瘤),39例(35%)来自第二次或第三次手术切除(复发性胶质母细胞瘤)。第一次和第二次切除之间的中位缓解期为10个月(范围从3到89个月)。比较原发性和复发性胶质母细胞瘤肿瘤样本的突变谱,两组临床相关分子变异的发生率见表2。
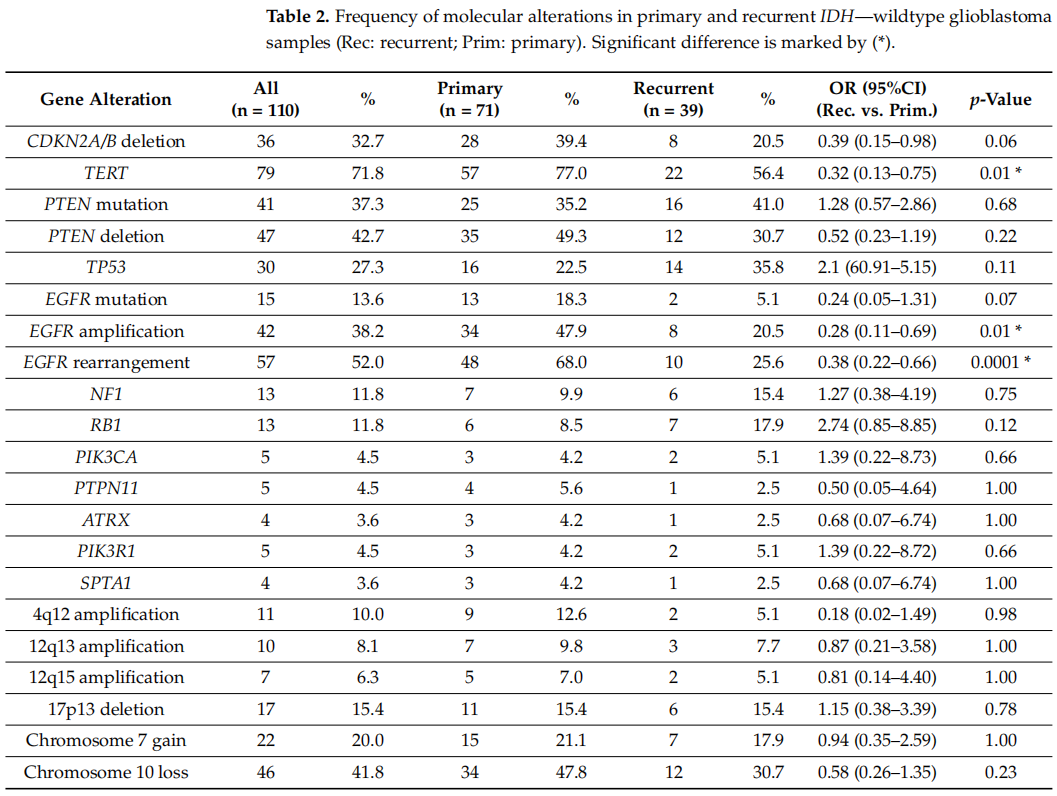
表2
研究者观察到,与随后切除的复发病例相比,原发性胶质母细胞瘤样本中TERTp突变、EGFR扩增和EGFR重排(包括突变和扩增)的频率显著更高(分别为77.0% vs. 56.4%、47.9% vs. 20.5%、68% vs. 25.6%,P < 0.05)。分析中其他基因的突变频率没有发现显著差异。
第二原发性胶质母细胞瘤患者的临床和基因特征:
在131名神经胶质瘤患者的样本中,有13人在发展为脑瘤之前患有另一种癌症。所有病例均为所谓的第二原发性胶质母细胞瘤(SPGB),IDH野生型。患者的详细特征见表3。
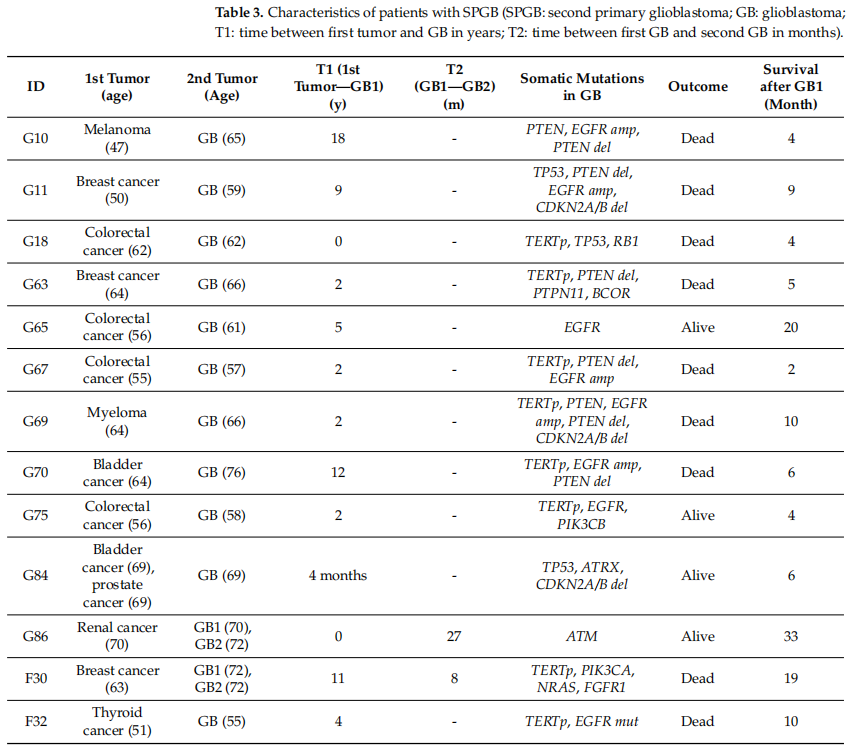
表3
最常见的原发肿瘤是结直肠癌(4/13,30%),其次是乳腺癌(3/13,23%)、膀胱癌(2/13,15%),还有黑色素瘤、肾癌、甲状腺癌和骨髓瘤各1例。从首次患肿瘤到发生胶质母细胞瘤的中位时间为2年(范围从0到18年)。有2名患者出现复发SPGB,首次手术和二次手术之间平均缓解期为17.5个月。一名患有肾癌且复发SPGB的患者携带ATM无义突变,在最后一次观察时仍存活。其他SPGB的体细胞突变具有胶质母细胞瘤的特征。
生存分析和Cox比例风险模型:
研究者分析了整个胶质瘤患者队列和HGG IDH野生型胶质母细胞瘤患者队列的生存率。
胶质瘤患者(LGG和HGG组):
对于整个胶质瘤患者群体而言,中位随访时间为18.8个月,中位总生存期(OS)为27.1个月(95%CI,19.5 - 38)。在第1年,生存率为0.772(95%CI,0.701 - 0.850),到第2年下降至0.550(95%CI,0.466 - 0.649),到第5年进一步降至0.252(95%CI,0.173 - 0.366)。研究者进一步评估了已知预后因素(如肿瘤分级和IDH突变状态)对OS的影响。
LGG患者和HGG患者之间(图3a),以及IDH突变型患者和IDH野生型患者之间(图3b),OS存在显著差异。LGG和IDH突变型与更良好的预后相关,这些患者组的中位OS尚未达到,而在HGG和IDH野生型患者组中,中位OS分别为19.78个月(95%CI,16.66 - 29.66)和21.52个月(95%CI,16.66 - 29.8)。
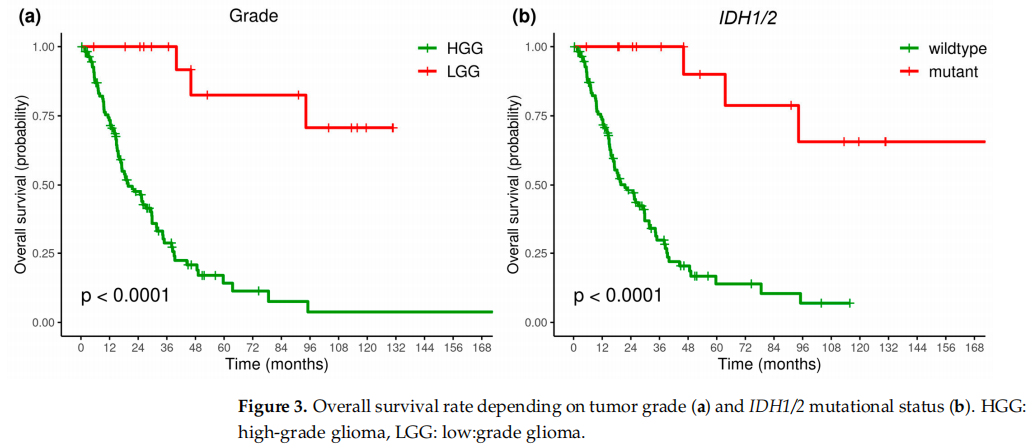
图3
IDH1/2突变在LGG患者中(78%)比HGG患者(3%)更常见,因此观察到肿瘤分级与IDH1/2突变的存在之间的相关性。在单因素和多因素Cox回归分析中,分级和IDH状态都是重要的预测因素,允许它们被认为是独立的预后因素(表4)。
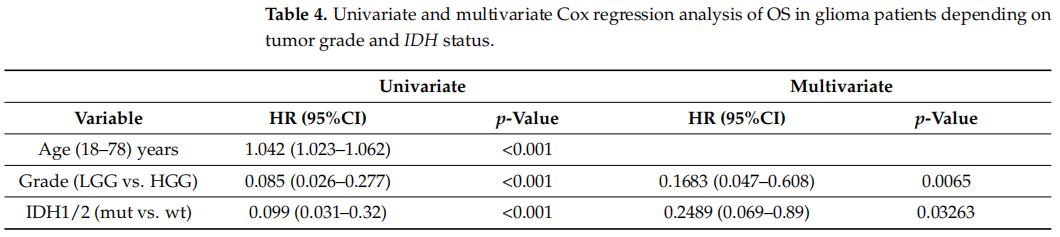
表4
在整个研究群体中,年龄与生存期显著相关。年龄的HR为1.04(p < 0.001),这意味着年龄每增加一岁,总生存期缩短的风险就会增加4%。同时,LGG患者明显比HGG患者年轻(中位年龄为36.5岁 vs. 59岁);经肿瘤分级和IDH状态调整后的年龄HR为1.01(95%CI,0.99 - 1.04,p = 0.1869)。由此得出结论,年龄并无独立影响,尤其是因为较年轻的年龄与更有利的肿瘤亚型相关这一事实。
HGG-IDH-野生型(胶质母细胞瘤)患者组的生存分析:
研究者根据突变情况进一步分析了胶质母细胞瘤患者的OS,将胶质母细胞瘤患者作为一个更具同质性的群体,以排除诸如疾病分级以及IDH1/2突变存在情况这类重要的预后因素。胶质母细胞瘤患者群体的中位OS为19.5个月(95%CI,16.1 - 29.6);1年、2年和5年的OS分别为0.726(95%CI,0.645 - 0.818)、0.457(95%CI,0.367 - 0.569)和0.107(95%CI,0.047 - 0.245)。
绘制了Kaplan–Meier曲线(图4和图5),并将生存分析纳入Cox比例风险模型,该模型的数据变量包含年龄、性别、是否患有其他癌症、手术切除次数、肿瘤位置、贝伐珠单抗治疗情况以及MGMT启动子甲基化状态。此外,还对CDKN2A/B、TERT、PTEN、TP53和EGFR基因变异以及7号染色体获得和10号染色体缺失情况进行了评估(表5)。首先,通过单变量分析对上述预测因素进行了评估。
在临床因素中,既往患其他癌症病史、再次手术以及贝伐珠单抗治疗是显著的预测因素。既往患其他癌症病史是不良预后因素,HR为2.7(95%CI,1.32 - 5.52,p = 0.006),SPGB患者的中位OS为9.3个月,而仅患有胶质母细胞瘤的患者中位OS为22.2个月,二者相比差异显著(p = 0.0044)。因胶质母细胞瘤复发而接受过两次或更多次手术切除的患者OS更佳:HR为0.53(95%CI,0.32 - 0.85,p = 0.009),中位OS为25.5个月,相比仅接受过一次手术的患者(中位OS为15.7个月)差异显著(p = 0.0082)。此外,接受贝伐珠单抗治疗的患者OS更好:HR为0.62(95%CI:0.39 - 0.98)(p = 0.04),中位OS为25.5个月,与未接受贝伐珠单抗治疗的患者(中位OS为12.3个月)相比差异显著(p = 0.042)。未发现根据性别、肿瘤位置(多叶或单叶胶质母细胞瘤)或MGMT启动子甲基化状态的不同在中位生存期方面存在显著差异(图4、表5)。
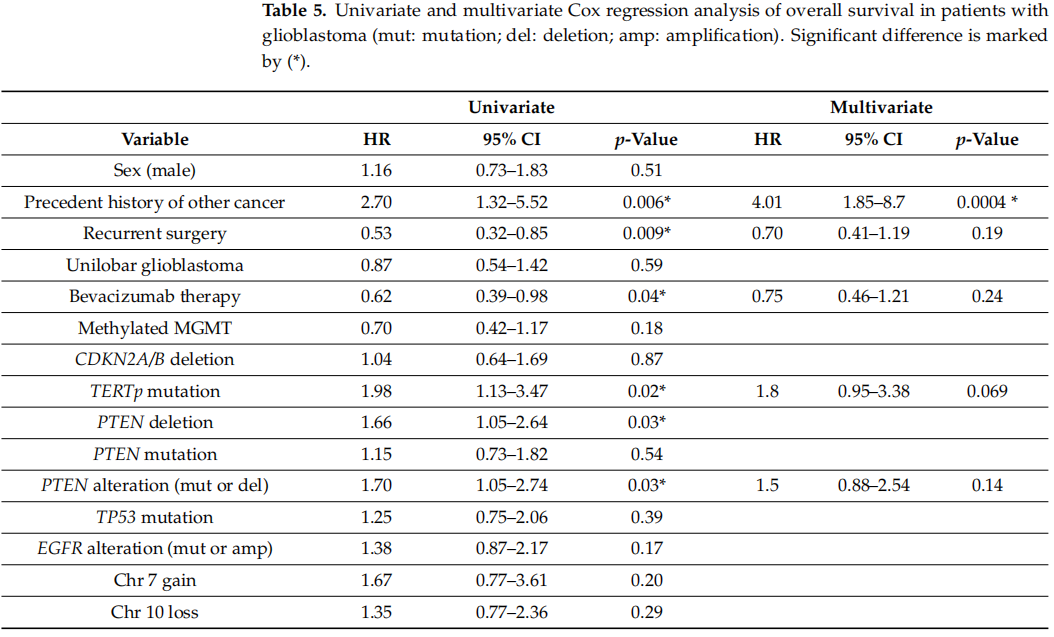
表5
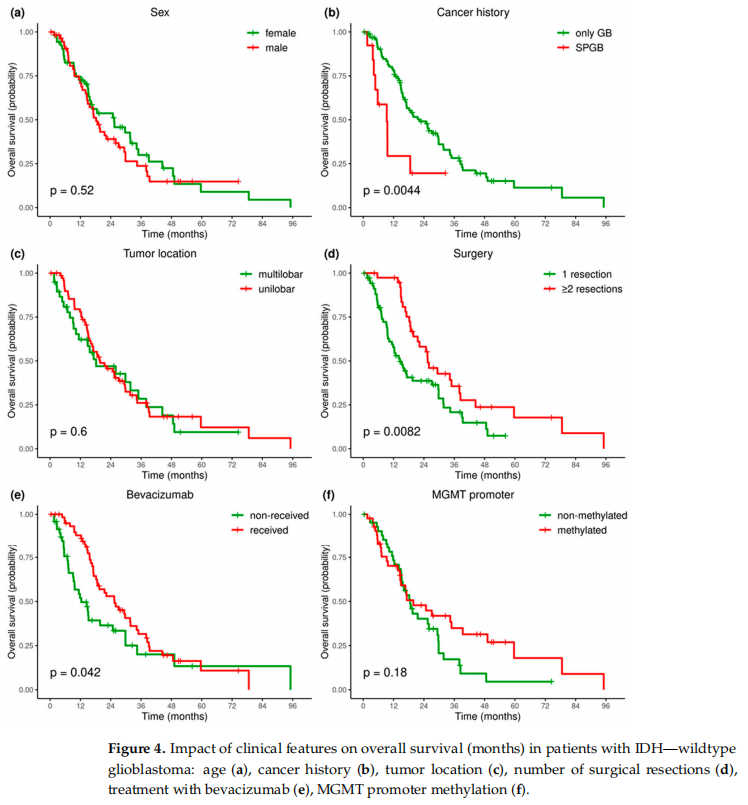
图4
研究者分析了OS与最常受影响的基因(CDKN2A、TERT、PTEN、TP53和EGFR)突变之间的关联。肿瘤样本中TERTp存在突变的胶质母细胞瘤患者,相较于TERTp为野生型的肿瘤患者,OS更差:HR为1.98(p = 0.02),中位OS分别为17.0个月和29.3个月(p = 0.015)。此外,因突变或缺失(PTEN变异)导致PTEN基因受损的患者,相较于PTEN为野生型的患者OS更差:HR为1.7(p = 0.03),中位OS分别为16.1个月和27.1个月(p = 0.028)。单独针对PTEN缺失情况也观察到了几乎相同的影响,HR为1.66(p = 0.03),但PTEN突变情况则未观察到这种影响。在生存率与CDKN2A/B缺失、EGFR基因变异、TP53突变或者7号染色体获得及10号染色体缺失之间,未观察到显著关联(p > 0.05)(图5、表5)。
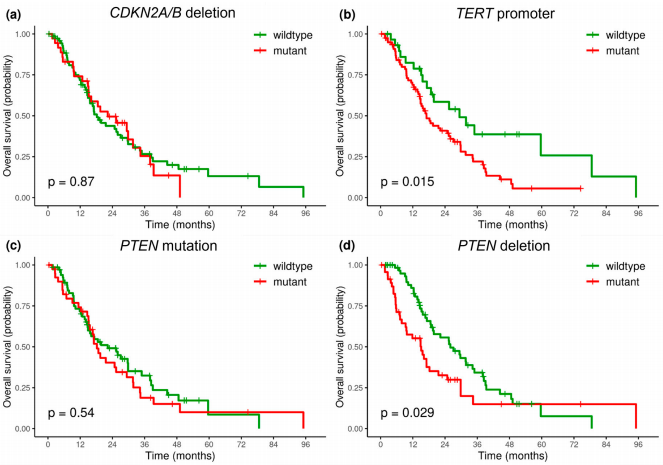
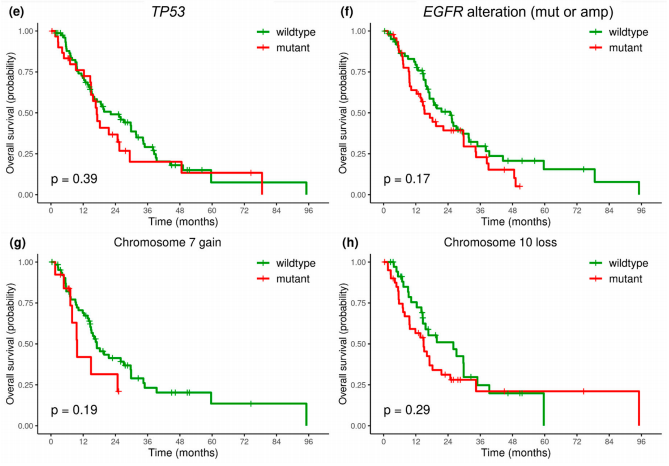

图5
在多变量分析中,只有既往有其他癌症病史仍然是具有统计学意义的预测因素(HR = 4.01,95%CI 1.85-8.7,p = 0.0004)(表5)。
分子匹配靶向治疗:
基因组分析的结果被应用于个性化治疗。在9名胶质瘤和胶质母细胞瘤患者中,可干预的分子靶点被识别出来并用于靶向治疗。这些患者的详细特征列于表6中。靶向治疗的候选患者(占整个群体的9/131,7%)是依据“ FoundationOne”基因检测所提供的建议筛选出来的。在病情进展或复发后,当其他治疗方案都已用尽时,由医疗会诊组将靶向治疗作为超说明书用药(同情用药)开出。
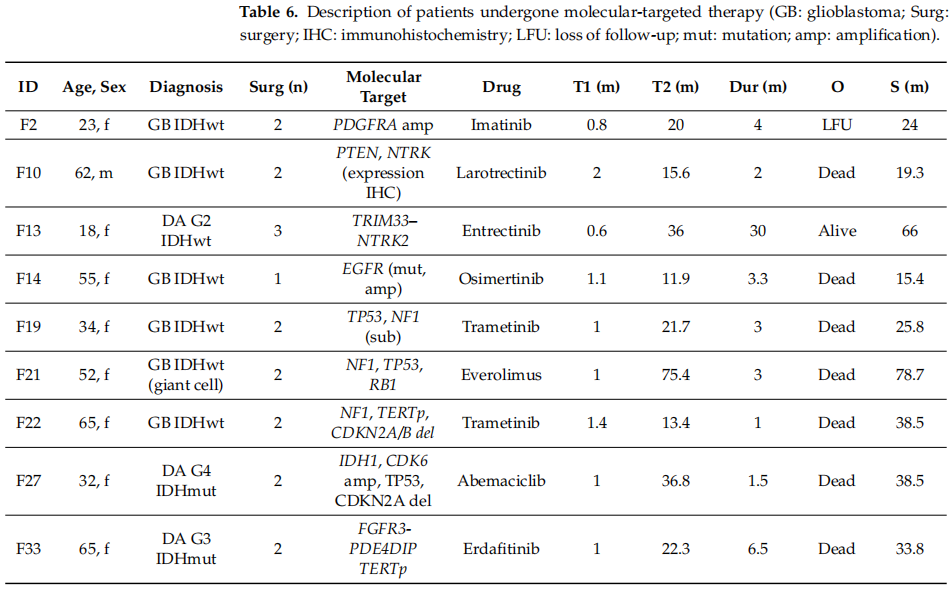
表6
3名患者被诊断为IDH野生型(2级)或IDH突变型弥漫性星形细胞瘤(3级和4级)。另外6名患者患有IDH野生型胶质母细胞瘤。所有患者都接受了标准的放射治疗,总剂量为60 Gy,同时联用替莫唑胺。初次手术切除与开始辅助治疗之间的平均间隔时间为1.1个月(范围:0.6 - 2.0个月)。几名患者(F10、F14、F27、F33)按照Stupp方案额外接受了6个周期的替莫唑胺治疗,并且F27总共接受了24个周期的替莫唑胺治疗。除F14外的所有患者,在分子靶向治疗之前或之后,都接受了贝伐单抗单药治疗或与化疗药物(替莫唑胺、伊立替康、紫杉醇、卡铂、洛莫司汀)或免疫治疗药物(纳武利尤单抗)联用的治疗。一名患有巨细胞胶质母细胞瘤的患者长期受益于丙卡巴肼治疗,之后因存在NF1突变,接受了贝伐珠单抗和纳武利尤单抗的联合治疗,随后又接受了依维莫司的靶向治疗。大多数患者进行了两到三次肿瘤切除手术;此外,还采用了立体定向放射治疗。从首次手术到开始靶向治疗的平均时间为27.4个月(范围:11.9 - 36.8个月),平均治疗时长为6.03个月(范围:1 - 30个月)。一名接受恩曲替尼治疗的患者(F13)在无进展生存期达30个月、总生存期达66个月的情况下仍存活。7名患者死亡,1名患者失访;平均生存时间为34.7个月(范围:15.4 - 78.7个月)。有1例死亡(F21)是由于感染新冠病毒所致,其他死亡病例则是由疾病进展导致的。在两例病例(F22和F33)中,用药期间出现了严重的毒性反应,这导致靶向药物(曲美替尼和厄达替尼)的使用中断或取消。
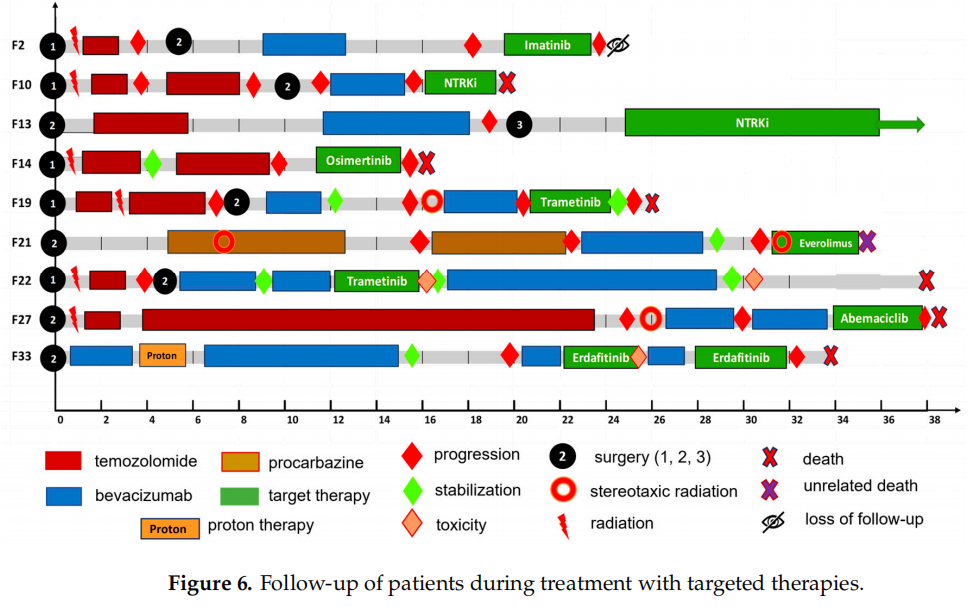
图6
讨 论
弥漫性胶质瘤样本的突变谱:
在本研究中,对131例胶质瘤患者样本中的突变情况和染色体变异进行了全面调查,并将分子检测结果与患者的临床特征进行了对比。LGG患者占整个队列的14%,且明显比HGG患者年轻;LGG患者的中位年龄为36.5岁,而HGG患者的中位年龄为59岁。LGG患者的总体OS明显优于HGG患者。在最后一次观察时,本研究中的LGG患者有83%仍然存活。在LGG患者中,IHD突变型胶质瘤占78%的病例,这与其他研究结果相符。如先前所示,IHD突变型胶质瘤约占组织学上低级别胶质瘤的70% - 80%,通常出现在50岁以下的患者中,并且相较于IHD野生型胶质瘤,一般对治疗的反应更好。
少突胶质细胞瘤(ODGs)被定义为在IDH1/2基因存在突变以及1号和19号染色体之间存在不平衡易位(1p/19q共缺失)的胶质瘤;它们依据有丝分裂活性、微血管增生或坏死等组织学特征被分为2 - 3级。在本研究中,被诊断为ODG的患者中有71%存在IDH1突变R132H以及1p/19q共缺失的情况,而有1名患者未携带IDH突变,仅存在1p缺失。在两例病例中,发现了CIC基因的突变,该基因是ODG的一个高度特异性标志物,其突变可能在多达50%的病例中出现。
不存在1p/19q共缺失的IDH突变型低级别胶质瘤被定义为星形细胞瘤,并按照2至3级进行分级。研究者在72%的患者中发现了IDH突变;多数病例为IDH1 R132H突变,有1例为IDH2 R172S突变。IDH2突变在胶质瘤中实属罕见情况,占病例的0.3% - 5.2%。其他分子变异包括TP53、ATRX、PIK3CA、PIK3CB、PTEN基因的突变以及CDKN2A缺失,这些已被发现是低级别胶质瘤特有的变异。在28%的LGG患者中发现了TERT启动子突变。在1例IDH野生型的肿瘤中,发现了TRIM33-NTRK1易位,该患者为一名18岁的年轻患者。NTRK家族基因融合现象较为罕见,在成人和儿童胶质瘤患者中仅占1%,而且这些低级别胶质瘤仅存在NTRK融合,无其他额外的基因变异。另外3例IDH野生型低级别胶质瘤根据明显的形态学标准被诊断为弥漫性星形细胞瘤。其中1例存在TERTp突变,依据2021年WHO CNS分类标准,可重新归类为4级胶质母细胞瘤。所有这些患者的中位生存时间为73个月,那名存在TERTp突变的患者在接受41个月的治疗后死亡。一些作者认为,在2021年WHO CNS分类标准下的此类病例属于IDH野生型2 - 3级弥漫性星形细胞瘤的一个独立亚型。手术切除是治疗IDH突变型胶质瘤的关键第一步,更广泛的切除与OS的改善相关。在本研究的LGG患者中,61%的患者进行了两次手术切除,首次和第二次切除之间的平均间隔时间为67个月(范围从7到117个月)。
在HGG组中,在3名4级弥漫性星形细胞瘤患者中发现了IDH1 R132H突变。突变谱是弥漫性星形细胞瘤所特有的,包括TP53和ATRX基因的突变、1例TERTp突变以及1例CDKN2A/B缺失,CDKN2A/B缺失被视为4级星形细胞瘤的一个标志性特征。所有患者年龄均小于30岁,且都进行了2次或3次手术切除。对近期复发的肿瘤进行了基因检测,经过组织学检查后,这些患者的原发肿瘤被判定为2级或3级弥漫性星形细胞瘤。据报道,高级别胶质瘤表型的形成与替莫唑胺驱动的超突变以及CDKN2A和CCND2获得性变异相关,这些变异已被证实仅出现在放疗后的IDH突变型胶质瘤中。
IDH野生型胶质母细胞瘤仍然是最常见的恶性成人型弥漫性胶质瘤。本研究患者胶质母细胞瘤样本的突变谱包括频发突变TERTp(71.8%)、PTEN(37.3%)、TP53(27.3%)、EGFR(13.6%)、NF1(11.8%)、RB1(11.8%)、PIK3CA(4.5%)、PIK3R1(4.5%)、PTPN11(4.5%)、SPTA1(3.6%)、PIK3CB(1.8%)和MTOR(1.8%)。此外,CDKN2A/B缺失(32.7%)、PTEN位点缺失(37.3%)、EGFR位点扩增(38.2%)、染色体4q12(10%)、12q13(8.1%)和12q15(6.3%)扩增、17p13缺失(15.4%)、7号染色体获得(22%)和10号染色体缺失(46%)在胶质母细胞瘤标本中常见。PDGFRA、KIT和KDR基因定位于染色体4q12区域,在胶质母细胞瘤的发生发展中起关键作用。染色体12q13和12q15区域扩增分别涉及CDK4和MDM2基因。CDK4基因被认为在胶质母细胞瘤中调节细胞侵袭和干性,而MDM2基因在p53通路中起重要作用。染色体17p13区域(TP53基因的定位区域)的杂合性缺失发生在许多癌症中,并且通常与预后不良相关。在本研究的胶质母细胞瘤患者队列中发现的突变频率与其他研究的结果一致。值得注意的是,在一些亚洲胶质母细胞瘤患者中已经描述了不同的突变模式。
神经胶质瘤样本中受影响的信号通路:
胶质瘤中最常变异的基因涉及与癌症发展和进展相关的不同信号通路。酪氨酸激酶受体(RTKs),即EGFR、PDGFR、VEGFR和FGFR及其配体的过表达是胶质瘤发生过程中最常见的变异之一,导致其下游分子通路的异常激活。所有这些信号通路形成一个复杂的网络,调节许多细胞过程。在本研究样本中,EGFR基因的扩增或突变,以及PDGFRA和KIT基因的扩增,可能导致它们的过表达,在HGG IDH野生型胶质母细胞瘤中普遍存在。此外,影响PTEN、PI3K家族和MTOR基因(PI3K/AKT/ MTOR信号轴的关键参与者)的突变和重排在IDH野生型胶质母细胞瘤(80%)中比LGG(38%)更常见。在另一项研究中,基因组分析也在21.7%的IDH突变的弥漫性胶质瘤中预测了PI3K/AKT/mTOR通路活性。然而,当检测蛋白表达时,56.6%的样本检测到PI3K/AKT/mTOR信号通路的激活。因此,综合研究可以更充分地评估肿瘤细胞中信号通路活性的水平。
RAS/MAPK信号通路在胶质瘤的发生中也起着重要作用,而RAS癌基因的负调控因子NF1基因在成人型胶质瘤中最常受影响。在本研究中,NF1基因的功能缺失突变在LGG(6%)和HGG(12%)样本中均被发现。TP53基因是肿瘤中最常见的失调控基因之一,尤其是在胶质瘤中,而蛋白53是TP53/MDM2/MDM4通路的核心部分,该通路在响应DNA损伤或其他细胞变化时变得活跃。与HGG(27%)相比,TP53基因临床相关突变在LGG中更常见(44%),可能是因为TP53/MDM2/MDM4通路受损在LGG中更具有特征性。
CDKN2A基因的蛋白产物p16通过与RB1基因编码的视网膜母细胞瘤抑癌基因相互作用,在细胞周期调控中发挥重要作用。此外,CDKN2A/B参与了p16INK4a/CDK4/RB1通路和TP53/MDM2/MDM4通路。在本研究中,相比于LGG(5%)样本,CDKN2A/B缺失或RB1突变(可能影响p16INK4a/CDK4/RB1通路)主要见于HGG(44%)。
因此,在整个HGG样本和IDH野生型胶质母细胞瘤(占97%的病例)中,基因组谱预测最重要的细胞信号通路有非常高水平的损伤。
原发性和复发性胶质母细胞瘤的突变谱:
研究者比较了原发性胶质母细胞瘤肿瘤和第二次或第三次切除后获得的复发胶质母细胞瘤的突变谱。除了TERT和EGFR外,研究者没有发现原发肿瘤和复发肿瘤的基因突变谱和频率有实质性的差异。在本研究中,与复发肿瘤样本相比,TERTp突变(77% vs. 56.4%,p = 0.01)和EGFR扩增(47.9 vs. 20.5%,p = 0.01)在原发性胶质母细胞瘤中更常见。先前的研究表明,PTEN变异在原发性胶质母细胞瘤中普遍存在,而EGFR扩增在复发性肿瘤中普遍存在。在其他研究中,拷贝数变异(CNV)在复发肿瘤中更为常见,CDKN2A/B缺失显著富集,但该研究包括IDH1/2突变型胶质瘤,其中CDKN2A/B缺失是肿瘤进展的标志。胶质母细胞瘤是一种突变负荷低的肿瘤,因此肿瘤的进化和新突变的出现比其他癌症慢得多。第1次手术与第2次手术的间隔时间为3 ~ 89个月,平均16个月。同时,建议尽可能从最新的肿瘤组织样本进行分子检测,以提供最准确的分子分析。以前,复发样本中平均TMB的增加被发现是由于替莫唑胺治疗引起的超突变。在本研究中,TMB的变化范围为0 ~ 18 mut/Mb,中位值为3 mut/Mb,但有1例MSH6突变的原发性胶质母细胞瘤样本的TMB为82 mut/Mb。之前已经在至少一个错配修复(MMR)基因(MLH1、MSH2、MSH6和PMS2)突变的原发性和复发性胶质母细胞瘤样本中描述了超突变表型。据报道,在其他癌症中,较高的突变负荷与纳武利尤单抗或帕博利珠单抗的疗效相关,但只有MMR缺陷和高TMB的一小部分胶质瘤患者可能从免疫检查点抑制剂单药治疗中获益。
临床特征和总生存期:
在本队列的131例胶质瘤患者中,13例患者有另一种癌症,发生在CNS肿瘤之前。所有患者的CNS肿瘤均为IDH野生型胶质母细胞瘤。根据SEER项目数据,0.09%的患者发生了系统性恶性肿瘤之后的原发性恶性脑肿瘤,胶质母细胞瘤是最常见的病理类型,占所有第二原发性CNS肿瘤的68.4%。更多情况下,第二原发性中枢神经系统肿瘤发生于前列腺癌、乳腺癌、皮肤黑色素瘤或膀胱癌患者。在本研究中,最常见的首发恶性肿瘤是结直肠癌、乳腺癌和膀胱癌。SPGB患者最常见的基因变异为CDKN2A/B缺失(46%)、TERTp突变(61%)、PTEN缺失(54%)、TP53突变(23%)和EGFR扩增(54%)。
生存分析显示,在整个胶质瘤患者队列中,肿瘤分级低和IDH1/2突变是预后较好的独立因素。因此,本研究的IDH野生型胶质母细胞瘤患者与LGG IDH野生型患者和HGG IDH突变型患者相比,预后最差,这与许多其他研究结果一致。研究者发现,若在胶质母细胞瘤之前存在其他部位患癌病史,会极大地降低生存率,并且这种不良的预后价值与其他特征无关。
胶质母细胞瘤的治疗主要基于尽可能大范围的切除;当至少80%的肿瘤体积被切除时,预后被认为是良好的。然而,全切除(GTR)并非总能实现,因为这可能会影响大脑中有重要功能且敏感的区域。在这些情况下,运用术前及术中神经影像学技术就显得尤为重要。功能磁共振成像(fMRI)已在神经生理学研究中被广泛应用,并且已证实在针对因存在神经功能缺损风险不确定而先前被认为无法切除的患者进行术前神经外科规划时特别有用。
二次手术是少数患者的一种治疗选择,通常是由于患者临床状况不佳或大脑关键区域受到累及,有资格接受二次手术的患者比例大约为20% - 30%。目前关于后续手术干预在复发性胶质母细胞瘤中所起作用的数据仍然缺乏临床证据。与此同时,多项研究已证实了再次手术在复发性胶质母细胞瘤治疗中的潜在益处,可使患者生存期延长。在本研究中,手术干预次数对胶质母细胞瘤患者来说很关键,那些接受了不止一次切除手术的患者预后更好。这可能与患者初始身体状况较好以及肿瘤进展较慢有关,因为人们认为接受再次手术的患者通常更年轻,卡氏功能状态评分(KPS≥70)更高,且肿瘤体积更小。此外,复发性胶质母细胞瘤患者生存期的延长可能与将再次手术、再次放疗以及化疗作为联合治疗手段有关,相较于单独使用这些治疗方法,联合使用能产生更显著的效果。
由于尚无公认的二线化疗方案,患者通常会按照试验性的治疗方案接受治疗。贝伐珠单抗能高特异性地与VEGF结合并阻断血管生成,在治疗疾病进展方面已展现出较高的应答率。然而,据观察这种效果持续时间不长,这可能是由于血管通透性发生了变化。在多项临床研究中,贝伐珠单抗已显示出能提高无进展生存期,但OS获益情况并非总能被稳定观察到。在本研究中,观察到使用贝伐珠单抗治疗的患者在最初两年内其生存率有显著提高,但大约三年后这种差异几乎消失了。为了最大限度地发挥贝伐珠单抗治疗的益处,会将贝伐珠单抗与其他治疗手段联合使用以增强协同抗肿瘤效果。在本研究中,34%的患者接受了贝伐珠单抗联合治疗。另一个被认为会影响放疗与替莫唑胺联合治疗疗效的关键参数是MGMT启动子的甲基化状态,它已被证实是胶质母细胞瘤患者身上唯一兼具预后和预测价值的分子特征。已表明MGMT未甲基化的患者从化疗中获益有限,而且他们对放疗的反应可能也会降低。在本研究中,MGMT甲基化患者的中位生存期更长,但差异并不显著,这可能是由于已知甲基化状态的参与者数量有限。
突变对总生存期的影响:
过去十年中的多项研究已经探究了患者生存期与TP53、PTEN、EGFR和TERT启动子基因突变以及CDKN2A/B缺失之间的关联。纯合性CDKN2A/B缺失作为IDH野生型胶质母细胞瘤患者生存期更差的独立预后生物标志物的作用已被指出,但有关其他基因的数据存在很大争议。研究者发现患者生存期与TERTp突变和PTEN缺失存在显著关联,二者均是预后更差的生物标志物;而其他基因变异并未对临床结局产生显著影响。此外,在本研究的复发性胶质母细胞瘤患者中,TERTp突变较为少见,其具有更好的预后价值。多项研究也报道了TERTp突变具有负面的独立预后影响,而其他研究则表明,TERTp突变的不良影响与相关分子及临床因素(如高龄、IDH野生型状态以及MGMT启动子未甲基化)的存在相关。对于PTEN变异也观察到了同样的情况。在多项研究中,PTEN突变与总生存期改善相关,然而其他报告则表明,PTEN突变对IDH野生型胶质母细胞瘤患者的临床结局有负面影响。已发现10q23/PTEN纯合性缺失与生存期缩短相关,尤其在45岁以上的患者中更是如此。同时,CDKN2A、CDKN2B、EGFR、PTEN、TERT启动子以及TP53基因的突变影响已被证实与手术切除范围相关,而且这些基因中任意基因的突变与全切除(GTR)相结合可能会使生存期得到改善。
因此,在影响预后的基因因素中,IDH1/2突变的影响最为显著。其他频繁突变基因的变异对胶质瘤患者的总生存期影响则要小得多。与此同时,了解该疾病的分子特征并识别出特定的受损基因,为靶向细胞内进程提供了巨大的潜力。相当多的胶质瘤患者可发现潜在可干预的分子变异(多达76%的病例),但实际上,只有约10%的患者被认为可从分子靶向药物中获益。事实上,在胶质瘤和胶质母细胞瘤患者中发现的最常见分子变异(CDKN2A/2B、PTEN、TP53、TERT、PIK3CA/B以及EGFR变异)并没有可用于治疗中枢神经系统肿瘤的临床有效药物。
分子靶向治疗:
在本研究使用靶向药物治疗的患者中,NTRK抑制剂恩曲替尼显示出了最佳疗效,实现了持久的完全缓解。恩曲替尼此前已在携带NTRK基因变异的成人晚期及转移性实体瘤以及儿童CNS肿瘤患者中进行过试验。本研究使用恩曲替尼治疗的患者起初也具备有利的临床背景(年纪较轻且患低级别胶质瘤);在另一名通过免疫组化检测到NTRK表达增加的胶质母细胞瘤患者中,使用NTRK抑制剂拉罗替尼并无益处。在其他研究中,泛FGFR激酶抑制剂厄达替尼已取得了有前景的结果。在本研究中,一名使用厄达替尼治疗的患者出现了毒性反应,导致治疗中断。曲美替尼是一种MEK1/2抑制剂,已被发现对治疗BRAF V600E突变型胶质瘤有效,并且也正在NF1突变患者的治疗中进行试验。本研究未显示出曲美替尼在胶质母细胞瘤患者治疗中有积极效果。在另一名患有巨细胞胶质母细胞瘤且有NF1突变的患者中,使用依维莫司(mTOR抑制剂)或许产生了影响,但该患者因感染新冠病毒而死亡。由于一名患者可能携带多种可采取相应治疗措施的突变,包括那些影响肿瘤进展的突变,这些突变之间复杂的相互作用可能会影响单一靶向药物治疗的结果。此外,胶质瘤可能具有显著的肿瘤间及肿瘤内基因组异质性,而且在疾病进展过程中,复发的肿瘤可能会转变为与细胞、组织学及分子特征变化相关的不同表型。
研究的局限性:
本研究存在若干局限性。首先,研究者在对样本进行测序时使用了两种不同的靶向基因检测 panel,它们在所检测基因的数量上有所不同。不过,这两种 panel 都极具代表性,几乎涵盖了目前已知的所有与中枢神经系统肿瘤发生发展相关的具有临床意义的基因。
其次,弥漫性胶质瘤,尤其是胶质母细胞瘤,具有高度的肿瘤内异质性特征;因此,不同的肿瘤部位其突变谱可能存在差异。为尽量减少此类误差,研究者对部分样本的突变谱进行了重复研究。
第三,在本研究中,研究者并未考虑术中干预的程度,尽管切除范围可能会影响临床结局。这在一定程度上是由研究设计导致的,因为研究者纳入了在其他中心接受首次手术的患者,而这些数据无法获取。
第四,本研究的样本量不是很大,这可能导致在分析各种临床及基因因素对生存期的影响时,无法得出具有统计学意义的差异。样本量小是因为大部分样本是前瞻性的,研究者不仅采集了肿瘤样本,还采集了外周血样本作为正常组织。这使研究者能够更准确地识别肿瘤样本中的体细胞突变和染色体重排。
总 结
本研究证实了下一代测序技术在胶质瘤患者中的临床应用价值。治疗效果和临床结局主要取决于肿瘤的恶性程度以及IDH的突变状态。研究表明,较低的肿瘤恶性程度以及存在IDH1/2突变是预后较好的独立因素,这与其他研究结果相符。在IDH野生型胶质母细胞瘤患者中,既往身体其他部位患癌病史非常重要,且会大幅降低总生存期。此外,治疗细节(一次或多次手术、贝伐珠单抗治疗)也是预后因素。与原发性胶质母细胞瘤且仅接受一次切除手术的患者相比,复发胶质母细胞瘤且接受多次手术的患者总生存期更高。贝伐珠单抗治疗在最初的两年内提高了生存率,但从更长时间来看,这种效果消失了。TERTp突变和PTEN缺失会降低胶质母细胞瘤患者的总生存期,而其他基因标志物的影响并不显著。基因组分析结果被用于为一小部分患者选择分子靶向治疗。在一名携带NTRK融合基因的患者身上,使用恩曲替尼取得了最为成功的疗效,其总生存期超过66个月,治疗时长超过30个月。因此,可能需要进行NGS分析,让更多患者参与新型靶向药物的临床试验,以便为生存期较差的患者群体找到有效的治疗方法。
参考文献:
Varachev, V.; Susova, O.; Mitrofanov, A.; Naskhletashvili, D.; Krasnov, G.; Ikonnikova, A.; Bezhanova, S.; Semenova, V.; Sevyan, N.; Prozorenko, E.; et al. Genomic Profiling in Glioma Patients to Explore Clinically Relevant Markers. Int. J. Mol. Sci. 2024, 25, 13004. https://doi.org/10.3390/ijms252313004

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)