首页 > 医疗资讯/ 正文
牙周炎是一种常见的慢性炎症性疾病,与大自噬(或称宏自噬)密切相关,后者在维持牙周稳态中起着双重作用。尽管自噬在牙周炎中的重要性已被广泛认识,但自噬与牙周炎发病机制之间的精确关系尚未完全阐明。
2024年12月11日,浙江大学丁佩惠和王慧明共同通讯在Autophagy在线发表题为“USP4 depletion-driven RAB7A ubiquitylation impairs autophagosome-lysosome fusion and aggravates periodontitis”的研究论文。该研究揭示了由去泛素化酶USP4(泛素特异性肽酶4)水平降低介导的RAB7A的泛素化,干扰了正常的溶酶体转运和自噬体-溶酶体融合,从而在牙周炎的进展中发挥重要作用。
具体来说,通过对临床牙龈样本的基因组学和组织学分析,作者观察到在牙周炎中RAB7A的表达下降以及自噬活性的受损。通过实验性牙周炎小鼠进一步证实,RAB7A的失活直接影响了自噬效率,并推动了牙周炎的进展。接下来,作者探讨了RAB7A在促进溶酶体转运动态和自噬体-溶酶体融合中的作用,结果显示,RAB7A的泛素化抑制了由牙周致病菌普氏牙龈卟啉单胞菌(Porphyromonas gingivalis,P. g.)刺激的巨噬细胞中的这些过程。最后,通过蛋白质组学分析,作者揭示了RAB7A的泛素化是由USP4介导的,并验证了USP4的上调可以减轻体内牙周炎的症状。总之,这些发现突出了USP4和RAB7A之间的相互作用,作为治疗牙周疾病的潜在靶点,具有重要的临床应用前景。

牙周炎是一种全球第六大常见的口腔炎症性疾病,是导致牙齿丧失的主要原因,进而影响咀嚼功能、美容效果和生活质量。牙周炎的病因逐渐被认为涉及口腔致病菌与宿主免疫反应之间的复杂相互作用。这些相互作用包括致病菌逃避免疫系统的策略以及口腔微生物群组成的变化。值得注意的是,普氏牙龈卟啉单胞菌(Porphyromonas gingivalis,P. g.)由于其能够干扰宿主的固有免疫防御,被公认为牙周炎发展的关键致病菌。其毒力因子使P. g.能够进入血液或脑脊液,与冠心病、类风湿性关节炎和阿尔茨海默病等全身性疾病相关联。
大自噬(或称宏自噬)是细胞的重要自我降解过程,涉及一系列步骤:起始、核化、吞噬体的形成和延伸、以及自噬体与溶酶体的融合。自噬对于维持牙周组织的平衡至关重要,能够通过抑制炎性细胞因子如IL1B/IL-1β(一种在牙周感染早期升高的细胞因子)来防止牙槽骨吸收。研究表明,经典自噬和非经典自噬形式(如LC3相关吞噬/LAP)均能抑制IL1B的产生和释放。在缺乏自噬的情况下,脂多糖(LPS)刺激的巨噬细胞会依赖NLRP3激活产生过量的IL1B。来自体外实验的越来越多的证据表明,不同类型的牙周组织细胞(如牙龈上皮细胞、牙龈成纤维细胞和巨噬细胞)在暴露于P. g.时会激活自噬。然而,最近的研究揭示了一个矛盾的发现:P. g.通过增强溶酶体的外排,干扰了自噬流,阻止自噬体与溶酶体的融合,并在口腔上皮细胞中诱导了IL1B的产生。同样,在人类树突状细胞和大鼠心肌细胞中,P. g.通过激活AKT-MTOR通路或切割VAMP8,避免自噬降解,从而加剧了炎症。值得注意的是,受损的自噬与多种器官的炎症性组织损伤加重有关,如肝脏、肺脏和肾脏。基于这些发现,作者提出,自噬的状态(无论是增强还是受损)可能在牙周炎的不同阶段发生波动。
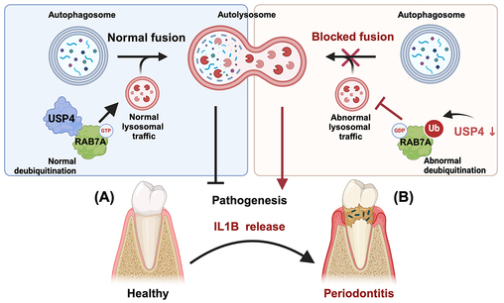
模式机理图(图片源自Autophagy)
已知,自噬体与溶酶体的融合是自噬降解功能的关键步骤,这一过程受多种膜动力学调节因子的调控,包括可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体(SNAREs)、牵引蛋白、V-ATP酶和RAB7A等。其中,RAB7A在自噬体与溶酶体融合过程中的重要性已被多项研究强调,它对溶酶体的生物合成、定位和功能至关重要。与其他GTP酶类似,RAB7A在其无活性形式(结合GDP)和活性形式(结合GTP)之间循环,依赖于GTP的结合。在活跃状态下,RAB7A招募RILP(Rab交互溶酶体蛋白),促进自噬体靠近细胞核聚集并与溶酶体融合。近期研究表明,RAB7A功能的缺失或破坏会损害肺动脉内皮细胞和外周感觉神经元的功能,这与肺动脉高压和Charcot-Marie-Tooth 2B型疾病的发展相关。这些发现提示,RAB7A的缺失或失活可能也有助于牙周炎的发展。
因此,深入研究影响RAB7A活性的因素,对于确定精准的治疗靶点至关重要。已知RAB7A的泛素化修饰调控其功能,包括协调膜转运动力学以及与下游效应蛋白如RILP的相互作用。研究揭示,PRKN(Parkin)介导的RAB7A泛素化在稳定该蛋白并增强其与RILP结合以实现有效的囊泡转运方面起着至关重要的作用。类似地,E3泛素连接酶TRAF6介导的RAB7A泛素化促进其与STX17(一种对于成熟自噬体至关重要的SNARE蛋白)的结合,从而促进自噬体与溶酶体的融合。此外,研究还表明,去泛素化酶USP32使非泛素化的RAB7A能够有效介导晚期内体的负极端转运(核转运)。有趣的是,可逆的泛素化作为一种分子开关,使RAB7A在其不同功能角色之间交替。
研究中,作者通过生物信息学和临床牙龈标本的组织学分析,系统地比较了牙周炎患者与健康对照组之间自噬水平和RAB7A表达的差异。随后,采用实验性牙周炎小鼠模型,作者探讨了RAB7A失活和自噬受损如何促进牙周炎的发病机制。此外,作者还通过体外实验分析了RAB7A活性及其在调节溶酶体转运、自噬体-溶酶体融合和IL1B释放中的作用。在这一过程中,作者发现去泛素化酶USP4(泛素特异性肽酶4)是调节RAB7A泛素化及其功能的关键因子。最后,作者验证了USP4的表达,并探讨了其与牙周炎中IL1B的相关性,综合证实了减少USP4介导的RAB7A泛素化破坏了正常的溶酶体转运动力学,损害了自噬体-溶酶体的融合,并显著促进了牙周炎的进展。
原文链接:
https://doi.org/10.1080/15548627.2024.2429371
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)