首页 > 医疗资讯/ 正文
引言
精神压力被广泛认为是心血管疾病(CVD)的一个重要危险因素。大量临床和实验研究表明,长期的精神压力会增加患心血管疾病的风险,尤其是在易感个体中。无论是急性压力还是慢性压力,都会对心血管健康产生不利影响。尽管这是一个广为人知的常识,但在具体的生理和分子机制方面,我们仍然缺乏深入的理解。
RBM24是一种RNA结合蛋白,参与调节mRNA的选择性剪接和翻译起始。RBM24在心肌细胞和非肌肉头部区域呈高表达,在小鼠和斑马鱼中的缺失导致胚胎、心脏、眼睛和内耳发育异常。出生后条件性敲除RBM24,会表现出扩张型心肌病、心力衰竭。在成年小鼠心脏中过表达Rbm24诱导心脏纤维化。然而,关于RBM24磷酸化在机体中的功能仍不清楚。
2024年11月23日,华中农业大学张敏教授、华中科技大学王擎教授、山东职业学院李辉教授等研究机构合作的一项最新研究揭示了精神压力诱发心血管疾病的关键分子机制。该研究发表在Nature Communications杂志上,题目为“Dysregulated RBM24 phosphorylation impairs APOE translation underlying psychological stress-induced cardiovascular disease”。研究首次明确了RNA结合蛋白RBM24的S181位点磷酸化在精神压力与心血管健康之间的重要桥梁作用。

研究结果
1. 精神压力导致RBM24 S181A KI小鼠行为及心脏电生理异常
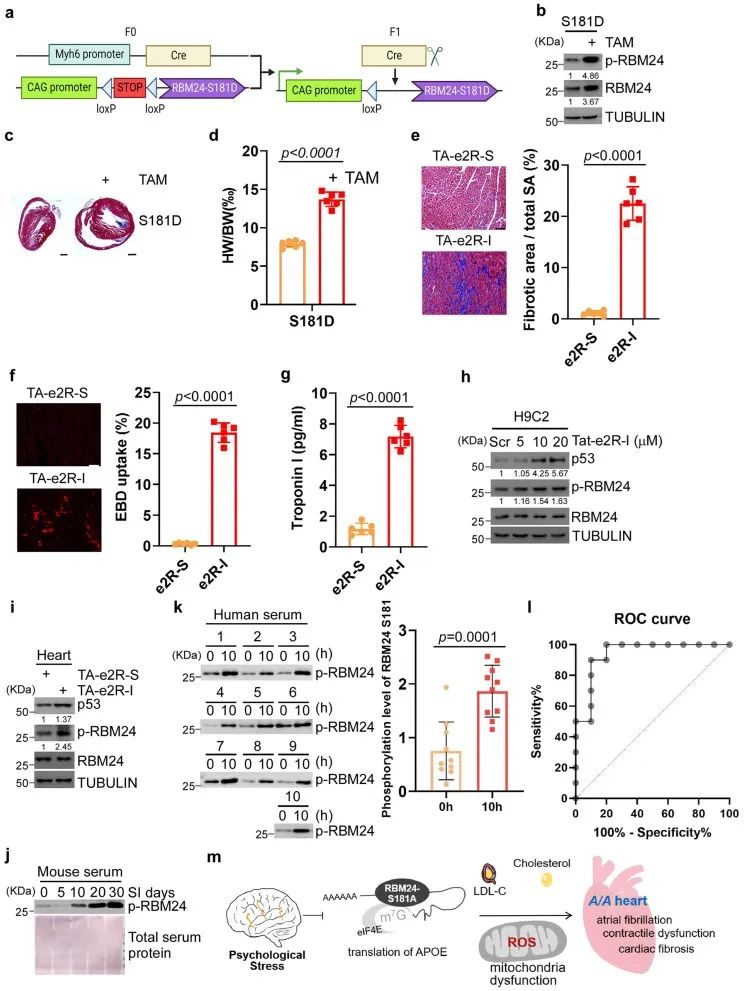
研究团队构建了RBM24 S181A KI小鼠模型,该模型中RBM24 S181位点被突变为丙氨酸,从而无法发生磷酸化。首先,通过注射肾上腺素来诱导急性应激反应,结果显示,S181A KI小鼠的四肢力量显著下降,最大和平均握力均低于野生型小鼠。此外,当小鼠暴露于TMT(狐狸粪便提取物)以诱发先天的恐惧反应时,S181A KI小鼠表现出完全“冻结”反应,几乎不动,显示出行为异常。进一步地,对急性压力下的S181A KI小鼠进行心电图监测,发现这些小鼠出现了房颤,主要表现为RR间期不规律及P波消失。在低剂量肾上腺素注射后,通过社会隔离模型诱发慢性压力,S181A KI小鼠表现出明显的心脏收缩功能障碍。这些结果揭示了RBM24 S181磷酸化在调节压力反应中的生理功能,特别是其磷酸化状态如何影响心脏的耐受能力。
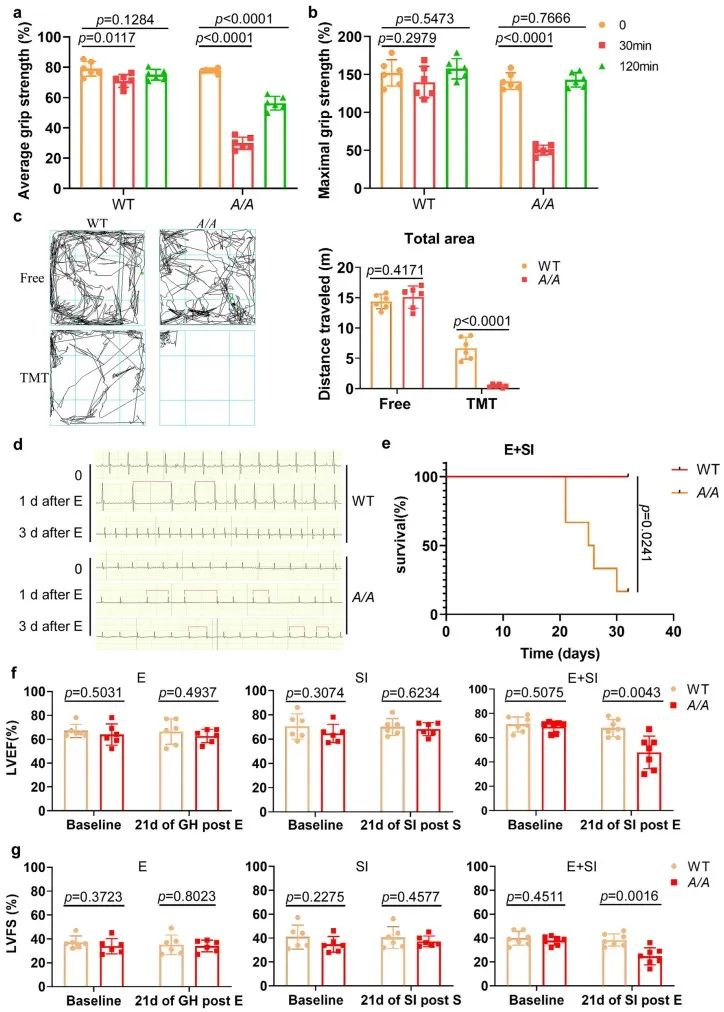
2. 精神压力导致RBM24 S181A KI小鼠心脏损伤和心脏纤维化
心脏纤维化是导致心脏收缩功能障碍和房颤的主要原因之一。在急性压力下,S181A KI小鼠的心肌细胞膜通透性增加,并且心肌损伤标志物Tn-I显著升高。在慢性压力下,RBM24 S181A KI小鼠的心脏发生了纤维化,而野生型小鼠的心脏没有明显变化。这些研究结果提示,RBM24的S181位点磷酸化在应对由应激引起的心脏病理变化中可能发挥重要的保护作用。
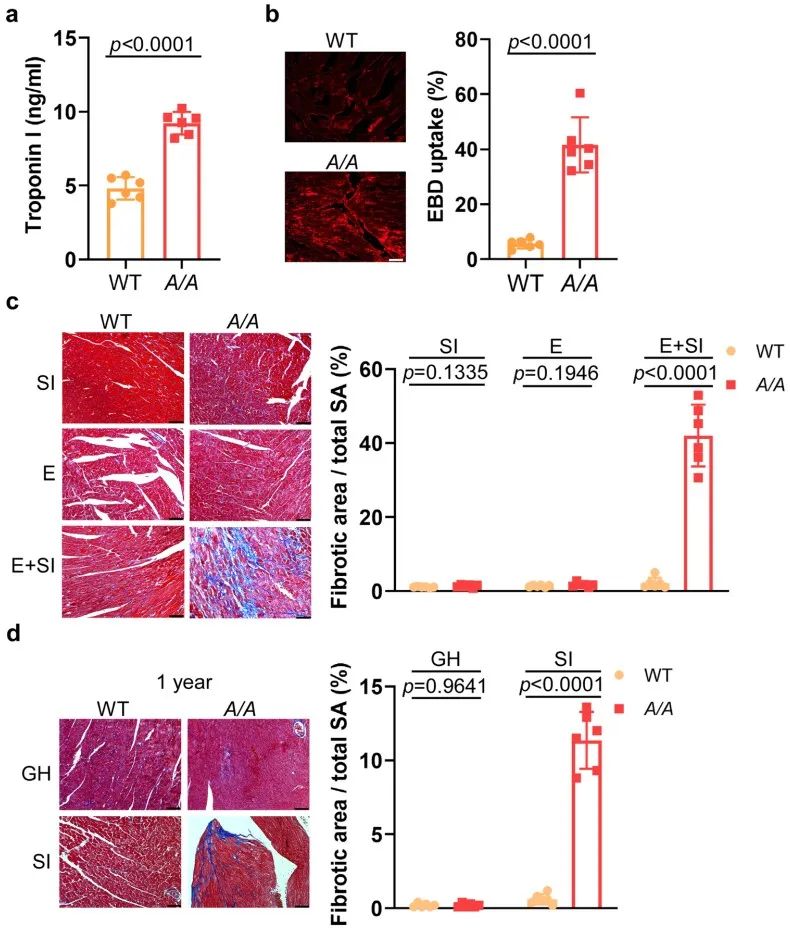
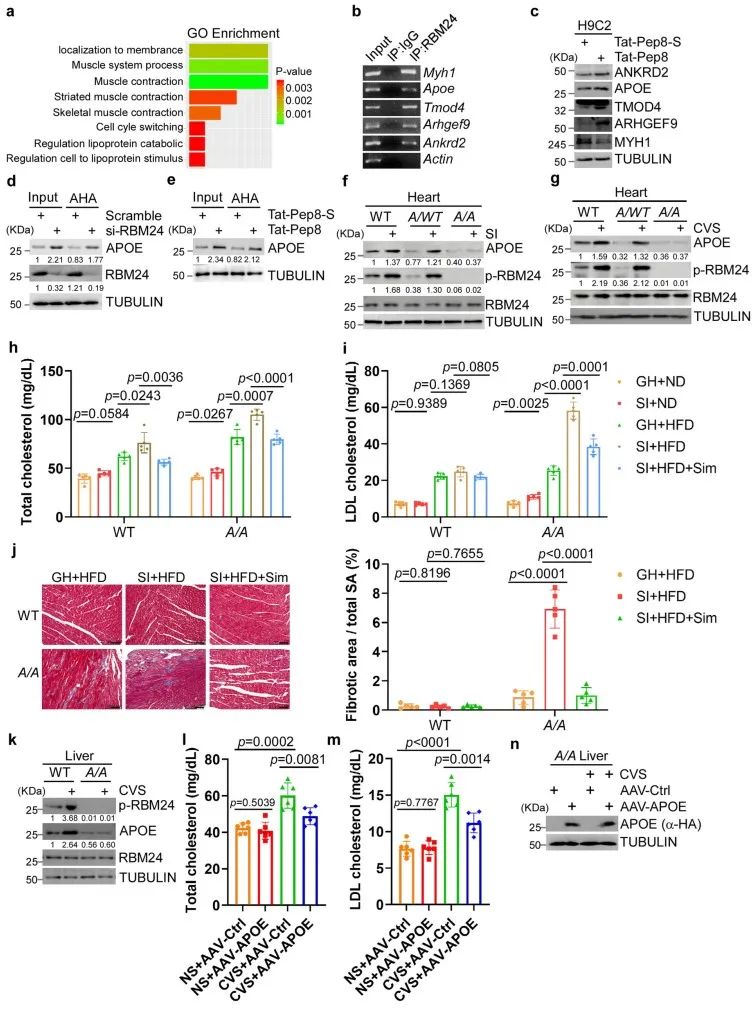
3. S181A KI小鼠心肌细胞中APOE翻译被抑制,导致血脂异常和纤维化
研究团队进一步探讨了S181A KI小鼠在心脏表型中的分子机制。通过翻译组测序(RNC-Seq),鉴定出25个关键基因受RBM24调控,其中大多数基因包含RBM24结合的mRNA基序(GUGUG或GAGUG)。在这些基因中,APOE与心血管疾病和血脂异常密切相关。进一步通过EMSA、RNA-ChIP、AHA等实验,证明了RBM24与APOE mRNA的结合以及APOE受RBM24 S181磷酸化调控。由于APOE与脂质代谢相关,在慢性压力模型下,发现S181A KI小鼠的血清中总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平显著升高,心脏发生纤维化。相比之下,野生型小鼠并未表现出类似的变化。这一效应可以通过HMG-CoA还原酶抑制剂(如他汀类药物)逆转。这些研究结果表明,RBM24的S181磷酸化在调节脂质代谢和应对由应激引起的心脏病理变化中发挥着重要的保护作用。
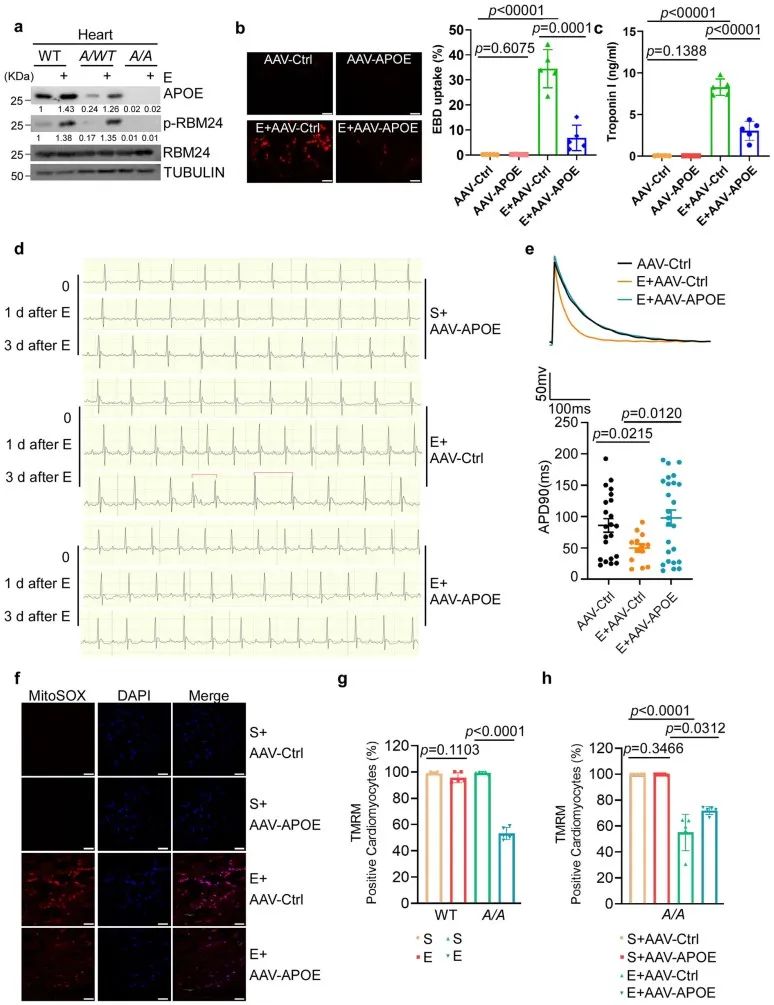
4. APOE过表达可拯救S181A KI小鼠在急性和慢性压力下诱发的心脏异常
研究团队通过蛋白质谱比较了急性压力下S181A KI小鼠和野生型小鼠心脏中的蛋白质表达变化。结果显示,S181A KI小鼠对压力更为敏感,压力导致的差异蛋白数量更多,且下调表达的蛋白质明显与线粒体功能和脂质代谢密切相关。因此,RBM24 S181磷酸化在压力条件下可能通过调节脂质代谢和线粒体功能,影响心脏的健康。进一步研究证明,在S181A KI小鼠心肌细胞中过表达APOE能够减轻肾上腺素引起的心肌损伤,同时显著减少心律不齐等心脏电生理异常。此外,APOE过表达还改善了心肌细胞的电位,延长了APD90(动作电位持续时间),减少了房颤发生的几率。一致的是,S181A KI小鼠在急性应激下表现出明显的线粒体功能障碍,包括线粒体膜电位下降和ROS水平升高。而APOE过表达可以显著减少ROS生成以及恢复线粒体膜电位。同时,APOE过表达也能够有效地减轻慢性压力引起的心脏纤维化和小鼠心功能收缩障碍。这些结果表明,APOE在压力引发的心脏病理变化中起着关键作用,并进一步强调了APOE在线粒体稳态及应对氧化应激中的重要保护作用,从而减轻心脏纤维化和收缩功能障碍。
5. RBM24 S181磷酸化激活的分子机制
研究团队在细胞和小鼠水平证明,GSK3β介导了急性压力和慢性压力对RBM24磷酸化的调控。进一步发现,eIF4E2-GSK3β-RBM24复合物是调控RBM24 S181磷酸化的关键信号通路。具体来说,eIF4E2与GSK3β的相互作用会促进RBM24 S181的磷酸化,而eIF4E2与RBM24的直接相互作用则可能抑制这种磷酸化。综合来看,RBM24 S181磷酸化由GSK3β-eIF4E2-RBM24相互作用调控,并处于一种动态平衡中。这种动态平衡对心脏健康至关重要。

6. 持续的RBM24 S181磷酸化也会造成心脏异常
然而,研究人员也发现,RBM24磷酸化的持续激活同样对心脏有害,这表明RBM24的磷酸化水平存在“过犹不及”的现象。虽然适度激活的RBM24磷酸化可以保护心脏,但长期或持续的压力会导致其过度激活,从而对心脏产生负面影响。因此,避免持续的精神压力或恢复RBM24的磷酸化水平至正常状态,对于心脏健康至关重要。
7. RBM24 S181磷酸化是一个潜在预估高压人群心脏健康的血清标志物
研究通过对小鼠、大鼠和兔子进行社会隔离实验,发现压力可以激活心脏中RBM24 S181的磷酸化,并且这一变化可以在血清中检测到。特别是,研究团队对健康人类志愿者进行了10小时的社会隔离实验,发现在隔离后血清中的RBM24 S181磷酸化水平显著高于隔离前。这一发现为未来开发非侵入性精神压力检测工具提供了重要依据,并间接证明了RBM24的S181磷酸化在人类心脏保护中的重要作用。
研究结论
这项研究从分子机制上深化了对精神压力与心血管疾病关系的理解,为潜在的治疗策略提供了重要方向。研究团队认为,基于RBM24磷酸化异常的疾病模型更贴近人类心血管疾病的自然发展过程及其多方面的病理表型。通过进一步探究精神压力如何激活RBM24的磷酸化信号转导机制,并干预RBM24的磷酸化途径,有望预防精神压力对心脏的损害,从而服务于“治未病”的策略。
华中农业大学张敏教授、华中科技大学王擎教授、山东职业学院李辉教授为该论文的通讯作者;华中农业大学博士毕业生(现清华大学基础医学院博士后)杨鹤、华中农业大学博士毕业生(现清华大学生物医学工程学院博士后)孙雷、华中科技大学博士生白雪梅为该论文的第一作者。本项目得到国家重点研发项目(应激反应诱导心脑失能和猝死的分子与发育机制)、国家自然基金面上项目等支持。
原文链接:
https://www.nature.com/articles/s41467-024-54519-0
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)