首页 > 医疗资讯/ 正文
[摘要] 膀胱癌是常见的泌尿系统恶性肿瘤之一,严重威胁着中国人民的生命健康。近年来,随着人均寿命的延长,以及人口老龄化的加速,膀胱癌的发病率和死亡率呈逐年上升趋势。提高早期膀胱癌的检出率并进行及时有效的治疗,既可改善患者的预后和生存质量,又能减轻其经济负担,但目前中国尚缺乏膀胱癌早诊早治的统一规范。因此,中国肿瘤医院泌尿肿瘤协作组的相关专家,根据近年的膀胱癌国内外指南、研究进展和临床实践经验,通过专家会议讨论、德尔菲问卷调查等形式,对专家意见进行调查汇总、归纳整理和修改完善,最终形成《膀胱癌早诊早治专家共识(2024年版)》。希望通过本共识,推进中国膀胱癌早诊早治的规范化,也为相关临床工作者提供相应的指导意见和规范依据。本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册号为PREPARE-2024CN458。
[关键词] 膀胱癌;早诊早治;共识
[Abstract] Bladder cancer is one of the common cancers of urinary system, which seriously threatens the life and health of Chinese population. In recent years, with the extension of life expectancy and the acceleration of aging, the incidence and mortality rates of bladder cancer are increasing year by year. Enhancing the detection rate of early bladder cancer followed by prompt and effective treatment can not only improve the prognosis and quality of life of patients, but also reduce their economic burden. However, there is still a lack of standardization for early diagnosis and treatment of bladder cancer in China. Therefore, based on the recent guidelines, research and clinical practice experience of bladder cancer, clinical experts in Urologic Chinese Oncology Group summarized and refined the opinions from expert meeting and Delphi questionnaire survey, and finally developed “expert consensus on early diagnosis and treatment of bladder cancer (2024 edition)”. We hope that this consensus will promote the standardization for early diagnosis and treatment of bladder cancer in China, and provide corresponding guidance and standardized criteria for urologic oncologist. The consensus has been registered on Practice guideline REgistration for transPAREncy (PREPARE) with the registration number PREPARE-2024CN458.
[Key words] Bladder cancer; Early diagnosis and treatment; Consensus
《膀胱癌早诊早治专家共识(2024年版)》
中国肿瘤医院泌尿肿瘤协作组
通信作者
-
叶定伟 | 复旦大学附属肿瘤医院泌尿外科
执笔专家
-
朱一平 | 复旦大学附属肿瘤医院泌尿外科
参与共识讨论的专家
(按姓氏汉语拼音字母排序)
-
边家盛 | 山东省肿瘤医院泌尿外科
-
崔 巍 | 中国医学科学院肿瘤医院检验科
-
陈惠庆 | 山西省肿瘤医院泌尿外科
-
陈海戈 | 上海交通大学医学院附属仁济医院泌尿外科
-
陈光勇 | 首都医科大学附属北京友谊医院病理科
-
范晋海 | 西安交通大学附属第一医院泌尿外科
-
何朝宏 | 河南省肿瘤医院泌尿外科
-
胡志全 | 华中科技大学同济医学院附属同济医院泌尿外科
-
胡 滨 | 辽宁省肿瘤医院泌尿外科
-
姜艳芳 | 吉林大学第一医院基因诊断中心
-
李长岭 | 中国医学科学院肿瘤医院泌尿外科
-
廖 洪 | 四川省肿瘤医院泌尿外科
-
刘卓炜 | 中山大学附属肿瘤医院泌尿外科
-
刘 南 | 重庆大学附属肿瘤医院泌尿外科
-
路 军 | 首都医科大学附属北京朝阳医院病理科
-
涂新华 | 江西省肿瘤医院泌尿外科
-
许 华 | 复旦大学附属肿瘤医院泌尿外科
-
王海涛 | 天津医科大学第二医院肿瘤科
-
王 鹏 | 北京大学第三医院健康管理中心
-
王奇峰 | 复旦大学附属肿瘤医院病理科
-
王小林 | 南通市肿瘤医院泌尿外科
-
姚 欣 | 天津医科大学肿瘤医院泌尿外科
-
杨 勇 | 北京大学肿瘤医院泌尿外科
-
叶定伟 | 复旦大学附属肿瘤医院泌尿外科
-
张爱莉 | 河北医科大学第四医院泌尿外科
-
张 朋 | 四川大学华西医院泌尿外科
-
周良平 | 复旦大学附属肿瘤医院放射诊断科
-
周晓燕 | 复旦大学附属肿瘤医院病理科
-
朱绍兴 | 福建医科大学附属协和医院泌尿外科
-
朱一平 | 复旦大学附属肿瘤医院泌尿外科
-
邹 青 | 江苏省肿瘤医院泌尿外科
膀胱癌是常见的泌尿系统恶性肿瘤之一。最新发布的数据显示,2022年中国预计新发膀胱癌9.29万例,其中男性7.32万例,其发病率居男性所有恶性肿瘤的第8位;预计死亡4.14万例,其中男性3.25万例[1]。膀胱癌是严重威胁中国人民生命健康的恶性肿瘤之一,如何有效地降低膀胱癌的疾病负担是亟待解决的重大公共卫生问题。
肌层侵袭和远处转移是膀胱癌患者死亡或预后不良的主要因素。肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC)患者的5年总生存率为50%左右,转移性膀胱癌患者的5年总生存率更低至5%,而非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer,NMIBC)患者的5年生存率则高达90%[2-4]。研究显示,大部分的MIBC患者是在诊断时发现的,而不是NMIBC患者进展后发现,提示早诊可以有效地降低肌层浸润和转移性膀胱癌的发生率[5]。
已有研究[6-8]表明,对膀胱癌开展早诊早治,可以显著地提高早期病变检出率,改善患者预后和生活质量。但迄今为止,中国尚缺乏膀胱癌早诊早治的相关专家共识。为此,中国肿瘤医院泌尿肿瘤协作组的相关专家,结合膀胱癌相关的指南和规范、国内外近年的文献报道和临床实践,编制了《膀胱癌早诊早治专家共识(2024年版)》。本共识将在国内膀胱癌领域学术会议上进行宣讲。计划每两年更新一次,纳入最新的研究成果和技术进展,为患者提供更为个体化和精准化的治疗方案。
本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册号为PREPARE-2024CN458。
1 共识的制定方法
1.1 共识专家构成
共有31名来自上海、北京、天津、广东、山东、福建、四川、江苏、湖北、江苏等16个不同省市自治区的专家参与问卷咨询与调研。
1.2 系统全面检索相关文献
检索的英文数据库包括PubMed、Embase和Cochrane Library,中文数据库包括中国知网(CNKI)、万方数据库和中国生物医学文献数据库,检索时限均为建库至2024年3月23日。英文文献检索词主要包括bladder cancer、early diagnosis、non-muscle-invasive bladder cancer、muscle-invasive bladder cancer、transurethral rep of bladder tumors、radical cystectomy、intravesical instillation、minimal residual disease、follow-up strategies;中文文献检索词主要包括膀胱癌、早期诊断、非肌层浸润性膀胱癌、肌层浸润性膀胱癌、经尿道膀胱肿瘤切除术、根治性膀胱切除术、灌注治疗、微小残留病灶、随访策略。我们排除了非中英文、学位论文、索引目录、无法获取全文的文献及重复发表的文献。经过文献的检索、筛选和证据总结后,开始初步撰写“草稿”。
1.3 德尔菲问卷调查法
通过德尔菲问卷调查法就膀胱癌早诊早治相关“草稿”进行专家函询。投票设置“非常同意”“基本同意”“不确定或不同意”3个选项,专家可对“草稿”的每个章节提出修改意见。每次调查结束后,根据专家的反馈意见对 “草稿”进行修改或增补。鉴于德尔菲问卷调查法目前尚无统一标准化的赞同水平,参考相关共识的形成方法,若同意率(即选择“非常同意” 或“基本同意”的专家人数比例)≥75%则认为该章节达成共识。
1.4 共识的证据分级
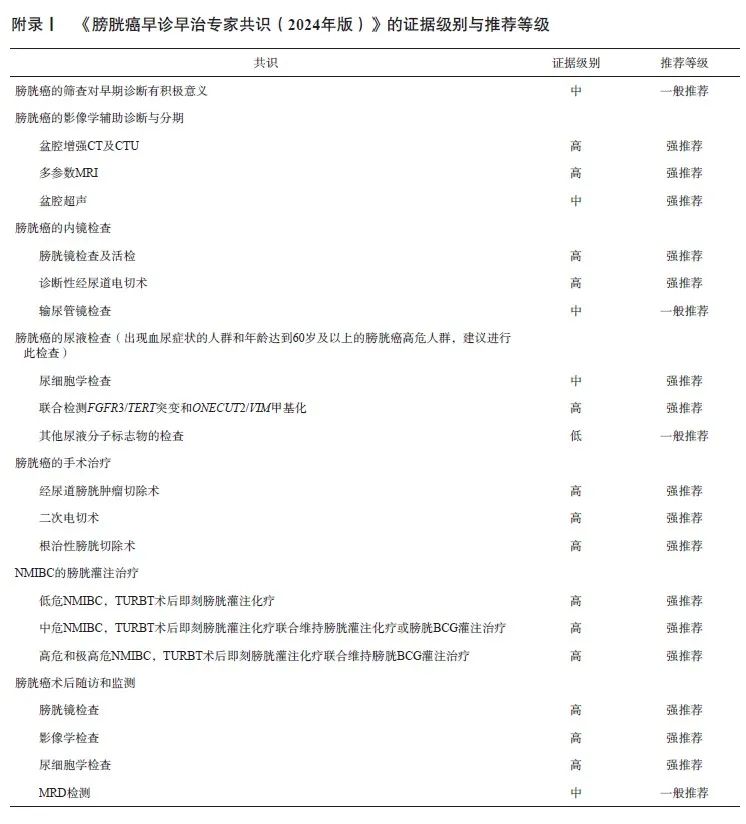
专家小组对证据和共识的分类采用推荐意见分级的评估、制定及评价(Grading of Recommendations, Assessment, Development and Evaluation,GRADE)系统[9](表1)。

2 问卷及检索结果
2.1 问卷收集情况
共开展了2次问卷调查,31名专家参与问卷填写,收集了53条专家建议。汇总分析2次问卷数据,基于审核专家的一致意见,删除了部分内容,调整或增补专家意见,最终纳入本共识的内容均达成共识。最后经审核并部分修改后定稿。
2.2 文献检索结果
根据检索策略检索数据库,共检出相关文献610篇。按照纳入和排除标准初步筛选得到文献442篇,通过阅读题目和摘要进行再次筛选得到文献79篇,进一步阅读全文剔除文献30篇,最终纳入有效文献49篇。其中,纳入的绝大部分文献发表在中文核心期刊和SCI收录期刊上,确保了纳入研究的质量。文献筛选流程见图1。
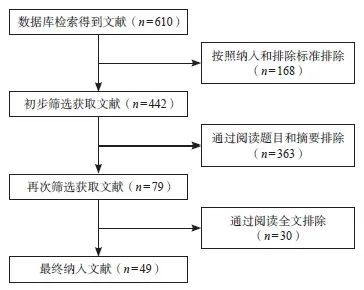
图1 文献筛选流程图
3 共识达成情况
3.1 膀胱癌的筛查和早期诊断
3.1.1 膀胱癌筛查现状
目前,大规模的膀胱癌筛查研究正在积极开展。在一项研究[10]中,1 575名50岁及以上的男性人群通过连续时间段内的血尿试纸检测方法进行膀胱癌筛查。结果显示,258名(16.4%)男性血尿检测阳性,其中21名(8.1%)最终诊断为膀胱癌。进一步与509例新诊断为膀胱癌的未筛查患者进行比较发现,经筛查男性被诊断为MIBC的比例显著低于未经筛查的男性(4.8% vs 23.6%)。在历时14年的随访中,经筛查男性的疾病特异性死亡率显著降低,其中经筛查发现的膀胱癌患者没有1例死于膀胱癌,而未经筛查发现的膀胱癌患者死于膀胱癌的比例为20.4%。另一项研究17名(3.6%)被诊断为膀胱癌,且所有患者均为NMIBC。在7年的随访中,经筛查发现的膀胱癌患者仅有3例死于膀胱癌。此外,一项利用尿液NMP22检测方法对1 502名无症状高危人群(50岁以上且有10年以上吸烟史或15年以上高风险职业暴露)的膀胱癌筛查研究[12]中,85名(5.7%)参与者NMP22检测阳性,其中2名被诊断为膀胱癌。上述数据表明,在无症状人群中进行膀胱癌筛查可以早期发现膀胱癌,并可能提高生存率。尽管目前还缺乏强有力的临床证据支持膀胱癌筛查,但筛查对于膀胱癌的早期诊断似有重要意义。
共识:膀胱癌的筛查对早期诊断有积极意义,其证据级别为中,推荐级别为一般推荐(附录Ⅰ)。
3.1.2 非肌层浸润性膀胱癌的定义
非肌层浸润性膀胱癌是指局限于膀胱黏膜层(Tis期、Ta期)及固有层(T1期),即肌层未见浸润的膀胱恶性肿瘤[13]。
3.1.3 早期检查的获益人群
3.1.3.1 膀胱癌高危因素
膀胱癌的发生、发展是多因素和多步骤的病理学变化过程,其发病机制尚未完全清楚,内在的遗传因素与外在的环境因素可能均有重要作用。与膀胱癌发生相关的高危因素如下:① 长期吸烟史;② 有油漆、染料、化工、金属或石油产品等职业接触史;③ 一级亲属有膀胱癌病史;④ 饮水少,有经常染发和憋尿的习惯;⑤ 接受过盆腔部位的放射治疗;⑥ 曾使用过环磷酰胺或异环磷酰胺等抗肿瘤药物;⑦ 曾服用过含马兜铃酸的中草药,如广防己、青木香、天仙藤、马兜铃、寻骨风和朱砂莲等;⑧ 饮用砷含量高的水,如某些地区的地下水砷含量超标;⑨ 反复急慢性膀胱感染史,包括血吸虫引起的膀胱感染。
3.1.3.2 膀胱癌的早期临床表现及检查策略
血尿是膀胱癌患者最常见的临床表现,80%~90%的患者以间歇性、无痛性全程肉眼血尿为首发症状,仅少数患者表现为镜下血尿。部对2 356名60~85岁的男性人群利用血尿试纸检测方法进行膀胱癌筛查,474名(20.1%)男性血尿检测阳性,其中分膀胱癌患者会伴有膀胱刺激症状,如尿频、尿急或尿痛等。另外,有少部分患者是在体检或因其他疾病进行例行检查时无意中发现膀胱癌[14- 16]。
参考国内外膀胱癌早诊策略,结合最新的高质量临床研究证据,建议中国膀胱癌早诊的流程如下:对于出现血尿症状的人群,需进行尿细胞学及尿液肿瘤标志物联合影像学检查:① 如果任一项阳性或异常,需进行膀胱镜检查;② 如果检查正常,但属于膀胱癌高危人群,且年龄≥60岁,需每年1次尿常规联合超声和尿液肿瘤标志物检查[17]。对于体检或其他疾病例行检查过程中发现的影像学检查结果异常的人群,需进行膀胱镜检查。
基于上述检查策略,具体的膀胱癌早诊建议流程见图2。
3.1.4 膀胱癌检查的技术或方法
3.1.4.1 影像学检查
⑴ 超声检查:超声是诊断膀胱癌常用的检测方法之一,具有无创、价廉、简便等特点。对于肿瘤突出于膀胱黏膜,且直径>0.5 cm的膀胱肿瘤,超声检出率高达90%以上[18]。经腹部超声检查诊断膀胱癌的灵敏度为63%~98%,特异度为99%[19]。但传统超声检查无法诊断膀胱原位癌(bladder carcinoma in situ,CIS),且对于膀胱内< 1 cm和位置隐蔽的占位性病变,容易漏诊。
⑵ 计算机体层成像(computed tomography,CT)检查:CT检查在诊断膀胱肿瘤和评估肿瘤浸润范围方面有一定价值。CT可以发现较小肿瘤(1~5 mm),对膀胱癌诊断的灵敏度为79% ~ 93%,特异度为94%~99%[20]。但CT检查不能诊断原位癌;很难准确地区分NMIBC(Ta、T1)和T2-3a期膀胱癌;不能区分肿大淋巴结是肿瘤转移还是炎症。
⑶ CT尿路造影(CT urography,CTU):建议膀胱多发性肿瘤、高危肿瘤及膀胱三角区肿瘤患者行CTU检查。CTU能提供上尿路、周围淋巴结和邻近器官的状态等信息,可替代传统静脉尿路造影(intravenous urography,IVU)检查[14-16]。
⑷ 磁共振成像(magnetic resonance imaging,MRI)检查:MRI检查的软组织分辨率较高,能够诊断并进行肿瘤分期。动态增强MRI在尿路上皮癌诊断中的准确率高于CT,对淋巴结的显示与CT相仿,对于一些小病灶的显示也优于非增强MRI。多参数MRI检查对于评估膀胱癌肌层是否受侵犯有重要价值,其灵敏度为90%~94%,特异度为87%~95%[21]。高场强(3.0 T)MRI扫描可以提高诊断灵敏度和特异度[14-16]。
共识:对于膀胱癌的影像学辅助诊断与分期,盆腔增强CT及CTU证据级别为高,多参数MRI证据级别为高,盆腔超声检查证据级别为中,推荐级别均为强推荐(附录Ⅰ)。
3.1.4.2 内镜检查
⑴ 膀胱镜检查及活检:膀胱镜检查和活检是膀胱癌诊断的最可靠方法,可以在直视下观察肿瘤的数目、大小、形态、部位、生长方式及周围膀胱黏膜的异常情况,并对肿瘤和可疑病变进行活检以明确病理学类型。近年来,新的成像技术如荧光膀胱镜和窄带成像膀胱镜的应用,使膀胱镜检查的准确性显著提高。
⑵ 荧光膀胱镜:荧光膀胱镜检查能发现普通膀胱镜难以观察到的小肿瘤或原位癌,与普通膀胱镜相比可提高14%~25%的检出率[22-23]。当怀疑有CIS或尿细胞学检查阳性而普通膀胱镜检查未见异常时,建议选择荧光膀胱镜进一步检查。
⑶ 窄带成像(narrow band imaging,NBI)膀胱镜:NBI膀胱镜显示膀胱黏膜表面微细结构和黏膜下血管时较传统的白光模式内镜会更清晰,立体感更强,有助于早期发现与诊断微小病灶。NBI膀胱镜对膀胱肿瘤和CIS诊断的灵敏度和准确率均优于普通膀胱镜。当同时使用两者进行检查时,只能通过NBI膀胱镜发现而普通膀胱镜未发现的肿瘤占17.1%,反之仅占1.9%。42%尿细胞学阳性而普通膀胱镜检阴性患者通过NBI膀胱镜检查时发现膀胱肿瘤[24-25]。
3.1.4.3 诊断性经尿道电切术(transurethral rep,TUR)
如果影像学检查发现膀胱内有肿瘤样病变,可以省略膀胱镜检查,直接行诊断性TUR,其目的一是切除肿瘤,二是明确肿瘤的病理学诊断和分级、分期,为进一步治疗及判断预后提供依据。
3.1.4.4 输尿管镜检查
对膀胱癌伴随可疑上尿路病变的患者,通过CTU或MRU检查仍无法明确诊断时,可进行诊断性输尿管镜检查和活检[14-15]。
共识:对于膀胱癌的内镜检查,膀胱镜检查及活检、诊断性经尿道电切术的证据级别均为高,推荐级别均为强推荐。对膀胱癌伴随可疑上尿路病变者,输尿管镜检查的证据级别为中,推荐级别为一般推荐(附录Ⅰ)。
3.1.4.5 尿液检查
⑴ 尿细胞学检查:尿细胞学检查是膀胱癌诊断和术后随访的重要方法之一。尿细胞学检测膀胱癌的灵敏度为13%~75%,特异度为85%~00%,且灵敏度与肿瘤分级呈正相关[26]。尿标本中癌细胞数量少、细胞的不典型或退行性变、泌尿系统感染、结石、膀胱灌注治疗和检查者的技术差异等因素会影响尿细胞学检查结果[14]。
⑵ 尿液分子标志物检查:目前已有多种相对成熟的膀胱肿瘤尿液分子标志物检查技术,如尿荧光原位杂交(fluorescence in situ hybridization,FISH)、核基质蛋白22(nuclear matrix protein 22,NMP22)、膀胱肿瘤抗原(bladder tumorantigen,BTA)相关检查(BTA Stat及BTA TRAK)和免疫-细胞检测等。
① FISH:FISH检测具有较高的灵敏度和特异度,特异度低于尿细胞学检查。有膀胱炎症、结石、放疗等病史者的尿液标本中,FISH结果的特异度降低[27]。UroVysion 2001年被美国食品药品管理局(Food and Drug Administration,FDA)批准用于膀胱癌的诊断。② NMP22检测:NMP22在膀胱癌中呈现高表达,并可在肿瘤细胞凋亡后释放到尿液中,其诊断灵敏度为52%~69%,特异度为87%~89%[28]。③ BTA Stat及BTA TRAK检测:当患者患有膀胱癌时,尿液中BTA浓度(U/mL)会显著升高[29]。BTA Stat诊断灵敏度为57%~82%,特异度为68%~93%。BTA TRAK诊断灵敏度为66%~77%,特异度为5%~75% [28]。④ 免疫-细胞检测:检测的目标是膀胱癌细胞表达的癌胚抗原和黏蛋白,诊断灵敏度为60%~100%,特异度为75%~84%[28]。
⑶ DNA和RNA检测:基于尿液DNA或RNA检测膀胱癌的技术也逐渐成为近年来的研究热点,有望成为膀胱癌无创诊断的新方法。
① DNA检测:DNA检测是利用尿液DNA的基因突变和甲基化等特征对膀胱癌进行诊断,基因突变和甲基化等特征对膀胱癌进行诊断,近年来成为研究的热点之一。多项研究表明,TERT、FGFR3、VIM和ONECUT2是膀胱癌早期诊断的重要标志物[30-35]。例如,通过检测FGFR3、TERT和KRAS基因突变,对膀胱癌的诊断灵敏度为93.3%,特异度为80.0%[31];通过检测VIM、GDF15和TMEFF2的甲基化,对膀胱癌的诊断灵敏度可达94%,特异度可达100%[32];基于对ONECUT2、OSR1、SIM2、OTX1和MEIS1的甲基化检测,对膀胱癌的诊断灵敏度为82%,特异度为82%[34]。越来越多的研究[36-38]表明,基于尿液DNA的多维度、多靶点联合检测在尿路上皮癌的诊断中具有重要价值,值得在临床进一步推广应用。其中,一项在复旦大学附属肿瘤医院、北京大学第一医院和天津医科大学第二医院三家中心招募的前瞻性、双盲、大型的临床研究[39]显示,通过联合检测FGFR3/TERT突变和ONECUT2/VIM甲基化,对尿路上皮癌的诊断灵敏度可达91.37%,特异度可达95.09%,且此方法能够同时早期检出膀胱癌和上尿路上皮癌,灵敏度分别为90.9%和92.9%。② RNA检测:基于尿液RNA的检测方法,是通过评估膀胱癌中特异基因的表达特征,以此实现对膀胱癌的早期诊断。研究显示,通过对IGFBP5、HOXA13、MDK、CDC2和CXCR2的mRNA表达量进行检测,其诊断膀胱癌的灵敏度为82%,特异度为85%[40]。通过检测CRH、IGF2、UPK1B、ANXA10和ABL1的mRNA表达,其诊断膀胱癌的灵敏度为73%,特异度为90%[41]。此外,有研究[42-46]发现,利用尿液中特定miRNA(miR-101,miR-126和miR-182等)和lncRNA(H19、HOTAIR、 HYMA1、MALAT1和UCA1等)的检测,也有助于膀胱癌的早期诊断。
共识:对于出现血尿症状的人群和年龄达到60岁及以上的膀胱癌高危人群,建议进行膀胱癌的尿液检查。尿细胞学检查的证据级别为中,推荐级别为强推荐。尿液分子标志物检查方法中,联合检测FGFR3/TERT突变和ONECUT2/VIM甲基化的方法,证据级别为高,推荐级别为强推荐;其他尿液分子标志物的检查方法,证据级别为低,推荐级别为一般推荐(附录Ⅰ)。
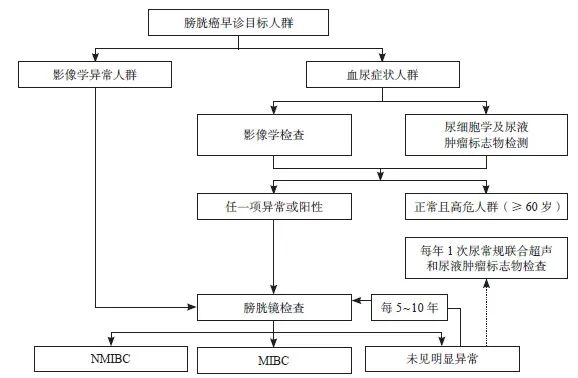
图2 膀胱癌早诊的建议流程
3.2 早期治疗
3.2.1 手术治疗
⑴ 经尿道膀胱肿瘤切除术(transurethral rep of bladder tumors,TURBT):TURBT是NMIBC的标准治疗方式,也是除极高危组外NMIBC的首选治疗方式。TURBT要求对内镜下可见的所有膀胱肿瘤行深达肌层的切除,肿瘤切除方式包括分块切除或整块切除。对于较小肿瘤(直径<1 cm),可将肿瘤与其基底的部分膀胱壁同时切除进行病理学检查;对于较大肿瘤,进行分块切除,直至露出正常的膀胱壁肌层。对于可疑CIS区域进行选择性活检,不要求全部切除。送检标本要求包含膀胱肌层成分,并尽量减少灼烧对标本组织的破坏[14-15]。
⑵ 二次电切术(Re-TURBT):不同分期的NMIBC在初次TURBT后均可能残留肿瘤。Re-TURBT的适应证包括:① 首次TURBT未切除全部肉眼可见肿瘤或怀疑存在残余病灶;② 首次TURBT标本中没有肌层组织(TaLG/G1肿瘤或原发性CIS除外);③ T1期肿瘤。
⑶ 根治性膀胱切除术(radical cystectomy,RC):RC的手术指征为无远处转移、局部可切除的MIBC(T2-4a,N0-x,M0);极高危和部分高危组的NMIBC。对于诊断为MIBC的患者,新辅助化疗后行RC并联合盆腔淋巴结清扫术,是这类人群的标准治疗方式。
经典的RC手术范围包括膀胱及周围脂肪组织、输尿管远端,同时行盆腔淋巴结清扫术;男性患者还应包括前列腺、精囊;女性还应包括子宫、部分阴道前壁、附件。如果肿瘤侵犯女性膀胱颈部或男性尿道前列腺部,或术中快速冷冻切片病理学检查显示切缘阳性,则应考虑同时行全尿道切除[47]。
共识:对于膀胱癌的手术治疗,TURBT、Re-TURBT在NMIBC治疗中的证据级别为高,推荐级别为强推荐。对于MIBC的治疗,RC的证据级别为高,推荐级别为强推荐;膀胱部分切除术的证据级别为中,推荐级别为一般推荐(附录Ⅰ)。
3.2.2 膀胱灌注治疗
3.2.2.1 NMIBC危险程度分组
NMIBC危险程度分组见表2。
3.2.2.2 膀胱灌注化疗
TURBT术后即刻膀胱灌注化疗能显著降低NMIBC患者的复发率,其原理是术后即刻灌注化疗能够杀灭术中播散或/和创面残留的肿瘤细胞[48-49]。因此,为了预防肿瘤细胞种植,应在术后24 h内尽早完成膀胱灌注化疗。当存在TURBT术中膀胱穿孔或术后严重肉眼血尿时,不建议术后即刻膀胱灌注化疗。低危NMIBC术后即刻灌注化疗可以显著降低复发率,可以不进行后续维持膀胱灌注化疗;中、高危NMIBC则需要诱导和维持膀胱灌注化疗或膀胱灌注卡介苗(Bacille Calmette-Guérin,BCG)治疗。
膀胱灌注化疗常用药物包括吡柔比星(常用剂量为每次30~50 mg)、表柔比星(常用剂量为每次50~80 mg)、多柔比星(常用剂量为每次30~50 mg)、羟基喜树碱(常用剂量为每次10~20 mg)、丝裂霉素(常用剂量为每次20~60 mg)和吉西他滨(常用剂量为每次1 000 mg)[14-16]。
3.2.2.3 膀胱灌注免疫治疗
膀胱灌注免疫治疗主要使用的药物是BCG,国内也有A群链球菌、红色诺卡菌细胞壁骨架等生物制剂,但这些生物制剂需要RCT和长期随访来完善相关证据[50-51]。BCG膀胱灌注适应证包括中、高危NMIBC和CIS。低危NMIBC不推荐BCG灌注治疗,高危NMIBC和CIS,强烈推荐BCG灌注[14-15]。
基于上述的治疗策略,具体的膀胱癌早期治疗流程如图3。
共识:对于NMIBC的膀胱灌注治疗,TURBT术后即刻膀胱灌注化疗在低危NMIBC中的证据级别为高,推荐级别为强推荐;TURBT术后即刻膀胱灌注化疗联合维持膀胱灌注化疗或膀胱BCG灌注治疗在中危NMIBC中的证据级别为高,推荐级别为强推荐;TURBT术后即刻膀胱灌注化疗联合维持膀胱BCG灌注治疗在高危和极高危NMIBC中的证据级别为高,推荐级别为强推荐(附录Ⅰ)。

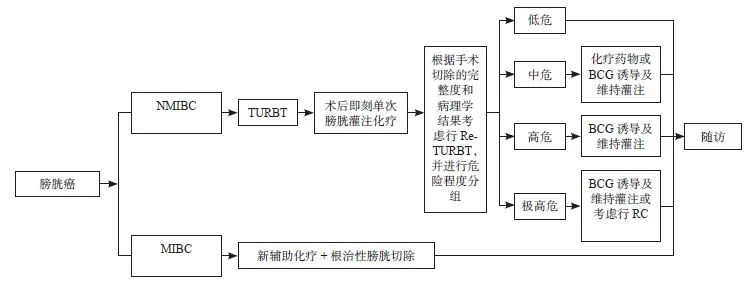
图 3 膀胱癌早期治疗的流程
3.3 术后随访和术后复发的早期监测
3.3.1 术后随访和监测的方法
3.3.1.1 膀胱癌的术后随访项目
TURBT的术后随访项目包括膀胱镜检查、影像学检查(上尿路影像学检查、腹盆腔影像学检查)和尿液细胞学检查等。
RC的术后随访项目包括体格检查、血液生化检查、影像学检查(胸腹部CT或MRI)和尿液细胞学检查等。
3.3.1.2 膀胱癌的分子残留病灶(molecular residual disease,MRD)检测
膀胱癌的MRD是指经过治疗后,常规实验室检测和传统的影像学检查没有发现,但通过分子生物学方法发现无创液体样本中存在肿瘤来源的分子异常,进而提示膀胱癌的持续存在或临床进展可能。近年来,膀胱癌中基于尿液肿瘤标志物对治疗后MRD的检测,取得了一些进展。例如,有研究[52]利用癌症个体化深度测序技术发现尿液DNA的基因突变在膀胱癌MRD的检测中具有重要作用,此方法能检测到91%最终复发的膀胱癌患者,且比膀胱镜检测能更早提示肿瘤复发。此外,国内的研究[53-54]显示,通过联合检测评估尿液DNA的基因突变和拷贝数变异,对膀胱癌治疗后MRD的检测灵敏度可达100%,并且在上尿路尿路上皮癌的术后监测中也具有潜在的应用价值。上述数据表明,MRD检测有助于评估膀胱癌的复发风险,但其能否指导膀胱癌患者的预后随访,仍需大规模的前瞻性临床试验进一步研究。
共识:对于膀胱癌术后随访和监测的方法,膀胱镜在TURBT后的证据级别为高,推荐级别为强推荐;影像学检查及尿液细胞学检查的证据级别为高,推荐级别为强推荐;膀胱癌的MRD检测的证据级别为中,推荐级别为一般推荐(附录Ⅰ)。
3.3.2 术后随访方案
3.3.2.1 TURBT的术后随访方案
推荐所有NMIBC 患者在术后3个月时进行第1次膀胱镜检查。低危患者如果第1次膀胱镜检查结果为阴性,建议术后1年时行第2次膀胱镜检查,以后每年1次,共5年。高危患者推荐术后两年内每3个月进行1次膀胱镜及尿细胞学检查,以后每6个月1次,5年后每年1次。中危患者的随访方案介于低危和高危患者之间。此外,中危和高危患者推荐每年1次上尿路影像学检查(CTU检查)[14-16]。
3.3.2.2 RC的术后随访方案
可根治性切除的膀胱癌患者术后3个月进行第1次检查,包括体格检查、血液生化检查,以及胸腹部CT或MRI,怀疑转移时可进行正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)检查。另外,可以进行尿液细胞学和尿液肿瘤标志物检查[14-16]。
4 总结
本共识根据新近的研究证据,在膀胱癌的筛查、早期诊断、早期治疗和术后随访等方面进行了推荐,并形成共识发布,以推进中国膀胱癌早诊早治的规范化,从而为相关临床工作者提供有效可行的指导意见和规范依据。然而,由于我国目前暂缺少膀胱癌筛查方面的大样本高质量循证医学研究,本土科学证据相对不足,共识制定工作组也将持续关注相关研究进展,在后续的共识更新时予以充实和完善。
利益冲突声明:所有作者均声明不存在利益冲突;本共识制订过程中无第三方提供赞助。
[参考文献]
[1]郑荣寿, 陈 茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3): 221-231.
ZHENG R S, CHEN R, HAN B F, et al. Cancer incidence and mortality in China, 2022 [J]. Chin J Oncol, 2024, 46(3): 221-231.
[2]PAKMANESH H, ANVARI O, FOREY N, et al. TERT promoter mutations as simple and non-invasive urinary biomarkers for the detection of urothelial bladder cancer in a high-risk region [J]. Int J Mol Sci, 2022, 23(22): 14319.
[3]GURNEY H, CLAY TD, OLIVEIRA N, et al. Systemic treatment of advanced and metastatic urothelial cancer: the landscape in Australia [J]. Asia Pac J Clin Oncol, 2023, 19(6): 585-595.
[4]LIU S T, HUI G, MATHIS C, et al. The current status and future role of the phosphoinositide 3 kinase/AKT signaling pathway in urothelial cancer: an old pathway in the new immunotherapy era [J]. Clin Genitourin Cancer, 2018, 16(2): e269-e276.
[5]LOBO N, AFFERI L, MOSCHINI M, et al. Epidemiology, screening, and prevention of bladder cancer[J]. Eur Urol Oncol, 2022, 5(6): 628-639.
[6]SHIRODKAR S P, LOKESHWAR V B. Potential new urinary markers in the early detection of bladder cancer[J]. Curr Opin Urol, 2009, 19(5): 488-493.
[7]KAMAT A M, HAHN N M, EFSTATHIOU J A, et al. Bladder cancer [J]. Lancet, 2016, 388(10061): 2796-2810.
[8]ARORA H C, FASCELLI M, ZHANG J H, et al. Kidney, ureteral, and bladder cancer: a primer for the internist [J]. Med Clin North Am, 2018, 102(2): 231-249.
[9]ATKINS D, BEST D, BRISS P A, et al. Grading quality of evidence and strength of recommendations [J]. BMJ, 2004, 328(7454): 1490.
[10]MESSING E M, MADEB R, YOUNG T, et al. Long-term outcome of hematuria home screening for bladder cancer in men [J]. Cancer, 2006, 107(9): 2173-2179.
[11]MAYFIELD M P, WHELAN P. Bladder tumours detected on screening: results at 7 years [J]. Br J Urol, 1998, 82(6):825-828.
[12]LOTAN Y, ELIAS K, SVATEK R S, et al. Bladder cancer screening in a high risk asymptomatic population using a point of care urine based protein tumor marker [J]. J Urol, 2009, 182(1): 52-57.
[13]中华人民共和国国家卫生健康委员会. 膀胱癌诊疗规范(2018年版). [EB/OL]. [2024-05-10] http://www.nhc.gov.cn/ewebeditor/uploadfile/2018/12/20181225162248671.doc.
National Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of bladder cancer (2018 edition) [EB/OL]. [2024-05-10] http://www.nhc.gov.cn/ewebeditor/uploadfile/2018/12/20181225162248671.doc.
[14]黄 健, 张 旭. 中国泌尿外科和男科疾病诊断治疗指南(2022版)[M]. 北京:科学出版社, 2022.
HUANG J, ZHANG X. Chinese guidelines for diagnosis and treatment of urology and andrology diseases (2022 edition) [M]. Beijing: Science and Technology Press, 2022.
[15]中华人民共和国国家卫生健康委员会. 膀胱癌诊疗指南(2022年版). [EB/OL]. [2024-05-10] http://www.nhc.gov.cn/yzygj/s2911/202204/a0e67177df1f439898683e1333957c74/files/7224e506d4a24b90a9df0424888ba38a.pdf.
National Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of bladder cancer (2022 edition). [EB/OL]. [2024-05-10] http://www.nhc.gov.cn/yzygj/s2911/202204/a0e67177df1f439898683e1333957c74/files/7224e506d4a24b90a9df0424888ba38a.pdf.
[16]中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)尿路上皮癌诊疗指南-2022 [M]. 北京:人民卫生出版社, 2022.
Guidelines Working Committee of the Chinese Clinical Oncology Society. Chinese Society of Clinical Oncology (CSCO) guidelines for the diagnosis and treatment of urothelial carcinoma-2022 [M]. Beijing: People’s Health Publishing House, 2022.
[17]上海市抗癌协会. 居民常见恶性肿瘤筛查和预防推荐(2023年版)[J]. 抗癌, 2023, 36(2): 1-25.
Shanghai Anticancer Association. Recommendations for screening and prevention of common malignancies among residents (2023 edition) [J]. Anti Cancer, 2023, 36(2): 1-25.
[18]NICOLAU C, BUNESCH L, PERI L, et al. Accuracy of contrast-enhanced ultrasound in the detection of bladder cancer [J]. Br J Radiol, 2011, 84(1008): 1091-1099.
[19]DATTA SN, ALLEN GM, EVANS R, et al. Urinary tract ultrasonography in the evaluation of haematuria-a report of over 1 000 cases [J]. Ann R Coll Surg Engl, 2002, 84(3): 203-205.
[20]RAMAN S P, FISHMAN E K. Bladder malignancies on CT: the underrated role of CT in diagnosis [J]. AJR Am J Roentgenol, 2014, 203(2): 347-354.
[21]HUANG L, KONG Q, LIU Z, et al. The diagnostic value of MR imaging in differentiating T staging of bladder cancer: a meta-analysis [J]. Radiology, 2018, 286(2): 502-511.
[22]KRIEGMAIR M, BAUMGARTNER R, KNÜCHEL R, et al. Detection of early bladder cancer by 5-aminolevulinic acid induced porphyrin fluorescence [J]. J Urol, 1996, 155(1): 105-109.
[23]DENZINGER S, BURGER M, WALTER B, et al. Clinically relevant reduction in risk of recurrence of superficial bladder cancer using 5-aminolevulinic acid-induced fluorescence diagnosis: 8-year results of prospective randomized study [J]. Urology, 2007, 69(4): 675-679.
[24]ZHU Y P, SHEN Y J, YE D W, et al. Narrow-band imaging flexible cystoscopy in the detection of clinically unconfirmed positive urine cytology [J]. Urol Int, 2012, 88(1): 84-87.
[25]NASELLI A, INTROINI C, TIMOSSI L, et al. A randomized prospective trial to assess the impact of transurethral rep in narrow band imaging modality on non-muscle-invasive bladder cancer recurrence [J]. Eur Urol, 2012, 61(5): 908-913.
[26] XYLINAS E, KLUTH LA, RIEKEN M, et al. Urine markers for detection and surveillance of bladder cancer [J]. Urol Oncol, 2014, 32(3): 222-229.
[27] 柳家园, 彭 翔, 宁向辉, 等. 尿脱落细胞荧光原位杂交检查阳性在尿路上皮癌中的临床价值[J]. 北京大学学报(医学版), 2017, 49(4): 585-589.
LIU J Y, PENG X, NING X H, et al. Clinical value of fluorescence in situ hybridization positive of exfoliated urothelial cells in urothelial carcinoma [J]. J Peking University (Health Sciences), 2017, 49(4): 585-589.
[28] NG K, STENZL A, SHARMA A, et al. Urinary biomarkers in bladder cancer: a review of the current landscape and future directions [J]. Urol Oncol, 2021, 39(1): 41-51.
[29] PRIOLO G, GONTERO P, MARTINASSO G, et al. Bladder tumor antigen assay as compared to voided urine cytology in the diagnosis of bladder cancer [J]. Clin Chim Acta, 2001, 305(1-2): 47-53.
[30] MAAS M, TODENHÖFER T, BLACK P C. Urine biomarkers in bladder cancer-current status and future perspectives [J]. Nat Rev Urol, 2023, 20(10): 597-614.
[31] BATISTA R, VINAGRE J, PRAZERES H, et al. Validation of a novel, sensitive, and specific urine-based test for recurrence surveillance of patients with non-muscle-invasive bladder cancer in a comprehensive multicenter study [J]. Front Genet, 2019, 10: 1237.
[32] COSTA VL, HENRIQUE R, DANIELSEN SA, et al. Three epigenetic biomarkers, GDF15, TMEFF2, and VIM, accurately predict bladder cancer from DNA-based analyses of urine samples [J]. Clin Cancer Res, 2010, 16(23): 5842-5851.
[33] GUO R Q, XIONG G Y, YANG K W, et al. Detection of urothelial carcinoma, upper tract urothelial carcinoma, bladder carcinoma, and urothelial carcinoma with gross hematuria using selected urine-DNA methylation biomarkers: a prospective, single-center study [J]. Urol Oncol, 2018, 36(7): 342.e15-342.e23.
[34] BEUKERS W, KANDIMALLA R, VAN HOUWELINGEN D, et al. The use of molecular analyses in voided urine for the assessment of patients with hematuria [J]. PLoS One, 2013, 8(10): e77657.
[35] WU Y, JIANG G, ZHANG N, et al. HOXA9, PCDH17, POU4F2, and ONECUT2 as a urinary biomarker combination for the detection of bladder cancer in chinese patients with hematuria [J]. Eur Urol Focus, 2020, 6(2): 284-291.
[36] VAN KESSEL K E, VAN NESTE L, LURKIN I, et al. Evaluation of an epigenetic profile for the detection of bladder cancer in patients with hematuria [J]. J Urol, 2016, 195(3): 601-607.
[37] VAN KESSEL K E, BEUKERS W, LURKIN I, et al. Validation of a DNA methylation-mutation urine assay to select patients with hematuria for cystoscopy [J]. J Urol, 2017, 197(3 Pt 1): 590-595.
[38] VAN KESSEL K E M, DE JONG J J, ZIEL-VAN DER MADE A C J, et al. A urine based genomic assay to triage patients with hematuria for cystoscopy [J]. J Urol, 2020, 204(1): 50-57.
[39] WU J, LIN Y, YANG K, et al. Clinical effectiveness of a multitarget urine DNA test for urothelial carcinoma detection: a double-blinded, multicenter, prospective trial [J]. Mol Cancer, 2024, 23(1): 57.
[40] O'SULLIVAN P, SHARPLES K, DALPHIN M, et al. A multigene urine test for the detection and stratification of bladder cancer in patients presenting with hematuria [J]. J Urol, 2012, 188(3): 741-747.
[41] WALLACE E, HIGUCHI R, SATYA M, et al. Development of a 90-minute integrated noninvasive urinary assay for bladder cancer detection [J]. J Urol, 2018, 199(3): 655-662.
[42] HANKE M, HOEFIG K, MERZ H, et al. A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-182 are related to urinary bladder cancer [J]. Urol Oncol, 2010, 28(6): 655-661.
[43] CHEN X. MiR-101 acts as a novel bio-marker in the diagnosis of bladder carcinoma [J]. Medicine (Baltimore), 2019, 98(26): e16051.
[44] MILOWICH D, LE MERCIER M, DE NEVE N, et al. Diagnostic value of the UCA1 test for bladder cancer detection: a clinical study [J]. Springerplus, 2015, 4: 349.
[45] GIELCHINSKY I, GILON M, ABU-LAIL R, et al. H19 noncoding RNA in urine cells detects urothelial carcinoma: a pilot study [J]. Biomarkers, 2017, 22(7): 661-666.
[46] YU X, WANG R, HAN C, et al. A panel of urinary long noncoding RNAs differentiate bladder cancer from urocystitis [J]. J Cancer, 2020, 11(4): 781-787.
[47] BLACK P, GONTERO P. SIU-ICUD consultation on bladder cancer 2018 [J]. World J Urol, 2019, 37(1): 1-2.
[48] BOSSCHIETER J, NIEUWENHUIJZEN J A, VAN GINKEL T, et al. Value of an Immediate Intravesical Instillation of Mitomycin C in patients with non-muscle-invasive bladder cancer: a prospective multicentre randomised study in 2 243 patients [J]. Eur Urol, 2018, 73(2): 226-232.
[49] MESSING EM, TANGEN CM, LERNER SP, et al. Effect of intravesical instillation of gemcitabine vs saline immediately following rep of suspected low-grade non-muscleinvasive bladder cancer on tumor recurrence: SWOG S0337 randomized clinical trial [J]. JAMA, 2018, 319(18): 1880-1888.
[50] 于顺利, 顾朝辉, 罗彬杰, 等. 红色诺卡菌细胞壁骨架膀胱灌注预防非肌层浸润性膀胱癌术后复发的疗效和安全性[J]. 中华泌尿外科杂志, 2019, 40(7): 521-525.
YU S L, GU C H, LUO B J, et al. The value of intravesical instillation of nocardiarubra cell wall skeleton in preventing recurrent after transurethral rep for the treatment of nonmuscle invasive bladder cancer [J]. Chin J Urol, 2019, 40(7): 521-525.
[51] 孙祥宙, 邓春华, 戴宇平, 等. 沙培林膀胱灌注预防膀胱癌术后复发的机制[J]. 临床泌尿外科杂志, 2004, 19(7): 407-409.
SUN X Z, DENG C H, DAI Y P, et al. Intravesical instillation of OK-432 in the prophylaxis of local recurrence after rep of bladder cancer [J]. J Clin Urol, 2004, 19(7): 407-409.
[52]DUDLEY J C, SCHROERS-MARTIN J, LAZZARESCHI D V, et al. Detection and Surveillance of Bladder Cancer Using Urine Tumor DNA [J]. Cancer Discov, 2019, 9(4): 500-509.
[53]YANG K, HU H, WU J, et al. Letter to the Editor: clinical utility of urine DNA for noninvasive detection and minimal residual disease monitoring in urothelial carcinoma [J]. Mol Cancer, 2023, 22(1): 25.
[54]左 炜, 郭璇骏, 唐 琦, 等. 一项新型基于尿液的utLIFE检测模型在UTUC早期诊断及术后监测中的价值研究[J]. 中华泌尿外科杂志, 2023, 44(9): 661-664.
ZUO W, GUO X J, TANG Q, et al. Application of a novel urine DNA predictor for non-invasive early diagnosis and monitoring minimal residual disease in upper tract urothelial carcinoma [J]. Chin J Urol, 2023, 44(9): 661-664.
猜你喜欢
- 专家:沙尘天加花粉季 过敏性疾病患者应减少外出
- 里程碑突破:碱基编辑疗法成功治愈白血病,让13岁小女孩重获新生
- EHA 2023 | 张毅教授:6个月CR达67%!双靶点FasTCAR-T细胞治疗复发/难治性B细胞淋巴瘤结果亮相EHA!
- BMC Endocr Disord:糖皮质激素治疗降低活动期中重度甲状腺相关眼病的高眼压
- 今起“地铁内进食”等7类行为将严格约束
- 【病例分享】高伴糖患者的血压治疗心得
- stroke:单纯血管内血栓清除术治疗大血管闭塞——基于 Meta 分析的成本效益评估
- 外泌体在皮肤科的应用前景
- 病例分享:这个肺部结节发现才1天,为何我们又立即建议她住院手术?
- 醋泡黑豆的做法
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)