首页 > 医疗资讯/ 正文
[摘要] 由于传统抗肿瘤手段在临床应用中具有特异度低、不良反应大的缺点,新型的抗肿瘤免疫疗法受到关注并逐渐得以应用。肿瘤免疫疗法通过调节机体免疫系统,增强抗肿瘤免疫应答以实现对肿瘤的控制和杀伤。肿瘤免疫疗法包括免疫检查点阻断疗法、过继细胞免疫治疗和肿瘤疫苗。其中,肿瘤疫苗通过递送肿瘤细胞特异性抗原刺激免疫系统产生特异性免疫细胞或抗体从而消除肿瘤细胞以达到治疗肿瘤的目的。近年来,mRNA疫苗相关领域迅速发展,所需的mRNA在合成及制备方面的工艺日趋成熟,为肿瘤mRNA疫苗的研究奠定了良好的基础。因mRNA具有易被降解、无法自主进入细胞等特点,此类疫苗需要合适的递送载体才能成功地被细胞摄取并发挥功效。因此,mRNA疫苗递送系统的发展成为其能否被更好地利用的关键,这也是在肿瘤治疗领域里mRNA疫苗能否被开发利用至临床阶段的重要一环。本文简要介绍肿瘤的免疫治疗方法、肿瘤疫苗种类和肿瘤mRNA疫苗的作用机制及制备方法,介绍用于肿瘤治疗的免疫疗法中mRNA疫苗及其常见的递送系统的研究进展和相关应用,并对进入临床试验阶段的肿瘤mRNA疫苗进行归纳和整理,以期为今后针对肿瘤的mRNA疫苗的研究工作提供帮助。
[关键词] mRNA疫苗;递送系统;抗肿瘤治疗;免疫治疗
[Abstract] Due to the drawbacks of low specificity and high risk of side effects of traditional anti-tumor treatments in clinical practice, novel anti-tumor immunotherapy has received attention and has been gradually applied. Tumor immunotherapy is to enhance the anti-tumor immune response by regulating the body’s immune system in order to achieve control and killing of tumors. Tumor immunotherapies include immune checkpoint blockade therapy, over-the-counter cellular immunotherapy and tumor vaccines. Among them, the tumor vaccine stimulates the immune system to produce specific immune cells or antibodies by delivering tumor cell-specific antigens thereby eliminating the tumor cells for the purpose of treating the tumor. In recent years, The field of mRNA vaccines is developing rapidly, and the required mRNA in the synthesis and preparation of the process has been developed and matured, laying a good foundation for the research of tumor mRNA vaccine. Because of the fact that mRNA is easily degraded and cannot enter the cell autonomously, this vaccine requires a suitable delivery vehicle to be successfully taken up by the cell to be effective. Therefore, the development of mRNA vaccine delivery systems has become critical for their better utilization, which is also an important part of whether mRNA vaccines can be developed and utilized for the clinical stage in the field of tumor therapy. This paper briefly introduced the immunotherapeutic methods for tumors, types of tumor vaccines and the mechanism of action and preparation methods of tumor mRNA vaccines, reviewed the research progress and related applications of mRNA vaccines and their common delivery systems in immunotherapy for tumor treatment, and summarized the tumor mRNA vaccines that entered into the phase of clinical trials with the aim of providing assistance for the research of mRNA vaccines for tumors in the future.
[Key words] mRNA vaccine; Delivery system; Anti-tumor therapy; Immunotherapy
肿瘤治疗方法的探究和开发是改善人类健康的关键环节。环境因素或遗传因素的改变可能是导致肿瘤形成的重要原因。尽管目前已有许多有效的肿瘤治疗方法进入临床或临床试验阶段,但在肿瘤预防和治疗方面仍需进一步探究[1]。当下肿瘤免疫治疗受到了极大关注,其中,将mRNA递送进细胞促使其发挥抗肿瘤免疫效果的mRNA疫苗及其递送系统则是研究的重要部分。
1 肿瘤免疫治疗及相关疫苗的类型和应用
恶性肿瘤细胞具有无限增殖、异常分化、高浸润性和转移性等生物学特征。肿瘤临床治疗中面临手术伤害大、化疗不良反应大、肿瘤细胞对药物的多药耐药性、术前肿瘤多发转移丧失手术机会以及原发肿瘤切除后复发等实际问题。因此,开发新的肿瘤治疗方法以及实现多种疗法相结合的治疗策略至关重要[2]。
1.1 肿瘤免疫治疗的主要方法
免疫治疗作为一种新型抗肿瘤治疗策略,通过调节机体免疫系统增强抗肿瘤免疫应答以实现对肿瘤的控制和杀伤。目前,肿瘤免疫治疗策略主要包括免疫检查点阻断疗法、过继细胞免疫治疗和肿瘤疫苗等(图1)。免疫检查点阻断疗法是通过利用免疫检查点抑制剂对免疫细胞中表达的免疫调节分子进行抑制以达到治疗肿瘤的目的[3-4],过继细胞免疫治疗是通过向患者输入经过刺激的T细胞达到杀伤肿瘤的作用[5],肿瘤疫苗是通过将特异性抗原呈递至抗原提呈细胞,随后刺激免疫系统激活并诱导机体产生细胞免疫和体液免疫应答以获得抗肿瘤免疫能力,进而控制肿瘤细胞增殖、转移和侵袭等[6]。
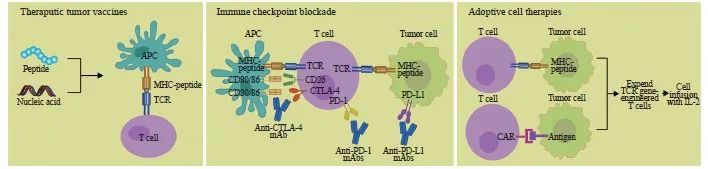
图1 肿瘤免疫治疗的3种主要方式
Fig. 1 Three main kinds of tumor immunotherapy methods
APC: Antigen presenting cell; MHC: Major histocompatibility complex; TCR: T cell receptor; CTLA-4: Cytotoxic T lymphocyte associated antigen-4; PD-1: Programmed death-1; PD-L1: programmed death-1; IL-2: Interleukin-2.
1.2 肿瘤疫苗的类型和应用
肿瘤疫苗通过递送肿瘤细胞特异性抗原刺激免疫系统产生特异性免疫细胞或抗体从而消除肿瘤细胞[7]。经过研究者多年来对肿瘤疫苗的不断探索,现在已有应用较为广泛的肿瘤疫苗出现。根据递送的种类主要分为蛋白质类疫苗、细胞疫苗和核酸类疫苗。
1.2.1 蛋白质类疫苗
大多数蛋白质类肿瘤疫苗中的抗原选取自肿瘤细胞,通过诱导广泛而有效的肿瘤免疫反应达到抗肿瘤效果。但是这种肿瘤疫苗具有免疫原性差、靶向性不足等缺陷,通过筛选具有高免疫原性的抗原蛋白并改良抗原递送系统可以进一步提高其抗肿瘤治疗效率[8]。
1.2.2 细胞疫苗
治疗肿瘤的细胞疫苗主要分为经修饰的自体/同种异体肿瘤细胞疫苗及树突状细胞疫苗[9]。肿瘤细胞具有可以表达完整的抗原谱和无需识别显性表位的优点,但肿瘤细胞本身具有躲避免疫系统监视的潜能,这是其最大的缺点[10]。而树突状细胞作为具有极强的抗原递呈功能的免疫细胞在人体免疫反应中发挥重要作用,可以承载多种抗原并有效地激活人体的特异性免疫应答,且经临床试验证明安全可靠,具有广阔的应用前景[11]。
1.2.3 核酸类疫苗
核酸类疫苗可分为DNA疫苗和RNA疫苗。DNA疫苗是通过将编码相关抗原基因的质粒DNA转染进入细胞核中,随后发生转录和翻译,使细胞表达抗原,进而诱导机体产生免疫反应。RNA疫苗中研究最热的mRNA疫苗可以用于治疗由异常蛋白表达引起的多种疾病。通过翻译使细胞产生相应抗原,刺激免疫系统以治疗疾病[12]。mRNA疫苗作为一种新型有效的肿瘤免疫疗法,已成为替代蛋白质类疫苗的潜在选择[13]。与DNA疫苗相比,mRNA疫苗在制备和合成过程中更经济、简单、安全[14],无需进入细胞核,可直接在细胞质中进行翻译表达,避免了宿主细胞基因组突变的潜在风险[15-16]。
与传统疫苗相比,肿瘤mRNA疫苗具有多种优势[17]:制备周期短,对于任何具有已知序列的靶蛋白,均可通过体外转录在短时间内合成,争取更长的治疗时间[13];利用mRNA体内表达具有疏水性且亲和力高的抗原肽,可以解决此类药物成药性差的问题[18];可以同时递送多个肿瘤抗原片段和包含多个表位的完整抗原,增加抗原多样性[19];mRNA本身能激活免疫细胞释放细胞因子,可以发挥佐剂作用增强免疫功能[20]。
有临床试验[21]证明,将mRNA疫苗与一些现有的临床疗法相结合,可以增强疗效并改善患者预后。2022年,Moderna等公司[22]通过使用肿瘤mRNA疫苗和程序性死亡蛋白-1(programmed death-1,PD-1)抗体作为术后辅助治疗,以防止ⅡB期黑色素瘤复发。2023年,Moderna等公司[22]使用mRNA-4157(V940)与Keytruda联合治疗晚期黑色素瘤,术后患者的临床试验评估结果显示,该联合治疗可显著降低肿瘤复发、远处转移和死亡率。BioNTech公司[23]同样推出mRNA疫苗BNT116联合PD-1抗体疗法,用于治疗晚期非小细胞肺癌,结果表明,联合治疗组优于单独用药组。另外,BioNTech公司还推出了BNT122与化疗的联合治疗,可显著延缓接受手术切除的胰腺癌患者的复发时间[24]。
肿瘤mRNA疫苗以其制备简单、不良反应小及可个性化设计等优势,能在一定程度上降低肿瘤治疗的难度,但肿瘤细胞是非常顽固的细胞,因此mRNA疫苗与其他治疗方法的结合已成为一个有潜力和必要性的方向。
2 mRNA疫苗的作用机制及其制备流程
2.1 mRNA疫苗的免疫学作用机制
肿瘤mRNA疫苗能够快速并低成本地针对不同病症设计其翻译的主要肿瘤抗原,并在被递送进细胞后于细胞质中表达,通过激活并维持抗肿瘤的细胞免疫和体液免疫来达到预防及治疗肿瘤的目的(图2)[25]。
在1963年,研究者就开始了对于RNA用于免疫治疗的作用机制的探索[26]。研究发现,当mRNA被递送至细胞质中,其作为损伤相关分子模式会被模式识别受体识别或通过表达相应抗原引起免疫反应。将包裹有纯化后的mRNA的递送载体递送至核内体并被分解释放出mRNA,Toll样受体7和Toll样受体8会对其进行识别,随后激活髓样分化因子并引起干扰素(interferon,IFN)和炎症因子的分泌。被激活的IFN信号通路既能刺激机体产生更强的免疫反应,还能间接利用寡聚腺苷酸合成酶信号通路来调控降低mRNA表达效率,平衡免疫应答强度。被表达出的抗原经由组织相容性复合体Ⅰ(major histocompatibility complex Ⅰ,MHC Ⅰ)识别并水解,刺激细胞毒性T淋巴细胞的激活并清除带有该抗原的细胞。此外,部分抗原被抗原呈递细胞摄取后被MHC Ⅱ识别呈递至CD4+ T淋巴细胞,进一步激活细胞免疫和体液免疫[27],从而达到mRNA疫苗抗肿瘤的免疫治疗效果。
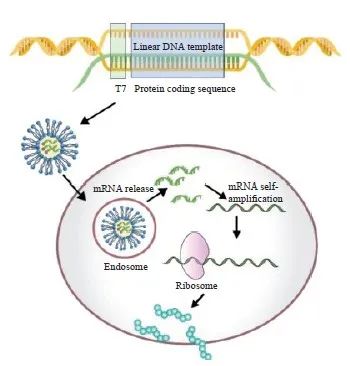
图2 mRNA的细胞递送及翻译表达示意图
Fig. 2 Schematic diagram of the cellular delivery and the translational expression of mRNA
2.2 mRNA疫苗的设计及制备工艺
mRNA是利用线性DNA模板通过体外转录过程合成产生的,随后将未反应组分和双链RNA去除进行纯化。对于序列的优化主要通过在5’端加帽、3’端加Poly(A)尾、添加非翻译区(untranslated region,UTR)序列、优化开放阅读框(open reading frame,ORF)序列和修饰核苷酸[28-29](图3)。
通过5’加帽,mRNA能被机体识别为“内源RNA”,以防止其被核酸外切酶水解。Poly(A)尾作为大多数哺乳动物3’末端具有的一段可与多聚腺苷酸结合蛋白形成腺苷酸残基的修饰,通过设计序列并转录控制这段多聚腺苷酸的长度,可以保证mRNA的稳定性及其正常翻译。UTR对mRNA的稳定性和翻译效率也具有重要影响。其中,5’UTR能够改善起始密码子选择,3’UTR则会影响mRNA的翻译、稳定性及亚细胞分布。ORF作为编码蛋白质的序列通过使用高频率的密码子进行优化,能够直接提高mRNA的翻译效率。将mRNA中的核苷酸进行修饰能够降低其免疫原性、增强稳定性和翻译效率[30]。
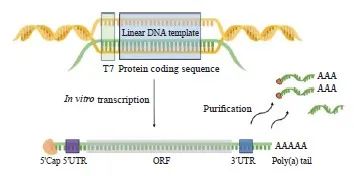
图3 mRNA疫苗制备示意图
Fig. 3 The preparation diagram of mRNA vaccines
3 mRNA疫苗的载体递送系统
尽管mRNA疫苗具有巨大的应用前景,但其仍然面临着体外运输和储存困难、体内递送过程中稳定性不足等挑战。在此基础上,开发安全高效的mRNA疫苗递送系统,在保护mRNA免受核酸酶降解的同时,实现mRNA的有效细胞摄取、递送和高效释放,是mRNA疫苗开发及提高mRNA疫苗免疫保护效力的关键[31]。常见的非病毒性递送载体主要包括脂质体、无机纳米颗粒、高分子聚合物载体及蛋白/多肽衍生物-mRNA复合体等[32](图4)。
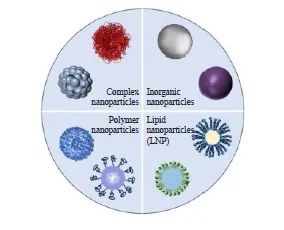
图4 几种常用的mRNA疫苗递送系统
Fig. 4 The commonly used mRNA vaccine delivery systems
3.1 脂质体及脂质复合物
脂质体是由具有亲水头部和疏水尾部的两亲性聚合物分子在水相溶液中形成的一种类似细胞膜的脂质结构,被认为是较为安全可靠的非病毒递送载体之一,也是临床上最常应用的基因治疗载体[33-34]。1978年,Dimitriadis[35]用脂质体将mRNA递送到脾脏淋巴细胞并成功表达兔源蛋白后,mRNA的脂质类递送载体得到更深入的开发研究。Chen等[36]通过皮下注射证明阳离子脂质体mRNA疫苗有增强抗肿瘤免疫应答的作用。除此之外,脂质体还可以有效地促进细胞摄取和溶酶体逃逸。
脂质复合物依靠内吞作用进入细胞,具有比脂质体相对更高的转染效率和稳定性[37]。Parmar等[38]制备小干扰RNA的添加剂聚链,为mRNA疫苗递送系统的研发提供了新的思路。Perche等[39]报道了包载mRNA的甘露糖基化脂质复合物诱导抗癌免疫反应。Arya等[40]利用脂质体递送系统与假尿苷修饰的mRNA形成独特的纳米脂质复合物,介导体内转染,可增强体液和细胞免疫应答。
但是这些脂质类载体存在一些缺点,如体内毒性、对抗原呈递细胞缺乏活性选择性以及难以共递送多种佐剂。
3.2 无机纳米材料
无机材料制备的纳米递送载体可通过表面修饰阳离子涂层,增强溶酶体逃逸并提高递送及核酸的表达效率。Yang等[41]将金纳米颗粒经过阳离子肽修饰后靶向肿瘤细胞,增强免疫应答反应。Shi等[42]通过氧化石墨烯的纳米偶联物靶向治疗肿瘤。由于无机纳米材料的稳定性较差且受环境影响较大,因此对于无机材料作为mRNA疫苗的递送系统在人体内长期的安全性进行评估是非常必要的。
3.3 高分子聚合物
高分子聚合物载体本身易于制备,对其表面性质微调可达到所需效果,可促进抗原的交叉提呈,对聚合物纳微球表面进行修饰能介导靶向免疫细胞,提高抗原利用率,以更低的抗原剂量激活免疫系统[43]。
聚合物纳米载体材料可分为人工合成大分子聚合物和天然高分子聚合物。人工合成聚合物是通过化学合成方法合成的聚合物材料,可以根据需要进行定制设计。常见的人工合成大分子聚合物包括聚乙烯、聚丙烯和聚苯乙烯等,具有易于合成、价格低廉及无免疫原性等特性[44]。Yihunie等[45]首先使用聚赖氨酸作为阳离子聚合物来传递基因,为mRNA递送提供了一种新方法。Demir-Dora等[46]成功地将质粒DNA递送到乳腺癌细胞中,证明了聚乙烯亚胺复合物作为非病毒载体在核酸递送方面应用的可行性。Wang等[47]合成了用于mRNA递送的氟烷烃接枝聚乙烯亚胺,能够引发抗肿瘤免疫反应。Zhang等[48]通过脂蛋白模拟肽自组装原理创建了高密度脂蛋白样肽-磷脂支架,为包载mRNA肿瘤疫苗的递送提供了新的选择。
天然高分子材料具有良好的生物相容性和可降解性,可作为mRNA疫苗载体用于实现mRNA的高效递送。其中,壳聚糖纳米颗粒可以通过提高疫苗的细胞摄取效率和发挥免疫佐剂作用来增强免疫应答效果,在核酸类疫苗领域有很好的应用前景[44]。
3.4 蛋白/多肽衍生物-mRNA复合体
肽/蛋白疫苗是最常见的一类疫苗,具有抗原序列明确、生产成本低且易于制备等优点[49]。Lou等[50]开发了一种肽功能化mRNA多链体的简便方法,以促进树突状细胞呈递mRNA抗原,细胞摄取量高且无细胞毒性。Mai等[51]基于鱼精蛋白构建了防止mRNA降解并促进抗原呈递细胞抗原呈递同时可诱导抗肿瘤免疫应答的递送载体。Lin等[52]通过将肽与原卟啉偶联构建成新化合物用于靶向治疗和光能治疗。此类制剂为mRNA疫苗递送系统的开发提供了强有力的依据。
3.5 其他方法
除以上几类常用的mRNA疫苗递送材料外,还存在一些其他的递送系统。Chen等[53]以环糊精-聚乙二醇水凝胶和胞嘧啶-磷酸-鸟嘌呤纳米佐剂相结合,缓解了肿瘤微环境不适合免疫反应的问题,增强了免疫治疗效果。Sung等[54]将包载有白细胞介素-22 mRNA的自组装纳米颗粒通过口服的给药方式对结肠癌损伤部位进行靶向治疗,证明了口服递送mRNA的可行性。Kitagawa等[55]利用双歧杆菌构建口服mRNA疫苗载体抑制膀胱癌。Uchida等[56]通过增加纳米胶束核心的疏水性,可以有效地防止血液中纳米胶束的解离,进一步增加凝聚mRNA的能力。Cheng等[57]设计了一种用于mRNA细胞内递送的三嵌段共聚物,显著提高了载体的生物相容性和mRNA的稳定性,进而增强其抗肿瘤能力。Liu等[58]开发了一种双佐剂多功能纳米胶囊,用于肿瘤预防性mRNA纳米疫苗。
4 肿瘤mRNA疫苗的临床研究现状
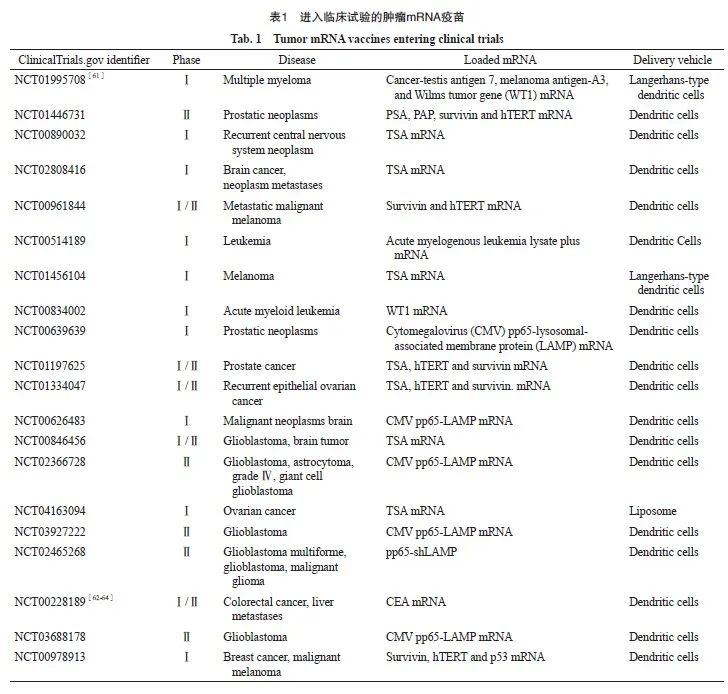
肿瘤mRNA疫苗的靶点根据其表达和定位可分为肿瘤相关抗原和肿瘤特异性抗原[59]。肿瘤相关抗原是在正常组织和肿瘤细胞中都表达,但在肿瘤中表达异常的蛋白。而肿瘤特异性抗原通常不在正常细胞中表达,具有很强的肿瘤特异性和免疫原性。现进入临床试验阶段的肿瘤mRNA疫苗绝大多数通过转染进树突状细胞中来实现递送[60]。肿瘤mRNA疫苗产品的临床试验正在如火如荼地开展,如表1所示。
5 结语
近年来,肿瘤mRNA疫苗经临床试验证明有效,在肿瘤免疫治疗领域展现出了巨大的潜力。科研人员在抗肿瘤相关领域的研究与探索中,通过将传统肿瘤治疗方法与新兴疗法相结合,推动了肿瘤治疗的发展。肿瘤疫苗的发展为预防肿瘤的产生和控制肿瘤细胞增殖、转移作出了巨大贡献。相信在不久的将来,会有更多成熟的治疗性肿瘤疫苗被应用于临床,而mRNA疫苗的开发利用有望为患者提供更有效、更个性化的治疗方案,为肿瘤患者带来更好的治疗效果和生活质量。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
辛美仪:文献调研,撰写初稿,文章审读和修订。
林玉红:写作指导,文章审读和修订。
赵凯:总体构思,写作指导,基金支持。
[参考文献]
[1] LIU Y X, YAN Q J, ZENG Z Y, et al. Advances and prospects of mRNA vaccines in cancer immunotherapy[J]. Biochim Biophys Acta Rev Cancer, 2024, 1879(2): 189068.
[2] ZHANG A, JI Q M, SHENG X, et al. mRNA vaccine in gastrointestinal tumors: immunomodulatory effects and immunotherapy[J]. Biomedecine Pharmacother, 2023, 166: 115361.
[3] WOLCHOK J. Putting the immunologic brakes on cancer[J]. Cell, 2018, 175(6): 1452-1454.
[4] SHI S J, HUANG J C, KUANG Y, et al. Stability and Hopf bifurcation of a tumor-immune system interaction model with an immune checkpoint inhibitor[J]. Commun Nonlinear Sci Numer Simul, 2023, 118: 106996.
[5] ZHU C J, WU Q, SHENG T, et al. Rationally designed approaches to augment CAR-T therapy for solid tumor treatment[J]. Bioact Mater, 2024, 33: 377-395.
[6] LIU C P, WANG Y C, LI L M, et al. Engineered extracellular vesicles and their mimetics for cancer immunotherapy[J]. J Control Release, 2022, 349: 679-698.
[7] LIU J, FU M Y, WANG M N, et al. Cancer vaccines as promising immuno-therapeutics: platforms and current progress[J]. J Hematol Oncol, 2022, 15(1): 28.
[8] GUO C Q, MANJILI M H, SUBJECK J R, et al. Therapeutic cancer vaccines: past, present, and future[J]. Adv Cancer Res, 2013, 119: 421-475.
[9] TÜRECI Ö, VORMEHR M, DIKEN M, et al. Targeting the heterogeneity of cancer with individualized neoepitope vaccines[J]. Clin Cancer Res, 2016, 22(8): 1885-1896.
[10] QIN X Y, YANG T, XU H B, et al. Dying tumor cells-inspired vaccine for boosting humoral and cellular immunity against cancer[J]. J Control Release, 2023, 359: 359-372.
[11] GEBRE M S, BRITO L A, TOSTANOSKI L H, et al. Novel approaches for vaccine development[J]. Cell, 2021, 184(6): 1589-1603.
[12] ZHANG X Y, CUI H Q, ZHANG W J, et al. Engineered tumor cell-derived vaccines against cancer: the art of combating poison with poison[J]. Bioact Mater, 2023, 22: 491-517.
[13] PARDI N, HOGAN M J, PORTER F W, et al. mRNA vaccines-a new era in vaccinology[J]. Nat Rev Drug Discov, 2018, 17(4): 261-279.
[14] WANG Y, ZHANG Z Q, LUO J W, et al. mRNA vaccine: a potential therapeutic strategy[J]. Mol Cancer, 2021, 20(1): 33.
[15] STEINER P A, CORTE D D, GEIJO J, et al. Highly variable mRNA half-life time within marine bacterial taxa and functional genes[J]. Environ Microbiol, 2019, 21(10): 3873-3884.
[16] YEAPURI P, OLSON K E, LU Y M, et al. Development of an extended half-life GM-CSF fusion protein for Parkinson’s disease[J]. J Control Release, 2022, 348: 951-965.
[17] YAN Y, LIU X Y, LU A, et al. Non-viral vectors for RNA delivery[J]. J Control Release, 2022, 342: 241-279.
[18] CHU Y Y, ZHANG Y, WANG Q K, et al. A transformer-based model to predict peptide-HLA class Ⅰ binding and optimize mutated peptides for vaccine design[J]. Nat Mach Intell, 2022, 4: 300-311.
[19] BELL M R, KUTZLER M A. An old problem with new solutions: strategies to improve vaccine efficacy in the elderly[J]. Adv Drug Deliv Rev, 2022, 183: 114175.
[20] XU S Q, YANG K P, LI R, et al. mRNA vaccine eramechanisms, drug platform and clinical prospection[J]. Int J Mol Sci, 2020, 21(18): 6582.
[21] CHEN G, ZHAO B W, RUIZ E F, et al. Advances in the polymeric delivery of nucleic acid vaccines[J]. Theranostics, 2022, 12(9): 4081-4109.
[22] WEBER J S, CARLINO M S, KHATTAK A, et al. Individualised neoantigen therapy mRNA-4157 (V940) plus pembrolizumab versus pembrolizumab monotherapy in resected melanoma (KEYNOTE-942): a randomised, phase 2b study[J]. Lancet, 2024, 403(10427): 632-644.
[23] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[24] ROJAS L A, SETHNA Z, SOARES K C, et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer[J]. Nature, 2023, 618(7963): 144-150.
[25] LIANG X P, LI D P, LENG S L, et al. RNA-based pharmacotherapy for tumors: from bench to clinic and back[J]. Biomedecine Pharmacother, 2020, 125: 109997.
[26] MITCHELL W. The 1986 Nobel Prize in chemistry[J]. Science, 1986, 234(4777): 673-674.
[27] SCHMITT W E, STASSAR M J, SCHMITT W, et al. In vitro induction of a bladder cancer-specific T-cell response by mRNA-transfected dendritic cells[J]. J Cancer Res Clin Oncol, 2001, 127(3): 203-206.
[28] MA S J, LI X L, MAI Y P, et al. Immunotherapeutic treatment of lung cancer and bone metastasis with a mPLA/mRNA tumor vaccine[J]. Acta Biomater, 2023, 169: 489-499.
[29] BERNARD M C, BAZIN E, PETIOT N, et al. The impact of nucleoside base modification in mRNA vaccine is influenced by the chemistry of its lipid nanoparticle delivery system[J]. Mol Ther Nucleic Acids, 2023, 32: 794-806.
[30] MEULEWAETER S, ZHANG Y, WADHWA A, et al. Considerations on the design of lipid-based mRNA vaccines against cancer[J]. J Mol Biol, 2024, 436(2): 168385.
[31] YAN Y F, LIU X M, WANG L Y, et al. Branched hydrophobic tails in lipid nanoparticles enhance mRNA delivery for cancer immunotherapy[J]. Biomaterials, 2023, 301: 122279.
[32] SUN B, WU W X, NARASIPURA E A, et al. Engineering nanoparticle toolkits for mRNA delivery[J]. Adv Drug Deliv Rev, 2023, 200: 115042.
[33] QU Y, XU J, ZHANG T, et al. Advanced nano-based strategies for mRNA tumor vaccine[J]. Acta Pharm Sin B, 2024, 14(1): 170-189.
[34]ESTAPÉ SENTI M, GARCÍA DEL VALLE L, SCHIFFELERS R M. mRNA delivery systems for cancer immunotherapy: Lipid nanoparticles and beyond[J]. Adv Drug Deliv Rev, 2024, 206: 115190.
[35]DIMITRIADIS G J. Translation of rabbit globin mRNA introduced by liposomes into mouse lymphocytes[J]. Nature, 1978, 274(5674): 923-924.
[36]CHEN Z, MENG C Y, MAI J H, et al. An mRNA vaccine elicits STING-dependent antitumor immune responses[J]. Acta Pharm Sin B, 2023, 13(3): 1274-1286.
[37]SHARMA P, HOORN D, AITHA A, et al. The immunostimulatory nature of mRNA lipid nanoparticles[J]. Adv Drug Deliv Rev, 2024, 205: 115175.
[38]PARMAR M B, K C R B, LÖBENBERG R, et al. Additive polyplexes to undertake siRNA therapy against CDC20 and survivin in breast cancer cells[J]. Biomacromolecules, 2018, 19(11): 4193-4206.
[39]PERCHE F, BENVEGNU T, BERCHEL M, et al. Enhancement of dendritic cells transfection in vivo and of vaccination against B16F10 melanoma with mannosylated histidylated lipopolyplexes loaded with tumor antigen messenger RNA[J]. Nanomed-Nanotechnol Biol Med, 2011, 7(4): 445-453.
[40]ARYA S, LIN Q B, ZHOU N, et al. Strong immune responses induced by direct local injections of modified mRNA-lipid nano complexes[J]. Mol Ther Nucleic Acids, 2020, 19: 1098-1109.
[41]YANG A F, BAI Y, DONG X, et al. Hydrogel/nanoadjuvant-mediated combined cell vaccines for cancer immunotherapy[J]. Acta Biomater, 2021, 133: 257-267.
[42]SHI S X, YANG K, HONG H, et al. VEGFR targeting leads to significantly enhanced tumor uptake of nanographene oxide invivo[J]. Biomaterials, 2015, 39: 39-46.
[43]MALLA R, SRILATHA M, FARRAN B, et al. mRNA vaccines and their delivery strategies: a journey from infectious diseases to cancer[J]. Mol Ther, 2024, 32(1): 13-31.
[44]CHARBE N B, AMNERKAR N D, RAMESH B, et al. Small interfering RNA for cancer treatment: overcoming hurdles in delivery[J]. Acta Pharm Sin B, 2020, 10(11): 2075-2109.
[45]YIHUNIE W, NIBRET G, ASCHALE Y. Recent advances in messenger ribonucleic acid (mRNA) vaccines and their delivery systems: a review[J]. Clin Pharmacol, 2023, 15: 77-98.
[46]DEMIR-DORA D, ÖNER F. Development and evaluation of polyethylenimine polyplexes as non-viral vectors for delivery of plasmid DNA encoding shRNA against STAT3 activity into triple negative breast cancer cells[J]. J Drug Deliv Sci Technol, 2023, 82: 104113.
[47]WANG K L, WANG X Y, JIANG D, et al. Delivery of mRNA vaccines and anti-PDL1 siRNA through non-invasive transcutaneous route effectively inhibits tumor growth[J]. Compos Part B Eng, 2022, 233: 109648.
[48]ZHANG Z H, QIAN Y, JIN H L, et al. Peptide-lipid nano-delivery system for cancer theranostics[J]. Nanomed Nanotechnol Biol Med, 2018, 14(5): 1867.
[49]KORDALIVAND N, TONDINI E, LAU C Y J, et al. Cationic synthetic long peptides-loaded nanogels: an efficient therapeutic vaccine formulation for induction of T-cell responses[J]. J Control Release, 2019, 315: 114-125.
[50]LOU B, KOKER S D, LAU C Y J, et al. mRNA polyplexes with post-conjugated GALA peptides efficiently target, transfect, and activate antigen presenting cells[J]. Bioconjug Chem, 2019, 30(2): 461-475.
[51]MAI Y P, GUO J S, ZHAO Y, et al. Intranasal delivery of cationic liposome-protamine complex mRNA vaccine elicits effective anti-tumor immunity[J]. Cell Immunol, 2020, 354: 104143.
[52]LIN H X, ZHOU R H, YU T J, et al. An acid-targeting peptide can be used as a carrier for photodynamic therapy (PDT)[J]. Mater Today Commun, 2022, 31: 103659.
[53]CHEN S, LI J G, MA X Y, et al. Cationic peptide-modified gold nanostars as efficient delivery platform for RNA interference antitumor therapy[J]. Polymers, 2021, 13(21): 3764.
[54]SUNG J, ALGHOUL Z, LONG D P, et al. Oral delivery of IL-22 mRNA-loaded lipid nanoparticles targeting the injured intestinal mucosa: a novel therapeutic solution to treat ulcerative colitis[J]. Biomaterials, 2022, 288: 121707.
[55]KITAGAWA K, TATSUMI M, KATO M, et al. An oral cancer vaccine using a Bifidobacterium vector suppresses tumor growth in a syngeneic mouse bladder cancer model[J]. Mol Ther Oncolytics, 2021, 22: 592-603.
[56]UCHIDA S, KINOH H, ISHII T, et al. Systemic delivery of messenger RNA for the treatment of pancreatic cancer using polyplex nanomicelles with a cholesterol moiety[J]. Biomaterials, 2016, 82: 221-228.
[57]CHENG C, CONVERTINE A J, STAYTON P S, et al. Multifunctional triblock copolymers for intracellular messenger RNA delivery[J]. Biomaterials, 2012, 33(28): 6868-6876.
[58]LIU Y H, LI S H, LIN S Y, et al. A tetrahedral framework nucleic acid based multifunctional nanocapsule for tumor prophylactic mRNA vaccination[J]. Chin Chemical Lett, 2023, 34(7): 107987.
[59]YAO R H, XIE C Y, XIA X J. Recent progress in mRNA cancer vaccines[J]. Hum Vaccin Immunother, 2024, 20(1): 2307187.
[60]HE Q, GAO H, TAN D J, et al. mRNA cancer vaccines: advances, trends and challenges[J]. Acta Pharm Sin B, 2022, 12(7): 2969-2989.
[61]CHUNG D J, SHARMA S, RANGESA M, et al. Langerhans dendritic cell vaccine bearing mRNA-encoded tumor antigens induces antimyeloma immunity after auto-transplant[J]. Blood Adv, 2022, 6(5): 1547-1558.
[62]FIGDOR C G, De VRIES I J, LESTERHUIS W J, et al. Dendritic cell immunotherapy: mapping the way[J]. Nat Med, 10(5): 475-80.
[63]LESTERHUIS W J, AARNTZEN E H, DE VRIES I J, et al. Dendritic cell vaccines in melanoma: from promise to proof?[J]. Crit Rev Oncol Hematol, 2008, 66(2): 118-134.
[64]De VRIES I J, BERNSEN M R, LESTERHUIS W J, et al. Immunomonitoring tumor-specific T cells in delayed-type hypersensitivity skin biopsies after dendritic cell vaccination correlates with clinical outcome[J]. J Clin Oncol, 2005, 23(24): 5779-5787.
猜你喜欢
- Arthrosc Sports Med Rehabil:儿童胫骨骨折手术治疗后是否存在生长障碍
- 打瘦脸针蛙鳃,真的是因为注射深度不够吗?
- J Am Acad Dermatol:DISCREET试验结果揭晓——Apremilast显著改善生殖器银屑病患者的症状与生活质量
- JCC: 硫唑嘌呤联合肠内营养与硫唑嘌呤单药治疗对于克罗恩病患者术后复发的影响
- IVD前沿丨便携式唾液酸检测技术推进癌症检测的挑战、机会和前景
- 膝盖莫名“打软腿”?警惕!这些疾病可能正在“预警”
- Eur Heart J Cardiovasc Imaging:右心房和右心室应变:预后价值取决于三尖瓣反流的严重程度
- JPD:中国50万人大研究:爱吸烟vs喝茶的人,长期患帕金森的风险如何?
- 注意!防晒霜涂太厚可导致中暑
- 喝醋真的可以减肥吗 怎么最有效果
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)