首页 > 医疗资讯/ 正文
腹主动脉瘤(abdominal aortic aneurysm, AAA)是一种危及生命的疾病,其特征是腹主动脉壁内侧层变性。然而,目前关于腹主动脉功能与状态的调控因子的研究仍不完整。因此,深入了解参与AAA发生和发展的细胞类型和信号通路对于药物治疗至关重要。单核/巨噬细胞等炎症细胞在主动脉重构中起重要作用,成瘤样本中此类细胞的数量和比例明显高于未成瘤的腹主动脉。此外,不同类型的单核细胞可分化为具有不同功能的巨噬细胞亚群。干扰素诱导的单核巨噬细胞(interferon-inducible monocytes/macrophages, IFNICs)是一群表达干扰素刺激基因(interferon-stimulated genes, ISGs)的单核/巨噬细胞。既往研究表明,IFNICs来源于骨髓中I型干扰素介导的单核细胞和单核细胞祖细胞,参与动脉粥样硬化、心肌梗死等炎症性疾病。然而,IFNICs对于AAA形成的影响尚未得到深入研究。
2024年6月5日,华中科技大学同济医学院附属协和医院心脏大血管外科夏家红教授团队在Cardiovascular Research杂志在线发表了题为“Single-cell RNA sequencing identifies IFNICs as a cellular target for mitigating the progression of abdominal aortic aneurysm and rupture risk”的研究论文。该研究首次揭示了IFNICs对腹主动脉瘤形成和主动脉破裂的影响。通过单细胞RNA测序(Single-Cell RNA Sequencing, scRNA-seq)对腹主动脉样本进行分析,发现IFNICs在腹主动脉瘤组织中大量浸润,而在腹主动脉夹层/壁内血肿组织及未成瘤组织中浸润数量和比例较低。信号通路研究表明,胞质DNA感应cGAS-STING和Janus激酶/信号转导与转录激活因子(JAK/STAT)信号通路的激活是IFNICs形成的重要原因。

首先,研究者依照Daugherty等人的分类方法,将腹主动脉样本分为以下几类:正常腹主动脉(normal aorta, NA)、腹主动脉扩张无夹层形成(abdominal dilated aorta without disp, AAD)、腹主动脉瘤无夹层形成(single aortic aneurysm without disp, AAA)、动脉夹层/壁内血肿无动脉瘤形成(aortic disp/intramural hematoma without aneurysm, IMH-I)、单个腹主动脉瘤伴有夹层/壁内血肿(single aortic aneurysm with disp/intramural hematoma, IMH-II)、多个明显的腹主动脉瘤伴有夹层/壁内血肿(multiple distinct aortic aneurysms with disp/intramural hematoma, IMH-III)。为了探究不同病理特征腹主动脉样本的单细胞转录水平,研究者对以上类型的样本进行了酶解,并采用10XGenomics公司的GemCode™ 技术平台,共捕获了76472个符合条件的细胞并建立scRNA-seq文库。单细胞RNA测序结果显示有11种细胞类型参与腹主动脉病变。
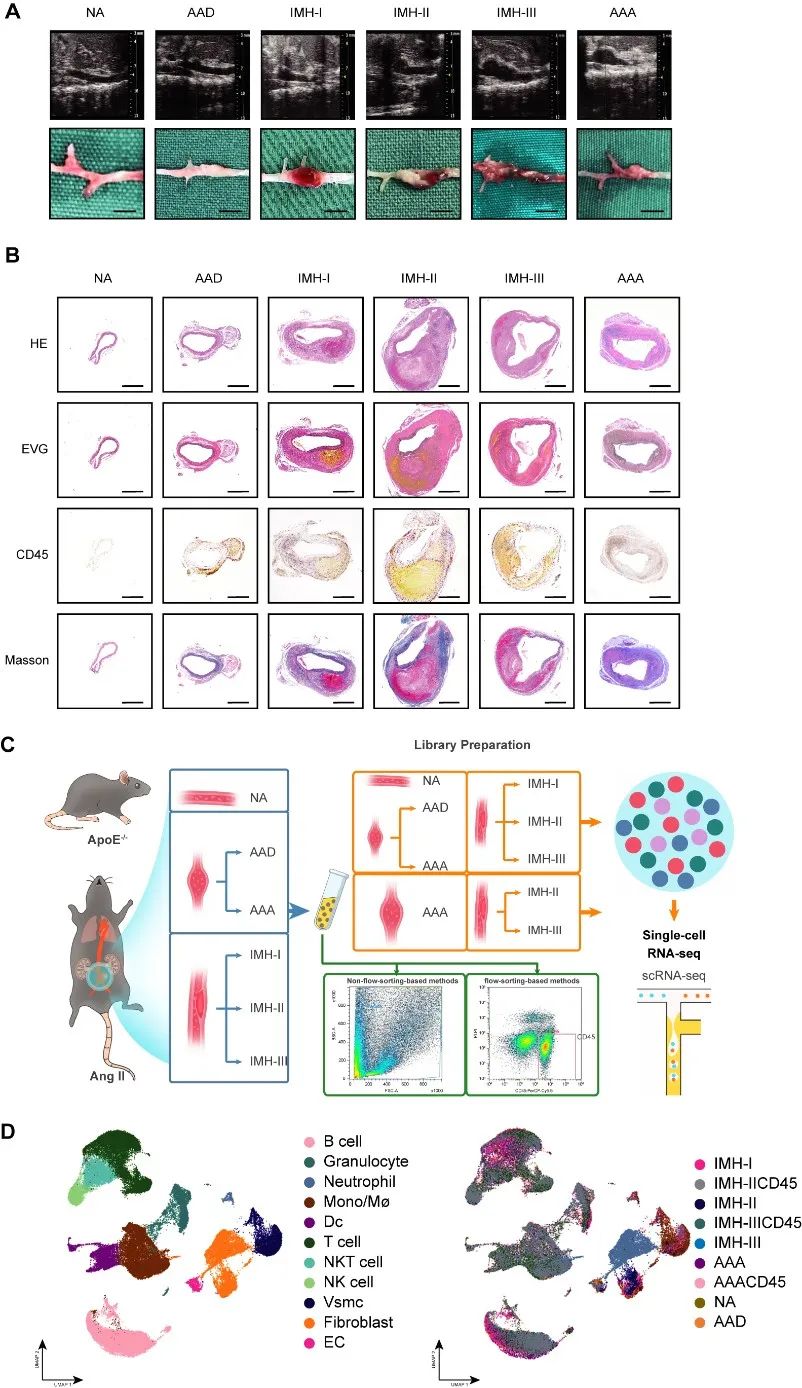
研究者从整体细胞群中提取出单核/巨噬/树突状细胞亚群进一步分析,观察到临近单核/巨噬细胞亚群有一群独特的细胞亚群,该细胞亚群高表达ISGs (Isg15, Irf7, Ifit1, Ifit3 and Rsad2),在AAA组织中占有很高的细胞比例。为证实以上结论,研究者使用了相关实验进一步验证,证实IFNICs确实大量存在于AAA样本。
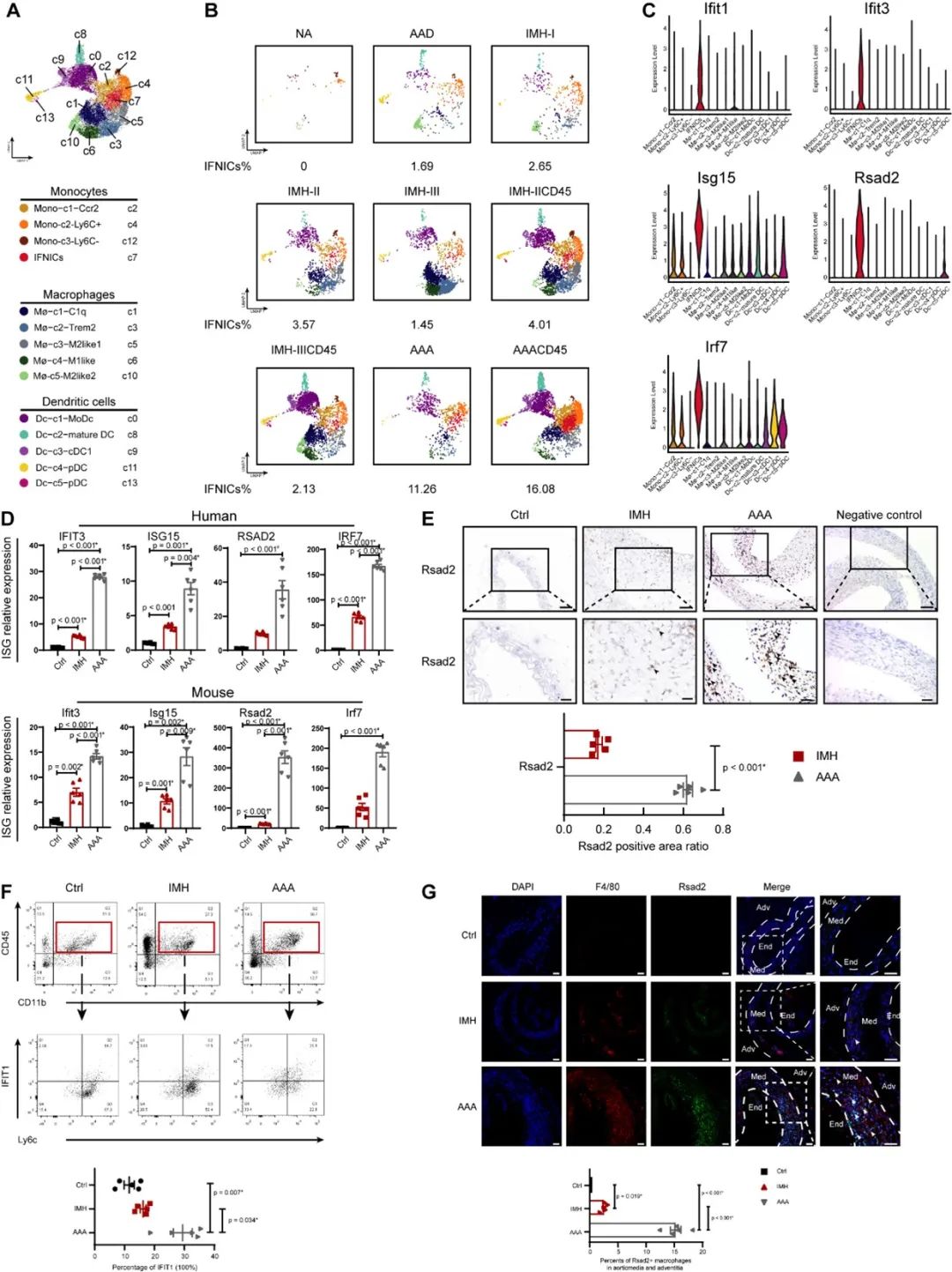
为了进一步研究IFNICs的起源、身份、信号转导通路和分化,研究者使用Monocle 2与RNA速率分析其分化轨迹,发现IFNICs处于单核细胞和巨噬细胞之间的过渡状态,是分化终末期细胞。接着,研究者使用单细胞调控网络推断与聚类分析(single-cell regulatory network inference and clustering, SCENIC)推断调控各细胞亚群分化的转录因子,结果表明JAK/STAT信号通路的激活与IFNICs的分化密切相关,Irf7是调控IFNICs分化的关键转录因子。研究者通过GSVA对各细胞亚群进行通路分析, 发现干扰素的生物合成与反应、病毒感染相关信号、DNA损伤信号、胞质DNA感应cGAS-STING与JAK/STAT信号通路在IFNICs中激活。
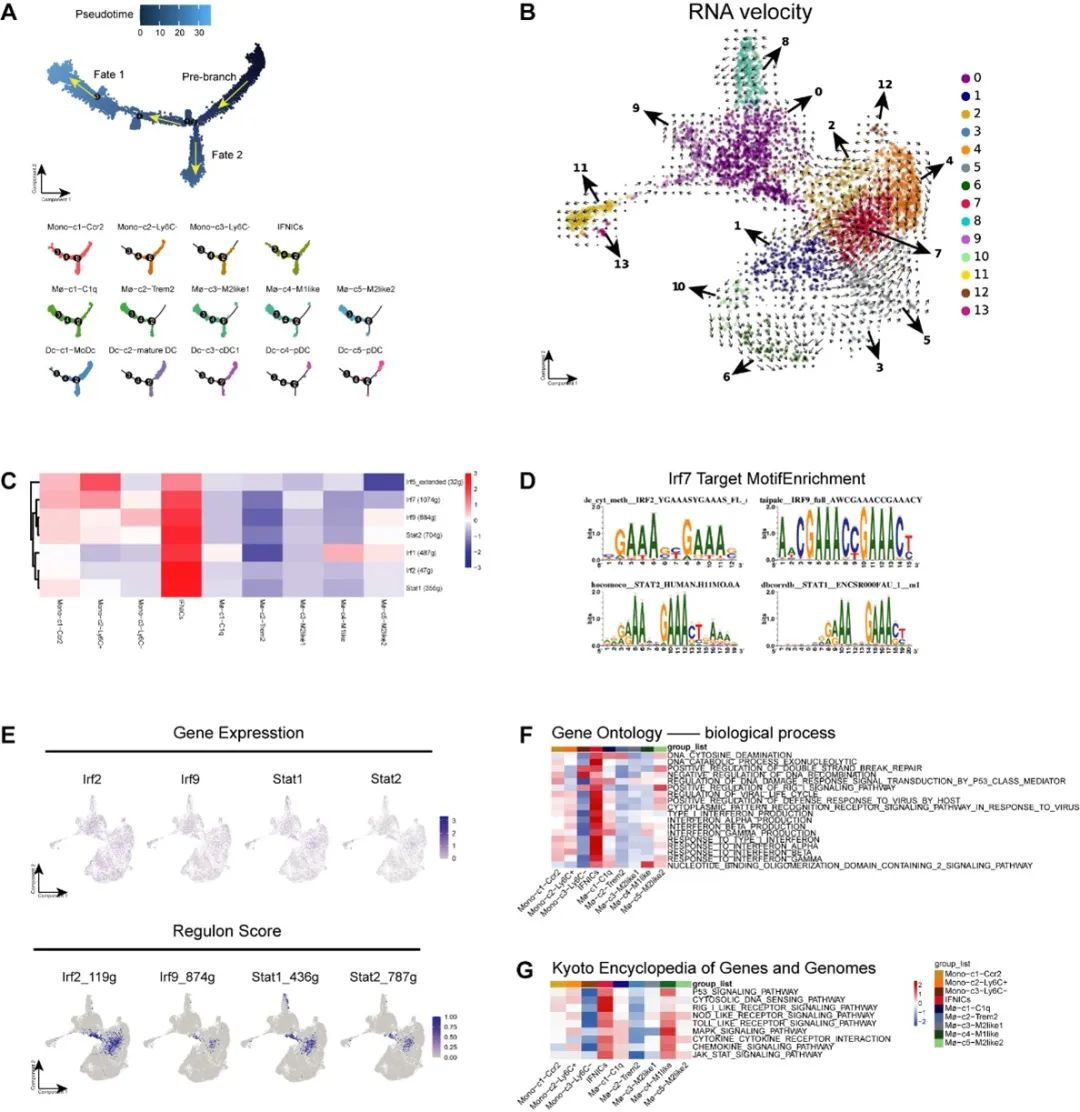
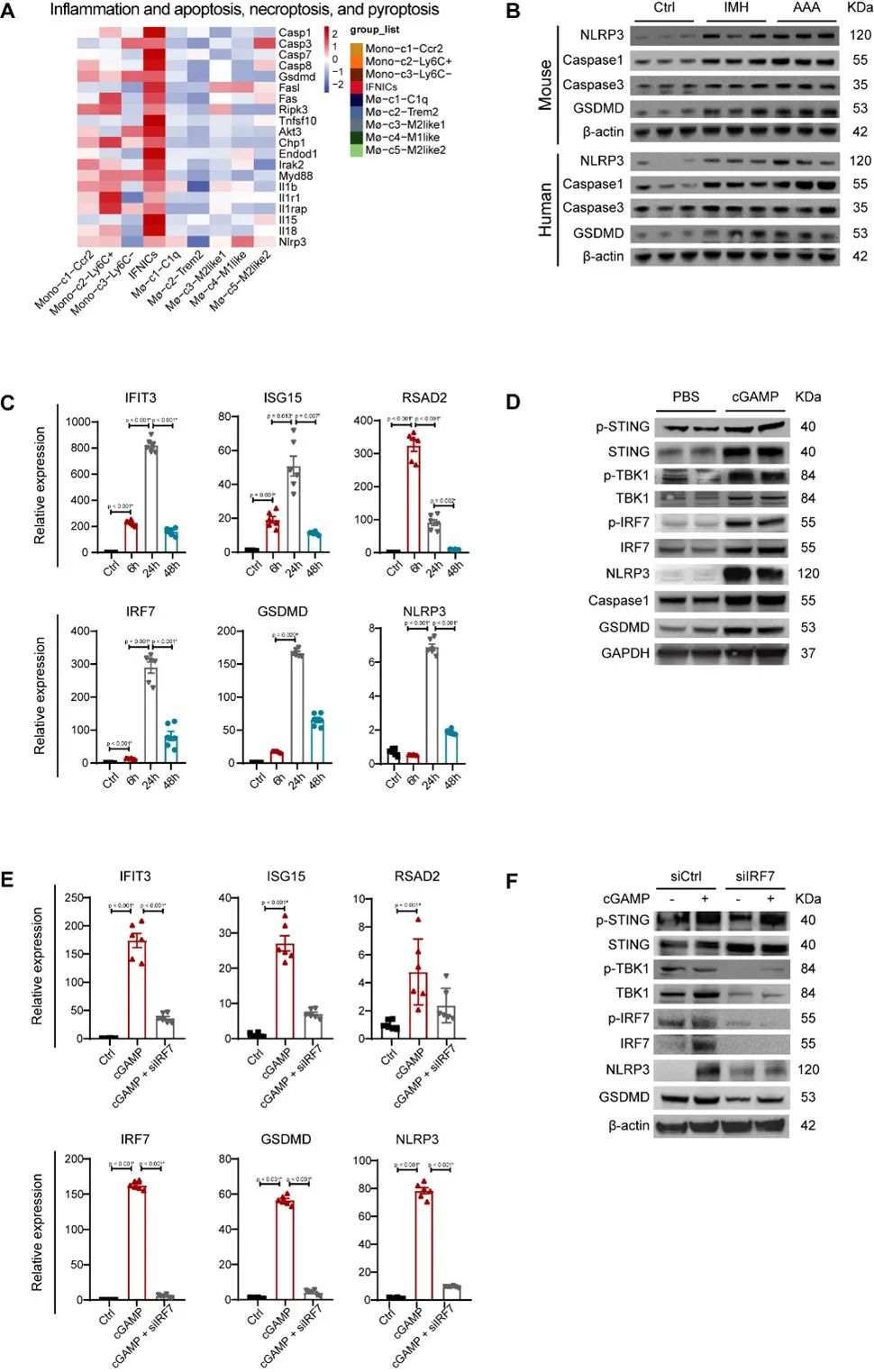
研究者进一步证实,AAA存在DNA损伤信号激活,浸润于AAA内的巨噬细胞的胞浆内有大量断裂的dsDNA产生,cGAS-STING信号通路在AAA中明显激活。
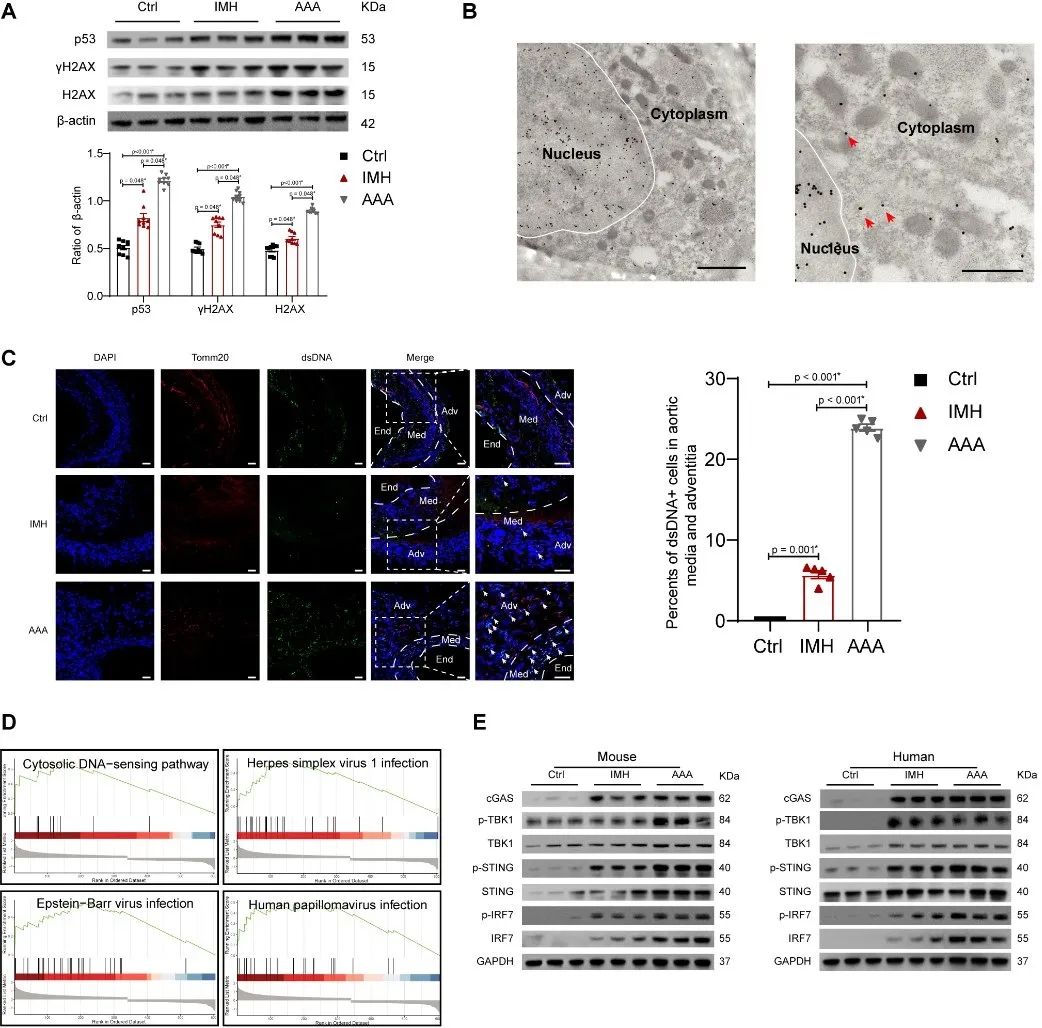
为了探索cGAS-STING信号通路与AAA形成的关系,研究者通过构建Lyz2-Cre+/-; Sting1flox/flox小鼠,证实cGAS-STING信号通路的激活增加主动脉破裂风险,促进AAA的形成,但对主动脉夹层/壁内血肿的形成无明显影响。
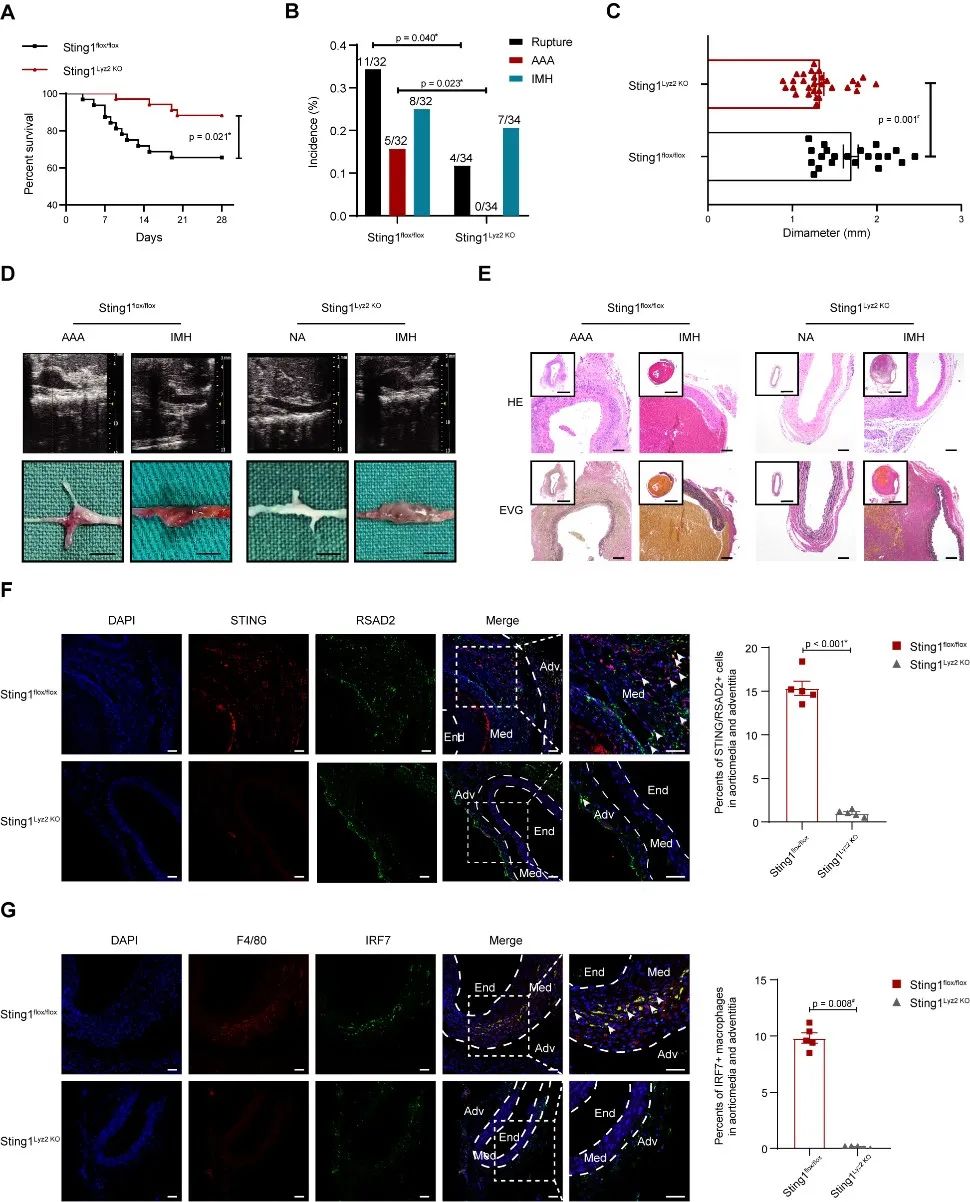
研究者进一步体外诱导IFNICs的形成,证实细胞焦亡和炎症相关信号通路在IFNICs中激活并且受IRF7的表达所调控。
为了探索IFNICs与AAA的关系,研究者在骨髓细胞中分别敲除Sting1基因与Ifnar1基因,证实IFNICs的形成会增加主动脉破裂风险,促进AAA的形成,但对主动脉夹层/壁内血肿的形成无明显影响。
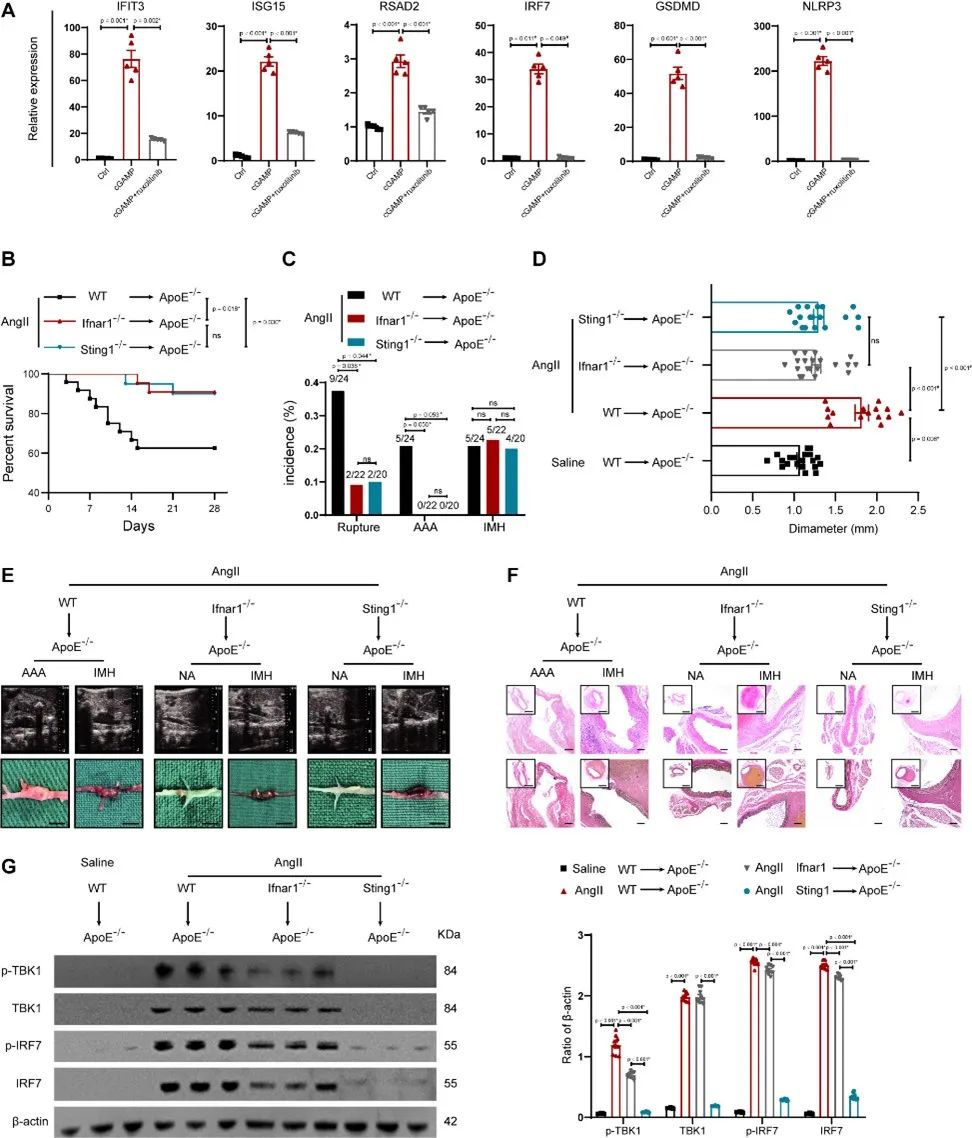
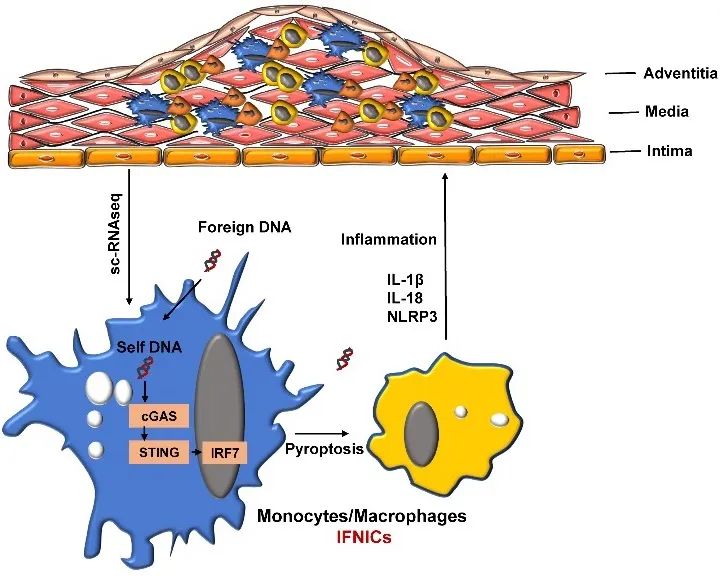
综上所述,该研究通过对不同病理特征的腹主动脉样本进行单细胞RNA测序,发现IFNICs在AAA中大量存在,且IFNICs的形成与DNA损伤信号通路、胞质DNA感应cGAS-STING信号通路与JAK/STAT信号通路的激活有关。IRF7在IFNICs中调控细胞焦亡与炎症相关信号通路,影响AAA的形成与主动脉的破裂。
该研究由华中科技大学同济医学院附属协和医院心脏大血管外科夏家红教授指导完成。乐晟博士、吴佳助理研究员、刘浩博士、杜一帆博士为该论文的共同第一作者。华中科技大学同济医学院附属协和医院夏家红教授和武汉市中心医院叶平教授是文章的共同通讯作者。该工作得到多项国家自然科学基金项目资助。
夏家红教授课题组先后在Cell、Immunity、Science Immunology、Circulation、Cell metabolism、Cellular & Molecular Immunology、Journal of Clinical Investigation、Hepatology、Nature Communication、Arteriosclerosis、Thrombosis, and Vascular Biology、 Cardiovascular Research等国际著名期刊发表研究论文。
原文链接:
https://academic.oup.com/cardiovascres/advance-article/doi/10.1093/cvr/cvae117/7688137?searchresult=1#supplementary-data
猜你喜欢
- Eur Heart J Cardiovasc Imaging:通过等长握力运动评估动态二尖瓣反流的患病率、机制和预后影响
- J Cosmet Dermatol:一种新型的含有肽和糖胺聚糖的睫毛生长促进剂的疗效分析
- 从传统药材到抗衰新突破!Chin Med证实:驴皮胶原蛋白让光老化小鼠皱纹减少、弹性回升
- Stroke:缺血性卒中和短暂性脑缺血发作患者的戒烟干预的成本效益
- 减肥能不能吃肉?多吃这4种食材帮你刮油减肥!
- Gut:频繁使用抗生素会导致炎症性肠病发病率增高,这个年龄段人群尤其如此!
- 男人必知 身体最脏的四大部位
- 瑜伽减肥运动方法有哪些 六式减肥瑜伽动作快速瘦身
- Eur Urol Oncol:肌层浸润性尿路上皮膀胱癌患者中新辅助 Pembrolizumab 与顺铂化疗或前期根治性膀胱切除术的疗效比较
- 18岁的他,却走路如醉汉,通过基因检测才找到病因……
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)