首页 > 医疗资讯/ 正文
Cronkhite-Canada综合征(CCS)亦称为息肉-色素沉着-脱发-指(趾)甲营养不良综合征,目前被认为是一种非遗传性罕见疾病,临床主要表现为消化道症状(全消化道多发息肉、腹泻、腹痛、食欲不振、味觉异常、口渴等)和外胚层症状[毛发脱落、指(趾)甲脱落、色素沉着]等[1]。该病于1955年首次被报道[2],截至2014年世界范围内仅报道500余例[3],截至2021年中国累计报道103例[4]。
新型冠状病毒感染亦可导致脱发、味觉减退等非特异性症状,故CCS患者在病程早期可被误诊为新型冠状病毒(下文简称“新冠病毒”)感染[5-6]。本文报道1例合并无症状新冠病毒感染CCS病例的诊疗经过,并结合文献复习,以期加深临床医生对该病的认识,提高对该罕见病的诊治水平。
1 病例资料
患者男性,57岁,因“毛发脱落、食欲及味觉减退、皮肤色素沉着2个月,指甲脱落1个月”,于2023年7月14日收住北京协和医院老年医学科。
2023年5月中旬起,患者无明显诱因出现毛发脱落伴食欲下降。脱发最早出现,晨起枕巾可见一薄层头发,症状进行性加重,1周内头发、眉毛全部脱落,胡须停止生长、阴毛脱落近一半。同时伴食欲减退、食量减少约40%,味觉明显减退,嗅觉正常。进食油腻食物后间断腹泻,呈水样便(2~3次/d),可见黏液、脓血,无腹痛,自服莫西沙星3 d后症状有所好转。
2023年6月1日于当地医院检测新冠病毒核酸阳性,胸部CT未见异常。该期间患者无咳嗽、咳痰、气促、喘息等呼吸道症状。当地医院考虑为新冠病毒感染引起的上述症状,嘱随访观察,未予药物治疗。
2023年6月中旬起,患者出现双手指甲变软,间断脱落,6月下旬起逐渐出现颜面部、眶周、双手皮肤颜色加深,双手掌色素沉着。于当地医院查血常规、肝肾功能、抗核抗体谱、抗中性粒细胞胞浆抗体均未见异常。
自发病以来,睡眠差、精神弱、乏力,体质量下降5 kg。
既往史、个人史及家族史
自述近8年来因家庭经济原因压力大。
2022年9月因“急性充血性结膜炎”口服泼尼松(20 mg/d)3 d后病情好转。
2022年10月出现全身泛发性湿疹,自行服用醋酸泼尼松(20 mg/d)约20 d后皮疹消退。
2022年12月出现发热(最高体温38.5 ℃)伴乏力、嗜睡,无咳嗽、咳痰、咽痛、喘息、气促,自测新冠病毒抗原阳性,服用“布洛芬颗粒”并休息2 d后症状缓解。
2021年4月4日、5月8日、11月17日先后接种第1、2、3剂新冠病毒疫苗(北京科兴中维生物技术有限公司)。
否认吸烟、饮酒史。
哥哥因白血病去世。
入院查体
体温37.0 ℃,心率64次/min,呼吸频率19次/min,SpO2为98%;双上肢血压对称(111/78 mm Hg),身高172 cm,体质量60 kg。发育正常,体型消瘦。头发脱落,可见新生毳毛;眉毛部分脱落,无胡须;双手背皮肤变黑,双手掌多发色素沉着,双手指甲、双足趾甲呈黄白色,部分脱落;双眼睫毛变长、弯曲上翘(图1)。心律齐,双肺呼吸音清。腹软,无压痛、反跳痛,双下肢无水肿。营养评估:营养风险筛查(NRS-2002)评分为4分,提示存在营养风险。
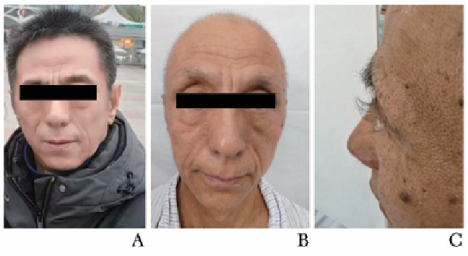
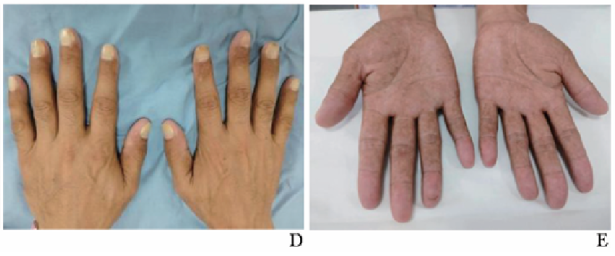
图1 患者发病前后身体毛发变化
A.发病前(2023年2月)毛发正常;B.入院时头发、眉毛、胡须脱落;C.入院时睫毛变长并弯曲上翘;D.入院时双手指甲呈黄白色且部分脱落;E.入院时双手掌色素沉着
实验室检查
血常规示白细胞9.85×109/L,中性粒细胞百分比56.0%,血红蛋白156 g/L,血小板279×109/L;尿常规+沉渣见潜血(trace),余未见异常;便常规+潜血(+),白细胞0~1,红细胞5~10。生化:血钾3.8 mmol/L,白蛋白40 g/L,前白蛋白259 mg/L,肌酐65 μmol/L;血清肿瘤标志物均正常;
炎症及免疫相关检查:红细胞沉降率6 mm/h,超敏C反应蛋白8.29 mg/L(↑);补体水平均正常;免疫球蛋白:IgM 0.26 g/L(↓),IgG、IgA水平均正常;总免疫球蛋白(T-IgE)497.0 KU/L(↑);
IgG亚类测定:IgG1 3431 mg/L(↓),IgG3 87 mg/L(↓),IgG4 2262 mg/L(↑);
细胞因子:白细胞介素(IL)-6 10.85 ng/L(↑)、IL-8 189.50 ng/L (↑),IL-10 7.12 ng/L(↑),肿瘤坏死因子-α 5.70 ng/L(↑)。
抗核抗体谱、系统性血管炎自身抗体谱、类风湿关节炎早期诊断自身抗体谱、抗磷脂抗体谱均为阴性。
内分泌相关检查:总25羟维生素D 18.2 μg/L(↓);清晨血总皮质醇228 μg/L(↑),血浆促肾上腺皮质激素82.2 ng/L(↑),24 h尿游离皮质醇41.6 μg;
甲状腺功能:甲状腺球蛋白抗体76.6 IU/mL(↑),甲状腺过氧化物酶抗体186 IU/mL(↑),余指标均正常;
性激素:泌乳素13.9 μg/L(↑),余指标均正常。
感染相关检测:新冠病毒核酸(鼻咽拭子)阴性;结核T细胞检测(T-SPOT.TB):ESAT-6 432FC/10S6MC(↑),CFP-10 340FC/10S6MC(↑);
TB细胞亚群:CD8+T细胞 1133/μL(↑),自然杀伤细胞 998/μL(↑),CD4+ T细胞计数正常。
全血重金属元素中毒筛查:砷(As)、铋(Bi)、镉(Cd)、汞(Hg)、铅(Pb)、铊(Tl)均正常。
影像学检查
胸部平扫CT示双肺多发点状钙化灶,余未见异常;腹部、盆腔平扫+胰腺薄层扫描CT示肝右侧后叶边缘小囊肿,余未见异常。超声心动图未见异常。超声示双侧肾上腺区未探及明确实质性包块。胃镜:胃体下部小弯、窦体交界处、胃角及胃窦黏膜皱襞粗大,可见弥漫性、大小不一、密集分布的充血息肉样改变(图2),直径为0.2~2.0 cm不等,呈无蒂、亚蒂或有蒂状;
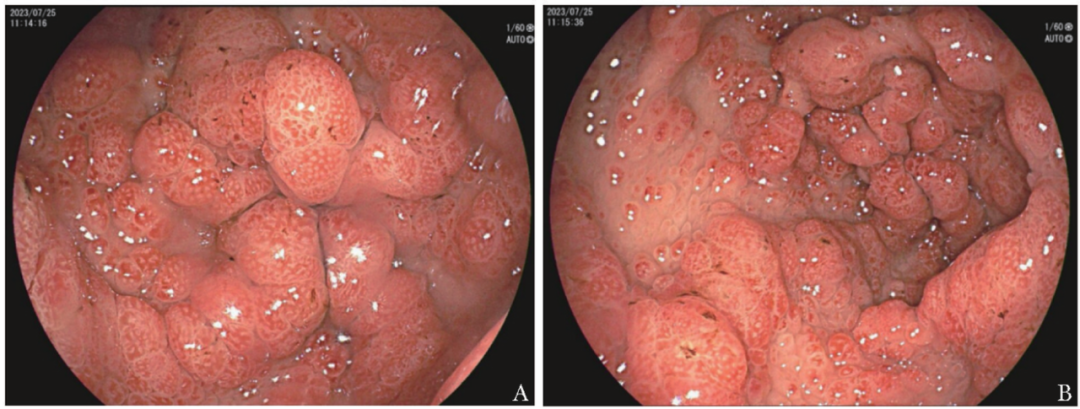
图2 胃镜检查示胃体下部小弯、胃窦黏膜可见弥漫性、大小不一、密集分布的充血息肉样改变(2023-07-25)
幽门周围黏膜明显充血水肿,内镜通过无阻力;幽门螺杆菌快速尿素酶试验为阴性。胃镜下黏膜活检病理:胃窦病变符合胃错构瘤性息肉;十二指肠降部小肠黏膜慢性炎症。结肠镜:全结肠可见多发息肉(图3),多为无蒂、色红息肉,直径约0.3~1.5 cm;盲肠、升结肠息肉间黏膜充血水肿明显,余结肠、直肠息肉间黏膜尚光整。
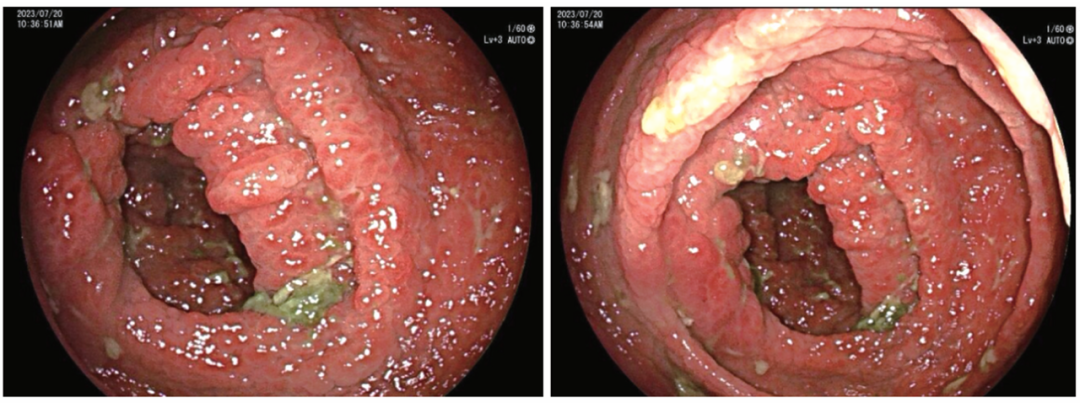
图3 结肠镜检查示多发无蒂、色红息肉(2023-07-20)
选取乙状结肠1.0 cm息肉(Kudo分型Ⅳ型),圈套器电烧切除。结肠镜下切除息肉病理:乙状结肠病变符合结肠错构瘤性息肉,局部伴低级别异型增生(图4)。
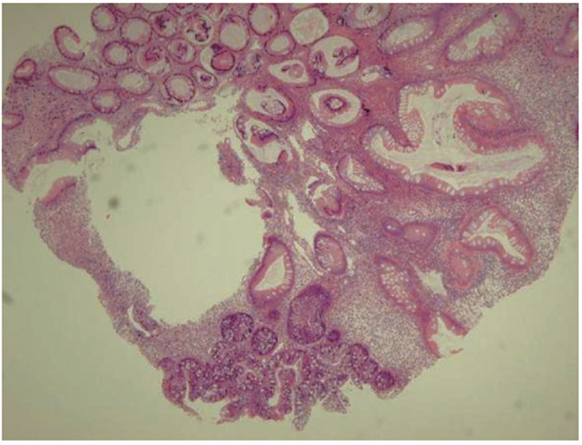
图4 患者结肠镜下切除息肉病理示错构瘤性息肉,局部伴低级别异型增生(HE,×40)
诊断与治疗
结合病史、辅助检查结果,患者诊断为CCS。2023年7月28日起予以泼尼松40 mg/d口服,连续3周;8月17日起每周减量2.5 mg,9月7日减量至30 mg/d;之后每周减量5 mg,9月21日减量至20 mg/d;之后每周减量2.5 mg,10月19日减量至10 mg/d并维持该剂量。鉴于病程中体质量显著下降,且合并营养不良,在软食的基础上,予瑞素(500 mL/d)分次小口啜饮。针对维生素D缺乏,予以维生素D3(1000 IU/d)口服。2023年8月30日门诊随访,患者毛发恢复生长,乏力明显改善,皮肤色素沉着减退(图5),体质量62 kg。
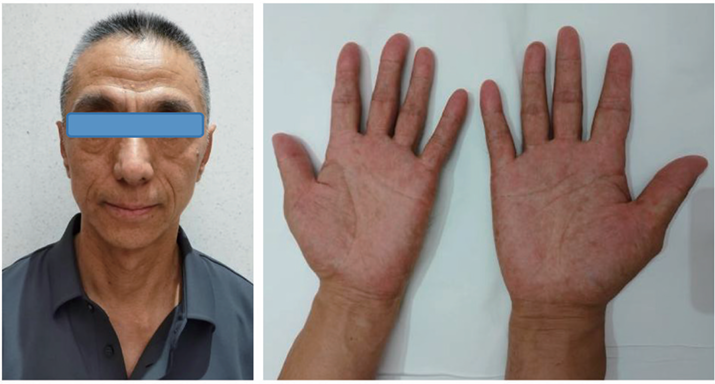
图5 随访期间患者毛发恢复生长,双手掌色素沉着减轻
2 讨论
患者中年男性,亚急性病程,病程中出现乏力、体质量减轻,全身多部位皮肤变深伴色素沉着,应考虑是否存在肾上腺皮质功能减退。原发性肾上腺皮质功能减退患者可出现倦怠、疲乏、无力、厌食、体质量减轻及色素沉着,其中色素沉着为最典型的查体发现。色素沉着为全身性,尤以光暴露部位(脸部、颈部及手背)、长期摩擦或受压部位(肘部、膝部、脊柱、指关节、腰带部位、腹带部位)为著[7]。患者病程中曾检出新冠病毒核酸阳性。新冠病毒感染可累及肾上腺并引起肾上腺皮质功能减退,影像学表现为肾上腺出血、梗死等改变[9-10]。
一项针对40例因感染新冠病毒而死亡患者的尸检病理显示,肾上腺周围脂肪组织存在细胞损伤和小血管炎,血管周围存在不同程度的淋巴细胞和浆细胞浸润,偶见红细胞渗出至血管腔外[11]。本例患者内分泌相关检查未发现肾上腺皮质功能减低证据,结合其存在明显的外胚层改变(脱发、甲营养不良、皮肤色素沉着),病程中出现味觉减退、腹泻,胃肠道黏膜存在广泛的息肉样改变,可明确诊断为CCS。
CCS的发病机制尚不清楚。目前认为可能与以下因素有关:
1 应激
精神和躯体应激均可诱发CCS[12]。在精神应激、结肠切除及足跟骨折后均有发生CCS的文献报道[13-15]。
2 自身免疫
文献显示,CCS患者外周血可检出抗核抗体和抗酿酒酵母抗体[16-17],部分CCS患者息肉病理可见IgG4+浆细胞浸润[18]。
3 幽门螺杆菌感染
Watanabe等[19]研究显示,54%的CCS患者合并幽门螺杆菌感染。部分CCS患者根除幽门螺杆菌后CCS相关症状得到缓解[20]。
4 基因突变
全基因组分析显示,PRKDC基因突变可能与CCS发病相关[21]。
5 变态反应
文献报道,部分CCS患者发病前有甲状腺素口服史[22],亦有病例显示CCS患者在发病前曾有中药服用史,血清IgE水平明显升高,提示药物引发的过敏反应可能与CCS发病相关[23]。详细追问病史,该患者长期存在精神压力,入院时血清总IgE升高,提示其发病可能与精神应激、变态反应均相关。
CCS可引起全消化道受累。一项回顾性研究显示,12.3%的CCS患者合并食管病变。多数病例表现为食管非特异性炎症,少数病例合并鳞状细胞乳头状瘤[19]。
对北京协和医院2000—2016年18例CCS患者的临床资料进行回顾性研究显示,病变以除食管以外的全消化道多发息肉为特点,其中胃与结肠最易受累。小至中等大小的息肉/假息肉呈地毯样分布,一般无蒂,直径2~30 mm,呈结节状或不规则状,息肉黏膜充血水肿,表面可有糜烂、溃疡等,息肉黏膜正常或充血水肿。受累黏膜皱襞常增厚,巨大的黏膜皱襞在胃大弯处最明显[24]。
小肠病变主要累及十二指肠和回肠末端,胶囊内镜检查可见海葵状肠黏膜、空肠弥漫性疱疹样息肉和回肠弥漫性草莓样红色息肉;十二指肠和空肠可见绒毛呈白色、拉长分枝状;小肠黏膜可出现水肿、变红。放大内镜后观察小肠,可见绒毛结构不规则,绒毛顶端散布白点(病理显示为扩张的淋巴管)。
血袢血管大小不一,绒毛内亦可出现点状红斑(病理显示为出血灶)[25-26]。CCS息肉可呈多种病理类型,如炎性息肉、增生性息肉、错构瘤性息肉和腺瘤性息肉。腺瘤性息肉可分为管状腺瘤、管状腺瘤伴低度上皮内瘤变和绒毛状管状腺瘤伴局部高分化腺癌,以及锯齿状腺瘤[27]。
除息肉外,CCS还具有以下病理特征:以嗜酸性粒细胞为主的炎症细胞浸润、腺/隐窝改变(包括腺/隐窝囊性扩张,部分充满蛋白液或黏液、枯萎和分枝),固有层水肿以及十二指肠绒毛萎缩。在无息肉区域,可见黏膜水肿并伴固有层和黏膜下层慢性炎症和充血。CCS息肉中亦可见IgG4阳性浆细胞浸润[28]。本例患者胃、结肠受累显著,病理结果示病变为错构瘤性息肉,符合CCS消化道受累的经典表现。
CCS可合并多种其他疾病。10%~20%的CCS患者合并胃癌及其他胃肠道肿瘤。目前认为,锯齿状腺瘤-腺瘤-肿瘤途径可能在CCS癌变中发挥作用[29]。与CCS相关的胃癌类型包括MUC5AC阳性的胃癌和CD10阳性的高度增生性、完全肠化型胃癌,肠道肿瘤包括十二指肠乳头状腺癌和结肠癌[30-32]。肠黏膜病变可继发吸收不良、低钙血症和维生素D缺乏,导致肋骨骨折和连枷胸[33-34]。
患者还可出现营养不良、水和电解质紊乱、低蛋白血症、慢性炎症性贫血、胃肠道出血、肠套叠、十二指肠乳头脱垂和由法特氏壶腹部息肉引起的复发性胰腺炎[35]。低蛋白血症、营养不良、心力衰竭、胃肠道出血、反复感染及败血症是CCS患者的主要死亡原因[36]。该患者病程中体质量下降明显,维生素D水平低下,提示存在因广泛胃肠黏膜病变继发的营养不良,故在治疗原发病的同时需加强肠内营养支持,并补充维生素D。
该患者病程中曾测出新冠病毒核酸阳性。为明确新冠病毒感染与CCS的因果关系,笔者在PubMed数据库以“Cronkhite-Canada Syndrome”和“COVID-19”为检索词共检索到2篇相关病例报道[5-6]。
病例1为65岁男性,因全身毛发脱落而就诊[5]。其就诊前2个月出现脱发,伴眉毛、睫毛和阴毛脱落,同时出现甲营养不良及味觉减退,脱发前约4周接种了第二剂新冠病毒疫苗[BNT162b2(Pfizer-BioNTech)],首次就诊时检出新冠病毒核酸阴性。由于脱发和味觉障碍是新冠病毒感染的常见症状(接种疫苗后出现上述症状较少见),患者被诊断为新冠病毒疫苗相关病症。予以泼尼松龙治疗后(20 mg/d、口服14 d,之后在5个月内逐渐减量),患者的毛发生长恢复,但味觉减退无改善。在激素减量过程中,患者出现腹痛症状,结肠镜显示为全结肠多发息肉。重新查体后发现患者甲周存在明显色素沉着,最终在首诊5个月后确诊为CCS。予以泼尼松龙30 mg/d口服,味觉逐渐恢复正常。之后泼尼松龙在半年内逐渐减量至5 mg/d,患者未再出现味觉障碍。
病例2为73岁男性,因味觉减退而就诊[6]。患者无呼吸道与胃肠道症状,亦无嗅觉减退。因处于新冠病毒感染疫情大流行期间(2020年),首诊怀疑为新冠病毒感染,但检测新冠病毒核酸为阴性,遂嘱患者居家观察。之后1个月内患者逐渐出现食欲不振、体质量减轻、腹痛、便血,不能耐受固体食物。再次就诊时出现皮肤颜色加深、毛发脱落及甲营养不良。内镜检查示胃和十二指肠内多发大小不一(5~15mm)的“草莓样”息肉。结肠镜检查示全结肠黏膜呈重度炎性息肉样改变,其中以右半结肠为著。病变区域活检示固有层腺体囊性扩张,伴严重水肿和炎症浸润,最终诊断为CCS。给予泼尼松龙40 mg/d口服后,症状迅速缓解。3个月后复查内镜,未见CCS相关黏膜病变。上述病例提示,感染新冠病毒或接种新冠病毒疫苗后亦可出现脱发、味觉减退等非特异症状,其中感染新冠病毒后味觉减退发生率高达44%[37],故在新冠病毒感染疫情期间,CCS患者在病程早期易被误诊为新冠病毒感染或新冠病毒疫苗相关不良反应,但二者是否存在因果关联尚缺乏充分的循证医学证据。
目前,对于CCS的治疗尚无统一标准,主要采用糖皮质激素疗法,其中以口服泼尼松为主。文献报道,85%以上的CCS患者对>30 mg/d的激素治疗有反应[19]。但当激素减量至10 mg/d后易出现复发,故在症状改善后,应根据患者具体情况逐渐、缓慢减量[38]。亦有泼尼松龙联合美沙拉嗪实现CCS长期缓解的病例报道[39]。
此外,个案报道显示英夫利昔单抗、根除幽门螺杆菌、非甾体抗炎药(如柳氮磺吡啶)及营养支持治疗亦可部分缓解CCS症状[23],但确切疗效仍需进一步验证。本例患者采用了泼尼松疗法,首剂量为40 mg/d,维持3周后逐渐减量,并于2个月后减至10 mg/d长期维持,最新随访显示毛发生长恢复,皮肤色素沉着减退,体质量回升,证明该疗法有效。后续拟在首诊6个月后复查内镜,观察消化道病变改善情况。
作为一种多系统受累的罕见疾病,CCS病程早期症状不典型,易被误诊,尤其在新冠病毒感染的背景下,更易被临床忽略而误诊。本文对病程中合并新冠病毒感染CCS病例的诊疗经过进行总结,以期提升临床医生对该病的认知。
作者贡献
张宁、杨晨皓负责病例整理、论文撰写及修订;孙晓红负责论文构思及修订;周良瑞提供患者病理图片;康琳、刘晓红、李骥、李海龙提供诊疗思路。
参考文献
[1]Vashistha N, Chakravarty S, Singhal D. Cronkhite-Canada syndrome[J]. Gastrointest Endosc, 2017, 86(5): 922-923.
[2]CRONKHITE L W, Jr, CANADA W J. Generalized gastrointestinal polyposis; an unusual syndrome of polyposis, pigmentation, alopecia and onychotrophia[J]. N Engl J Med, 1955, 252(24): 1011-1015.
[3]Slavik T, Montgomery E A. Cronkhite-Canada syndrome six decades on: the many faces of an enigmatic disease[J]. J Clin Pathol, 2014, 67(10): 891-897.
[4]Lu Y Y, Huang F X, Wang Y W, et al. Clinical and endoscopic characteristics of Chinese Cronkhite-Canada syndrome patients: a retrospective study of 103 cases[J]. Dig Dis, 2021, 39(5): 488-495.
[5]Miyawaki K, Komori T, Ishida Y, et al. Cronkhite-Canada syndrome mimicking COVID-19-related symptoms[J]. Acta Derm Venereol, 2022, 102: adv00812.
[6]Yoshimoto T, Okamoto T, Fukuda K. Cronkhite-Canada syndrome: a rare COVID-19 mimicker[J]. Am J Gastroenterol, 2021, 116(8): 1765.
[7]Øksnes M, Husebye E S. Approach to the patient: diagnosis of primary adrenal insufficiency in adults[J]. J Clin Endocrinol Metab, 2023, 109(1): 269-278.
[8]Hashim M, Athar S, Gaba W H. New onset adrenal insufficiency in a patient with COVID-19[J]. BMJ Case Rep, 2021, 14(1): e237690.
[9]Kumar R, Guruparan T, Siddiqi S, et al. A case of adrenal infarction in a patient with COVID 19 infection[J]. BJR Case Rep, 2020, 6(3): 20200075.
[10]Siejka A, Barabutis N. Adrenal insufficiency in the COVID-19 era[J]. Am J Physiol Endocrinol Metab, 2021, 320(4): E784-E785.
[11]Kanczkowski W, Evert K, Stadtmüller M, et al. COVID-19 targets human adrenal glands[J]. Lancet Diabetes Endocrinol, 2022, 10(1): 13-16.
[12]Goto A. Cronkhite-Canada syndrome: epidemiological study of 110 cases reported in Japan[J]. Nihon Geka Hokan, 1995, 64(1): 3-14.
[13]Murata I, Yoshikawa I, Endo M, et al. Cronkhite-Canada syndrome: report of two cases[J]. J Gastroenterol, 2000, 35(9): 706-711.
[14]Ikeda K, Sannohe Y, Murayama H. A case of Cronkhite-Canada syndrome developing after hemi-colectomy[J]. Endoscopy, 1981, 13(6): 251-253.
[15]Zong Y, Zhao H Y, Yu L, et al. Case report-malignant transformation in Cronkhite-Canada syndrome polyp[J]. Medicine (Baltimore), 2017, 96(6): e6051.
[16]Wen X H, Wang L, Wang Y X, et al. Cronkhite-Canada syndrome: report of six cases and review of literature[J]. World J Gastroenterol, 2014, 20(23): 7518-7522.
[17]Takeuchi Y, Yoshikawa M, Tsukamoto N, et al. Cronkhite-Canada syndrome with colon cancer, portal thrombosis, high titer of antinuclear antibodies, and membranous glomerulonephritis[J]. J Gastroenterol, 2003, 38(8): 791-795.
[18]Fan R Y, Wang X W, Xue L J, et al. Cronkhite-Canada syndrome polyps infiltrated with IgG4-positive plasma cells[J]. World J Clin Cases, 2016, 4(8): 248-252.
[19]Watanabe C, Komoto S, Tomita K, et al. Endoscopic and clinical evaluation of treatment and prognosis of Cronkhite-Canada syndrome: a Japanese nationwide survey[J]. J Gastroenterol, 2016, 51(4): 327-336.
[20]Kato K, Ishii Y, Mazaki T, et al. Spontaneous regression of polyposis following abdominal colectomy and Helicobacter pylori eradication for Cronkhite-Canada syndrome[J]. Case Rep Gastroenterol, 2013, 7(1): 140-146.
[21]Boland B S, Bagi P, Valasek M A, et al. Cronkhite Canada syndrome: significant response to infliximab and a possible Clue to pathogenesis[J]. Am J Gastroenterol, 2016, 111(5): 746-748.
[22]Ho V, Banney L, Falhammar H. Hyperpigmentation, nail dystrophy and alopecia with generalised intestinal polyposis: Cronkhite-Canada syndrome[J]. Australas J Dermatol, 2008, 49(4): 223-225.
[23]Wu Z Y, Sang L X, Chang B. Cronkhite-Canada syndrome: from clinical features to treatment[J]. Gastroenterol Rep (Oxf), 2020, 8(5): 333-342.
[24]李媛, 罗涵青, 吴东, 等. Cronkhite-Canada综合征临床病理学分析及IgG4阳性浆细胞浸润的意义[J]. 中华病理学杂志, 2018, 47(10): 753-757.
[25]Wallenhorst T, Pagenault M, Bouguen G, et al. Small-bowel video capsule endoscopic findings of Cronkhite-Canada syndrome[J]. Gastrointest Endosc, 2016, 84(4): 739-740.
[26]Murata M, Bamba S, Takahashi K, et al. Application of novel magnified single balloon enteroscopy for a patient with Cronkhite-Canada syndrome[J]. World J Gastroenterol, 2017, 23(22): 4121-4126.
[27]Jha A K, Kumar A, Singh S K, et al. Panendoscopic characterization of Cronkhite-Canada syndrome[J]. Med J Armed Forces India, 2018, 74(2): 196-200.
[28]Bettington M, Brown I S, Kumarasinghe M P, et al. The challenging diagnosis of Cronkhite-Canada syndrome in the upper gastrointestinal tract: a series of 7 cases with clinical follow-up[J]. Am J Surg Pathol, 2014, 38(2): 215-223.
[29]Nagata J, Kijima H, Hasumi K, et al. Adenocarcinoma and multiple adenomas of the large intestine, associated with Cronkhite-Canada syndrome[J]. Dig Liver Dis, 2003, 35(6): 434-438.
[30]Karasawa H, Miura K, Ishida K, et al. Cronkhite-Canada syndrome complicated with huge intramucosal gastric cancer[J]. Gastric Cancer, 2009, 12(2): 113-117.
[31]Watari J, Morita T, Sakurai J, et al. Endoscopically treated Cronkhite-Canada syndrome associated with minute intramucosal gastric cancer: an analysis of molecular pathology[J]. Dig Endosc, 2011, 23(4): 319-323.
[32]Maruno T, Kikuyama M. Cronkhite-Canada syndrome associated with sigmoid colon cancer[J]. Clin Gastroenterol Hepatol, 2011, 9(11): e118-e119.
[33]Yuan B S, Jin X X, Zhu R M, et al. Cronkhite-Canada syndrome associated with rib fractures: a case report[J]. BMC Gastroenterol, 2010, 10: 121.
[34]Liu S, Ruan G C, You Y, et al. A striking flail chest: a rare manifestation of intestinal disease[J]. Intest Res, 2019, 17(1): 155-156.
[35]Yasuda T, Ueda T, Matsumoto I, et al. Cronkhite-Canada syndrome presenting as recurrent severe acute pancreatitis[J]. Gastrointest Endosc, 2008, 67(3): 570-572.
[36]Yun S H, Cho J W, Kim J W, et al. Cronkhite-Canada syndrome associated with serrated adenoma and malignant polyp: a case report and a literature review of 13 Cronkhite-Canada syndrome cases in Korea[J]. Clin Endosc, 2013, 46(3): 301-305.
[37]Tong J Y, Wong A, Zhu D, et al. The prevalence of olfactory and gustatory dysfunction in COVID-19 patients: a systematic review and meta-analysis[J]. Otolaryngol Head Neck Surg, 2020, 163(1): 3-11.
[38]Zhu X, Shi H Y, Zhou X N, et al. A case of recurrent Cronkhite-Canada syndrome containing colon cancer[J]. Int Surg, 2015, 100(3): 402-407.
[39]Schulte S, Kütting F, Mertens J, et al. Case report of patient with a Cronkhite-Canada syndrome: sustained remission after treatment with corticosteroids and mesalazine[J]. BMC Gastroenterol, 2019, 19(1): 36.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)