首页 > 医疗资讯/ 正文

2024.V2-2024.4.30
胰腺癌
NCCN指南
2024年4月30日,胰腺癌NCCN指南更新至2024.V2,此次更新的主要内容为诊疗流程新增通过免疫组化检测HER2过表达;局部进展期/转移性疾病的后续治疗和复发疾病的治疗,体能状态评分良好0-1,新增德曲妥珠单抗(如果HER2阳性[IHC 3+])。详细更新内容如下:
01 诊疗流程
临床表现和检查
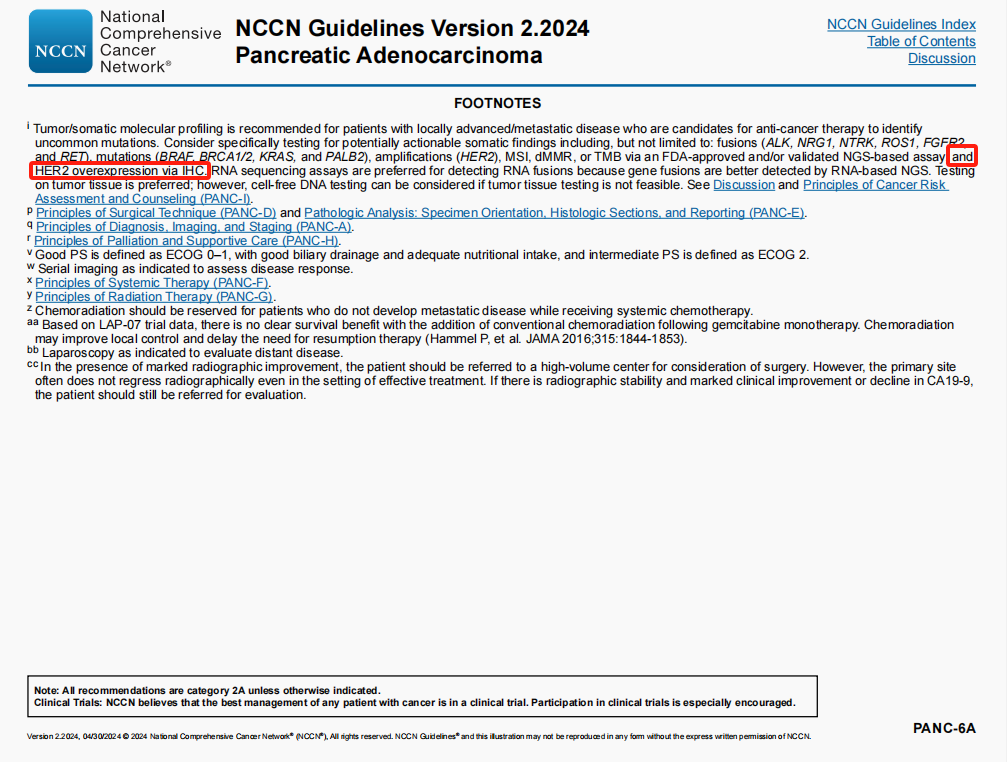
- 脚注i修改:新增“通过免疫组化检测HER2过表达”
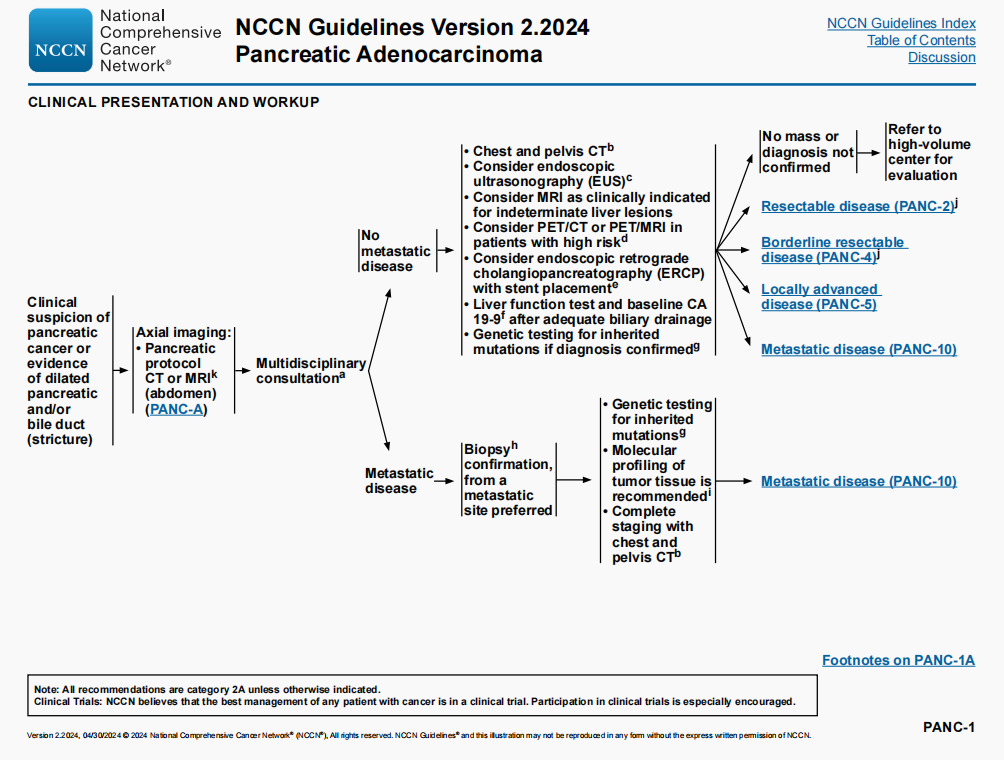

局部进展期疾病
- 脚注i修改:新增“通过免疫组化检测HER2过表达”

术后复发
- 脚注i修改:新增“通过免疫组化检测HER2过表达”

转移性疾病
- 脚注i修改:新增“通过免疫组化检测HER2过表达”

疾病进展
- 脚注i修改:新增“通过免疫组化检测HER2过表达”

02 全身治疗原则
一般原则
- 第3点修改:新增“通过免疫组化检测HER2过表达”

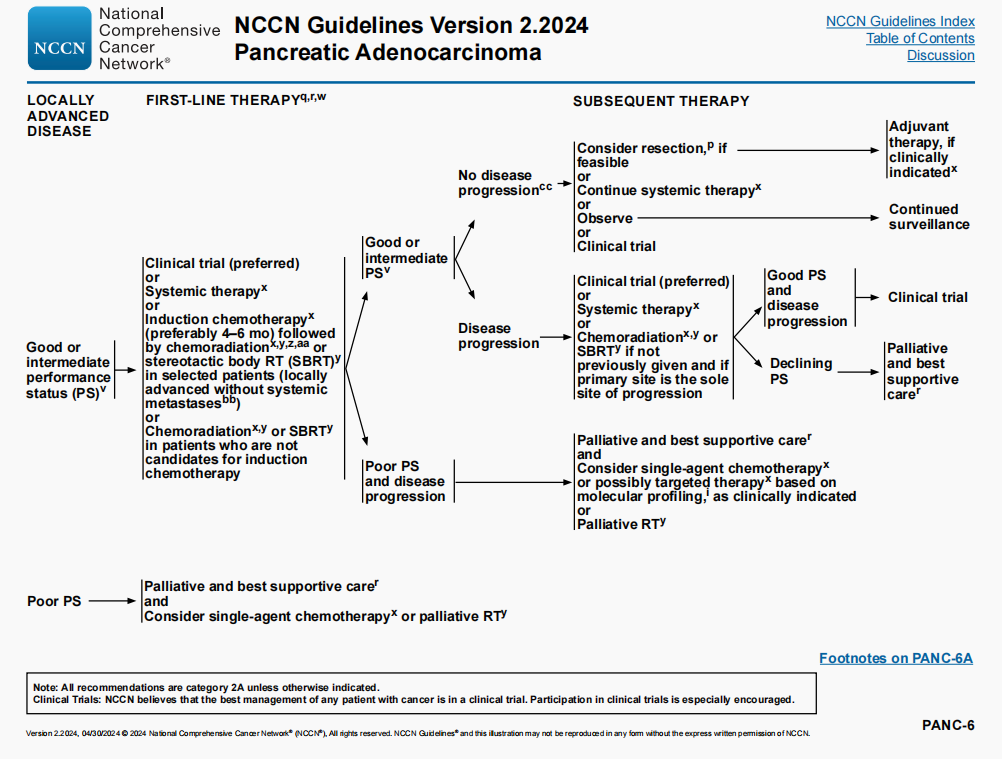
局部进展期/转移性疾病的后续治疗和复发疾病的治疗 体能状态评分良好0-1
- 在某些情况下有用
-
方案新增:德曲妥珠单抗(如果HER2阳性[IHC 3+])


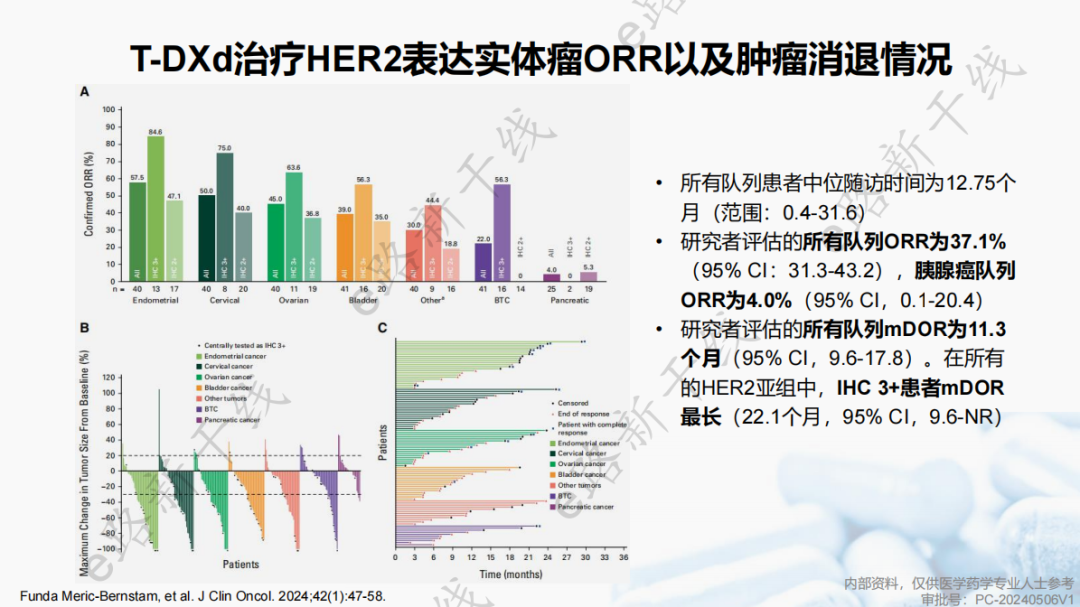
德曲妥珠单抗(T-DXd)方案的新增基于一项多中心、开放、Ⅱ期研究1(DESTINY-PanTumor02研究;NCT04482309),该研究旨在评估德曲妥珠单抗在局部进展期/转移性或不可切除的HER2表达实体瘤患者中的疗效和安全性。
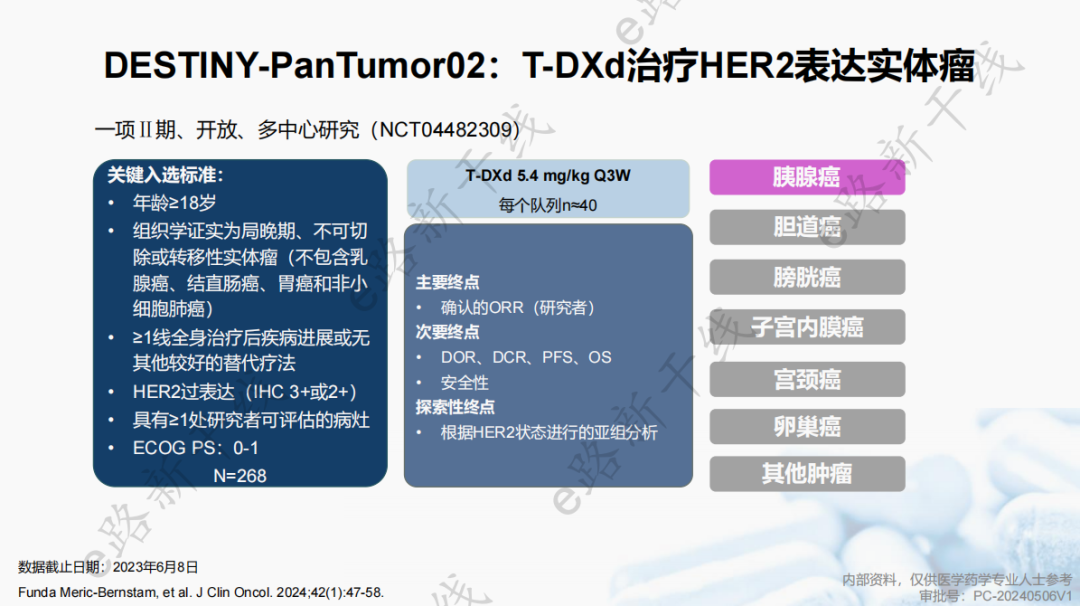
研究结果显示,所有队列患者中位随访时间为12.75个月(范围0.4-31.6),所有队列ORR为37.1%(95% CI,31.3-43.2),mDOR为11.3个月(95% CI,9.6-17.8),所有HER2亚组中IHC 3+患者mDOR最长(22.1个月,95% CI,9.6-NR)。
所有队列和胰腺癌队列mPFS分别为6.9个月(95% CI,5.6-8.0)和3.2个月(95% CI,1.8-7.2);所有队列和胰腺癌队列mOS分别为13.4个月(95% CI,11.9-15.5)和5.0个月(95% CI,3.8-14.2)。
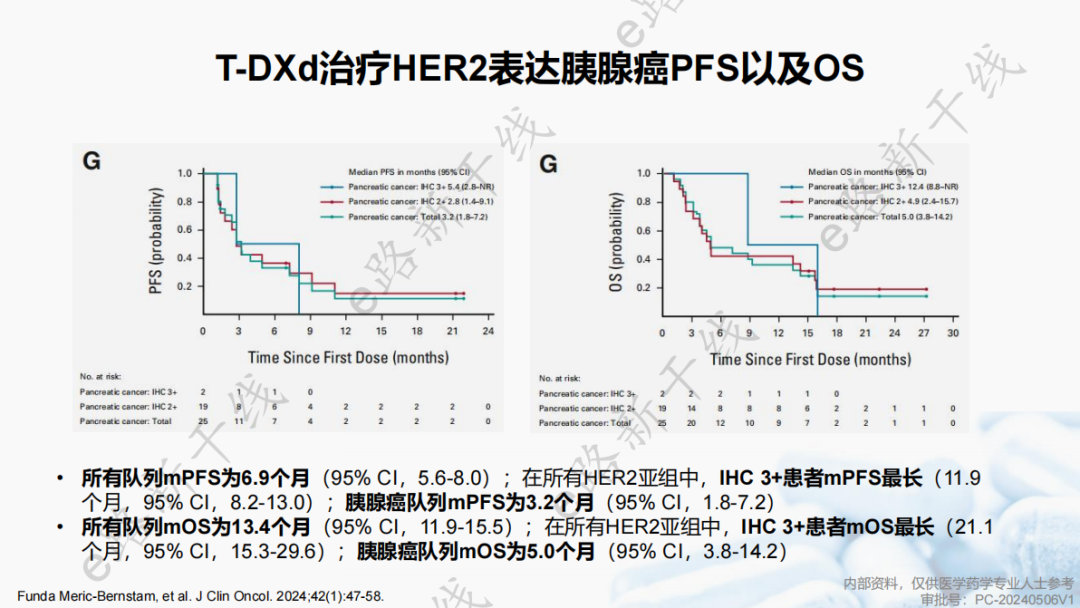
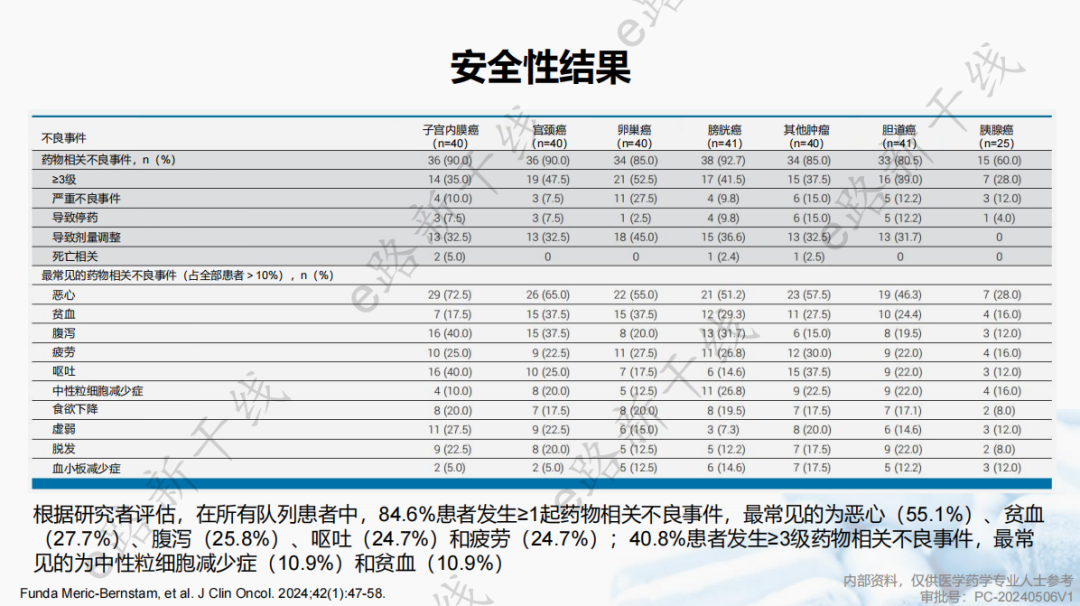
安全性结果与已知结果一致,安全性可控。
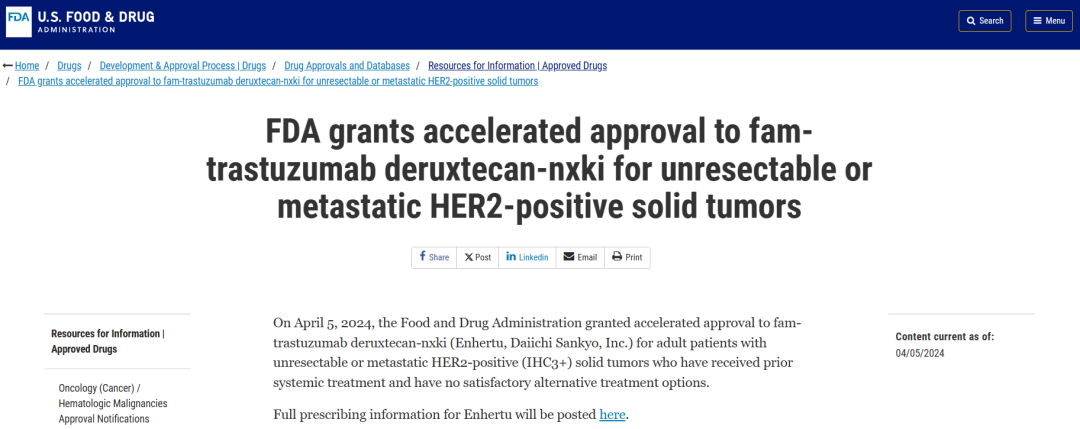
2024年4月5日,基于DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02研究的积极结果,FDA加速批准德曲妥珠单抗用于治疗不可切除或转移性HER2阳性(IHC 3+)实体瘤患者2。
03 总结
一直以来,化疗为胰腺癌全身治疗的基石,但由于化疗存在耐药性以及患者远期生存较差等问题,许多临床专家开始探索基于患者的基因突变和分子标志物类型展开个体化治疗。紧随FDA加速批准德曲妥珠单抗用于治疗不可切除或转移性HER2阳性(IHC 3+)实体瘤患者,本次胰腺癌NCCN指南更新强调了通过免疫组化检测HER2过表达并新增德曲妥珠单抗方案治疗HER2阳性(IHC 3+)患者,为胰腺癌患者靶向治疗再添选择。
参考文献:
1.Funda Meric-Bernstam, et al. J Clin Oncol. 2024;42(1):47-58.
2.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-unresectable-or-metastatic-her2.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)