首页 > 医疗资讯/ 正文
摘要
床旁超声是一款非常适合ECMO患者的诊断和监测工具,这些患者可能太不稳定,无法运送到医院其它区域进行诊断检查。然而,床旁超声检查,甚至可以前移到在ECMO启动之前。每一位考虑上ECMO的患者都应该对心脏和瓣膜功能以及血管解剖进行彻底的超声评估,而且不会延迟ECMO插管。启动ECMO前的超声检查,其作用是确认ECMO的适应症,识别ECMO不适用的临床情况,排除禁忌症,并确定ECMO配置类型的选择。在ECMO插管过程中,血管和心脏超声的使用降低了并发症的风险,并确保了插管定位的合适。超声在ECMO支持期间的监测、对ECMO并发症、故障排除起到重要的作用。例如,超声有助于评估血液引流情况是否充足通畅、血液动力学不稳定的可能原因、双心室功能、持续性低氧血症原因和VV-ECMO中的再循环情况。肺部超声可用于监测VV-ECMO肺部的恢复迹象。颅脑超声为ECMO提供了有价值的诊断和预后信息。在评估VA-ECMO脱机的准备情况中,超声心动图是必不可少的。最后,拔管后的超声检查,主要用于识别拔管后血栓和血管并发症。本综述将涵盖从头到脚的超声检查在成年ECMO患者从决定启动ECMO到拔管后阶段的管理中的作用。
关键词
超声,超声心动图,ECMO,监测
背景
体外膜肺氧合(ECMO)是一种潜在的挽救难治性呼吸或循环衰竭患者生命的支持手段。然而,ECMO具有其固有的风险,并可能伴有严重的并发症。因此,需要密切和全面的监控,以实现最佳的日常管理。超声,由于其广泛的可用性和无创性,是一款非常适合ECMO患者的诊断和监测工具。由于接受ECMO支持的患者通常是医院内最危重的患者,并且可能因病情不稳定而不能被运送到医院的其它区域进行诊断检查,因此,床旁超声具有独特的优势,它可以在床旁进行相关的诊断检查评估。此外,与其他更具有创性的监测和诊断工具(如有创性颅内压[ICP]监测)相比,床旁超声对ECMO患者的优势更为明显,这些患者在大多数情况下都正在接受全身抗凝治疗,并且容易发生侵袭性感染。虽然心脏超声(超声心动图)对ECMO的关键作用经常被强调,但值得注意的是,超声在心脏以外的应用也同样是ECMO治疗中重要的一部分,但不太被强调。由于ECMO支持期间出现的固有动态生理变化,使得超声存在独特的优势。为了准确评估和解释ECMO的超声检查结果,进行超声检查的医生必须熟悉这些生理变化、不同的ECMO配置类型及其各自的适应症,以及超声在该人群中的特异性。本综述将对超声的作用进行一个全面的概述:1)在ECMO启动前对患者的评估;2)ECMO插管期间的评估;3)用于在ECMO支持期间的监测和ECMO并发症的故障排除;和4)患者从ECMO中脱机前的准备情况评估。
ECMO前:超声在ECMO启动前的作用
超声心动图
插管前心脏评估可通过经胸或经食道超声心动图进行。经胸超声心动图(TTE)通常容易获得且无创。然而,由于患者的体质、近期手术或创伤以及机械通气(MV)可能会显著限制超声检查的可行性,在这种情况下,经食管超声心动图(TEE)可能是必要的。除了积极心肺复苏(CPR)的情况,ECMO启动前均需要进行超声心动图评估。然而,超声心动图的全面性应取决于患者的血流动力学状况。
适应症—禁忌症和ECMO配置类型的选择
所有考虑接受VV- ECMO支持的患者都应进行超声心动图检查,以排除呼吸衰竭的心脏原因(左心瓣膜病或严重的左心[LV]功能障碍)或心内分流的存在,同时不能延迟ECMO插管(在线资源1)。呼吸衰竭并伴有严重左室收缩功能障碍(如:脓毒性心肌病)的患者可能需要V-VA -ECMO。表1总结了ECMO启动前所需的主要超声参数。
表1 ECMO前的超声评估


重要参数以红色粗体显示
CFD:彩色血流多普勒;ECMO:体外膜肺氧合;LV 左心室;LVEF左室射血分数;LVOT VTI:左心室流出道血流速度时间积分;PA:肺动脉;PE:肺栓塞;RA:右心房,RV:右心室;RV FAC:右心室面积变化分数;RVSP:右心室收缩压;TAPSE:三尖瓣环平面收缩期位移;TR:三尖瓣反流
*这些不一定是ECMO的禁忌症,但需要识别,因为它们可能需要额外的干预措施
虽然VV-ECMO不提供任何直接的循环支持,但经过氧合和脱羧的血液返回到右心、以及接受ECMO支持后机械通气支持力度的降低,对右心室(RV)后负荷有着有益的影响。因此,继发于严重呼吸衰竭的急性右心衰,在接受VV-ECMO支持后通常会得到稳定,如果是外周VA-ECMO可能会出现氧合的差异表现。若在接受了VV-ECMO后,右心功能障碍仍持续存在,则可能需要进行额外循环支持,例如:V-VA- ECMO。在这样情况下,也可以考虑行静脉—肺动脉(V-PA)ECMO(使用单腔管,经右心房[RA]到肺动脉[PA],或双腔管,经PA回输灌注血液)。
VA-ECMO或V-PA-ECMO对慢性肺动脉高压患者有较好的支持作用。因此,识别慢性右心超负荷的征象至关重要,如:右心室肥大、收缩期PA压力>60-70 mmHg(注意,失代偿性右心衰时,PA压力可能较低)和心包积液。同样,继发于大面积肺栓塞的梗阻性休克最好用VA-ECMO支持。
根据目前的指南,心源性休克患者应进行完整的超声心动图检查,以量化心衰的程度,并评估是否需要单心室或双心室支持。超声心动图还有助于排除需要不同干预措施的休克原因,以及ECMO不适用(如:心脏压塞)或禁忌(如:主动脉夹层、严重主动脉瓣反流)的原因。此外,超声心动图可以识别可能需要额外手术干预(除了ECMO支持)的情况(例如,乳头肌或室间隔破裂)。
其他插管前超声心动图检查结果
由于左心室后负荷的增加可能会加重原有的瓣膜功能不全,所以在启动VA-ECMO之前,应记录原有瓣膜疾病的严重程度。心包积液的存在和积液量的多少应在ECMO插管前进行评估,因为心包积液的发展可能是围手术期的一种并发症。最后,插管前评估应包括检查中心血管和外周血管的解剖结构,以排除任何可能不适宜插管的潜在病理状况。应排除右心室、下腔静脉(IVC)和上腔静脉(SVC)中是否存在血栓,因为这可能会提示着需要选择不同的ECMO配置类型(在线资源2)。识别出突起的下腔静脉瓣膜、Chiari网、右心瓣膜狭窄(尽管罕见)或起搏器导线的存在也是至关重要的,因为这些可能会使导线和套管的插入变得复杂化。
心肺复苏术中的ECMO(ECPR)
当考虑行ECPR时,由于全面的插管前超声心动图检查是不可行的,超声心动图和肺部超声的作用主要是排除心脏骤停的可逆原因,如严重的低血容量和张力性气胸。值得注意的是,与经胸超声(TTE)相比,经食道超声(TEE)在心脏骤停中的使用与较短的胸部按压暂停相关。此外,一些作者建议使用TEE作为额外的监测工具,通过识别最大按压面积来评估CPR的质量。
肺部超声
肺部超声为呼吸衰竭的评估提供了有价值的见解,并有助于区分心源性和非心源性肺水肿。在肺部超声检查中,心源性肺水肿或液体超负荷表现为多个弥漫性B线。相反,胸膜线不规则、碎裂或增厚、肺通气丧失伴肺实变(不能用胸腔积液、肺不张或肿块来解释)和前侧胸膜下实变与非心源性肺水肿相符。在考虑启动ECMO之前,需要解决肺不张或明显的胸腔积液,因为肺复张或胸腔穿刺术可能会显著改善氧合(在线资源3)。在休克患者中,肺部超声有助于排除张力性气胸或胸腔积液。
床旁超声在ECMO置管操作中的引导作用(图1)
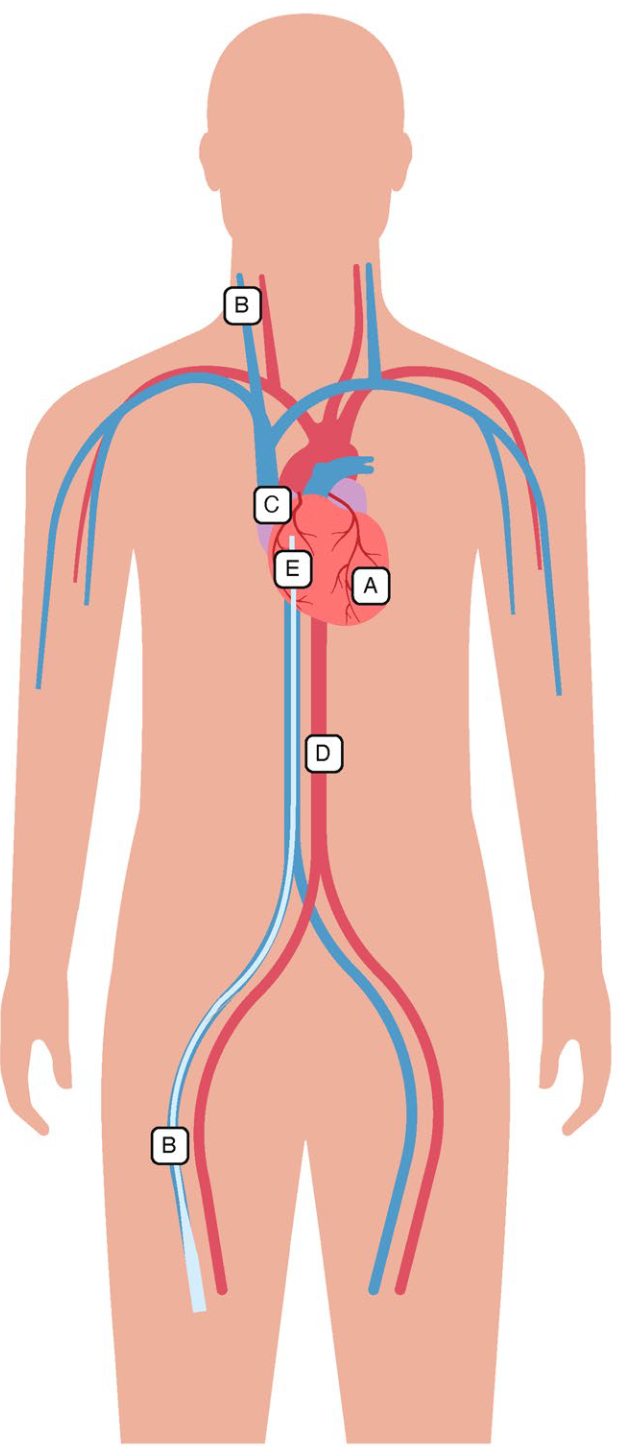
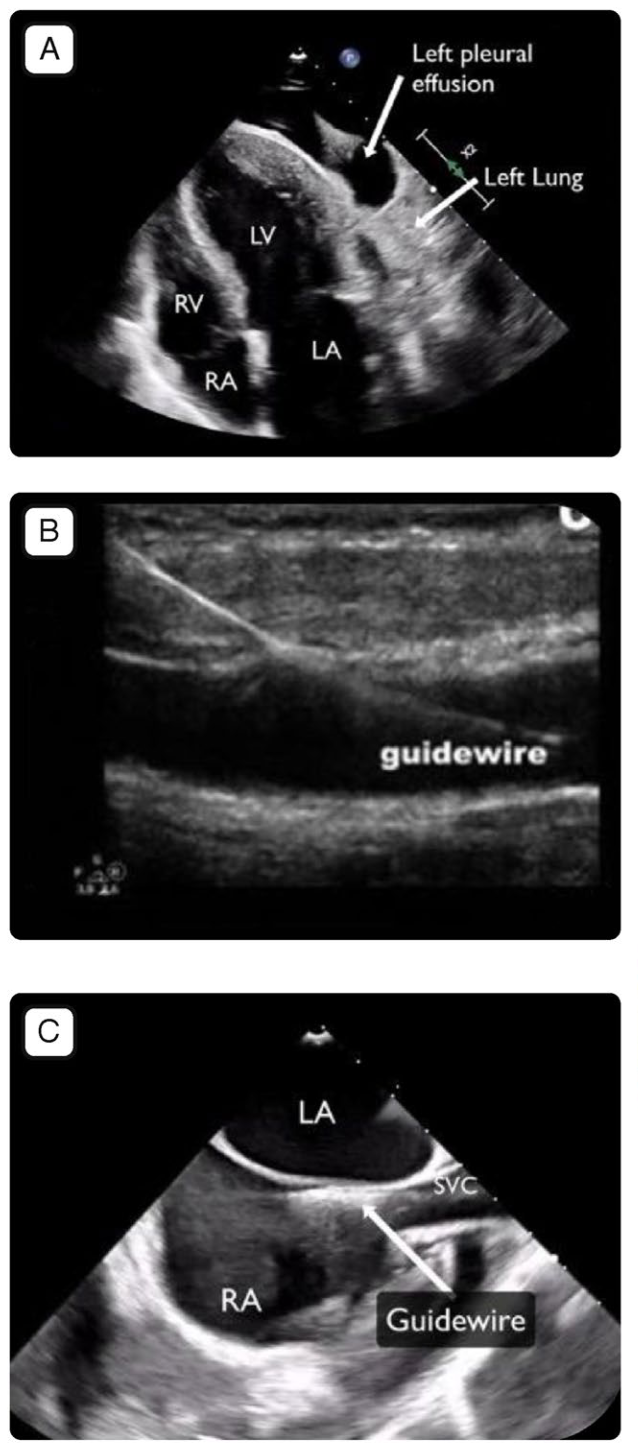
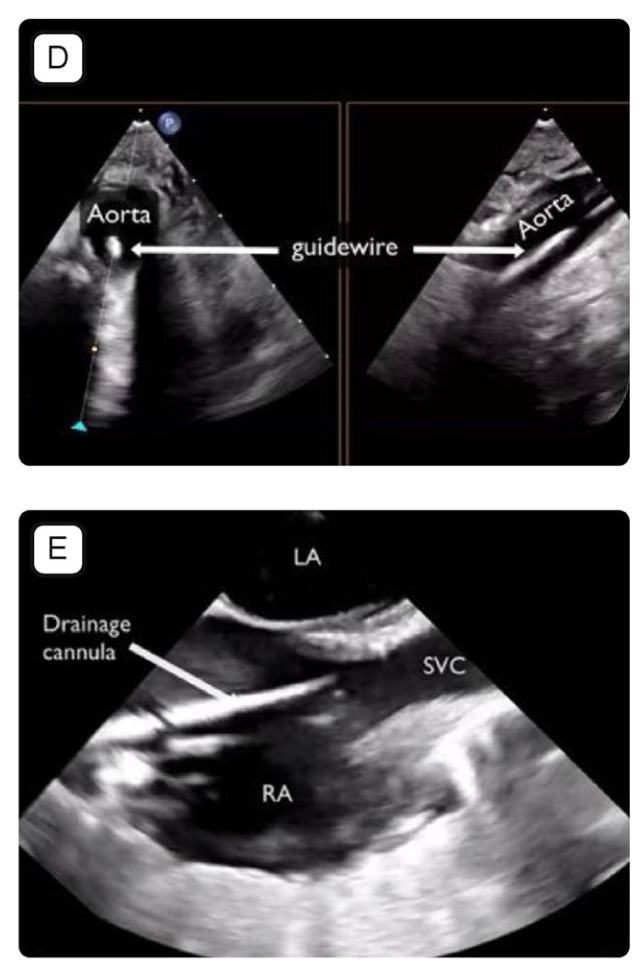
图1.ECMO前和ECMO插管时的主要超声切面。图A:经胸切面(心尖4腔心切面的后侧也获取了),可见大量胸腔积液、肺组织致密实变和改良的心尖4腔心。LA 左心房;LV 左心室;RA右心房;RV 右心室。图B:血管内有导丝的超声图像。图C:经食道心超,食管中段双心房横截面,上腔静脉内可见导丝;LA 左心房,RA 右心房,SVC 上腔静脉。图D:仅适用于VA-ECMO;经食道超声降主动脉切面,短轴切面及长轴切面内均可见动脉导丝位于其中。图E:经食管超声,食管中段双房切面,引流套管尖端位于右心房与上腔静脉交界处;LA 左心房,RA 右心房,SVC 上腔静脉。
超声引导下的血管通路建立
应全面检查外周血管解剖,以证实其通畅性,并排除血栓、动脉瘤或狭窄的存在。血管的直径决定了可以安全插入的最大插管尺寸(最大尺寸[Fr]=3×直径,单位为mm)。但是,为了安全插入,建议使用比最大尺寸小几个Fr的套管。推荐进行实时超声引导,以降低并发症发症率、降低隐股连接处插管、夹层和动静脉瘘的风险。
超声心动图引导ECMO置管
当由有经验的操作者进行检查时,超声心动图可减少与导线或套管错位相关并发症的发生率,例如血管损伤和心脏压塞。在穿刺使用扩张器前,应确定钢丝在外周血管(颈内静脉、股静脉和股动脉)和中心血管(静脉插管为腔静脉,动脉插管为降主动脉)中的正确位置。应注意,不要把伪影和导丝混淆,在反复扩张穿刺点的过程中,连续实时可视化是必不可少的,因为导丝可能会迁移、弯曲、盘绕在RA内、迁移到RV内或穿过房间隔(IAS)。如果插管无意中进入RA或RV,未被识别的导丝在RA或RV中的迁移或绕圈可能会导致潜在的危及生命的并发症。还可以实时追踪套管经导丝的插入和进入情况。值得注意的是,套管导入器的尖端很难与套管尖端区分开来,因此,超声心动图医师应注意,一旦接近RA时,导入器是否已部分缩回。超声心动图医师和操作者之间的沟通在整个过程中极其重要。
在线参考资料4至24中详细介绍了手术指导和每种ECMO配置类型的最佳插管位置所需的主要超声心动图切面。
重要的是,在ECMO支持时一旦改变机械通气设置,就可能导致肺容量的减少,这可能会改变膈肌和套管相对于心腔的位置。同样,患者的体位也可能会改变套管在心脏内的位置。因此,一旦改变患者体位时,以及在调整呼吸机参数时,最好是再确认导管的安全。
插管后的超声心动图有助于确定插管的最终位置,并排除插管与瓣膜的邻接、新出现的或增加的心包积液或VA- ECMO上的主动脉夹层。双心室功能和明显的瓣膜病变也应在ECMO上机支持后重新评估一次,尤其是在VA- ECMO。
床旁超声在ECMO支持过程中的监测作用(图2)
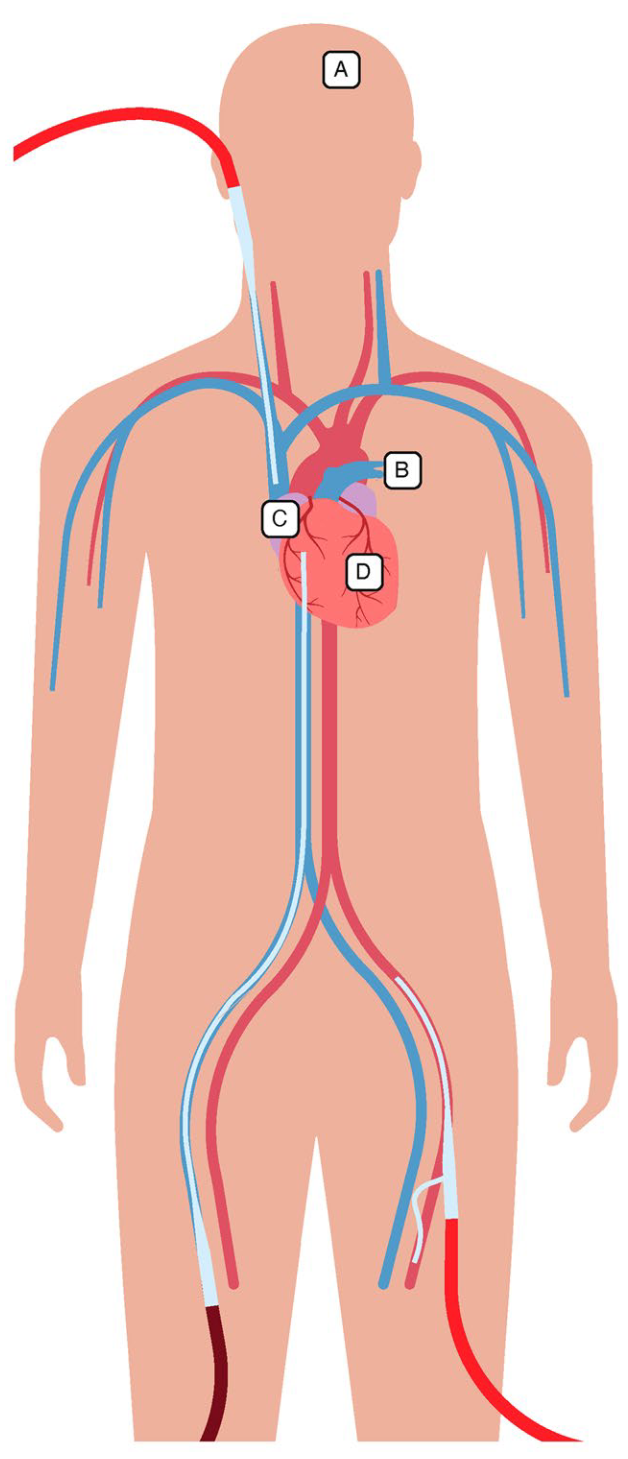
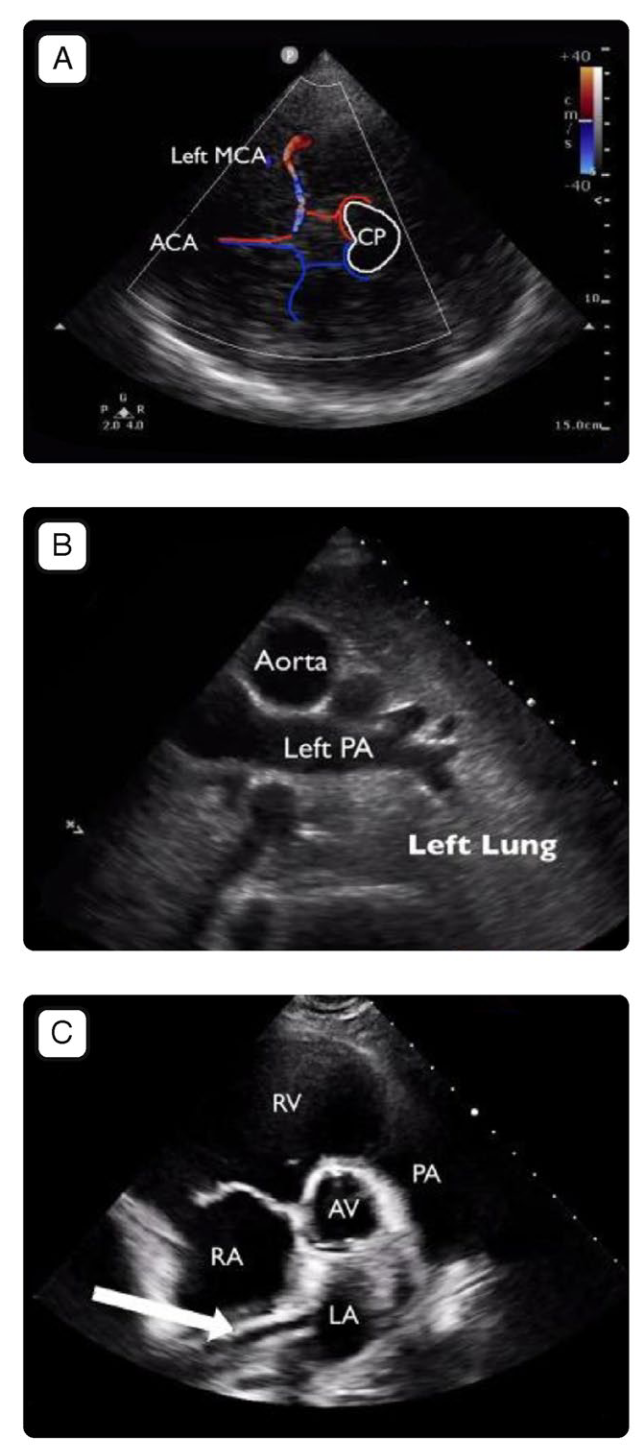
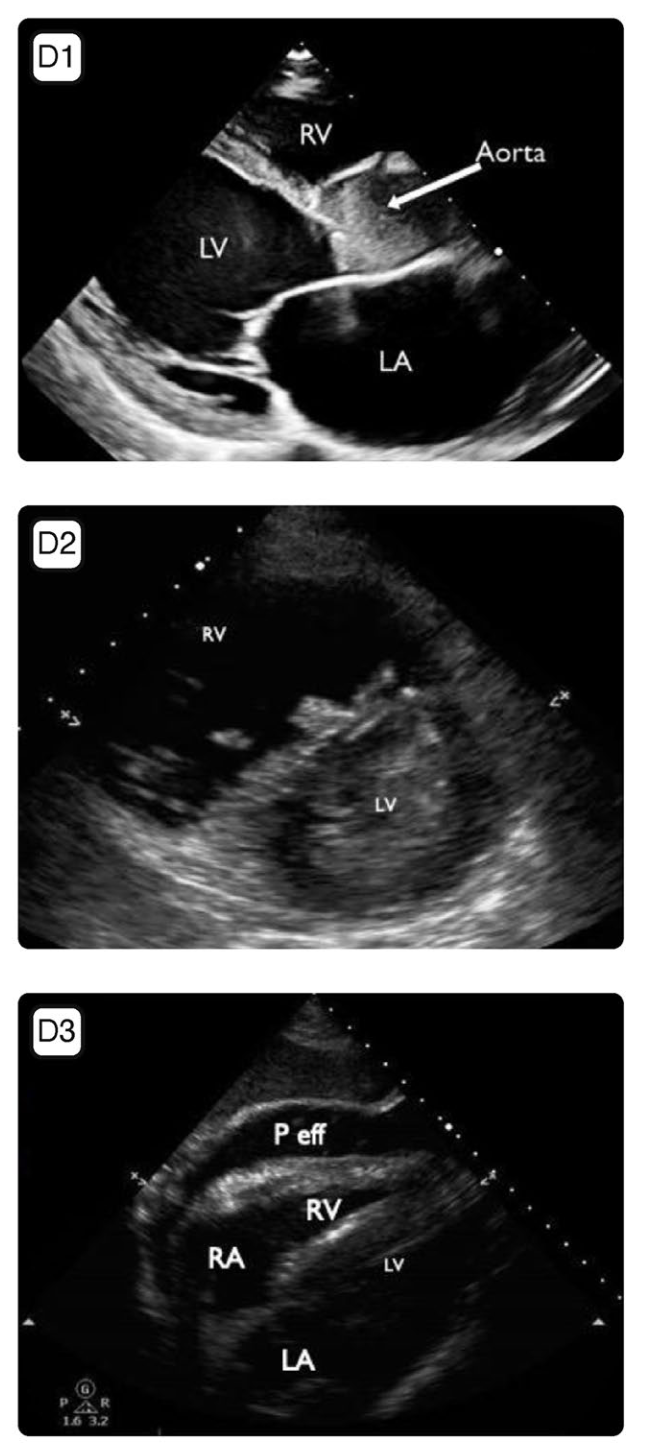
图2. 用于ECMO期间监测的主要超声切面。图A 外周VA-ECMO患者,从左颞窗获得的经颅多普勒切面。左侧大脑中动脉(MCA)清晰可见。ACA 大脑前动脉;CP 大脑脚。图B VV-ECMO患者肺实变的超声切面图。致密实变使得肺动脉及其节段性分支可见。PA 肺动脉。图C 经胸超声胸骨旁右心室流入口—流出口切面图,显示引流套管的尖端抵靠房间隔,在某些情况下,这可能导致引流功能不畅;AV 主动脉瓣,LA 左房,PA 肺动脉,RA 右房,RV 右室。图D1 从一名VA-ECMO患者中获得的经胸超声胸骨旁长轴切面,显示主动脉瓣未开放,升主动脉内自发显影。这只发生在VA-ECMO中。对于VA-ECMO支持的患者,应经常评估主动脉瓣的开放度情况LA 左房,LV左室,RV右室。图D2 经胸超声胸骨旁短轴中乳头水平切面,显示右心室严重扩张和明显的室间隔反常运动,提示肺动脉压升高。无论是哪种类型的ECMO,均应监测右心室功能,哪怕起始是是正常的;LV 左室,RV右室。图D3 经胸超声剑突下4腔心切面,显示存在心包积液;LA左房,LV左室,P eff心包积液,RA右房,RV右室。
超声心动图监测
超声心动图在排除ECMO并发症和持续评估心脏功能时是不可或缺的(表2)。机械通气支持强度降低后肺容积减少,通常可以改善超声的回声,对大多数患者进行TTE评估可能就足够了;尽管如此,TEE在ECMO患者中仍然是安全的。超声心动图可以帮助确定与ECMO回路无关的引流不畅和体外血流量(ECBF)下降的原因。引流不畅可能是由于插管位置改变、插管附近血栓形成、低血容量或咳嗽时胸内压力升高、张力性气胸、胸腔积液或心脏压塞。
表2. ECMO中的超声监测

CO心输出量,CPP脑灌注压,ECMO体外膜肺氧合,FAC面积分数变化,IABP主动脉内球囊反搏,ICP颅内压,IVC下腔静脉,LV左心室;LVEF左室射血分数;LVOTVTI左室流出道流度时间积分;RA右心房,RV右心室;3D RVEF 三维右心室射血分数;RVFAC 右心室面积分数改变;RVSP 右室收缩压;RV-PA coupling:右室-肺动脉耦联;SVC上腔静脉;TAPSE 三尖瓣环平面收缩期位移;TR 三尖瓣反流;VV-ECMO 静脉-静脉体外膜肺氧合;VA-ECMO 静脉-动脉体外膜肺氧合。
VA-ECMO的超声监测
建议对双心室功能(每日一次,必要时更频繁)、瓣膜功能、主动脉瓣(AV)开放度和套管放置情况进行系列评估(图2和在线资源7)。重要的是,由于前负荷和后负荷之间的复杂交互作用,VA-ECMO显著影响着大多数超声心动图参数(例如,左心室流出道流速时间积分[LVOT VTI],心室功能,舒张功能评估,IVC评估),使其解释具有挑战性。超声心动图的测量值应结合进行超声心动图检查时的ECMO参数、心肌收缩力和机械通气设置相结合来解读。VA -ECMO可增加主动脉压力和左室后负荷,导致左室扩张,由于右心室收缩力的保持、肺血流残余以及支气管静脉和Thebesian静脉血的回流可加剧左室扩张。伴随着左室收缩力的严重受损,左心室扩张和后负荷增加可能会阻碍主动脉瓣打开,从而导致左心室进一步扩张。可能会出现二尖瓣反流加剧、收缩期肺静脉血液逆流和舒张期二尖瓣反流。最终,心内膜下缺血,心内或主动脉内血栓形成,肺水肿和心律失常可能会随之而来。在超声心动图出现自发显影、心内或主动脉内血栓形成、继发于主动脉瓣开放不足的持续性脉搏丧失、二尖瓣反流恶化和肺水肿持续存在(尽管采取了最大药物措施和最低可耐受的体外循环血流)的情况下,可考虑左心室卸载的机械策略。对不同卸载策略及其各自优势的详细回顾超出了本综述的范围,但可能包括经皮(室间隔造口、经室间隔插管、主动脉内球囊反搏(IABP)、微型轴流泵Impella®)或外科手术(经肺静脉分流或直接左心室分流)。超声心动图将通过估计所需的额外支持程度和排除禁忌症,有助于围绕最佳卸载策略的选择做出决策。例如,在严重主动脉瓣反流中不推荐使用IABP和Impella®,在心内或主动脉内血栓的情况下,一些临时机械循环支持系统可能是禁忌的,因为栓塞的风险取决于仪器和血栓的位置。
在IABP支持的情况下,可能会导致没有实际左心室射血的虚假动脉波形(在线资源25)。降低IABP的辅助频率和进行超声心动图检查有助于确定真正的主动脉瓣开放情况。通过室间隔造口放置穿过房间隔的额外套管进行左心室引流,在超声心动图上也是可见的(在线资源26-27)。Impella®装置的正确位置对于最佳功能和卸载至关重要,并且可以在放置时通过超声心动图确定。由于它在安装插入之后还会出现移位,每日超声心动图检查是确认其保持在适当位置也很关键。在超声心动图中,可以看到Impella®通过主动脉瓣(TTE胸骨旁长轴和TEE食管中部主动脉瓣长轴),入口与瓣膜的距离取决于装置的类型(在线资源28)。
VV-ECMO的超声监测
超声心动图在VV-ECMO患者的管理中也起着重要作用(在线资源10)。VV-ECMO患者中新发的右心衰或右心衰出现恶化,其可能原因是肺损伤恶化和肺泡塌陷、液体超负荷、肺血栓形成或持续升高的肺血管阻力(PVR)。
超声心动图除了有助于血流动力学不稳定的监测之外,对于持续低氧的原因分析(虽然通过氧合器后有着最佳的氧输送)也是有帮助的。当怀疑存在血液再循环时,除了监测氧合器前后的血气分析之外,还应使用超声心动图重新评估ECMO套管的位置,因为超声检查可以确定套管相对于心腔的确切位置(在线资源29)。超声稀释技术结合超声心动图可以帮助量化再循环的比例,但不是常规进行的。当使用双腔套管时,有必要运用彩色多普勒评估血液回流是否朝向三尖瓣方向。如上所述,即使在初始阶段,插管处于最佳位置,随着患者体位改变和机械通气支持力度的下降,均有可能导致膈肌明显的移位,并改变右房内导管回输灌注孔的位置。在极端情况下,回输灌注的血流可能完全进入肝内,从而导致氧合效率低下,有时肝酶升高。由于V-PA ECMO套管是沿着右心室壁前行,当右心室大小随着时间的推移显著减小时,套管的尖端在其中一个肺动脉(PA)分支中可能变得选择性(在线资源30)。必要时,应在超声心动图指导下重新定位套管,以免损伤心脏(在线资源15)。超声心动图还可以帮助确定ECMO流量与心输出量的比值。
心脏压塞的超声心动图特征(针对所有类型的ECMO)
ECMO支持过程中的心脏压塞是一个特别具有挑战性的诊断,因为许多临床体征和超声心动图特点可能会缺失,即使存在压塞,体外循环血流量也可能维持不变。在VA-ECMO支持中,没有心包约束的情况存在下,高体外循环血流量伴有心包积液时,可能会导致心室塌陷(在线资源31)。持续的静脉引流可能会掩盖右心房压力的增加。当VA-ECMO发生心包填塞时,可能不会表现出低血压,临床症状可能局限于由于心室充盈和冠状动脉灌注减少而导致的射血减少和全身氧合增加(在线资源32)。在VV-ECMO中,由于肺顺应性差和超保护性机械通气策略的实施,在心包内压波动极小的情况下,可能不会出现奇脉和跨瓣膜呼吸变异。但最终会出现器官功能障碍和低血压;然而,这些可能是迟来的表现。因此,建议定期进行超声心动图监测(每天或根据患者情况更频繁)。
超声增强剂
超声增强剂(UEA)在ECMO患者中似乎是安全的,在评估左心室心肌功能和力学、或排除心腔内血栓存在时,对于超声回声受限的患者,可提高其诊断的准确性。然而,UEA是由封装的微气泡组成,偶尔可能会触发ECMO上的气泡检测器并导致血流量中断——检测器的瞬时中断血流可防止气泡的相关并发症。在外周VA-ECMO支持过程中,UEA可以帮助识别分水岭区域(顺向心输出量血流和ECMO逆向血流交汇的过渡点)。
肺部超声
肺部超声是检测包括ECMO患者在内的危重患者的肺水肿、肺实变、气胸和胸腔积液的另一种方法。当使用肺超诊断接受超保护性机械通气策略患者的气胸时,则需要仔细分析甄别,因为肺滑动征可能非常离散,甚至在非常低的潮气量下肺滑动征不存在。在没有肺滑动征的情况下,若可看到肺脉和胸膜产生的伪影、以及缺乏肺点,则表明没有气胸。然而,心脏收缩性极弱时,患者可能没有肺脉表现。
肺部超声评分(LUS)已被用于监测VV-ECMO患者肺部的恢复情况。初步研究表明,在基线LUS相似的存活者和非存活者中,可以发现从VV-ECMO脱机的患者中表现出LUS的明显改善。持续高LUS与较差的预后相关。此外,肺内彩色血流多普勒(CFD)和肺超声中可见到的动态支气管充气征,已被用于VA-ECMO患者医院获得性肺炎的诊断。
颅脑超声
颅脑超声是一种无创技术,可实时监测脑血流动力学,评估颅内压(ICP)和脑灌注压(CPP)。尽管其还有一些局限性,但与颅内压的有创监测相比,使用脑超对颅内压进行无创评估更有吸引力,因为ECMO患者通常进行全身抗凝治疗。
VV-ECMO中的颅脑超声检查
一个小型队列研究的初步数据显示,在启动VV-ECMO后,患者的脑血流速度(CBFV)和估计CPP显著下降,而搏动指数(PI)和估计ICP是升高的。有趣的是,平均CBFV、PI、估计ICP和CPP的变化与动脉血二氧化碳分压的变化无关。
经颅多普勒(TCD)也可以评估大脑的自动调节。在一个小型队列中,纳入了接受VV -ECMO支持的患者,大脑自动调节受损改变是常见的,并且存在于大多数非存活者中。几乎所有非存活者都存在颅内压升高。
VA-ECMO中的颅脑超声检查
虽然在大多数ECMO患者中可以可靠地获得平均血流速(MFV),但只有当LVEF高于20%或低于20%且有IABP辅助时,才能在VA-ECMO上检测到收缩期峰值(在线资源33)。因此,由收缩期和舒张期峰流速之差除以平均流速,计算得到的TCD衍生搏动指数(PI)与脉压和LVEF相关。在持续血流的VA-ECMO患者中,LVEF的后期改善导致PIs模式的改变,使得依靠初始TCD值进行神经预测具有挑战性。任何血管中PI的缺失都与脑实质内出血的风险增加有关。
全部ECMO患者
颅内出血是ECMO最可怕的并发症之一。对于因病情极不稳定而不能转运的患者,脑超可通过视神经鞘检查测量直径增大、大脑中线移位或TCD衍生的ICP增加来诊断ICP升高。
TCD还可以检测到微栓塞信号(MES)。MES分级与血栓栓塞事件相关,与LVEF呈负相关,但其意义尚不清楚。最后,TCD被提议作为脑死亡评估的一种测试。在存在搏动血流的情况下,与先前TCD(由同一操作者检查,记录原有血流存在)相比,若TCD显示舒张期血流丧失、动脉血流振荡或血流缺失,这样的结果与脑死亡诊断是相符的。在心脏射血量很小的患者中,对TCD血流缺失的解释更具挑战性,尽管一些作者支持使用TCD。
血管超声/多普勒
外周VA-ECMO的血管并发症和肢体缺血的风险仍然很高;定期监测插管肢体对于及时检测灌注不良至关重要。由于并不总是可触知脉搏的存在,通常需要多普勒来确定是否有足够的血流。腘动脉的对比增强多普勒超声也可用于确认远端腿部灌注,从而确定套管在股浅动脉中的适当位置中。尽管进行了全身抗凝治疗,但静脉血栓在ECMO中仍很常见;然而,在ECMO期间,尚没有关于深静脉血栓(DVT)筛查的循证推荐意见。
ECMO脱机及脱机后管理
VV-ECMO
关于超声心动图在引导VV-ECMO脱机中的作用,相关文献仍还很有限。由于低氧血症和高碳酸血症均可能增加右心后负荷并导致右心功能障碍,因此在ECMO脱机期间监测心功能可能是值得的;然而,在这种情况下唯一发表的研究却没有发现从VV- ECMO脱机后右心功能有任何变化。在脱机时,因右房压升高可能导致卵圆孔未闭而出现右向左分流,从而导致脱机失败。这可以通过彩色血流多普勒(CFD)或气泡试验来证实,证明存在右向左分流。同样,据我们所知,在成人的相文献中也没有关于肺超声引导下从VV-ECMO脱机患者结果的有效性的数据。
VA-ECMO
患者从VA-ECMO脱机的最佳时机需要综合考虑多个方面,包括心源性休克的病因和双心室恢复的情况,并应综合考虑血流动力学、生物学和超声心动图参数。一旦心脏得到充分恢复,应尽早尝试脱机,以避免延长ECMO支持引起的并发症。撤除VA-ECMO的支持,对血流动力学状况有显著影响,增加了右心室前负荷,降低了左心室后负荷。左心室和右心室对这些血流动力学变化的适应取决于双心室的收缩力、心室间的交互依赖作用、前负荷和后负荷。在脱机试验中,确定哪个心室是脱机的障碍,并相应地实施治疗是至关重要的。虽然还没有关于如何在VA-ECMO脱机试验中使用超声心动图评估心脏功能的标准化指导,但人们已经提出了几个参数,如:LVEF>20-25%、LVOT VTI>10 cm、收缩期组织多普勒二尖瓣环速度(TDSa)>6 cm/s、收缩期三尖瓣环平面位移(TAPSE)>10 mm和RVEF>25%,作为逐步降低体外循环血流(低至1L/min或瞬时钳夹)期间脱机成功的预后参数(在线资源34和35)。这些参数在床边相对容易获得;然而,它们中的大多数都受到负荷依赖性的限制。因此,非负荷依赖性参数、反映心室-动脉耦联的参数、以及心室交互依赖性对于准确评估VA-ECMO支持患者脱机期间的心功能状况非常重要。此外,在可耐受降低体外循环血流量(ECBF)的患者中,全ECMO血流支持和低ECMO血流支持之间的心肌速度动态变化,可能是反映心脏储备的更好的预后参数。这些超声心动图参数总结于表3中。虽然通过斑点追踪超声心动图测量的心肌变形(应变)可以提供对内在心肌功能的更好评估,但左心室应变显示受ECMO流量逐步减少的影响,因此无法预测脱机成功(在线资源36和37)。然而,在成功脱机的患者中观察到了左心室应变的显著改善,因此,确定了遵循Frank-Starling曲线的负荷依赖性收缩储备。重要的是,自身固有的右心室功能尤其难以评估,因为即使体外循环血流量(ECBF)极低,也可能在一定程度上掩盖了右心功能障碍。一些作者主张使用泵控逆流试验来规避这个问题,并允许在不钳夹回路的情况下评估ECMO的心肺功能;然而,这还没有在成年ECMO患者中广泛使用。最后,描述了实时超声的使用,以确保在VA-ECMO拔管期间经皮血管闭合装置的位置适当。
表3.预测VA ECMO脱机成功的其它有用的超声心动图参数
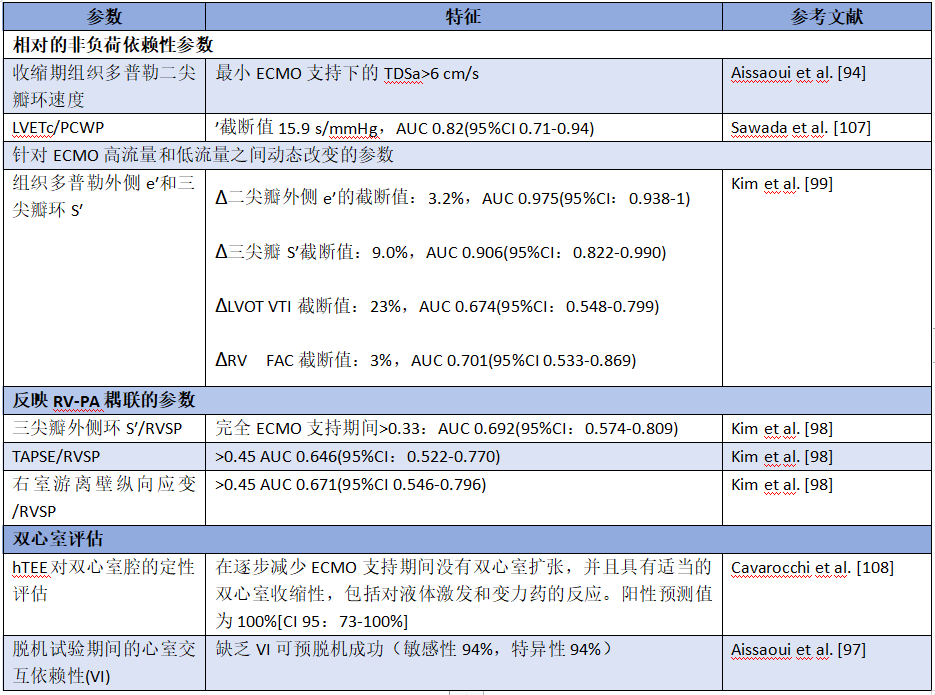
AUC 曲线下面积;CI 置信区间;ECMO 体外膜肺氧合;hTEE 经食道血流动力学超声心动图;LVETc 校正左心室射血时间;LVOT VTI 左心室流出道血流速度时间积分;PA 肺动脉;PCWP 肺毛细血管楔压;RV 右心室;RV FAC 右心室面积改变分数;RVSP 右室收缩压;TAPSE 收缩期三尖瓣环平面位移;TDSa 收缩期组织多普勒二尖瓣环速度;VI 心室交互依赖性。
ECMO后的心血管并发症
报告的ECMO后血栓形成的发生率在不同的研究中差异很大。最近的一项系统综述报告了大约一半的患者在ECMO后出现DVT。在接受ECMO治疗的严重急性呼吸综合征COVID-19的一小系列患者中,85%的患者出现了插管相关血栓。延长的ECMO支持、套管型号偏大和促凝状态是ECMO期间和ECMO后血栓形成的危险因素。因此,建议对先前的插管部位进行系统的拔管后血管成像检查(在线资源38)。同样,在ECMO期间也可能会形成心脏内血栓。
最后,血管并发症,如:假性动脉瘤或动静脉瘘,也可通过超声诊断。
结论
超声是医师在管理ECMO患者中不可或缺的工具。对ECMO支持引起的生理变化的深刻了解对于准确解释超声结果和支持这些患者的适当决策至关重要。
猜你喜欢
- 2020年12月14日每日养生小知识健康简报,星期一!健康是一种生活态度!
- 甲氨蝶呤注射液(美泰彤®)新增类风湿关节炎适应症中国获批,成为中国唯一一个拥有RA适应症的甲氨蝶呤制剂,惠及中国500万患者!
- 没事输点营养液能防病?你可能掉进了输液的坑!
- 【麻海新知】亚低温治疗对心搏骤停患者神经功能预后的影响
- 人类食谱是如何丰富的
- 经验积累:长径才1.3厘米的亚实性结节居然广泛转移?问题出在哪里?
- 脸上神经跳动怎么回事?
- 使用bb霜要注意些什么?这4点做不好皮肤变差
- 两会时间 | 政协委员为什么提案将低剂量螺旋CT肺癌筛查纳入医保?
- 2022中华医学会呼吸病学年会——黎毅敏:重度ARDS患者治疗:俯卧位+VV-ECMO真的会更有效?
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)