首页 > 医疗资讯/ 正文
CAR-T治疗Richter转化
慢性淋巴细胞白血病(CLL)患者中有10%~15%会发生Richter转化(RT),多转化为大B细胞淋巴瘤(LBCL)。一旦发展为RT,患者的中位生存期往往只有3-12个月。RT患者没有标准治疗,一般参考LBCL的方案。因此RT患者存在极大的未满足治疗需求。
CD19 CAR-T是LBCL的革命性治疗手段,但关键研究往往排除RT患者,RT患者接受CD19 CAR-T的报道极为缺乏。因此学者开展一项国际性多中心回顾性研究,以探讨CD19 CAR-T治疗RT患者的疗效和安全性,该研究是目前CD19 CAR-T治疗RT患者的最大样本研究,结果近日发表于《Journal of Clinical Oncology》。

研究结果
该研究纳入12家中心接受商业化CAR-T治疗的RT患者共69例(仅纳入非霍奇金淋巴瘤,排除霍奇金淋巴瘤和其他亚型),患者特征见表1。
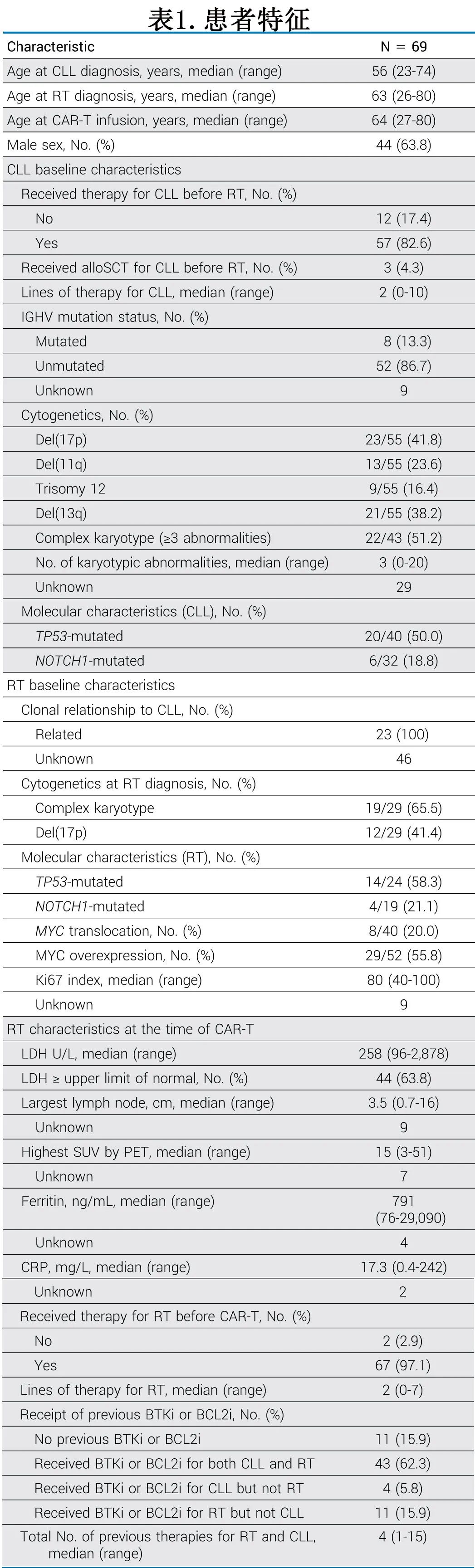
从诊断CLL到诊断RT的中位时间为6年,12例患者(17%)同时诊断为RT和CLL。23例患者评估了RT与原发CLL的克隆关系,均确定为克隆相关。在CAR-T治疗之前,58例(84%)患者接受过中位4线的CLL和/或RT治疗,包括BTKi、BCL2i或两者;除2例患者外,所有患者在CAR-T之前均接受过RT治疗,既往RT治疗的中位数为2线。CAR-T之前的末线治疗具有异质性,包括BTKi(13例患者,19%)、免疫化疗(20例患者,29%)和BTKi + BCL2i (8例患者,12%)。7例患者(10%)在CAR-T前有活动性或既往的RT相关CNS受累。
CAR-T输注时的中位年龄为64岁。59例患者(86%)在CAR-T输注前接受了桥接治疗;但只有2例患者将苯达莫司汀作为桥接治疗的一部分,且没有患者将苯达莫司汀作为CAR-T之前末线治疗的一部分。患者接受的CAR-T产品包括44例患者(64%) axi-cel、17例患者(25%) tisa-cel、7例患者(10%) lisocel和1例患者(1%) brexel。68例患者(99%)接受氟达拉滨和环磷酰胺清淋,1例患者(1%)接受苯达莫司汀治疗。从单采至CAR-T输注的中位时间为34日。41例(59%)患者接受BTKi作为CAR-T伴随治疗。
66例患者在CAR-T输注后接受缓解评估,3例患者在评估疗效前因CAR-T输注后的不良事件死亡。最佳总体缓解(ORR)为63.8%,包括:完全缓解(CR) 32例(46%),部分缓解(PR) 12例(17%),疾病稳定1例(1%),疾病进展21例(30%)。
CAR-T输注后中位随访24个月,中位PFS为4.7个月,中位OS为8.5个月;1年和2年PFS率分别为35.7%和28.9%,1年和2年OS率分别为42.9%和38.3%。
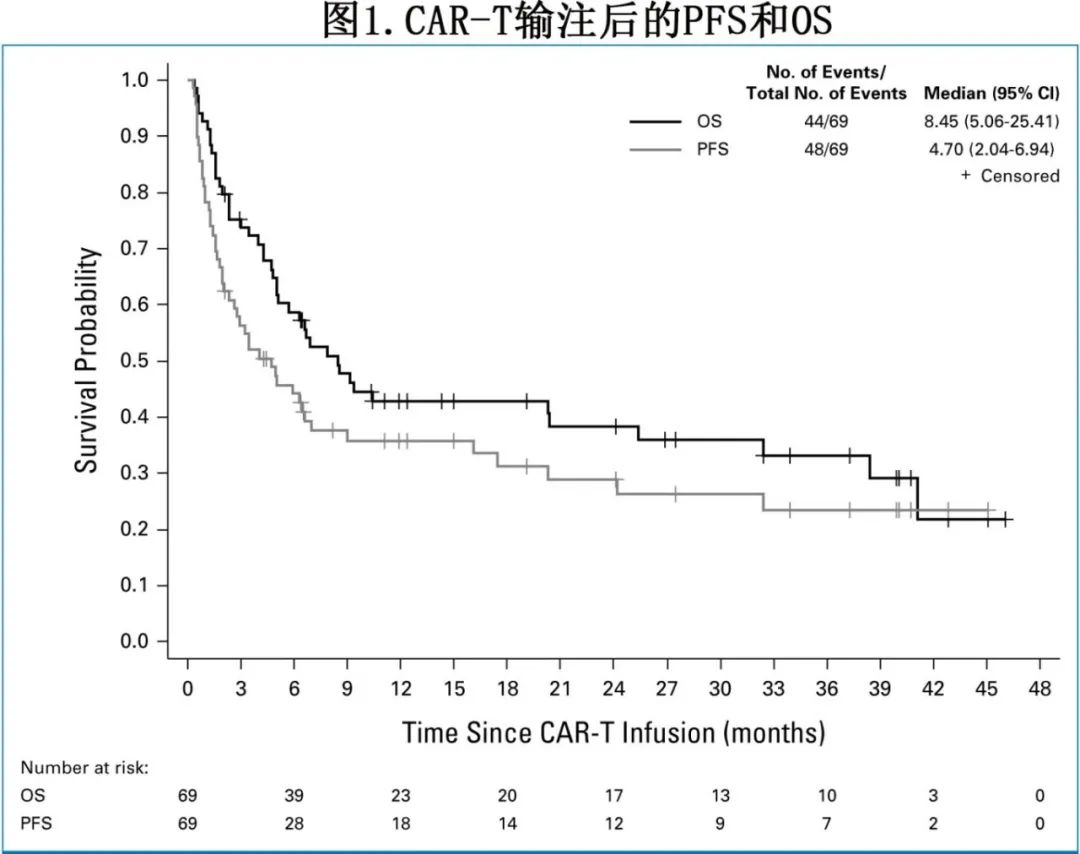
在39例疾病进展患者(57%)中,3例患者(占所有进展事件的8%)为CNS内进展。12例患者(17%)发生非复发死亡(NRM),其中9例死于感染(其中4例死于COVID-19), 1例死于呼吸衰竭,1例死于颅内出血,1例死于卒中。输注后3个月的NRM率为7.3%,12个月时为13.4%。图2所示,达到CR患者的中位缓解持续时间(DOR)为27.6个月,而达到PR患者为2.1个月。
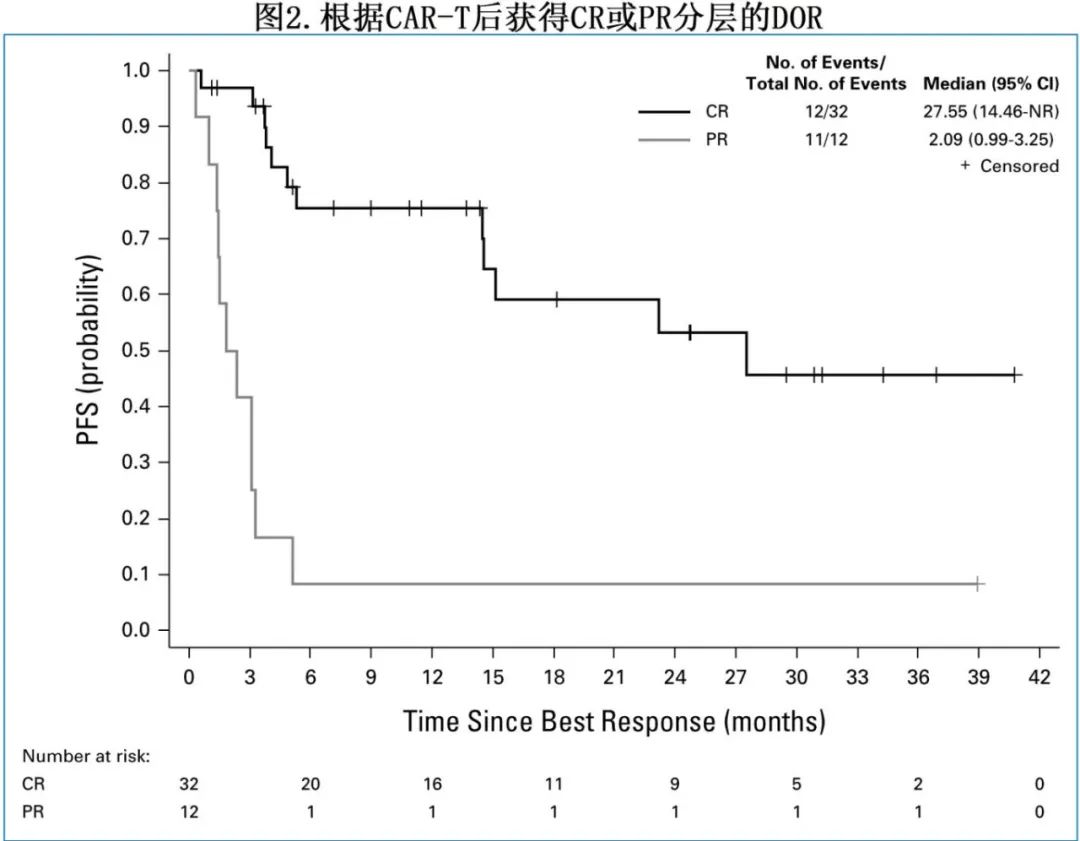
15例患者在达到CR之前达到PR,从PR到CR的中位时间为90天(图3)。在证实存在克隆相关RT的患者中,缓解率和生存期在数值上与总体研究人群相似。
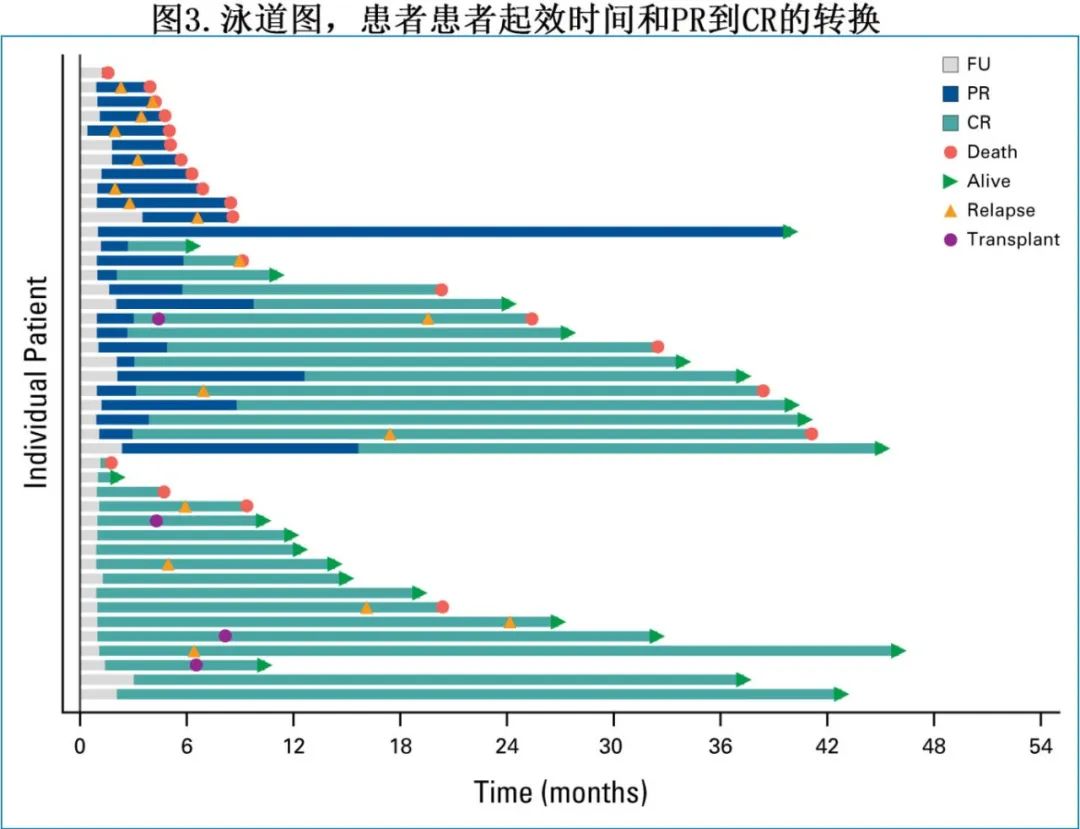
27例患者接受了治疗后CLL微小残留病(MRD)评估,其中23例患者通过流式细胞术进行MRD评估,3例患者通过clonoSEQ检测,1例患者方法未知。在血液样评估MRD的21例患者中,17例(81%)为MRD阴性(灵敏度10-4)(U-MRD4);在骨髓样本评估MRD的15例患者中,12例(80%)为MRD阴性;当同时考虑血液和骨髓样本时,27例患者中有22例(81%)为至少一种检测MRD阴性。16例患者在CAR-T治疗前和后进行了配对的MRD评估,其中9例(56%)在CAR-T治疗后达到血液或骨髓MRD阴性(1例通过ClonoSEQ, 8例通过流式细胞术),5例(31%)在CAR-T治疗前和治疗后的血液或骨髓均达到MRD阴性, 2例(13%)在CAR-T治疗前和治疗后均为MRD阳性。22例血液或骨髓MRD阴性患者的中位PFS为20.3个月,中位OS为38.4个月。4例患者在CAR-T输注后的中位5.5个月接受alloSCT巩固,这些患者在CAR-T后和移植前均处于CR状态;1例患者于移植后21个月因疾病进展死亡,其余3例患者均存活,分别随访3.8、6、24.3个月。无患者接受自体干细胞移植作为巩固治疗。
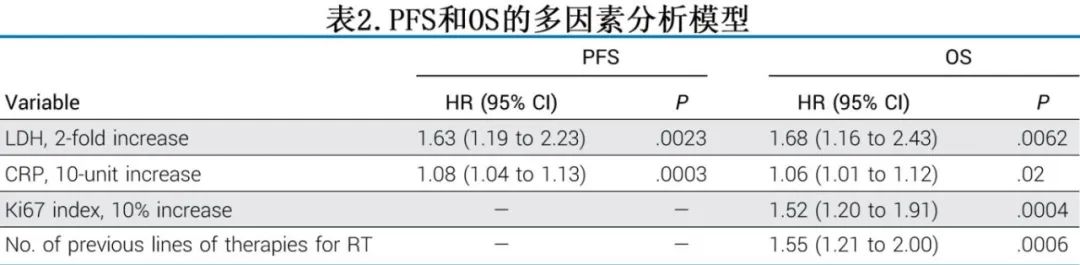
在CAR-T输注后PFS的多因素分析中(表2),较高的基线LDH和CRP仍与较短的PFS相关。在CAR-T输注后OS的多因素分析中,既往接受过较多的RT治疗线、较高的基线肿瘤Ki67增殖指数以及较高的基线LDH和CRP与较短的OS相关。作者重复分析以评估BTKi的不同用药模式(BTKi作为单采前最新治疗的一部分,或作为桥接治疗的一部分,或伴随CAR-T),未发现BTKi用药模式与PFS或OS改善显著相关。
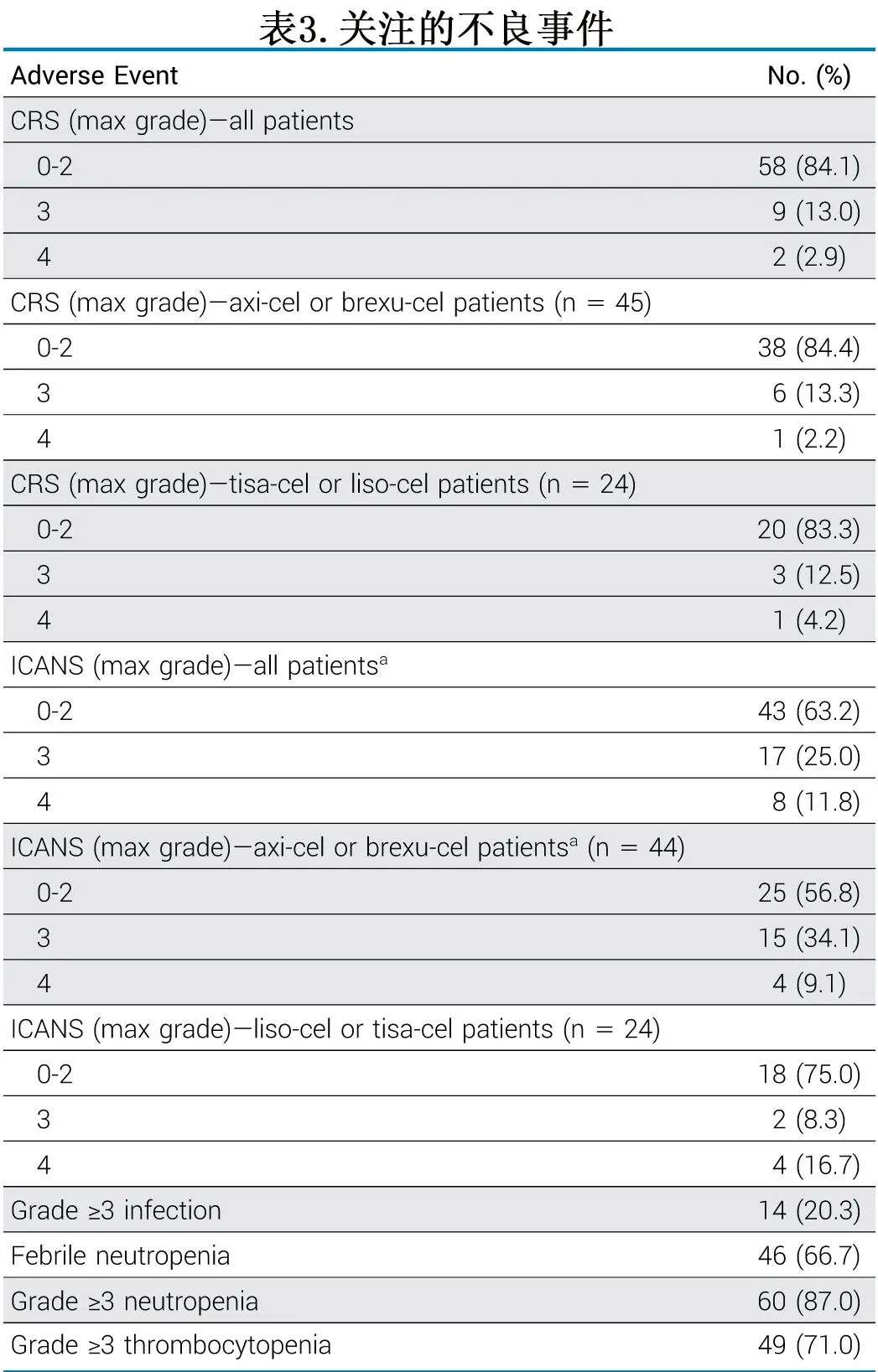
不良事件见表3。11例(16%)患者发生≥3级CRS, 25例(37%)患者发生≥3级ICANS。在接受axi-cel或brexus -cel治疗的患者和接受tisa-cel或liso-cel治疗的患者中,发生≥3级ICANS的患者比例分别为43%和25%。与总体研究人群相比,接受BTKi作为桥接治疗的患者和接受BTKi作为伴随治疗的患者的CRS和ICANS发生率相似。在logistic回归分析中,没有基线危险因素与≥3级CRS的较高风险相关,只有既往接受维奈克拉治疗CLL与≥3级ICANS的发生率差异相关(OR=0.24)
总结
该研究是CD19 CAR-T治疗RT患者的最大型研究,纳入69例患者。CAR-T输注时的中位年龄为64岁。患者既往接受过中位4线的CLL和/或RT治疗,包括58例(84%)患者既往接受过BTK和/或BCL2抑制剂治疗。给药的CAR-T产品包括44例患者(64%)为axicabtagene ciloleucel、17例患者(25%)为tisagenlecleucel、7例患者(10%)为lisocabtagene maraleucel和1例患者(1%)为brexucabtagene autoleucel。分别有11例(16%)和25例(37%)患者发生≥3级CRS和ICANS。总缓解率为63%,其中46%达到完全缓解(CR)。中位随访24个月,中位PFS为4.7个月,2年PFS为29% ;中位OS为8.5个月,2年OS为38%。在达到CR的患者中,中位缓解持续时间为27.6个月。
总的来说,该研究证实CAR-T治疗RT患者是安全有效的。但也需要进一步优化患者选择、桥接治疗和CAR-T后维持治疗,以提高疗效并减少毒性。与CAR-T治疗LBCL一样,感染仍然是NRM的主要原因,应严格关注抗感染预防,并采取措施降低COVID-19相关风险。该研究支持通过前瞻性临床试验继续探索CAR-T治疗RT。
参考文献
Kittai AS,et al. Anti-CD19 Chimeric Antigen Receptor T-Cell Therapy for Richter Transformation: An International, Multicenter, Retrospective Study.J Clin Oncol . 2024 Mar 29:JCO2400033. doi: 10.1200/JCO.24.00033.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)