首页 > 医疗资讯/ 正文
M蛋白免疫重建
有报道显示,多发性骨髓瘤(MM)患者自体造血干细胞移植(ASCT)后,血清免疫固定电泳(IFE)可能出现一过性异常蛋白条带(M蛋白免疫重建),但该现象的预后价值尚有争议。中山大学附属第一医院李娟教授团队开展一项回顾性研究,旨在探讨移植后 M 蛋白免疫重建对MM患者预后的影响,研究结果近日发表于《British Journal of Haematology》。

研究结果
患者特征
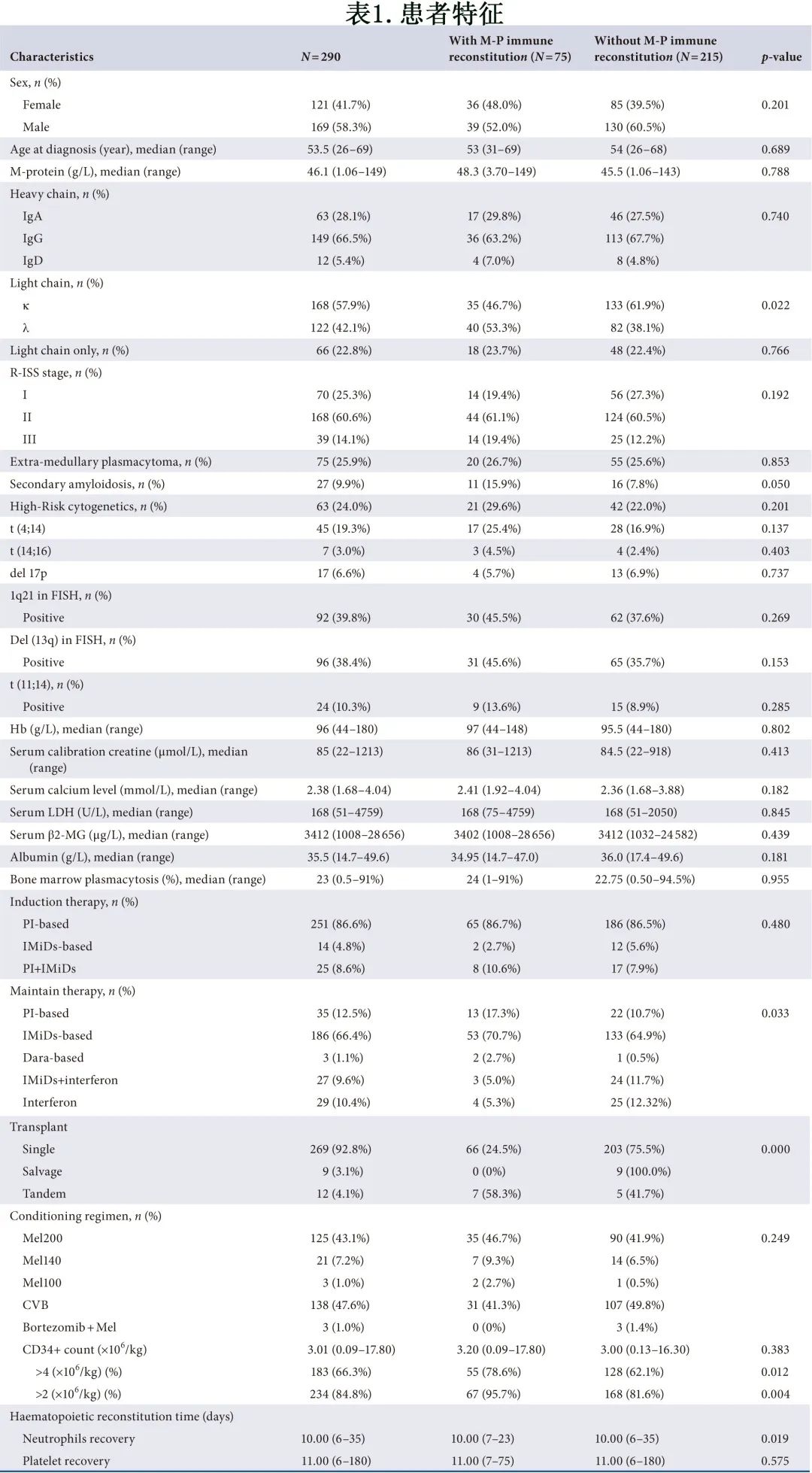
该研究纳入2008.1.1至2021.7.31在中山大学附属第一医院接受ASCT的290例新诊断 MM 患者,所有患者均符合 IMWG 2014 诊断标准。患者特征见表1。所有患者的中位随访时间为64个月。所有患者均接受含有新药的诱导方案,然后进行ASCT,PAD(硼替佐米、多柔比星和地塞米松)是236/290例 (77.9%) 患者最常使用的治疗方案,其次为VD(硼替佐米和地塞米松)(38/290例 (13.1%) 患者)、RAD(来那度胺+多柔比星和地塞米松)(16/290例 (5.5%) 患者)和VRD(硼替佐米,来那度胺和地塞米松),另有2例患者接受VCD(硼替佐米、环磷酰胺和地塞米松)和PADT(硼替佐米、多柔比星和地塞米松沙利度胺)作为诱导化疗方案。共有7.2%的患者接受二次ASCT,包括9例挽救性二次移植和12例串联移植。中位年龄为53.5岁,包括169例男性和121例女性患者。诊断时最常见的 M 蛋白为IgGκ(21.7%)。根据R-ISS,25.3%的患者为R-ISSⅠ期,60.6%为R-ISSⅡ期和14.1%为R-ISSⅢ期。分别有43.6%、15.3%和12.5%的患者存在贫血、肾损害和高钙血症。
M蛋白免疫重建
M蛋白免疫重建定义为,血清和/或尿液IFE存在单克隆峰,其重链和/或轻链可能与原始骨髓瘤蛋白不同,也可能与初诊时的单克隆蛋白相同。该现象需要与疾病复发相区分,例如,其不引起非受累免疫球蛋白减少且流式细胞术不检测到单克隆浆细胞。
75例 (25.9%) 患者 ASCT 后血清和尿液 IFE 出现 M蛋白免疫重建,有或无 M蛋白免疫重建患者的特征总结见表1。M蛋白免疫重建发生率以 IgG 型最多,其中最常见的是IgG-λ(33.3%)。移植后至发生 M蛋白免疫重建的中位时间为3个月,中位持续时间为4个月。在挽救性二次移植患者中未检测到 M蛋白免疫重建;串联移植患者有58.3%发生M蛋白免疫重建,显著高于单次移植患者 (24.5%,P=0.000)。两组在性别、年龄、诱导治疗、R-ISS分期、细胞遗传学或其他基本临床特征方面未发现显著差异。诊断时两组重链类型无差异,但轻链λ型在 M蛋白免疫重建组多见(53.3% vs.38.1%,P=0.022)。尽管两组间CD34+细胞恢复数量没有差异 (3.20 vs. 3.00 ×106/kg,p=0.383),但 M蛋白免疫重建组的CD34+ 细胞恢复至>2和>4×106/kg显著更多(95.7% vs. 81.6%,p=0.004,78.6% vs.62.1%, p=0.012)。
缓解
缓解评估标准为IMWG 2016。诱导治疗后35.2%的患者达到CR,48.6%达到VGPR;73.4%的患者在 ASCT 后达到CR(p=0.000)。31.9%的患者达到 MRD 阴性,所有患者 ASCT 后的 MRD 阴性率均较高 (70.7%,p=0.000)。移植前和移植后,M蛋白免疫重建组CR 率均明显高于非 M蛋白免疫重建组(49.3% vs. 30.2%,P=0.003;85.3% vs. 69.3%,p=0.013),且<PR的患者显著更少 (6.7% vs. 19.6%,p=0.003;1.4% vs. 9.3%,p=0.013);此外,诱导后和 ASCT 后 M蛋白免疫重建组的 MRD 阴性率均较高 (39.7% vs. 29.3%,P=0.143;81.9% vs. 66.5%,P=0.014)。
单因素和多因素分析
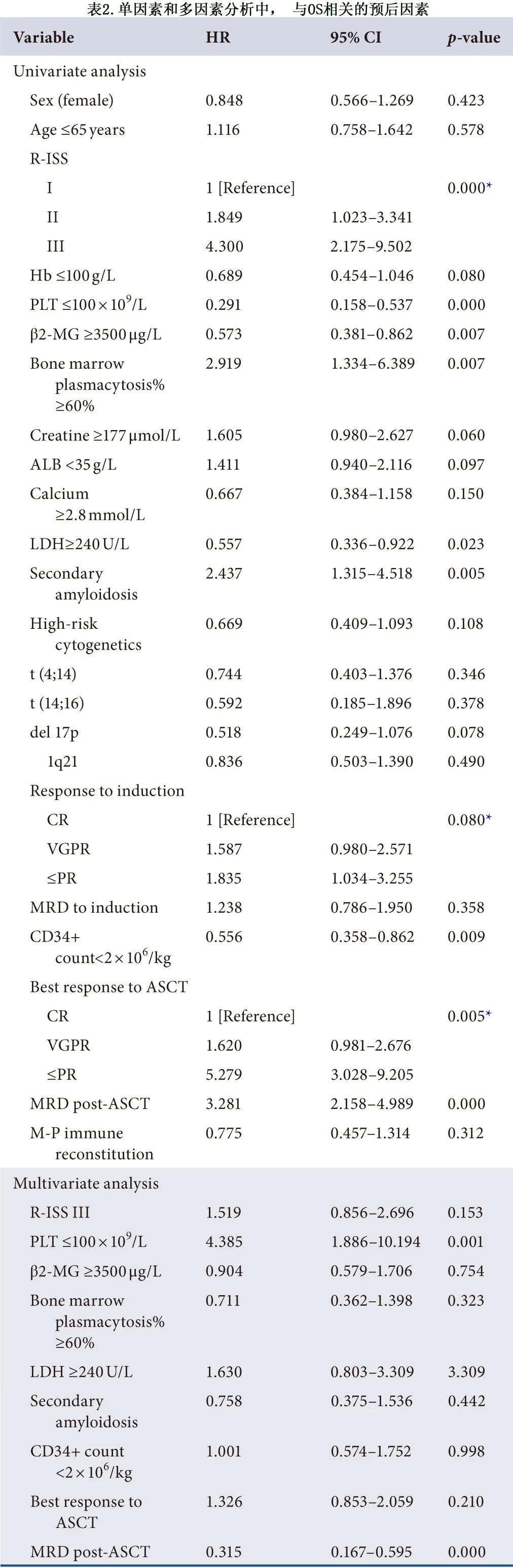
研究队列的中位OS为105个月。基于单因素和多因素 Cox 回归分析,表2和表3显示了与生存期显著相关的临床参数,并将单因素分析中 OS 和 PFS 的显著风险因素纳入多因素Cox 回归分析。在单因素分析中,与 OS 相关的具有统计学意义的因素包括:R-ISS 分期、血小板 (PLT)、β2-微球蛋白 (β2-MG)、骨髓浆细胞百分比、乳酸脱氢酶 (LDH)、继发性淀粉样变性、CD34+细胞需要输血才能恢复、ASCT后最佳缓解和MRD。随后使用 Cox 比例风险分析单因素分析显示具有预后性的因素。如表2所示,PLT<100 ×109/L、ASCT 后的反应和 MRD 与良好预后显著相关。
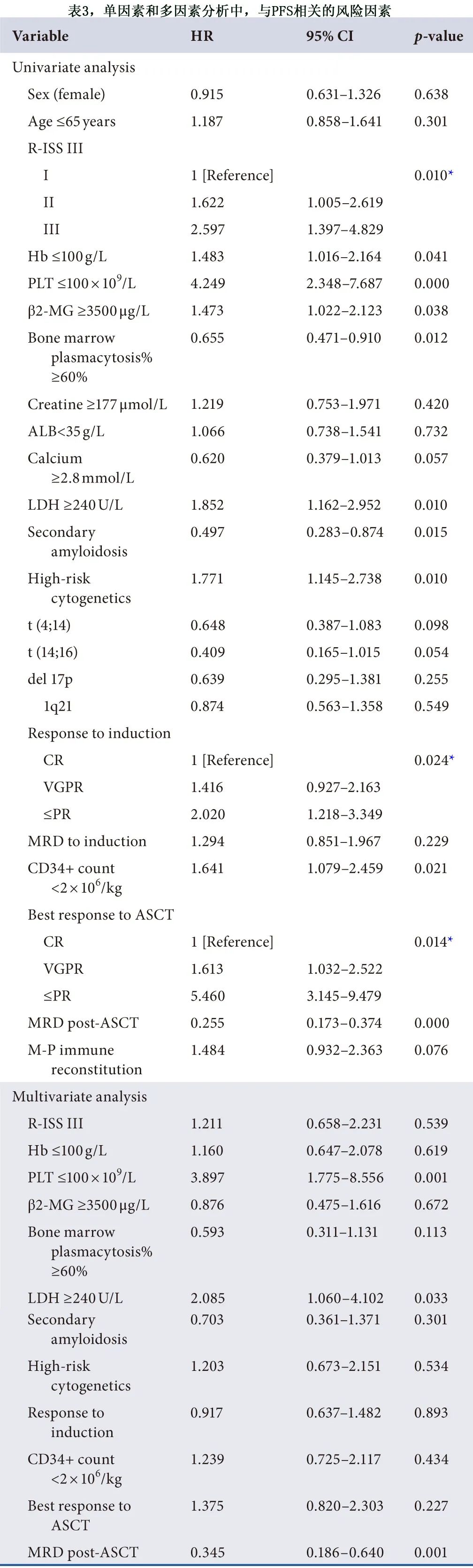
对于无进展生存期 (PFS),在单因素分析中,R-ISS分期、血红蛋白 (Hb)、PLT、β2-MG、骨髓浆细胞百分比、LDH、继发性淀粉样变性、高危细胞遗传学、对诱导治疗的反应、CD34+ 细胞需要输血才能恢复、ASCT后的最佳缓解和 ASCT 后 MRD 预示着更好的PFS。对于PFS,在多变量 Cox 回归模型中,PLT和LDH、ASCT后缓解和ASCT后MRD 的影响仍显著。
M蛋白免疫重建患者的生存期
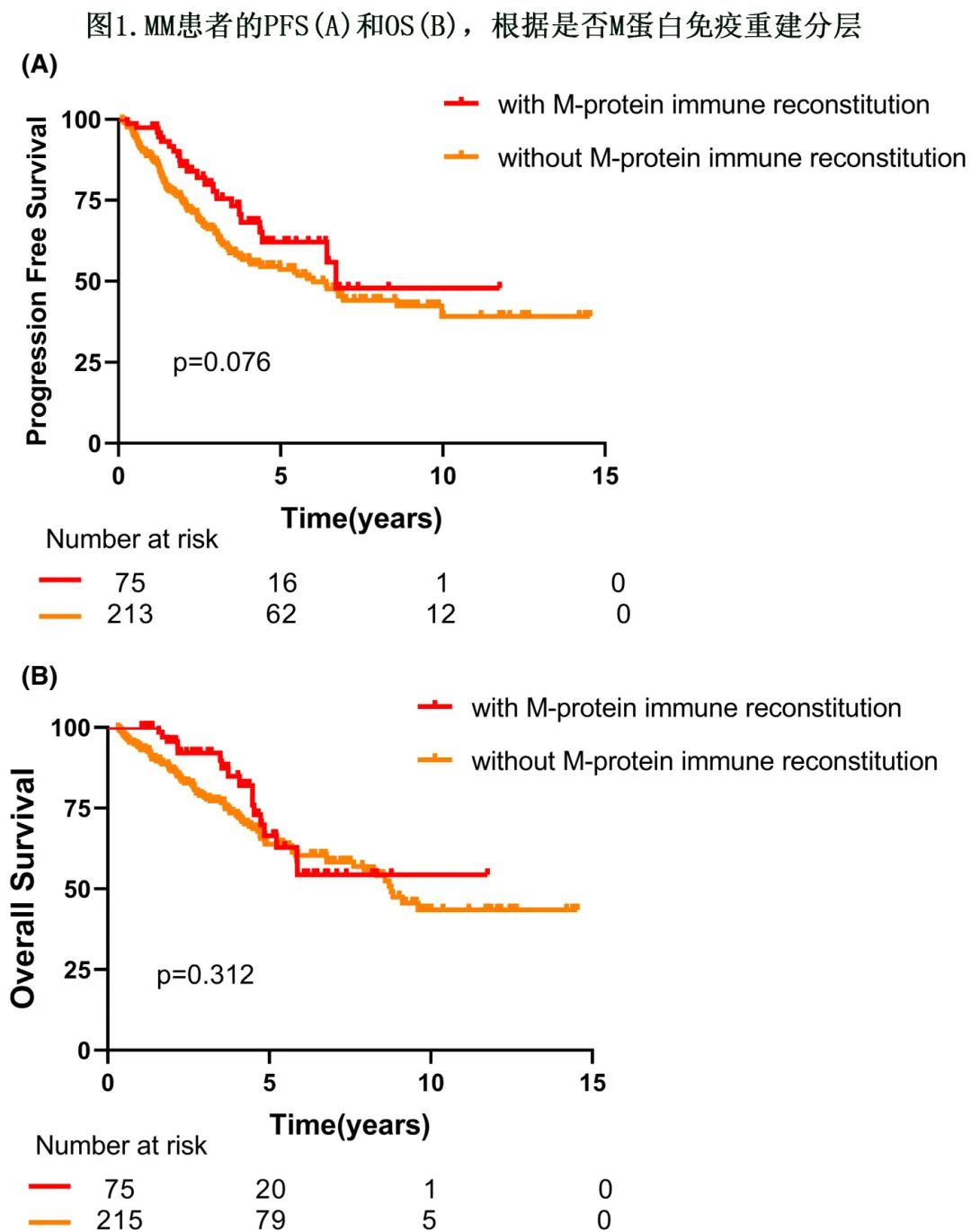
比较 M蛋白免疫重建患者与无 M蛋白免疫重建患者的临床结局,确定其存在是否具有预后意义。尽管无统计学显著性,但与 IFE 正常的患者相比,ASCT后发生 M蛋白免疫重建的75例患者的中位 PFS 和 OS 更长(80 vs. 72个月,HR=1.484,P=0.076;未达到vs. 105 个月,HR=0.775,P=0.312,图1)。
M蛋白免疫重建与细胞遗传学高危患者的生存期
具体分析了细胞遗传学高危患者对的生存期。高危细胞遗传学定义为包括以下之一:del 17p、t(4;14) 或t(14;16)。在高危亚组患者中,与缺乏 M蛋白免疫重建相比,移植后 M蛋白免疫重建的存在可导致更优的 PFS 和OS(80 vs. 31 个月,HR=3.073,P=0.010;未达到vs. 91个月,HR=3.385,p=0.026, 图2A,B)。
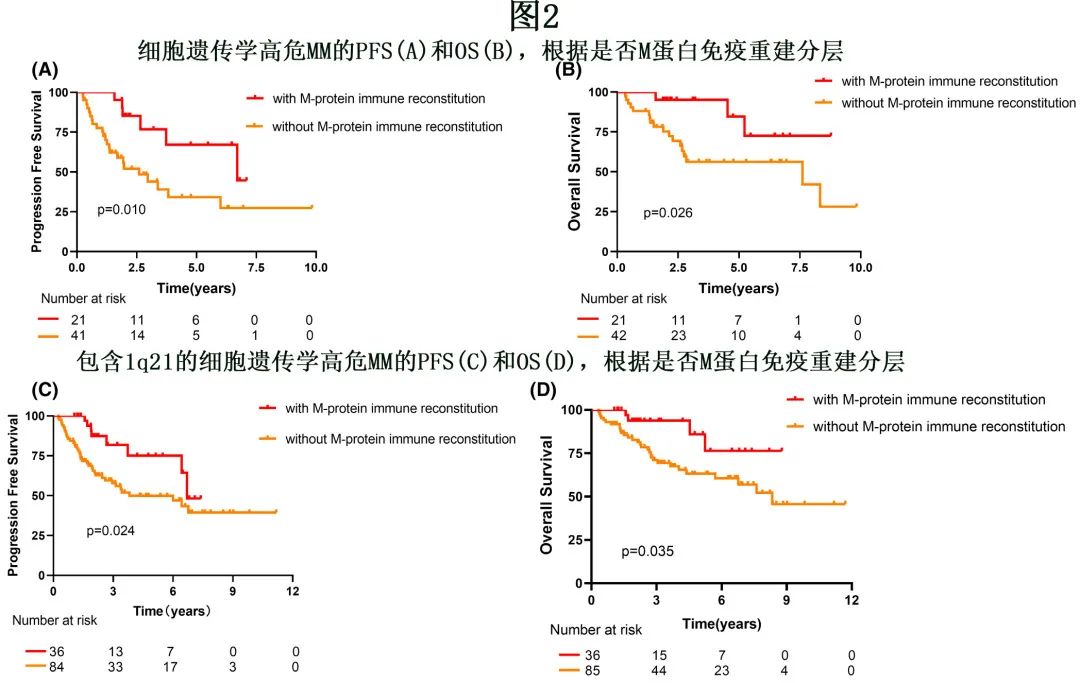
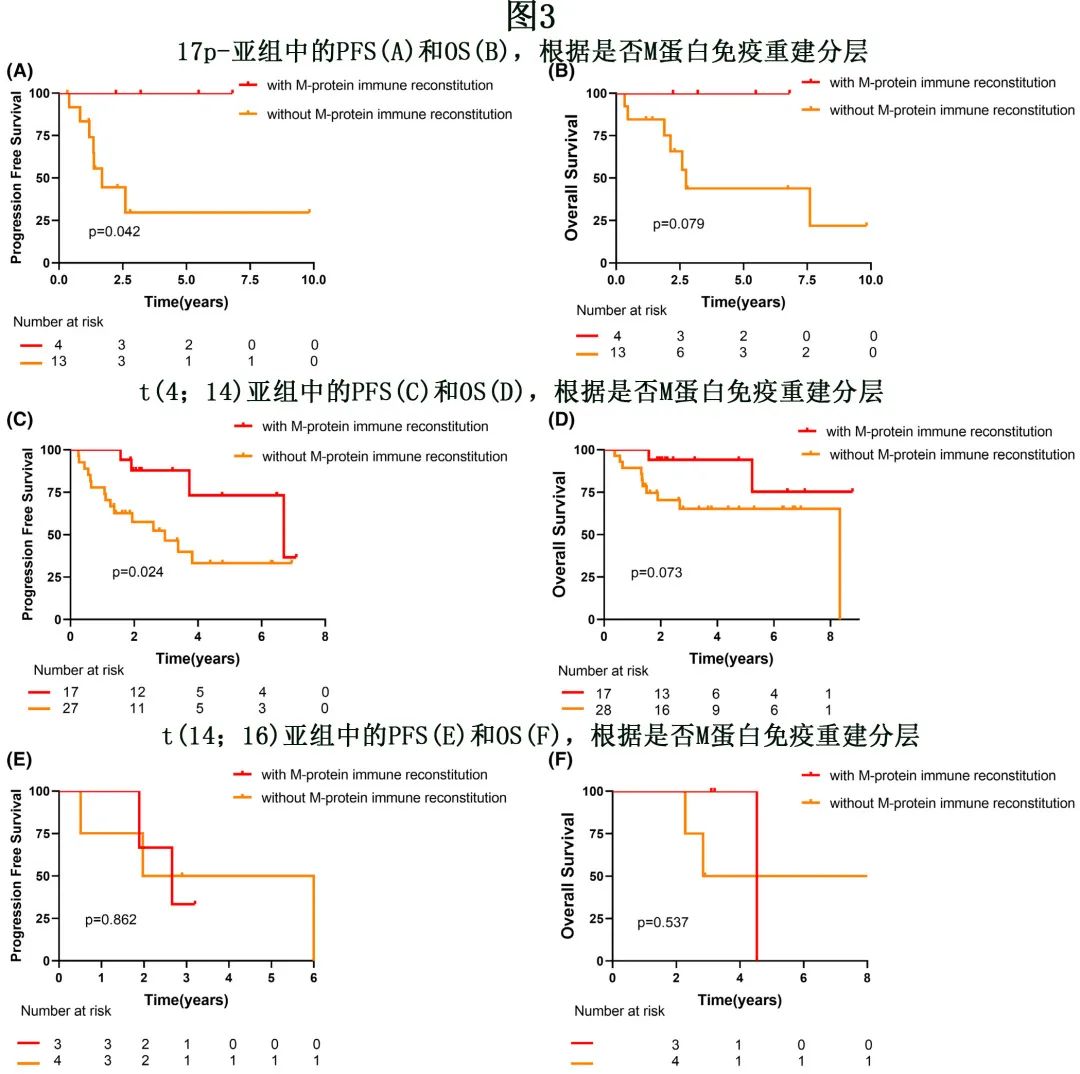
进一步分析了 M蛋白免疫重建对不同细胞遗传学高危 MM 患者预后的影响。17例 17p-患者中有4例出现 M蛋白免疫重建,M蛋白免疫重建组末次随访时无患者进展或死亡;PFS 具有统计学显著性,但 OS 不具有统计学显著性(未达到vs. 20个月,p=0.042;未达到vs. 33个月,p=0.079;图3A,B)。在t(4;14) 亚组,M蛋白免疫重建患者在 PFS 和 OS 方面具有更好的预后,但 OS 无统计学显著性(80 vs. 35个月,P=0.024;未达到vs.100 个月,P=0.073,图3C,D)。对于t(14;16) 亚组,M蛋白免疫重建组的中位 PFS 和 OS 长于非 M蛋白免疫重建组,但差异无统计学显著性(32 vs. 24个月,P=0.862。54 vs. 34个月,p=0.537;图3E,F)。
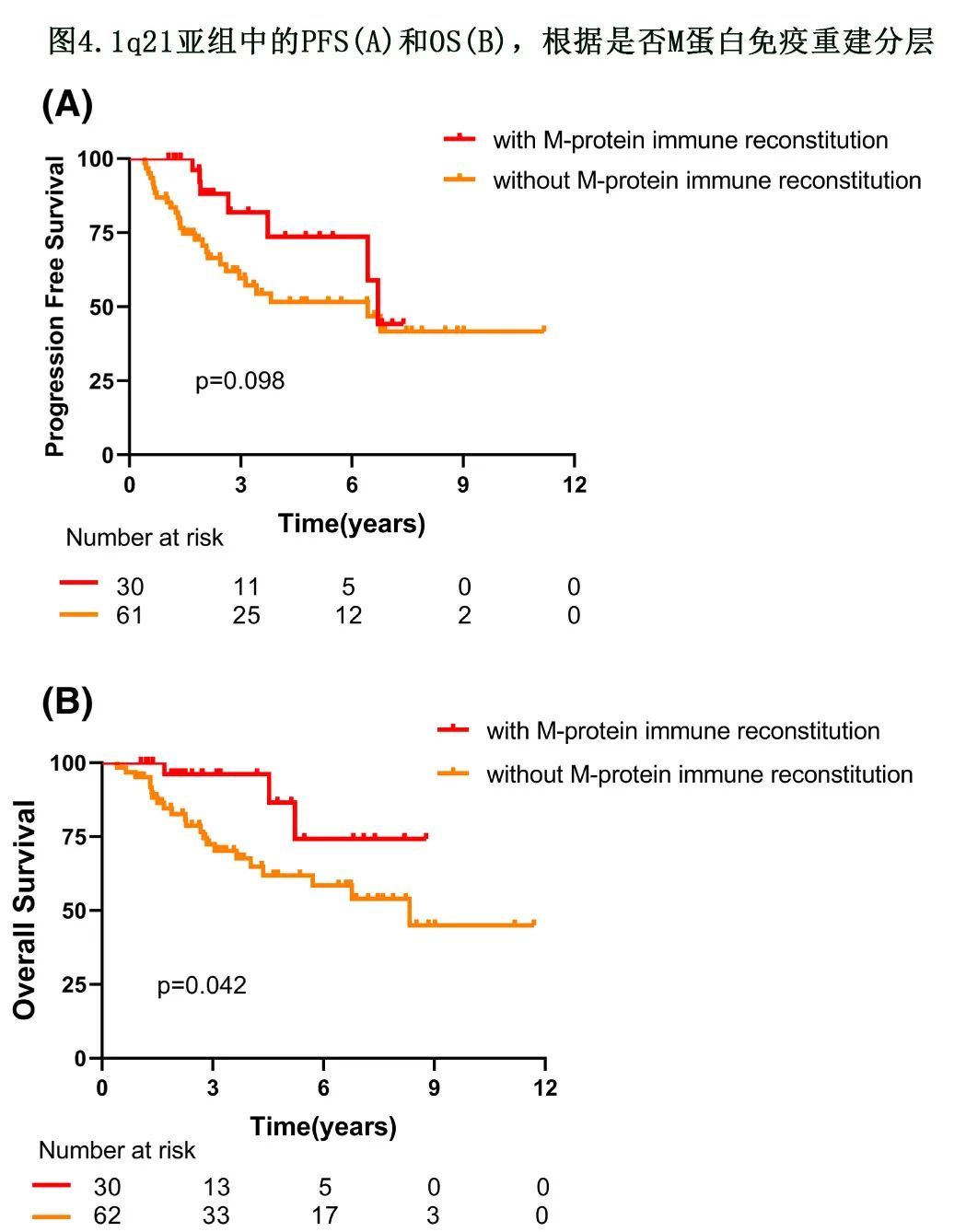
在 1q21 阳性亚组中,ASCT后 M蛋白免疫重建导致中位 PFS 和 OS 更优(80 vs. 77 M,P=0.098;未达到vs. 100 个月,P=0.042,图4)。且将1q21 纳入细胞遗传学高危后,M蛋白免疫重建组的 PFS 和 OS 仍优于非 M低蛋白免疫重建组(80 vs. 48个月,P=0.024;未达到vs. 100 个月,P=0.035)。图2C,D)。但在标危亚组中,M蛋白免疫重建未改善预后(77 vs. 83个月,P=0.427;70 个月vs.未达到,P=0.929)。
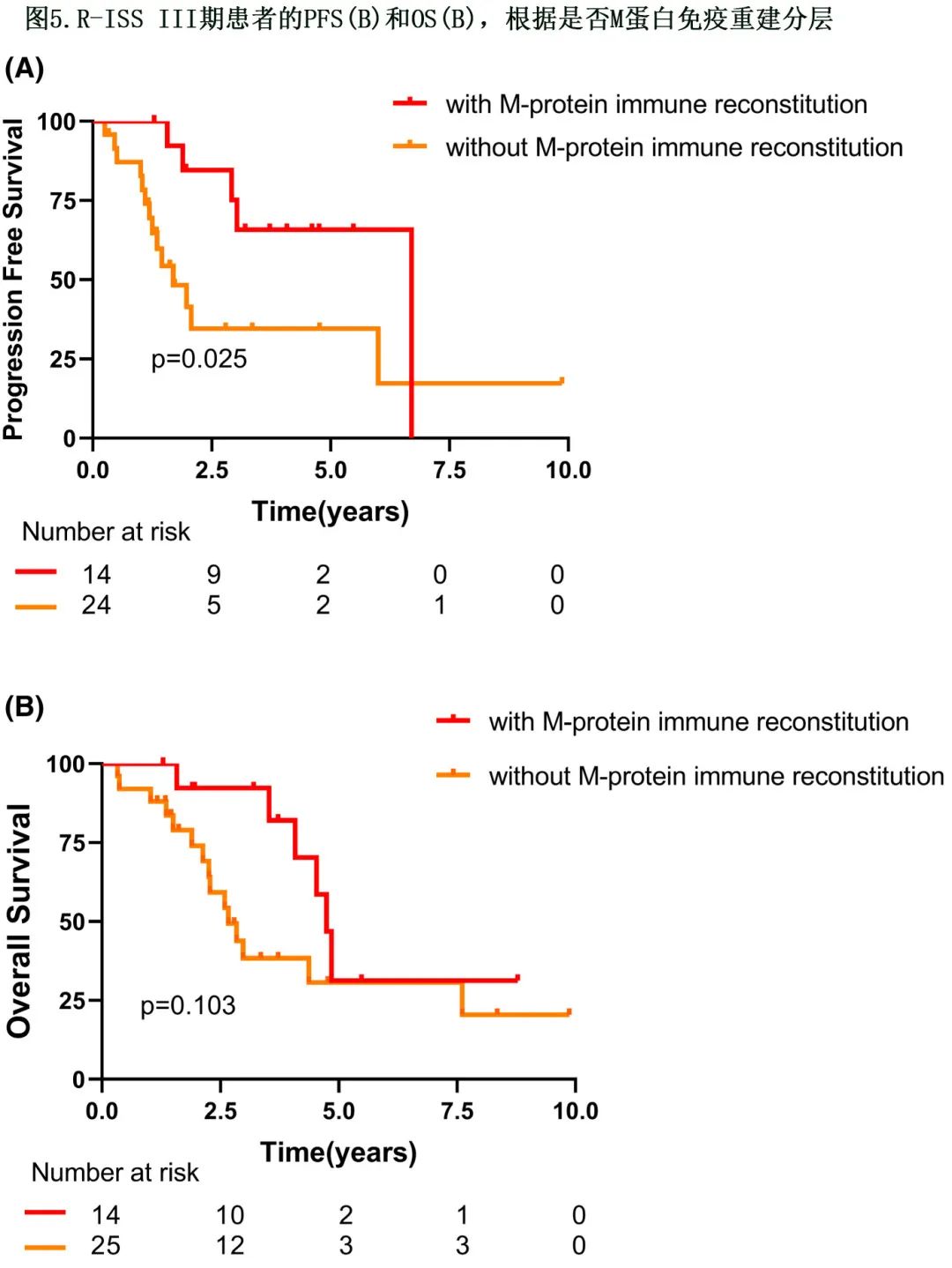
M蛋白免疫重建的R-ISS III期患者的生存期
在 R-ISS III 亚组分析中,M蛋白免疫重建组的 PFS 优于非 MP 免疫重建组 (80 vs. 20个月,HR=2.913,P=0.025,图5A),M蛋白免疫重建组的中位 OS 更长但无统计学显著性 (57 vs. 32 个月,HR=2.156,P=0.103,图5B)。
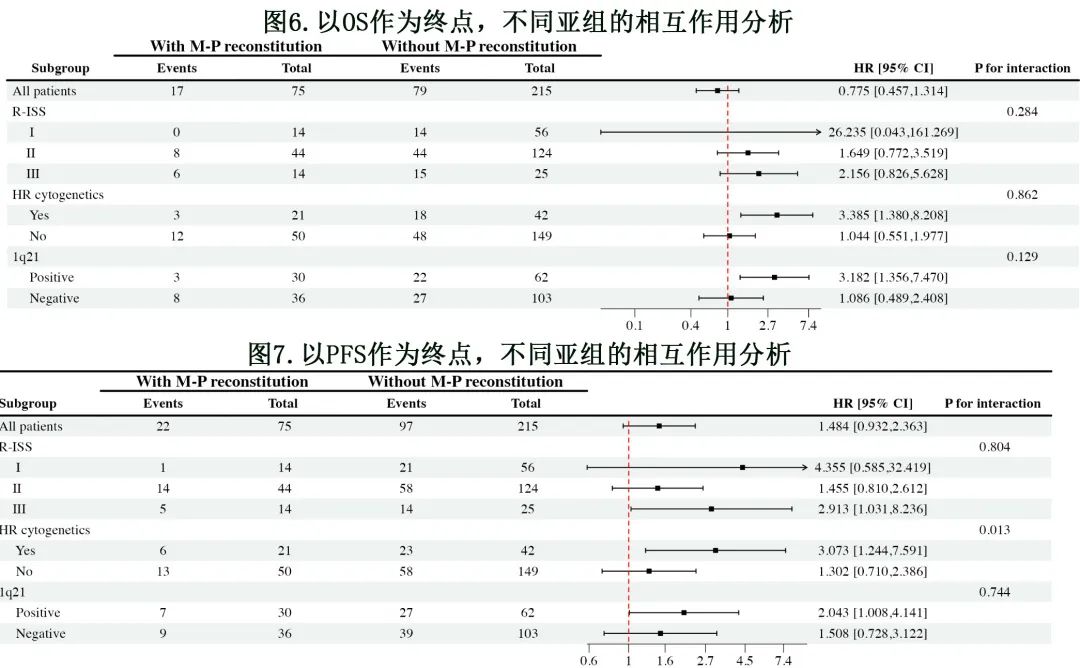
OS方面,M 蛋白免疫重建与细胞遗传学高危亚组和1q21存在相互作用,但与R-ISS 分期无相互作用;对于 PFS ,M 蛋白免疫重建与细胞遗传学高危亚组存在相互作用(图6和图7)。
总结
该研究纳入290例患者,25.9%(75/290) 的患者观察到 M 蛋白免疫重建。M 蛋白免疫重建组的 CR 率和 MRD 阴性率较高 (85.3% vs. 69.3%,p=0.013,81.9% vs. 66.5%,p=0.014)。尽管组间无显著差异,但 M 蛋白免疫重建组的中位PFS和OS更长(80 vs. 72个月,p=0.076;未达到vs. 105个月,p=0.312)。在细胞遗传学高危患者中,M蛋白免疫重建预示着更好的 PFS 和OS(80 vs. 31个月,p=0.010;未达到vs. 91个月,p=0.026)。此外,在R-ISS III 期患者中,M 蛋白免疫重建患者的 PFS 和 OS 更好 (80 vs. 20个月,p=0.025;57 vs. 32个月,p=0.103)。
ASCT 后的M蛋白免疫重建出现通常见于 CR 患者,且具有预后意义,该现象可能反映出强烈的体液免疫应答,从而导致免疫系统重建。M蛋白免疫重建与 MM 患者深而持久的缓解和早期免疫重建有关,其相关较好的预后可能与深度缓解有关。但M蛋白免疫重建本身并非生存获益,它只是 MM 患者缓解和免疫重建的标志。尽管如此,在高危患者中,早期获得免疫重建可能提示更好的预后。
参考文献
Zhu H, Liu J, Gu J, Chen M, Kuang L, Huang B, et al. Early M-protein immune reconstitution after autologous haematopoietic stem cell transplantation is a good prognostic marker for patients with high-risk cytogenetic multiple myeloma.Br J Haematol. 2024;00:1–12. https://doi.org/10.1111/ bjh.19275
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)