首页 > 医疗资讯/ 正文
间充质干细胞(MSC)作为一种多能干细胞,具有高度的自我更新能力和多向分化潜能。它们广泛分布于全身,具有多种用途,包括组织再生、免疫调节和血管生成。然而,干细胞治疗的一个重要挑战是移植后干细胞的低存活率,这与细胞的非特异性归巢和损伤部位的缺血/缺氧环境有关。此外,移植的干细胞在病理微环境中不能充分发挥其治疗功能,严重限制了干细胞的临床应用。
2023年11月29日,南开大学赵强课题组与合作者在Science Advances上发表题为“Intracellular delivery of nitric oxide enhances the therapeutic efficacy of mesenchymal stem cells for myocardial infarction”的文章。该工作通过对MSC进行基因工程改造,进而催化一氧化氮(NO)供体化合物在细胞内分解释放NO。与细胞外NO递送相比,细胞内产生的NO有效延长了MSC的存活时间,增强了MSC的旁分泌功能。利用小鼠和大鼠心肌梗死模型考察了工程化MSC联合细胞内NO递送的治疗效果,并进一步探索了通过二次开胸方式进行干细胞治疗的临床相关治疗方式。

自体间充质干细胞(MSC)移植是治疗心肌梗死的有效手段,但受患者自身慢性疾病的影响,自体MSC质量和功能明显下降。作者首先通过转录组测序发现,与健康人来源的MSC相比,糖尿病患者来源的MSC在基因水平上存在差异,抗凋亡和促血管新生功能显著降低。
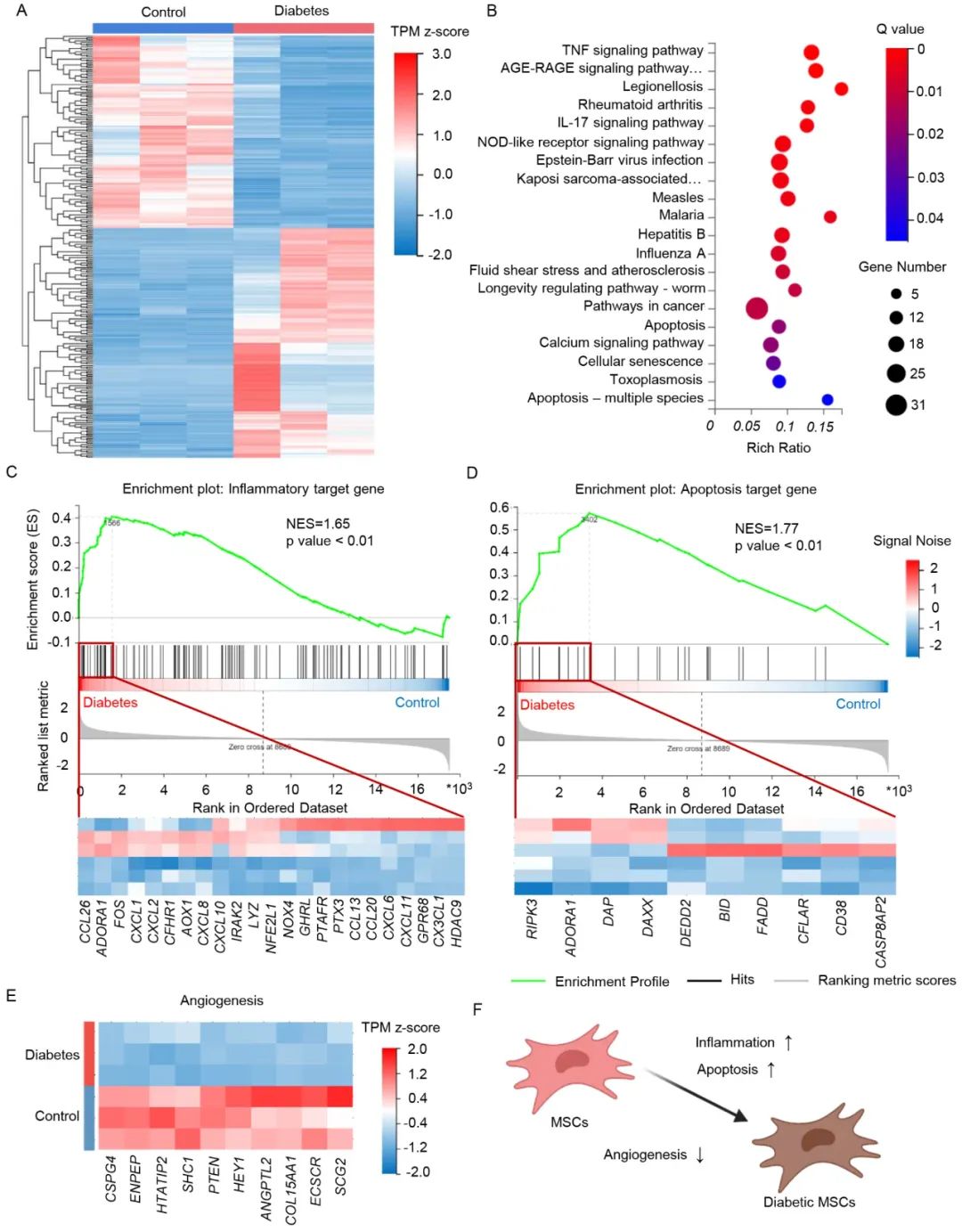
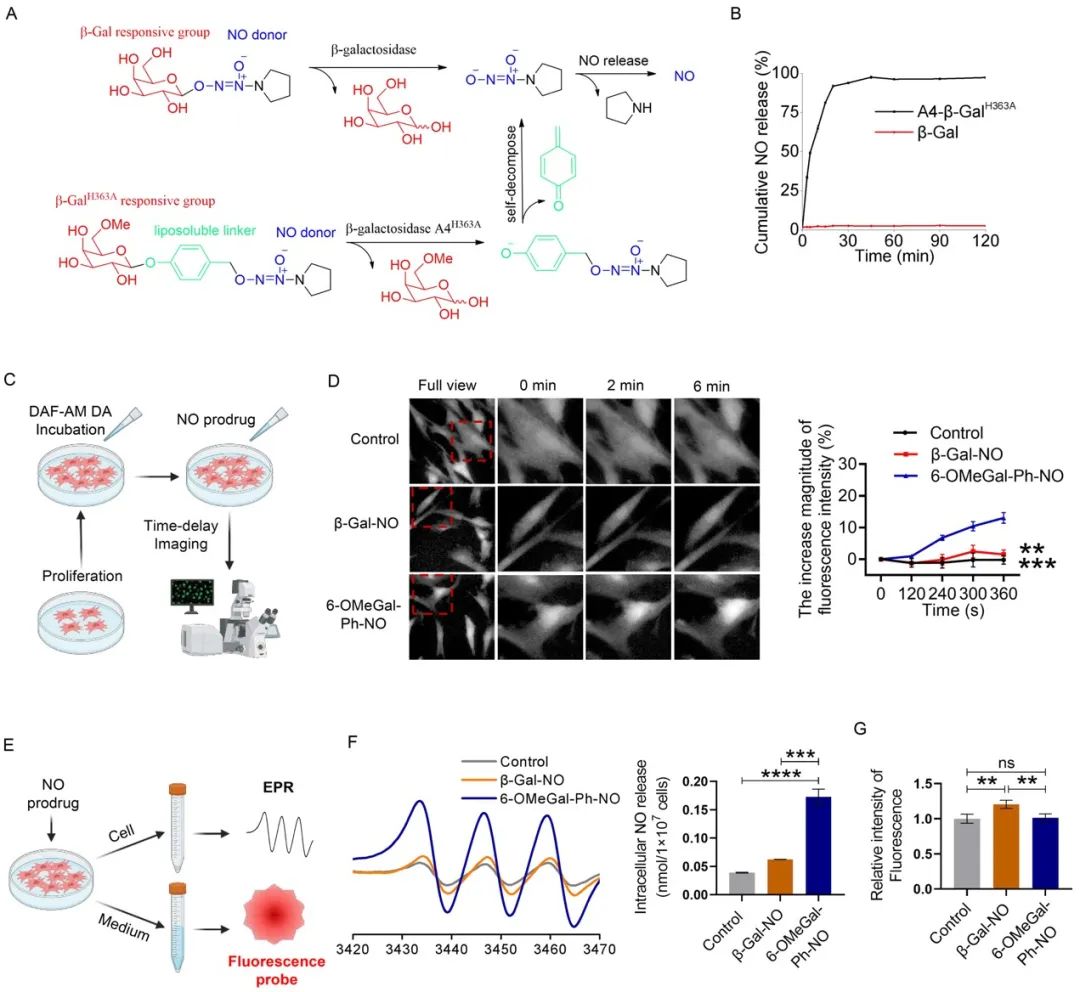
一氧化氮(NO)作为一种气体信号分子,可通过促进干细胞增殖、提高旁分泌功能、改善细胞微环境等途径来调控干细胞的功能和命运。因此,作者提出通过对MSC细胞进行工程化修饰,并利用外源性一氧化氮供体化合物通过细胞内递送NO,以改善细胞存活、增强细胞功能,从而提高其治疗效果。首先,作者采用慢病毒感染的方式对MSC进行工程化改造(eMSC),成功在MSC胞内表达突变的β-半乳糖苷酶(A4-β-GalH363A),相比于野生型β-半乳糖苷酶(β-Gal)主要表达在胞浆及细胞核周围,A4-β-GalH363A则集中定位于细胞核内。进一步,作者针对性设计了一种可通过细胞膜并被A4-β-GalH363A识别的一氧化氮供体化合物—6-OMeGal-Ph-NO。体外释放实验表明,6-OMeGal-Ph-NO能够特异性被A4-β-GalH363A有效识别并催化分解释放NO,而不能被野生型β-半乳糖苷酶识别。细胞延时成像进一步显示,经6-OMeGal-Ph-NO处理后,eMSC细胞内的NO信号强度明显升高,而β-Gal-NO处理组细胞内没有明显NO产生。作者还使用电子顺磁共振EPR和近红外荧光成像对细胞内外的NO水平进行检测,发现6-OMeGal-Ph-NO处理后eMSC胞内的NO水平显著高于对照组,而β-Gal-NO处理后eMSC胞外NO水平高于其他实验组。
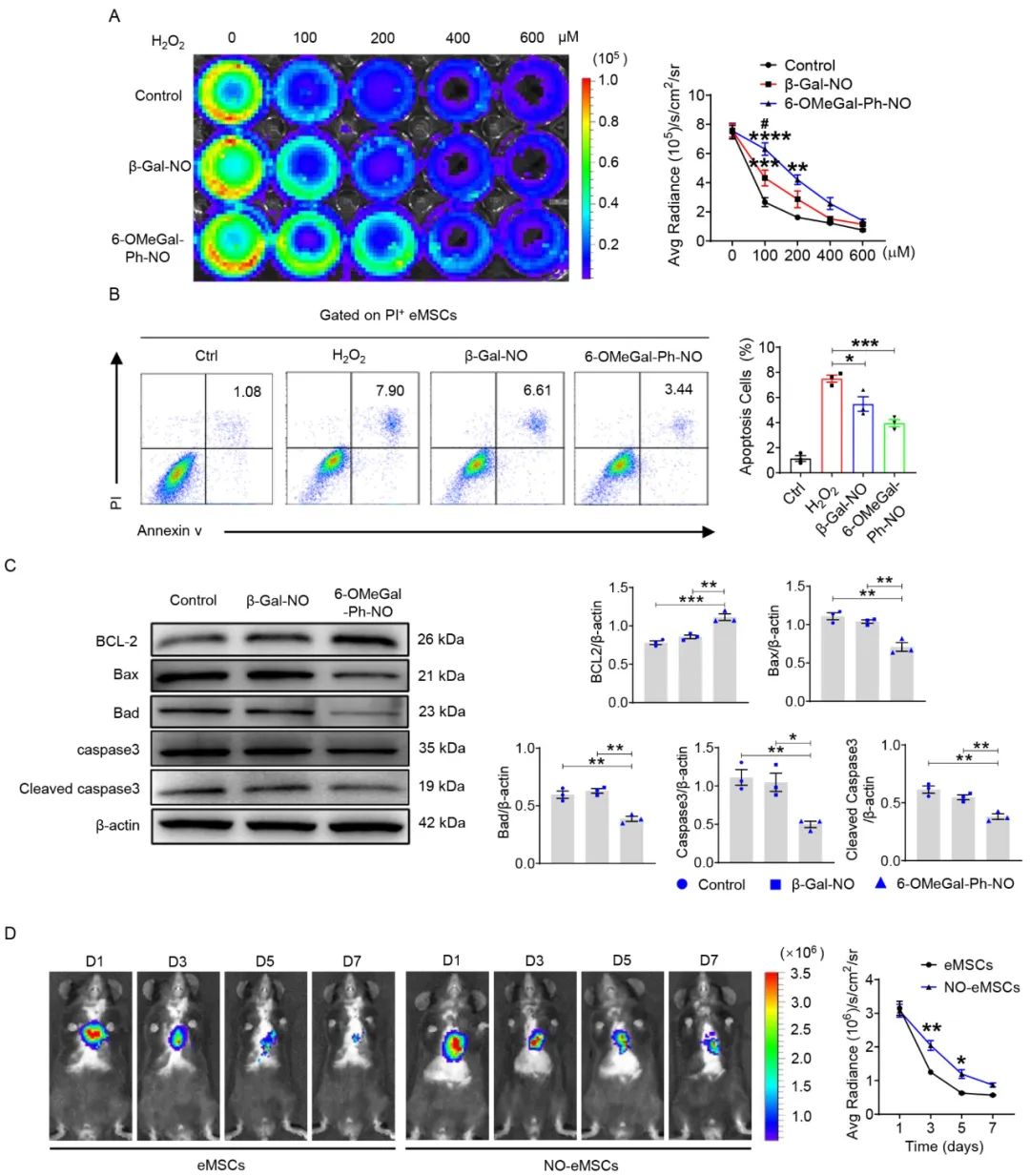
接下来,作者考察了外源性NO在氧化应激刺激下对eMSCs的保护作用,并重点比较了细胞内和细胞外两种不同NO递送方式的区别。结果表明,H2O2刺激引起细胞凋亡,通过细胞外和细胞内递送NO显著减少氧化应激刺激下eMSCs的凋亡,细胞内递送NO的效果更为明显。在基因和蛋白水平上,细胞内递送NO具有更明显的抗凋亡作用。活体成像结果也显示,细胞内递送NO可以改善eMSCs心脏原位移植后的存活率。
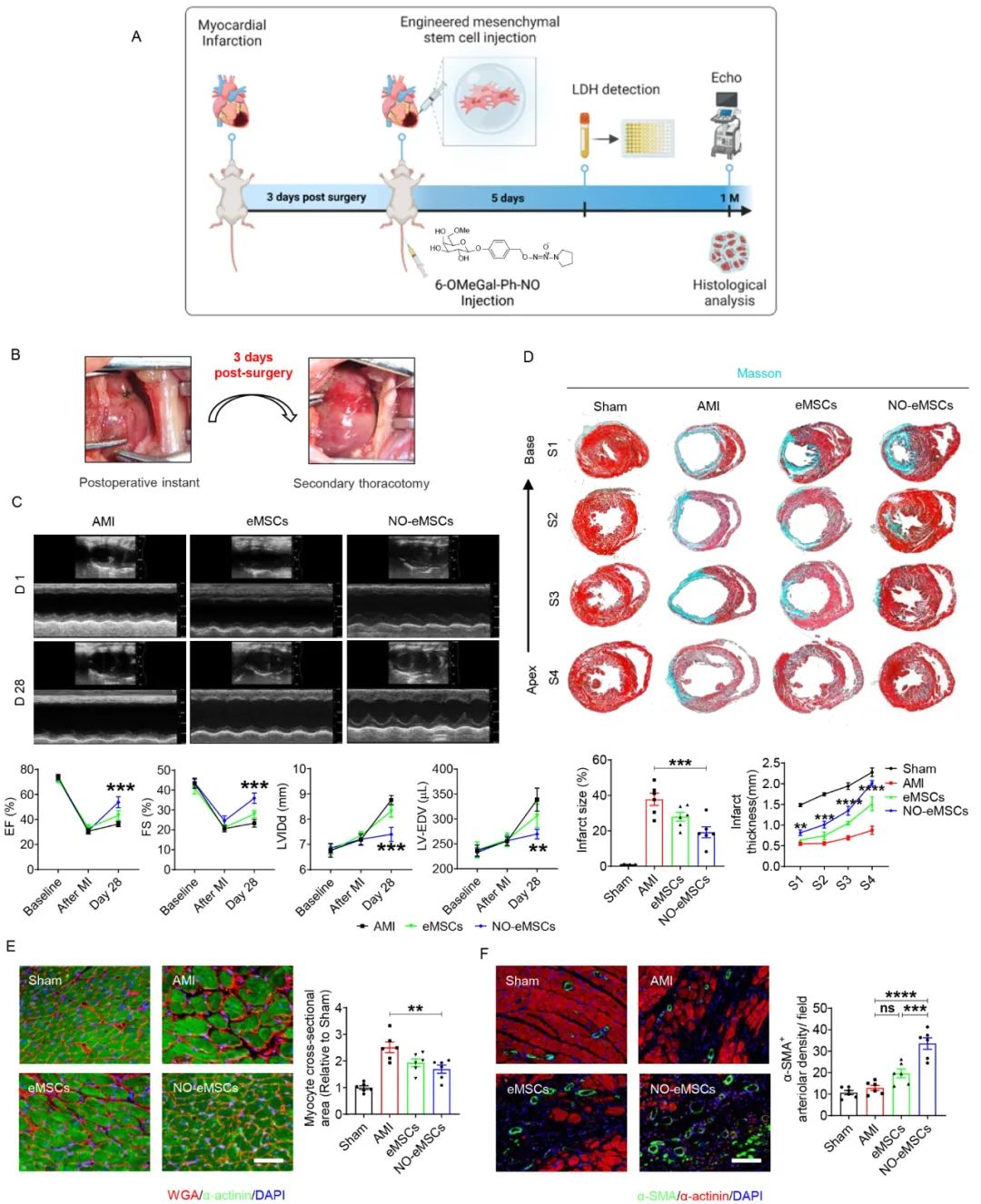
作者进一步考察了工程化干细胞eMSC联合细胞内NO递送对心肌梗死的治疗作用。在小鼠心梗早期,NO-eMSC治疗能调控凋亡相关蛋白的表达,抑制细胞凋亡,进而提高eMSC原位移植后的滞留率;与此同时,NO-eMSC的治疗能够促进巨噬细胞向M2表型极化,抑制炎症细胞浸润;NO-eMSC长期治疗能够恢复心肌梗死小鼠的心脏功能,提高心肌细胞缝隙连接蛋白的表达,促进心肌梗死边缘区血管的生成。
心肌梗死的急性期过后会导致不良心室重构的发生从而进一步影响病人的预后,然而由于小鼠的建模及给药方式的局限性,目前的研究通常在心肌梗死建模后立即进行治疗。心肌梗死后的3-7天是炎症反应的爆发期,因此研究结果并不能很好地反映临床心梗治疗情况。为此,作者通过在动物模型及给药方式进行优化:在大鼠心肌梗死建模3天后进行二次开胸治疗,从而模拟临床上心肌梗死的发生及治疗。通过心肌损伤标志物的检测,心功能超声和组织学分析进一步证实了工程化MSC结合细胞内NO递送策略在急性心肌梗死模型中的治疗效果。
综上,该研究通过对间充质干细胞进行工程化修饰使其在细胞核内表达突变酶A4-β-GalH363A,将工程化干细胞应用于急性心肌梗死的动物模型中,外源性NO供体化合物可在突变酶的催化下胞内释放NO,从而实现 NO与间充质干细胞的协同治疗。
南开大学生命科学学院赵强教授、医学院李宗金教授与首都医科大学安贞医院高霏教授为论文的共同通讯作者,南开大学博士研究生郝天、汲广博和博士后钱盟是论文的共同第一作者。论文还得到了天津市第一中心医院移植中心王树森教授与血管外科何菊主任医师、南开大学物理学院潘雷霆教授、天津市第三中心医院心脏中心李彤教授和高文卿副教授以及哈尔滨医科大学田进伟教授的支持和帮助。该研究受到了国家重点研发计划(2018YFE0200503)、国家自然科学基金(81925021、82330066、81921004、U2004126)和天津市自然科学基金(21JCZDJC00240)的资助。
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38019911/
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)