首页 > 医疗资讯/ 正文
在过去几十年间,以腹腔镜为代表的微创手术极大程度地减少了手术创伤,促进了患者术后快速康复,在胃、结直肠、肝脏手术中发展迅速。然而,在需要精细操作的手术中,腹腔镜手术则会面临“筷子效应”、反向操作、缝合打结困难等一系列问题。于20世纪末面世的达芬奇机器人手术系统具有高清放大的3D手术视野、7个自由度的灵活机械手腕且能过滤术者微小的震颤,从而可在狭小空间中实施更加精细的操作,显著提高了手术质量[1-2],弥补了传统腹腔镜的不足,进一步促进了微创手术的发展。
2003年,Giulianotti等[3]首次报道了机器人手术系统应用于肝胆胰手术的经验,并证实机器人肝胆胰手术的安全性和可行性。在随后的20年间,机器人手术系统逐渐应用于肝脏切除术、肝门部胆管癌根治术、胆囊癌根治术、胰体尾切除术、胰十二指肠切除术等复杂手术[4-14]。与开腹及腹腔镜手术相比,机器人手术系统在肝胆胰手术中的应用减少了术中出血量及中转率、缩短了患者术后住院时间,且学习曲线较短,便于年轻医生掌握[12,15-19]。
切除和重建是肝胆胰手术中最重要的核心策略,只有提高切除和重建质量,才能降低术后并发症的发生率,提高患者近期和远期疗效[20]。在机器人手术发展初期,开腹手术模式下的切除和重建方法无法直接应用于机器人手术,缺乏与机器人手术系统相适应和匹配的切除与重建技术制约了机器人手术在肝胆胰外科中的应用。
笔者自2011年起开展机器人肝胆胰手术,通过前期经验的积累和总结,对机器人肝胆胰手术中的切除与重建技术进行了优化,并提出环血管切除技术和双低重建技术,以期通过简单高效的切除与重建方法,促进机器人肝胆胰手术的临床应用和推广。
1 环血管切除技术
肝胆胰区域解剖结构复杂、血管变异多变,开腹手术中通过手指的触摸能够判断动脉走形并快速控制出血,而机器人手术系统缺乏力反馈,无法通过触觉感知血管及肿瘤的位置,一旦出现大量出血,只能通过缝扎的方式进行止血。
为减少术中对变异血管和非变异血管的医源性损伤以及不必要的出血,使切除过程有迹可循,笔者提出了环血管切除技术[21]。该技术以主要血管作为解剖标志,沿血管走形游离并切除血管周围软组织,不仅能够保护主要血管及其分支,对于恶性肿瘤还能够提高切除的彻底性,从手术安全性和根治性两个维度推动机器人切除技术在肝胆胰手术中的应用。
在胰十二指肠切除术中,通常以肠系膜上动静脉、肝动脉和门静脉为轴,沿其纵行方向切开动脉鞘及静脉外侧结缔组织[22],一方面能够更好地识别从血管主干发出的分支,避免误伤变异血管,提高了手术安全性;另一方面还能更好地判断肿瘤与主要血管的关系,评估其可切除性,更加彻底地清扫血管周围的淋巴结,提高R0切除(肿瘤完全切除)率。
同理,胰体尾癌的顺行模块化胰体尾脾切除术也可应用该方法,以腹腔干和肠系膜上动静脉轴为引导标志,沿血管走形切除其周围软组织,从而将血管游离出来[10]。此游离、显露血管的过程即为环血管切除的过程,当主要血管显露出来时,代表切除基本完成。此外,肝脏手术的循肝静脉切除以及Glisson 肝蒂解剖也可应用环血管切除技术,从而更好地游离和保护重要分支血管,减少术中出血。
笔者提出可将“四标手术”作为肝胆胰手术的要求,即定标(确定手术的解剖标志)、寻标(通过游离、解剖、清扫等外科技术找到解剖标志)、校标(根据术前的影像学资料,结合术中找到的解剖标志调整下一步手术入路和方向)、优标(对解剖标志及显露方式不断改进和优化),以提高肝胆胰外科术者对手术的理解,实现手术的规范化和模式化,最终使患者从高质量和高标准的手术中获益。
环血管切除技术是实施“四标手术”理念的重要环节,将血管作为重点解剖标志,沿其走形进行寻标和校标,既保护了重要血管及其分支,也可预判肿瘤的可切除性,从而提高恶性肿瘤的根治率[23]。
机器人手术系统具有手术视野相对开阔,机械臂操作稳定、精细的优点,更有利于血管的识别、游离和保护。在机器人手术系统的加持下,术者能够通过环血管切除将复杂的肝胆胰手术逐步分解,使复杂手术简单化、规范化,有助于缩短术者的学习曲线,有利于机器人手术的普及。
值得注意的是,机器人环血管切除技术需建立在对血管解剖及变异充分理解的基础上,同时需掌握精细的机器人手术操作技巧,如有条件可行术前三维重建,对血管走形和切除范围进行提前规划,否则在环血管切除过程中易损伤目标血管和变异血管。
2 双低重建技术
肝胆胰手术常需通过重建以恢复消化道的连续性,对于侵犯血管的肿瘤还需在联合血管切除后实施血管重建。重建手术的质量决定了术后并发症的发生率和患者的恢复程度,良好的重建不仅可提高患者的生存质量、缩短术后住院时间,还可使恶性肿瘤患者更早接受术后辅助治疗,延长患者的生存期[24]。
传统开腹手术空间大、缝合确切,而腹腔镜和机器人手术操作空间狭小、视野由下而上,难以完全使用传统开腹手术的重建方式,这增加了微创条件下重建手术的复杂性和困难性。特别是胰十二指肠切除术,需要完成胰肠/胰胃、胆肠和胃肠重建,涉及空腔-空腔、实质-空腔这2种重建方式,其中任何重建方式出现渗漏均会引起严重并发症。笔者根据不同组织重建后愈合的共性以及机器人手术的特点,提出了低张力低应力双低重建技术,分别通过减低重建过程中的组织张力以及单位面积上的牵拉应力提高重建质量,保护吻合口血供,促进吻合后的组织尽快达到组织学愈合,从而降低术后并发症的发生率[24]。
2.1 低张力重建技术
低张力重建即降低吻合口两侧相互牵引力的重建技术。由于机器人手术操作空间小、缺乏力反馈,术者无法直接提拉、牵引、翻转腹腔脏器,如需要吻合的脏器距离过远或有肥厚肠系膜的阻隔,均会造成重建时组织张力过高,从而影响吻合口的血供和愈合,最终导致消化道瘘。而通过路径择优和减张固定方式可降低重建过程中的组织张力。
2.1.1 路径择优方式
在行胃肠和胆肠吻合时,可利用横结肠系膜在结肠中动脉左右两侧的薄弱区域(L孔、R孔),将此无血管区域打开(图1),以缩短近端空肠与肝门胆管及胃之间的距离,降低胃肠和胆肠吻合的张力,减少牵拉、翻转肠管的次数,使吻合更直接,防止医源性肠管损伤。
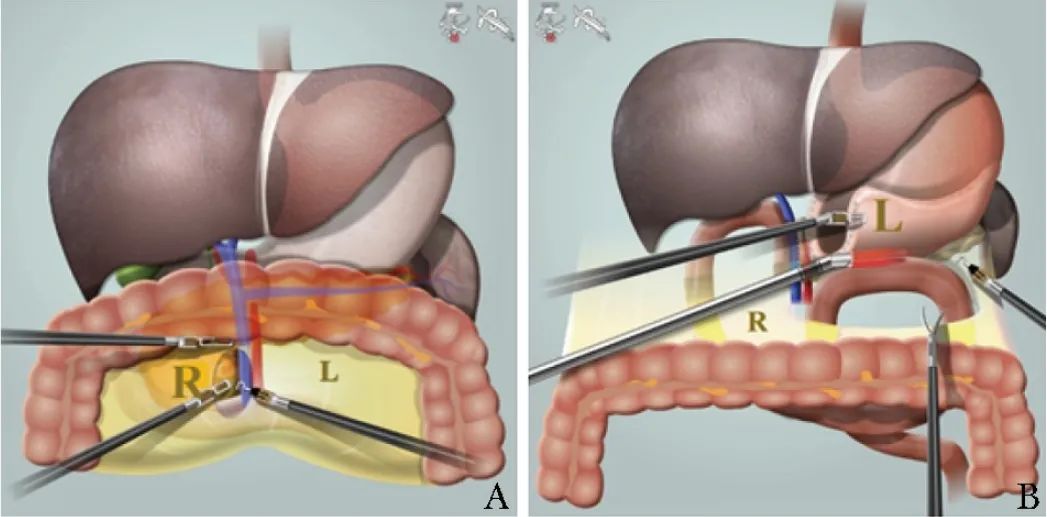
图1 胃肠和胆肠吻合术示意图
A. 经R孔行胰头钩突游离;B. 经L孔行胃肠吻合
笔者研究发现,在机器人辅助下经L孔能够便捷地找到近端空肠,避免对横结肠产生干扰,结肠后的胃肠吻合简化了手术操作,降低了吻合口的张力,与经结肠前的胃肠吻合相比,明显缩短了重建时间并降低了胃排空障碍的发生率[25]。此外,经L孔和R孔实施的胆肠吻合同样具有简化操作、避免牵拉肠管以及降低吻合口张力的优势。
2.1.2 减张固定方式
减张固定方式包括重建后的减张加固、带蒂大网膜的环绕固定、输入袢空肠与镰状韧带或胃壁的加固缝合,这些方法均可在一定程度上降低重建后的张力。此外,机器人助手的配合也很重要,特别是在收紧缝线使两侧组织对拢时,助手需根据牵拉缝线的速度及力度,将远端空肠慢慢向肝门部胆管靠拢,避免缝线对组织的切割[26]。
低张力重建技术还适用于肿瘤侵犯血管后的血管重建。需先评估血管断端之间的距离,如距离较近,可游离血管远近端组织韧带和松解粘连以缩短血管断端距离,还可用较长的相邻血管作为替代血管完成重建;如距离远,难以直接行对拢重建,可采用镰状韧带、肾前筋膜、大隐静脉、肾静脉以及脾静脉等自体组织和血管,以及人工血管来完成血管重建,不可在张力过大时勉强行血管端端吻合,以避免血管壁的切割和吻合口出血,防止因血管扭曲、血流动力学紊乱导致的血栓形成[27-30]。
2.2 低应力重建技术
2.2.1 “U+8”缝合
重建时的高应力也是导致组织切割、吻合口缺血,进而造成重建失败的重要因素。机器人系统由于缺乏力反馈,在缝合打结时难以掌握力度,更易造成吻合口局部高应力。特别是在胰肠吻合过程中,由于胰腺质地相对脆弱,一旦胰肠吻合口撕裂或因缺血水肿形成胰瘘,会引起腹腔感染、出血等严重并发症,甚至导致患者死亡。因此,笔者认为,胰肠吻合的关键在于胰肠对拢后维持充分的血供,使其早期形成生理性愈合,而不在于严密的机械缝合[31]。
对于软质胰腺而言,使其像硬质胰腺一样,均匀分散缝线的牵拉力和单位面积的应力是提高胰肠吻合质量的关键[32]。在机器人胰肠吻合中先对胰腺断端进行“U+8”缝合(图2),使其内部形成局部环网结构,再行胰肠吻合时既能分解缝线的局部应力,使之均匀分散,又能减少缝线对胰腺组织的切割,提高胰腺抵抗外载荷的能力,降低严重胰瘘的发生率[33-34]。
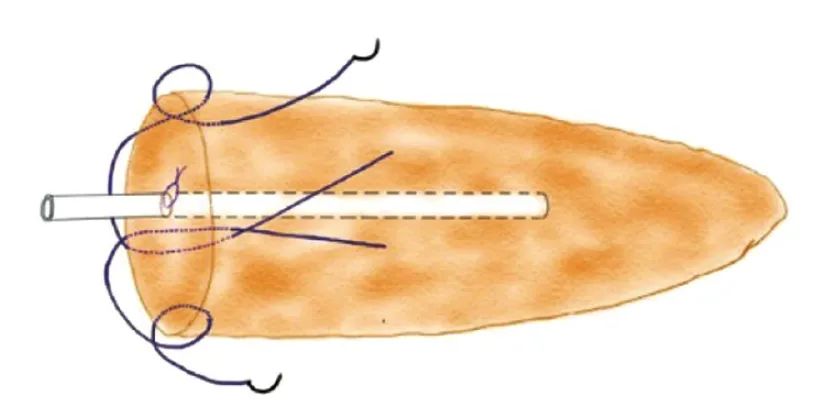
图2 胰腺断端的“U+8”缝合示意图
2.2.2 “301”胰肠吻合
为提高机器人胰肠吻合的效率,笔者对胰肠吻合操作步骤进行简化,从“1+2”胰肠吻合逐渐简化为“301”胰肠吻合(图3),主张通过宽针距的连续缝合分解重建的应力,通过空肠浆膜与胰腺断端的接触式单层对合代替紧密的多层缝合,从而保护吻合口的血供[31,33,35-36]。前瞻性随机对照研究显示,经“U+8”缝合加固后单层连续的胰肠吻合耗时仅14.1 min,B级和C级的胰瘘发生率非劣效于改良Blumgart胰肠吻合(6.7%比11.8%, P=0.0002)[37]。
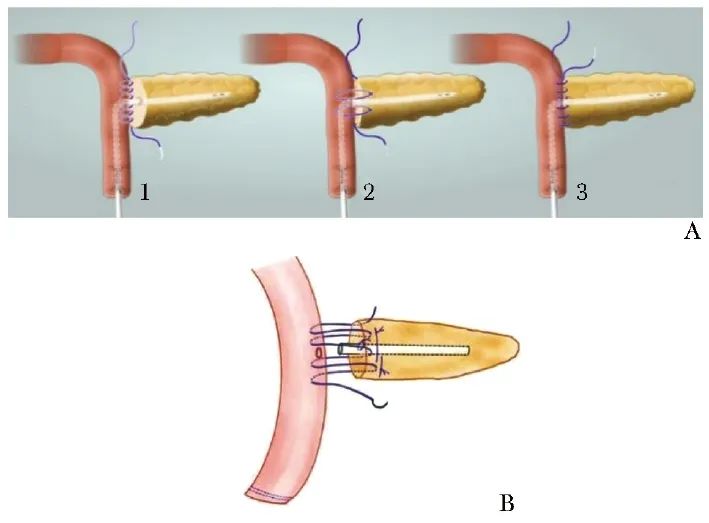
图3 胰肠吻合操作示意图
A“1+2”胰肠吻合,1表示单层后壁连续缝合,2表示支撑管上下各缝合一针,3表示单层前壁连续缝合;B“301”胰肠吻合
2.2.3 胰腺端端重建
针对于毗邻主胰管的胰腺良性肿瘤,笔者提出“胰管(修复)外科”这一概念,胰腺中段切除后进行胰腺端端重建是其中重要的术式之一[34]。此术式最大的难题在于胰腺的质地脆弱,难以承受过大的缝线牵拉力,容易造成胰腺撕裂。上述的胰腺断面“U+8”缝合能够增加胰腺内部结构,分解局部牵拉应力,为胰腺断端耐受一定程度的牵拉提供了基础,使胰腺端端对拢重建成为可能。
笔者自2017年首次报道机器人胰腺中段切除后胰腺端端重建术式以来[38],后续报道的相关队列研究和随机对照研究中均未出现C级以上胰瘘,初步证实了胰腺端端重建的可行性[39]。胰腺端端重建与传统胰肠吻合比较,手术时间及术后住院时间更短、术中出血更少,有利于患者术后恢复[40]。
2.2.4 降低缝线和组织间的剪切力
低应力重建技术还包括降低缝线和组织间的剪切力。Grobmyer等[41-42]在胰腺和空肠之间行褥式缝合,将空肠浆膜包裹胰腺断面,B级和C级胰瘘发生率为6.9%。在此基础上,研究者尝试通过改变缝合方向和打结的位置以进一步降低缝线对胰腺的切割,称为“改良Blumgart吻合”[43-45]。胆肠重建时,在完成后壁连续缝合后,一次性缓慢均匀地收紧缝线也可起到分散缝线剪切力和牵拉应力的作用[46]。
3 小结与展望
肝胆胰的解剖结构复杂、血管变异较多,手术切除与重建难度大,因此微创手术对术者的经验和操作技巧要求较高。机器人手术系统能够提供更加精确、稳定的操作,尤其在游离、缝合、打结方面,与腹腔镜手术相比具有明显优势,更加适用于肝胆胰手术。为克服机器人手术系统操作空间小、缺乏力反馈的缺点,笔者提出环血管切除技术和双低重建技术,将此两项技术应用于机器人肝胆胰手术中有望提高机器人手术的安全性、缩短术者的学习曲线,进一步扩大机器人手术的适应证,使更多患者从微创手术的科技发展中获益。
参考文献
[1]Garcia-Ruiz A, Gagner M, Miller JH, et al. Manual vs robotically assisted laparoscopic surgery in the performance of basic manipulation and suturing tasks[J]. Arch Surg, 1998, 133:957-961.
[2]Winer J, Can MF, Bartlett DL, et al. The current state of robotic-assisted pancreatic surgery[J]. Nat Rev Gastroenterol Hepatol, 2012, 9:468-476.
[3]Giulianotti PC, Coratti A, Angelini M, et al. Robotics in general surgery: personal experience in a large community hospital[J]. Arch Surg, 2003, 138:777-784.
[4]Berber E, Akyildiz HY, Aucejo F, et al. Robotic versus laparoscopic rep of liver tumours[J]. HPB(Oxford), 2010, 12:583-586.
[5]Zureikat AH, Nguyen KT, Bartlett DL, et al. Robotic-assisted major pancreatic rep and reconstruction[J]. Arch Surg, 2011, 146:256-261.
[6]Tsung A, Geller DA, Sukato DC, et al. Robotic versus laparoscopic hepatectomy: a matched comparison[J]. Ann Surg, 2014, 259:549-555.
[7]Liu R, Liu Q, Zhao ZM, et al. Robotic versus laparoscopic distal pancreatectomy: A propensity score-matched study[J]. J Surg Oncol, 2017, 116:461-469.
[8]Liu Q, Zhao ZM, Tan XL, et al. Short- and mid-term outcomes of robotic versus laparoscopic distal pancreatosplenectomy for pancreatic ductal adenocarcinoma: A retrospec-tive propensity score-matched study[J]. Int J Surg, 2018, 55:81-86.
[9]Sucandy I, Luberice K, Lippert T, et al. Robotic Major Hepatectomy: An Institutional Experience and Clinical Outcomes[J]. Ann Surg Oncol, 2020, 27:4970-4979.
[10]Liu Q, Zhao G, Zhao Z, et al. The standardized technique in robotic radical antegrade modular pancreatosplenectomy using the flip-up approach[J]. Langenbecks Arch Surg, 2021, 406:1697-1703.
[11]Liu Q, Zhao Z, Zhang X, et al. Perioperative and Oncological Outcomes of Robotic Versus Open Pancreaticoduodenectomy in Low-Risk Surgical Candidates: A Multicenter Propensity Score-Matched Study[J]. Ann Surg, 2023, 277(4):e864-e871.
[12]Liu Q, Zhang W, Zhao JJ, et al. Propensity-score Matched and Coarsened-exact Matched Analysis Comparing Robotic and Laparoscopic Major Hepatectomies: An International Multicenter Study of 4822 Cases[J]. Ann Surg, 2023. doi: 10.1097/SLA.0000000000005855.
[13]Machado MAC, Mattos BV, Lobo Filho MM, et al. Robotic Hepatic Bisegmentectomy (s4b + s5) and Hilar Lymphadenectomy for Incidental Gallbladder Cancer Using Glissonian Approach[J]. Ann Surg Oncol, 2023, 30:3392-3397.
[14]Li J, Tan X, Zhang X, et al. Robotic radical surgery for hilar cholangiocarcinoma: A single-centre case series[J]. Int J Med Robot, 2020, 16:e2076.
[15]Chen JW, van Ramshorst TME, Lof S, et al. Robot-Assisted Versus Laparoscopic Distal Pancreatectomy in Patients with Resectable Pancreatic Cancer: An International, Retrospective, Cohort Study[J]. Ann Surg Oncol, 2023, 30:3023-3032.
[16]Kwak BJ, Lee JH, Chin KM, et al. Robotic versus laparoscopic liver reps for hepatolithiasis: an international multicenter propensity score matched analysis[J]. Surg Endosc, 2023, 37:5855-5864.
[17]Choi M, Rho SY, Kim SH, et al. Total laparoscopic versus robotic-assisted laparoscopic pancreaticoduodenec-tomy: which one is better?[J]. Surg Endosc, 2022, 36:8959-8966.
[18]Zhang T, Zhao ZM, Gao YX, et al. The learning curve for a surgeon in robot-assisted laparoscopic pancreaticoduodenectomy: a retrospective study in a high-volume pancreatic center[J]. Surg Endosc, 2019, 33:2927-2933.
[19]Liu Q, Zhang T, Hu M, et al. Comparison of the learning curves for robotic left and right hemihepatectomy: A prospective cohort study[J]. Int J Surg, 2020, 81:19-25.
[20]刘荣, 刘渠, 王斐, 等. 预后控制外科:从理论到实践[J]. 科学通报, 2019, 64:1137-1148.
[21]刘荣, 刘渠, 赵国栋, 等. 环血管技术在胰十二指肠切除术中的应用[J]. 解放军医学院学报, 2022, 43:1109-1112.
[22]Zhao G, Liu Q, Zhao Z, et al. The standardized technique and surgical video of robotic pancreaticoduodenectomy at the Chinese PLA General Hospital[J]. Updates Surg, 2022, 74:245-254.
[23]刘荣, 刘渠. 肝胆胰外科应努力达到“四标”[J]. 中华医学杂志, 2022, 102:1323-1325.
[24]刘荣,刘渠. 外科低张力低应力重建[J]. 中华腔镜外科杂志(电子版), 2023, 16:1-4.
[25]Wang C, Huang T, Zhang K, et al. Retrocolic versus antecolic gastrointestinal reconstruction in robotic pancreaticoduodenectomy[J]. J Hepatobiliary Pancreat Sci, 2019, 26:517-523.
[26]姜洪池, 谷明旗. 胆肠吻合方式的合理选择和技术要点[J]. 中华消化外科杂志, 2017, 16:345-348.
[27]Machado MAC, Mattos BH, Lobo Filho MM, et al. Robotic Rep and Reconstruction of the Superior Mesenteric Vein Without Graft During Pancreatoduodenectomy (with Video)[J]. J Gastrointest Surg, 2021, 25:3010-3012.
[28]郭宏波, 宦玮, 尹任其, 等. 血管吻合技术的研究进展和应用现状[J]. 血管与腔内血管外科杂志, 2021, 7:845-850.
[29]彭云, 黄文贤, 江盼. 血管吻合技术研究进展和应用现状[J]. 血管与腔内血管外科杂志, 2020, 6:270-274.
[30]Kauffmann EF, Napoli N, Menonna F, et al. Robotic pancreatoduodenectomy with vascular rep[J]. Langen-becks Arch Surg, 2016, 401:1111-1122.
[31]刘荣, 刘渠, 赵之明, 等. 单针全层胰肠吻合(301式)在胰十二指肠切除术中的应用[J]. 腹腔镜外科杂志, 2018, 23:854-857.
[32]刘志平, 王志伟, 朱铭岩, 等. 胰空肠端侧吻合术生物力学及病理学研究[J]. 肝胆外科杂志, 2010, 18:135-138.
[33]刘荣, 赵国栋, 尹注增. 机器人LR式1+2胰肠吻合方法的理论与技巧:附104例病例报道[J]. 中华腔镜外科杂志(电子版), 2017,10:7-10.
[34]刘荣, 刘渠, 王子政, 等. 胰管(修复)外科的理论及实践[J].科学通报, 2023, 68:2376-2387.
[35]Liu Q, Zhao Z, Gao Y, et al. Novel single-layer continuous suture of pancreaticojejunostomy for robotic pancreaticoduodenectomy[J]. J Hepatobiliary Pancreat Sci, 2020, 27:56-63.
[36]刘荣, 赵之明, 姜楠. 胰肠吻合的历史发展及“301”式胰肠吻合的变迁[J]. 中华腔镜外科杂志(电子版), 2020, 13:1-4.
[37]Liu Q, Zhao Z, Gao Y, et al. Novel Technique for Single-Layer Pancreatojejunostomy is Not Inferior to Modified Blumgart Anastomosis in Robotic Pancreatoduodenectomy: Results of a Randomized Controlled Trial[J]. Ann Surg Oncol, 2021, 28:2346-2355.
[38]刘荣, 王子政, 高元兴, 等. 机器人“荣氏”胰腺中段切除术一例报道[J]. 中华腔镜外科杂志(电子版), 2017, 10:319-320.
[39]Wang ZZ, Zhao GD, Zhao ZM, et al. An end-to-end pancreatic anastomosis in robotic central pancreatectomy[J]. World J Surg Oncol, 2019, 17:67.
[40]Wang ZZ, Zhao GD, Zhao ZM, et al. A comparative study of end-to-end pancreatic anastomosis versus pancreaticojejunostomy after robotic central pancreatectomy [J]. Updates Surg, 2021, 73:967-975.
[41]Grobmyer SR, Kooby D, Blumgart LH, et al. Novel pancreaticojejunostomy with a low rate of anastomotic failure-related complications[J]. J Am Coll Surg, 2010, 210:54-59.
[42]Kleespies A, Rentsch M, Seeliger H, et al. Blumgart anastomosis for pancreaticojejunostomy minimizes severe complications after pancreatic head rep[J]. Br J Surg, 2009, 96:741-750.
[43]Fujii T, Sugimoto H, Yamada S, et al. Modified Blumgart anastomosis for pancreaticojejunostomy: technical improve-ment in matched historical control study[J]. J Gastrointest Surg, 2014, 18:1108-1115.
[44]Hirono S, Kawai M, Okada KI,et al. Modified Blumgart Mattress Suture Versus Conventional Interrupted Suture in Pancreaticojejunostomy During Pancreaticoduodenectomy: Randomized Controlled Trial[J]. Ann Surg, 2019, 269:243-251.
[45]Wang X, Bai Y, Cui M, et al. Modified Blumgart anastomosis without pancreatic duct-to-jejunum mucosa anastomosis for pancreatoduodenectomy: a feasible and safe novel technique[J]. Cancer Biol Med, 2018, 15:79-87.
[46]刘军, 郑元文. 腹腔镜“一针式降落伞胆肠吻合”缝合方式的应用与探讨[J]. 中华腔镜外科杂志(电子版), 2020, 13:328-331.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)