首页 > 医疗资讯/ 正文
提起基因编辑,就避不开被称作“基因魔剪”的CRISPR/Cas9技术。自2012年Jennifer Doudna和Emmanulle Charpentier在Science发表里程碑式论文,共同解析了CRISPR/Cas9基因编辑的工作原理;2013年张锋在Science发表论文,首次将CRISPR/Cas9基因编辑技术改进并应用于哺乳动物和人类细胞以来,这项便捷、高效的基因编辑技术被广泛应用于生物医药医学研究。
不过,CRISPR/Cas9基因编辑技术也面临着阻碍其进入临床应用的巨大挑战——如何准确地找到靶点并完成精确的切割和精准的编辑。为此,张峰的校友、同样是CRISPR技术的大牛,David Liu(刘如谦)在2016年在实验室开发出了单碱基编辑器(Base Editor),能够在不造成DNA双链断裂的情况下,实现C→T(或G→A)的碱基替换,不仅提升了编辑效率,还降低了脱靶效应,而且,这更适用于普遍存在的点突变情况。此即为胞嘧啶碱基编辑器(CBE),腺嘌呤碱基编辑器(ABE)、鸟嘌呤编辑器(GBE)和先导编辑器(Prime Editor)则是另外三种单碱基编辑器。
围绕单碱基编辑技术,刘如谦、张锋和J. Keith Joung在2017年共同创立了基因编辑公司Beam Therapeutics。Beam是三人继基因治疗遗传病公司Editas Medcine和基因编辑农业公司Pairwise Plants之后一起创立的第三家基因编辑领域公司。
Beam自成立以来,可谓顺风顺水,2018年5月就完成了8700万美元的A轮融资,2019年3月完成1.35亿美元的B轮融资,成立不到三年就成功在纳斯达克上市。近日,Beam又传来好消息,仅不到四个月,FDA就解除了对BEAM-201的临床暂停,并批准了其用于治疗复发/难治性T细胞急性淋巴细胞白血病(T-ALL)/T细胞淋巴细胞淋巴瘤(T-LL)的研究性新药申请,受此消息影响,Beam股价在盘前上涨了约6%。
BEAM-201是一种多重碱基编辑的特异性抗CD7 CAR-T细胞研究疗法,CD7是一种在T细胞上表达的蛋白质。目前FDA所批准的CAR-T都来自患者自身的细胞,这将限制该疗法的时间效率并导致高昂的成本。BEAM-201希望通过多重碱基编辑同时沉默多个靶基因来摆脱CAR-T疗法当前的限制,实现其细胞疗法的完全异体化,同时保留其普遍相容性和抵抗宿主排斥的能力。
在8月下旬提交的SEC报告中,Beam透露了FDA搁置BEAM-201临床试验的原因:监管机构要求从基因组重排研究中获得额外的控制数据,以及对脱靶编辑实验的进一步分析。监管机构还需要更多用于特定细胞因子非依赖性生长测定的控制数据,并要求提供更新的研究人员手册,提供任何新的非临床研究信息。
Beam在11月初发布的第三季度财务报告中指出,已经对FDA的要求作出了回应。Beam的首席执行官John Evans对于这次FDA解除暂停表示:“这对于Beam和基因编辑领域来说,都是一个激动人心的时刻。”此次FDA解除BEAM-201的临床暂停,标志着“多重碱基编辑研究药物的首个IND批准。”“BEAM-201结合四种高效的独特编辑器,将有望对患有T细胞癌的患者产生重大影响,目前这些患者缺乏针对性的治疗选择。期待在2023年提供该项目后续的最新信息。”
目前,Beam已经建立了十余条产品管线,其中体外疗法进展较快,分别是治疗镰状细胞病和β-地中海贫血的BEAM-101、治疗镰状细胞病的BEAM-102、以及治疗急性T淋巴细胞白血病和CD7阳性急性髓细胞白血病的BEAM-201。
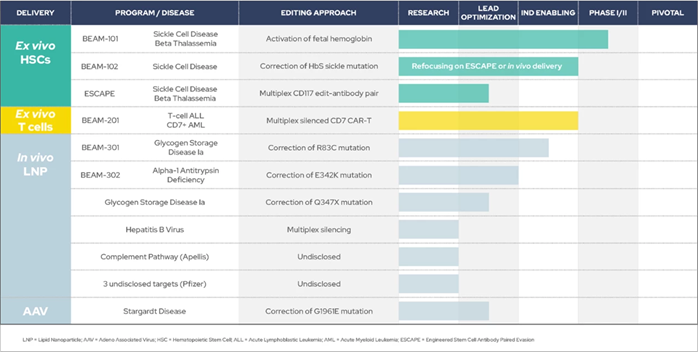
Beam Therapeutics产品管线(图源:Beam Therapeutics官网)
今年11月,同样遭遇了IND暂停的还有基因编辑治疗上市公司Verve Therapeutics。被暂停的是其在研碱基编辑疗法VERVE-101,用于治疗杂合子家族性高胆固醇血症,通过碱基编辑器一次性永久地关闭肝脏中的PCSK9基因表达,从而减少低密度脂蛋白胆固醇的含量。该疗法中的碱基编辑技术来自Beam的专利授权许可。目前Verve还尚未透露FDA暂停VERVE-101的原因,但有了Beam解除暂停的成功案例,可以期待Verve也将在短期内获得IND批准。
而以CRISPR/Cas9为核心技术的Editas Medicine正在进行的EDIT-101的I/II期BRILLIANCE临床试验,虽然所有的剂量组都显示出良好的安全性,但由于达到反应阈值的人数较少,Editas暂停了BRILLIANCE试验的招募,并寻求合作伙伴继续开发EDIT-101。EDIT-101是一种体内CRISPR/Cas9基因组编辑药物,用于治疗Leber先天性黑蒙10导致的失明,是Editas当前临床进展最快的项目。
不论是FDA的临床搁置,还是Editas的主动暂停,都体现出业界对于基因编辑疗法的谨慎态度。不过,随着这一领域层出不穷的新方法不断涌现,相信很快可以看到基因编辑技术给患者带去希望的那一天!
End
参考资料:
[1]https://www.biospace.com/article/fda-clears-first-ind-for-a-multiplex-base-edited-investigational-drug/
[2]https://www.globenewswire.com/news-release/2022/12/02/2566549/0/en/Beam-Therapeutics-Announces-FDA-Has-Lifted-the-Clinical-Hold-on-the-Investigational-New-Drug-Application-for-BEAM-201.html
[3]https://www.fiercebiotech.com/biotech/beam-sheds-more-light-clinical-hold-slapped-gene-edited-car-t
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)