首页 > 医疗资讯/ 正文
 摘要
摘要
输液给药是危重病人治疗的基石。本文的目的是重新评价输液给药的病理生理学,包括了与流量和压力指标交互作用有关的机制,对休克综合征的全身反应,不同类型的液体的影响和前负荷依赖的反应性概念。在这种情况下,前负荷、每搏量(SV)和输液给药之间的关系如下:输注的液体量必须足够大,才可增加静脉回流的驱动压,从而增加心脏舒张末期容积,只有当左右两心室的功能状态都在处于Frank-Starling曲线的陡峭部分时,舒张末期容积的增加才会导致SV的增加。因此,液体应该被当作药物来看待,液体的给药剂量和给药速度对最终结果均有影响。根据总输液量的滴定式液体治疗,同时也应关注所使用的液体类型是液体复苏的一个重要组成部分。目前尚没有一个单一的、可靠的、可行的生理或生化指标可用来确定SV变化和氧输送之间的平衡(即耦合“宏观”循环和“微”循环),这使得急性循环功能障碍的诊断主要是根据临床上的诊断。
小结
– 液体是用于休克患者以增加其心输出量的药物,目的是改善对细胞的氧供。对液体给药的反应是由心功能和静脉回流的生理交互作用决定的。在脓毒症休克中,液体给药的有益临床反应在几小时后迅速减少,液体给药量的滴定对避免有害的液体过负荷至关重要。液体冲击是以一定的速度把一定的液体量快速给患者输注,以评估其液体反应性。
– 危重病人理想的液体并不存在;但晶体应作为首选。平衡晶体溶液可能与更好的预后有关,但证据级别仍然很低。对于已经进行了液体复苏,并且有液体过负荷风险的患者,输注白蛋白可能有用。
- 液体给药被整合到压力和流量这些“宏观”血流动力学指标的复杂管理中,并与“微观”局部组织流量分布和局部新陈代谢结合。宏观指标是通过测量全身血压和评估整体心功能来管理的。细胞的氧供临界阈值很难估计,但可以考虑把一些指标和临床体征作为其替代指标,并整合到床旁决策流程中。
背景
输液给药是危重病人治疗中最常见但也是最有争议的治疗干预之一。更有争议的是如何评估和管理对液体给药的反应(根据流量和压力指标),从平常的“仅仅输液”到快速液体冲击,再到补液药前先评估患者对液体的反应性,最后是基于机器学习和人工智能的旨在个体化使用液体治疗的最新方法。
许多ICU患者都会发生休克,休克表现为一种危及生命的临床状况,需要及时识别和治疗,以提供足够的组织灌注,从而向细胞提供足够的氧。一项对1600多名因休克而进入ICU并需要血管升压药的患者的大型试验表明,脓毒症休克是最常见的休克类型,发生在62%的患者中,而心源性休克(16%)、低血容量性休克(16%)和其他类型的分布性休克(4%)或梗阻性休克(2%)较少发生。该综合征的进展与线粒体功能障碍和细胞信号通路的失调有关,可导致多器官损害和衰竭,最终导致无法治疗的血流动力学不稳定和死亡。
休克的最佳治疗是存在时间依赖性的,需要及时和充分的液体和/或血管升压药的联合支持治疗。由多项生理学和临床研究得出的有力证据支持的基本原理就是改善氧供(DO2),从而满足全身的氧需求。氧供被定义为血氧含量和心输出量(CO)的乘积。病理性细胞氧耗是由于组织氧需求超过DO2或组织不能利用O2。在过去的几十年中,我们对休克机制的认识有所提高,临床实践从过去“一刀切”政策转向个体化治疗。
对于急性循环衰竭的危重病人,补液是一线治疗,目的是增加静脉回流、每搏量(SV),从而增加CO和DO2。液体复苏后CO的增加对血压的影响不是线性关系的,而是与基线条件有关(参见"Fluids and ICU outcomes: does thetype of fluid matter?")。
Thomas Latta 在1832年给《柳叶刀》编辑的一封信中首次描述了应用液体复苏技术来治疗休克发作。他多次给一位老年女性患者输注晶体液,观察到第一次注射后没有产生任何临床相关的效果;然而,在多次注射(总共2.8升)后,“以下这些很典型的,眼睛凹陷,下巴下垂,苍白而冰冷,标志着死神印记的特征,开始发生转变,焕发出活力来;手腕上重新出现了脉搏”。这位女士最终就是文献报道的第一位液体治疗应答者。
这是个极有说服力的例子,讲述了几个生理和临床问题,这些问题在近200年后今天仍然有效:
CO是心功能(由Otto Frank和Ernest Starling在100多年前的观察描述)和静脉回流(基于Guyton提出的静脉容量血管的弹性回缩、容量扩张静脉、静脉顺应性和静脉系统阻力之间的关系)生理交互作用的因变量。存在液体反应性表明患者的心脏在Frank-Starling心功能曲线的陡峭部分运行,而不存在液体反应性则出现在曲线的平台部分,前负荷的增加不会进一步增加CO。Latta医生治疗的女士对第一次液体注射没有反应,可能是因为输注的液体量还不足以增加静脉回流(即引起与静脉顺应性相关的张力性容量的变化)。因此,输液量是一个至关重要的因素。最新的拯救脓毒症运动指南再次建议对脓毒症患者给予至少30ml/kg体重的初始液体量,这被认为是安全有效的平均目标量。然而,由于液体治疗的目标是增加SV,从而增加CO,只有当患者的心功能尚未达到曲线的平台时,才应给予输液。事实上,甚至可能在达到曲线平台这一点之前,不能增加CO的液体给药都可以被认为是徒劳。液体冲击(FC)是一种血液动力学诊断测试,快速给予输注一定量的液体,目的是识别存在液体反应性的患者,在液体输入时CO随之增加。这种方法使得液体治疗可以进行个体化滴定,并降低液体过负荷的风险,这会影响患者的临床结局和死亡率。
在临床实践中,对FC之后出现有益的临床反应的可能性,随着脓毒症休克复苏开始数小时后很快就降低,在没有血流动力学监测和复苏目标(即CO增加到预定阈值以上)的前提下,这使得液体治疗的优化相当复杂。
对于有液本反应性的休克患者,在给予液体治疗后常伴随着明显的器官灌注恢复的迹象。因此,自1832年以来,在休克期间给予输液并在床边观察患者的临床改善情况被证明是合理的。目标很重要吗?尚没有一个单一的临床或实验室指标可以简单地反映组织灌注状态。因此,提出了一种多模态评价方法。当确定一个指标作为液体复苏的潜在触发指标或目标指标时,应考虑几个方面,但最重要的是,该指标必须是流量敏感性的。这意味着需要选择一个对全身血流量和/或灌注压的增加表现出几乎实时响应的指标,并且可能适合于评估快速治疗的效果的,例如在非常短的时间内(例如,15分钟)进行快速液体输注。持续性高乳酸血症可能不是一个启动液体治疗的充分的触发因子,因为它有多种原因所致,包括一些在许多患者中与灌注无关的原因[例如:肾上腺素能亢进或肝功能障碍],因此,一味地追求乳酸正常化可能会增加液体过负荷的风险。事实上,最近的一项研究显示,在最终存活的脓毒症休克患者队列中,50%的患者血乳酸水平仍然是升高的。相反,一些流量敏感性指标,如:外周血灌注、中心静脉血氧饱和度、中心静脉-动脉二氧化碳分压差等指标,几乎80%的患者在2小时内恢复正常。以毛细血管再充盈时间(CRT)为代表的外周灌注指标,似乎是一个符合生理学的,可以作为液体复苏的触发因子和复苏目标。大量有力的证据证实,在早期或晚期复苏后出现的外周灌注异常,与发病率和死亡率的增加有关。皮肤湿冷、花斑和CRT延长被认为是脓毒症休克患者液体复苏的触发因素。此外,正常的CRT(或CRT恢复正常)与良好的预后相关、对液体负荷的反应时间快、简单易行、在资源匮乏的情况下也可行、与生理相关区域(如肝内脏局部)的灌注平行变化的能力,这些都是强烈支持将CRT作为脓毒症休克患者液体复苏目标的理由。最近的一项大型随机对照试验(RCT)表明,以CRT为导向的复苏与以乳酸为导向的复苏相比,死亡率更低,器官功能障碍更少,治疗强度更低,包括复苏液量更少。脓毒症休克的特点包括血管张力降低,影响小动脉和小静脉,产生心肌抑制,局部血流分布和微血管灌注改变,血管通透性增加。此外,宏观循环、微循环均受到生理学上的调节,以维持平均动脉压(MAP),使CO能够满足局部组织血流分布,这与局部代谢有关。从临床的角度来看,一旦器官灌注达到正常,再通过补液或给予血管升压药来增加宏观血流动力学指标(MAP和CO)的理由是相当弱的。
Latta医生治疗的这位女士“手腕恢复脉搏”,提示着流量和压力在其体内发生了关联。在日常实践中,低血压经常被用来触发启动液体治疗。MAP目标也被许多ICU医生用作停止补液的指标。这一假设在许多方面是有缺陷的。首先,把MAP恢复到预定目标之上并不一定意味着能逆转休克;同样,MAP值低于预先设定的阈值并不一定意味着存在休克。其次,更重要的是,SV的变化与MAP的变化之间的生理关系并不直接相关,而是取决于血管张力和动脉弹性。在高血管舒缩张力的患者中,输液后SV的增加将与MAP的增加相关。这在单纯低血容量的患者中非常典型,如失血性休克患者,对出血的生理反应包括严重的静脉和动脉收缩。在低血管舒缩张力的患者中,如脓毒症和深度麻醉期间的患者,尽管在补液后SV可能显著增加,但MAP几乎没有变化。MAP与SV之间缺乏明显的相关性已在许多ICU患者中被证实,尤其是在脓毒症休克期间。有趣的是,动态动脉弹性(用呼吸导致的脉压变化值除以SV的变化值来进行计算)可以用来识别那些可能因其对体液有反应而增加MAP的患者,但这需要特定的监测工具。最后,我们应该记住,液体给药的主要目的是增加组织灌注,因此,输液后MAP的变化被认为是有益的,但不应被当作液体治疗的主要目标。
由于人体生理学在几个世纪以来一直保持一致,流量和压力相互作用的机制、这些变量对休克综合征的系统反应、液体治疗的效果以及前负荷依赖性和前负荷反应性的概念就仍然有效。本文旨在将这些物理概念与ICU患者液体治疗的三个主要病理生理学方面的最新进展相结合。
液体冲击、液体推注和液体输注:给药速度有关系吗?
根据Frank-Starling定律,前负荷(舒张末期跨壁压)与其所产生的SV之间存在曲线关系,而SV受心肌收缩力状态的影响(对于给定的前负荷,心肌收缩力增强会增加SV,反之亦然)。该曲线可分为两个部分:(1)陡峭的部分,在该区域内前负荷略有增加就可导致SV显著增加(前负荷依赖区);(2)平坦的部分,在该区域内SV受前负荷变化的影响最小或不受影响(前负荷非依赖区)。
所描述的前负荷、SV和液体给药之间背后的生理学联系是,输注的液体量必须足够多,以增加静脉回流的驱动压,只有当左右两个心室都处在Frank-Starling曲线的陡峭部分时,舒张末期容积的增加才会导致SV的增加。因此,可以将FC定义为有效地冲击系统所需的最小液体容量。因此,在循环系统休克复苏时输液的唯一原因就是提升平均系统压,以增加静脉回流的驱动压(定义为平均系统压减去右房压),正如最近一项前瞻性研究所见,该研究探讨了脓毒症患者对复苏反应的心血管决定因素。如果给予的液体量足够多和输注速度足够快,大多数FC将会增加平均系统压,如下所述。然而,右房压的同时增加表明受试者没有容量反应性,他们的前负荷反应状态需要重新评估。
把FC当作一种药物(例如:应用药效学方法来研究其反应性)已成为少数几项研究的主题。第一项小型研究是由Aya在术后患者中进行的,证实了有效的FC所需的最小液体量为4ml/kg。但在文献报道中,绝大多数对ICU患者液体反应性和FC反应领域的研究都采用500ml液体量(平均),对绝大多数ICU患者来说,所给液体量远大于4 ml/kg。有趣的是,在FENICE研究中(一项包括46个国家311个中心的观察性研究),500ml液体也是临床实践中补液量的中位数,而较低的平均容量(250ml)则通常用于接受目标导向治疗优化的高风险的外科患者。这一差异可能暗示了更大的快速补液量通常不仅用于评估液体反应性,也用于治疗血流动力学不稳定的发作,提示了液体给药的治疗效果。然而,反复给予快速补液可能会增加液体过负荷的风险,在进行FC之前进行液体反应性预测也是一个关键点,不幸的是,这显然还存在很大的困难。事实上,在临床实践中采用的几种床边可观察到的临床体征、系统压力和静态容量指标,对FC补液效果的预测性较差。为了克服这些局限性,床旁功能性血流动力学评估已越来越流行,包括影响心功能和/或心肺交互作用的操作,这些操作手法可引起随后的血流动力学反应,其反应程度在液体应答者和非应答者之间会有所不同。
最近,与FC给药有关的各个方面都已有相关研究,表明补液量、补液速度和定义液体反应性的阈值对FC的最终结果均有影响。一项RCT显示,FC补液的持续时间对液体反应性的比例有影响,同样是4 ml/kg体重的液体量,输注时间10分钟的FC出现液体反应性的比例为51.0%,而输注时间为20分钟的FC仅有28.5%的液体反应性。然而,这项研究是在血液动力学稳定期的神经外科手术患者中进行的,这就限制了其结果延展到不同外科疾病患者或危重患者中的有效性。
在不使用FC技术的情况下给予快速输注液体时,最佳输液速度是多少?人们认为,由于静水压力不会突然增加,较慢的流速可能会限制血管渗漏。最近,一项大型多中心试验将10520名患者随机分为两组:一组是以符合当前治疗标准的输液速度接受输液[输液剂量为500ml,时间约为30分钟,即输液泵输液速度的上限(999ml/小时;16ml/分钟)],另一组是以较慢的输液速度(333ml/小时;5.5ml/分钟)接受输液,后者输液速度比FENICE队列研究中小于25%。重要的是,本试验采用的输液速度总体上比采用FC技术来纠正血流动力学不稳定的临床研究的输液速度(即:10分钟内输500ml=50ml/分钟;20分钟内500ml=25ml/分钟)要慢,这表明作者应用了快速液体输注,只是用了不“正确”的速度。两组在ICU住院期间的主要结果(90天死亡率)和所有次要临床结果均无差异,提示持续补液扩容的输液速度并不影响临床结果。这并不出乎意料,因为只有给药输液速度不同,而液体总量相同,两组中存在容量反应的患者比例可能也是相似(即使没有监测,根据大组随机化的效果,这一比例被认为相同)。
液体和ICU预后:液体的类型重要吗?
对于休克患者,理想的液体成分应与血浆相似,以促进细胞代谢,避免器官功能障碍,并能够实现血管内容量的持续增加,以优化CO。不幸的是,并没有理想的液体存在。可供选择的液体大致分为三类:晶体类、胶体类和血液制品。后者几乎没有非常具体的输注指征,包括创伤患者的休克和失血性休克,不在本文讨论。
胶体是由大分子组成,可以在血管内停留几个小时,增加血浆渗透压,减少对液体的进一步需求。尽管它们存在理论上的优势,但脓毒症患者常常存在糖萼改变和内皮通透性增加,这可能导致胶体大分子外渗,增加全身渗漏综合征的风险,并抵消了胶体的主要优势。胶体又分为半合成胶体和白蛋白。半合成胶体包括羟乙基淀粉、右旋糖酐和明胶,它们要么没有效果,甚至给危重病人带来有害的后果,增加急性肾损伤(AKI)的风险。因此,半合成胶体在休克患者中的应用应该被抛弃。
白蛋白分布于血管内液和血管外液体中。在健康状况下,每小时有高达5%的血管内白蛋白漏出到血管外间隙[经毛细血管逸出率(TER)],其分布的半衰时间约为15小时。脓毒症休克时,这一比率可能会增加到20%或更多。因此,所测得的白蛋白漏出到组织的TER(所谓的“TCERA”)被称为“血管通透性”指数。
白蛋白在液体治疗中的作用仍有争议。尽管其抗炎和抗氧化的特性被认为是有前途的,同时由于其表面负电荷与血管内糖萼之间的相互作用,使其在血管内的停留时间更长,但临床数据一直都是相互矛盾的。虽然白蛋白的使用与MAP的改善有关,但其相对死亡率风险与晶体相似。对SAFE研究的预定义亚组分析显示,创伤性脑损伤患者应避免使用白蛋白。相反,对慢性肝病患者推荐输注白蛋白治疗,对肝肾综合征患者推荐白蛋白联合特利加压素治疗。最新版的拯救脓毒症指南也建议在接受大量晶体液复苏的患者中使用白蛋白。
液体治疗的另一方面,晶体液由水和电介质组成。0.9%盐水是第一个用于人体的晶体溶液。它的缺点是氯和钠的非生理浓度和高渗透压,这与肾毒性和高氯性酸中毒有关。细胞外氯化物影响入球小动脉的张力,直接影响肾小球滤过率(GFR)。因而有几种平衡晶体液被引入临床,例如乳酸林格氏液,醋酸林格氏液和Plasma-lyte。这些溶液具有较低的氯浓度和较低的渗透压(在280-294mosm/L之间),并经过乳酸盐或醋酸盐缓冲从而保持了电中性。在健康成年志愿者中,输注2升0.9%盐水与输注2升平衡晶体液对比,盐水组尿中的水钠排泄明显减少。
最近的几项RCT评估了平衡溶液与0.9%盐水在危重病人中的效果(表 1)。在4家ICU中进行的SPLIT研究显示,两组患者均无获益。SMART研究是一项单中心研究(在1个医学中心的5个ICU中进行),在入住ICU的危重病人中把Plasma-lyte液和生理盐水进行对比。在综合预后MAKE30指标(由30天内任何原因死亡、新的肾脏替代治疗或30天内持续肾功能不全组成)方面,Plasma-lyte液组优于生理盐水组,具有显著性差异。PLUS研究(把Plasma-lyte148与生理盐水对比的研究)是一项盲法RCT,纳入了5037例预计在ICU停留至少72小时且需要液体复苏的的成年患者。创伤性颅脑损伤或有脑水肿风险的患者除外。结果发现两组之间的90天死亡率或AKI发病率并无显著差异。同样,BaSICS研究,这是一项在ICU中应用平衡溶液的研究,在巴西的75家ICU中进行的多中心双盲RCT,共纳入了11052例患者,把Plasma-lyte1与生理盐水进行对比,发现两组间的死亡率或肾脏结局均无显著差异。一项最新的对13项高质量RCT(包括Plus和Basics研究)的Meta分析显示,平衡晶体液组的住院死亡或28/30天死亡率更低,下降幅度达1%-9%,AKI的风险也有类似的降低。
研究不同类型晶体液对最终结果的影响的试验,可能与患者入组前的液体输入量和所用的液体类型有关,这可能是其中的混杂因素。事实上,对BaSICS研究进行二级事后分析,根据入组前24小时内使用的液体量和液体类型,把入组的患者进行分类,结果显示完全接受平衡晶体溶液的患者90天死亡率降低的可能性很大。
表1.近年发表的RCT,把生理盐水和平衡晶体液进行比较
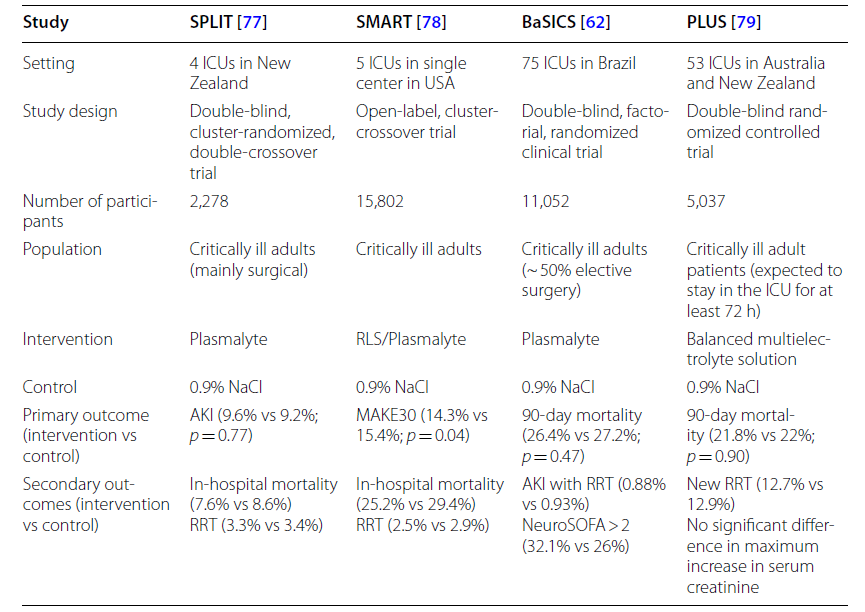 RLS 乳酸林格氏液,AKI 急性肾损伤,MAKE30 由30天内任何原因引起的死亡、新的肾替代治疗或持续肾功能不全组成,RRT 肾替代治疗,SOFA 序贯器官衰竭评分
RLS 乳酸林格氏液,AKI 急性肾损伤,MAKE30 由30天内任何原因引起的死亡、新的肾替代治疗或持续肾功能不全组成,RRT 肾替代治疗,SOFA 序贯器官衰竭评分
总的来说,与富含氯的溶液相比,平衡晶体溶液在脓毒症治疗中可能会改善预后,目前还缺乏把平衡晶体溶液和富含氯的溶液进行成本效益分析比较的研究,因此推荐(弱推荐)平衡晶体溶液作为脓毒症休克患者的一线液体类型。
急性循环衰竭时的补液反应
在急性循环衰竭早期及早进行及时的液体复苏是一项重要的干预措施。另一方面,对于已经接受了复苏治疗的患者,可用来提示是否停止(继续)液体复苏的血流动力学目标和液体量安全范围的指标仍相对不明确,并且很难根据具体的患者反应进行滴定。然而,有针对性的液体管理对于改善血流动力学不稳定的ICU患者的结局至关重要,因为低血容量和高血容量都是有害的。急性循环功能障碍常需要液体复苏,目的是优化CO以改善氧供。然而,目前尚无一个单一的、可靠的、可行的生理或生化指标来确定CO和氧供变化之间的平衡(即耦合“宏观”循环和“微”循环),使急性循环功能障碍的诊断以临床为诊断主。
然而,在认识到CO本身的价值或跟踪其在补液之后的变化,可以发现其与常用的床旁评估指标的相关性很差。事实上,ICU医生根据临床检查估计精确CO值的能力相当低,在42-62%的病例中,经常出现不一致的评估(即估计CO增加,而实际CO减少,反之亦然)。
在过去的几十年里,超声心动图在ICU中的作用发生了变化,越来越多地关注单个患者的特征。CCE(重症心脏超声)由ICU医师在床旁执行并解读,随时都可以进行,它用助于休克类型的诊断,并根据休克类型进行治疗,最后通过再次评估所采用的策略,从而指导床边治疗。由于技术问题(机器便携性和可用性)以及缺乏针对CCE的正式培训计划,使得CCE的普及遇到了阻碍。最近,随着技术的进步,在床边就可以获得高质量的图像,同时欧洲危重病医学会、美国加拿大超声医学会制定了新的技能认证指南和培训标准,填补了上述空白。CCE现在应该被考虑作为ICU血流动力学不稳定患者常规评估的一部分,因为心功能评估在治疗中起着核心作用。
CCE加强了血流动力学不稳定患者的临床评估,但它应该与临床指标相结合,用于评估氧供与氧耗是否匹配。事实上,尽管氧供“临界”值的确切值很难评估,但克服这个阈值的系统效应是可以被识别的。
CRT(毛细血管再充盈时间)是测定指尖受压变白后重新恢复红润色泽所所需要的时间。由于该操作有赖于施加的压力,Ait-Oufella建议施加一个恰好的压力使患者指端甲床无血色,在甲床下表现一个白色的新月形区域,持续15秒。开始液体复苏6小时后的CRT是14天死亡率的强预测因子(曲线下面积为84%[IQR:75-94])。Hernandez报道称复苏6小时后,CRT<4秒与复苏成功相关,与发生严重脓毒症/脓毒症休克24小时后乳酸水平恢复正常有相关性。一项前瞻性队列研究,纳入了1320名在急诊室就诊的低血压成人患者,研究显示CRT与住院死亡率之间存在相关性。
血乳酸是一种更客观的代谢指标,可用于指导液体复苏。无论乳酸来源如何,乳酸水平升高都与更坏的结局有关,与不采用乳酸监测为导向的复苏相比,以乳酸为导向的的复苏显著降低了死亡率。由于血乳酸不是组织灌注的直接指标,单个血乳酸值比乳酸清除趋势提供的信息要少。然而,血乳酸正常化表明休克逆转,而严重的高乳酸血症与极差的结局相关。最近发表的文章表明,ICU中乳酸水平>4 mmol/l伴低血压的严重脓毒症/脓毒症休克患者的死亡率为44.5%。例如,一项大型回顾性研究表明,ICU中严重高乳酸血症(乳酸>10mmol/L)患者的死亡率为78.2%,如果高乳酸血症持续超过24小时,死亡率将上升至95%。
中心静脉血氧饱和度(ScVO2)反映了氧供与氧耗之间的平衡,它可作为混合静脉血氧饱和度(SVO2)的替代指标(通常ScVO2比SVO2低2-3%)。它以前被当作治疗脓毒症休克早期阶段的一个治疗目标,但是被随后的三个大型多中心RCT的阴性结果发起了挑战,现不再推荐。然而,与Rivers的研究相比,ARISE、PROMISE和PROCESS这三大试验可能纳入了病情不太严重的危重病人(例如:入组时基础乳酸水平较低、ScVO2已处于或高于目标值,对照组的死亡率更低),脓毒症休克早期低ScVO2能恢复正常仍被当作成功复苏的良好目标。虽然当前实践中低ScVO2的发生率很低,但高ScVO2的持续存在与脓毒症休克患者的死亡率相关,可能提示存在细胞对氧摄取的不可逆性损伤。
中心静脉血-动脉血二氧化碳分压差(在此以△PCO2表示)与ScVO2可给我们提供辅助性临床信息。它可经中心静脉导管抽取中心静脉血、以及抽取动脉血分别作血气分析测得,△PCO2与混合静脉血-动脉血二氧化碳分压差(在此以Pv-aCO2表示)具有很好的一致性,混合静脉血可经肺动脉导管获取,Pv-aCO2=PvCO2-PaCO2。这一点很关键,因为过去几项分析休克时P(v-a)CO2变化的研究结果强调,测定中心静脉血的PCO2来替代混合静脉血的结果仍然是有用的。在健康人群中,△PCO2范围是2-6mmHg。
影响这一指标的病理生理学背景比较复杂,因为在休克状态下△PCO2变化和反映组织灌注的其它指标是耦联的。首先,根据修正的Fick方程,△PCO2与二氧化碳生成呈线性相关,与CO呈负相关。多项临床研究证实CO与P(v-a)CO2之间,以及微循环灌注损伤与组织PCO2之间均有密切相关性。因此,△PCO2升高可能是因为低CO所致,也可能是在CO充足的状态下组织仍处于低灌注,微循环不足以清除更多的CO2。
这些情况可以通过整合从△PCO2和ScVO2获得的信息来进一步研究。事实上,高△PCO2合并低ScVO2提示CO过低,而正常/升高的ScVO2合并高△PCO2提示组织灌注受损。因此,对于正常△PCO2(<6 mmHg)的休克患者,其下一步处理不应是增加CO;相反,在CO正常/升高的情况下,局部血流也可能受损。
 图1. 发生急性循环衰竭时,床旁使用决策流程指导和滴定液体给药治疗。CCE 重症超声心动图,CO 心输出量,CRT 毛细血管再充盈时间,FC 液体冲击,△PCO2 中心静脉-动脉二氧化碳分压差,ScVO2 中心静脉血氧饱和度。
图1. 发生急性循环衰竭时,床旁使用决策流程指导和滴定液体给药治疗。CCE 重症超声心动图,CO 心输出量,CRT 毛细血管再充盈时间,FC 液体冲击,△PCO2 中心静脉-动脉二氧化碳分压差,ScVO2 中心静脉血氧饱和度。
所有这些方面都可以整合到决策流程中去,流程还把低灌注的临床体征与CCE评估相结合(图1)。对全身低灌注体征的床旁识别就可启动液体复苏治疗,以优化CO和改善氧供。我们选择把液体当作药物来看待,也就意味着只有它可能会增加患者CO时才去使用它。在急性循环衰竭的复苏阶段就应监测液体反应性,这可以通过应用“闭环”手法策略来实现,发现存在组织灌注不足的迹象和CCE评估出相关结果,在每次输注液体后都要再次评估。当心血管系统达到临床反应平台时,或者更早,当CCE在患者基线检查时显示急性或急性-慢性心功能障碍时,更复杂的监测工具是有用的。
结论
危重病人输液给药的生理学是ICU的重要环节。在心血管功能和全身反应动态和复杂平衡的坚实基础上,应把液体视为药物,ICU医师应认识其药效学和生化特性,以优化治疗。由于尚没有一个单一的能够充分评估CO和组织灌注之间平衡的生理或生化指标,因此需要一种多模态的方法。通过临床观察和有创血流动力学监测,将不同组织低灌注体征的改变整合在一起,并根据重症心脏超声对心脏功能的评估,就可以获得患者对液体治疗反应的评估。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)