首页 > 医疗资讯/ 正文
[摘要] 背景与目的:越来越多的研究表明长链非编码RNA(long non-coding RNA, lncRNA)在肿瘤的发生、发展过程中发挥着重要作用,然而大多数lncRNA在胃癌中的作用和机制尚不明确。LncRNA DLEU7-AS1在胃癌中的作用和机制的研究鲜见报道。本文旨在研究DLEU7-AS1对胃癌恶性表型的影响并初步探讨其分子机制。方法:采用癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库分析DLEU7-AS1在胃癌组织中的表达及其对胃癌患者生存期的影响。采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)验证DLEU7-AS1在胃癌组织及胃癌细胞系中的表达情况。采用5-氮杂-2’-脱氧胞苷(5-aza-2’-deoxycytidine,DAC)和曲古抑菌素A(trichostatin A,TSA)处理胃癌细胞株,分析表观遗传学调控对DLEU7-AS1表达的影响。采用小干扰RNA(small interfering RNA,siRNA)下调HGC-27、AGS细胞株中DLEU7-AS1的表达,采用重组质粒上调MGC-803和MKN-45中DLEU7-AS1的表达,采用RTFQ-PCR验证效果;采细胞计数试剂盒(cell counting kit-8,CCK-8)细胞增殖毒性实验、transwell小室迁移实验、平板克隆形成实验以及流式细胞术研究DLEU7-AS1对胃癌细胞增殖、迁移及凋亡和细胞周期的影响;采用RNA测序技术(RNA-sequencing,RNA-seq)分析沉默DLEU7-AS1后的下游信号转导通路的变化,并采用RTFQ-PCR和蛋白质印迹法(Western blot)进行验证;采用RNA免疫共沉淀实验(co-immunoprecipitation,RIP)探讨DLEU7-AS1对下游信号分子的调控机制。结果:TCGA数据库分析及RTFQ-PCR检测均证明DLEU7-AS1在胃癌中表达升高。DLEU7-AS1的表达与胃癌患者生存期呈负相关。DAC和TSA处理胃癌细胞株后,DLEU7-AS1表达上调,说明其表达受表观遗传学调控。沉默DLEU7-AS1抑制胃癌细胞增殖、迁移,促进细胞凋亡;过表达DLEU7-AS1促进胃癌细胞增殖、迁移,抑制细胞凋亡。RNA-seq结果表明,DLEU7-AS1表达下调后会导致膜突蛋白(moesin,MSN)表达量的显著降低,RTFQ-PCR及Western blot的结果验证了这一结论。Rescue实验结果进一步证实,过表达MSN可部分回复干扰DLEU7-AS1对胃癌细胞增殖和迁移的抑制作用,提示MSN可能作为DLEU7-AS1下游效应分子。DLEU7-AS1主要定位在细胞核中,DLEU7-AS1与P300结合以及MSN启动子附近的H3K27的高度富集。结论:LncRNA DLEU7-AS1在胃癌中高表达并且其表达与胃癌患者生存期呈负相关,DLEU7-AS1可能通过招募P300调控MSN的转录进而促进胃癌的增殖和迁移等恶性表型。
[关键词] 胃癌;DLEU7-AS1;膜突蛋白;表观调控;增殖;迁移
[Abstract]Background and purpose: An increasing number of studies have demonstrated that lncRNA plays a critical role in the occurrence and development of tumors. However, the function of lncRNA in human gastric cancer remains largely unknown. So far, the role and mechanism of lncRNA DLEU7-AS1 in gastric cancer have not been reported. This study aimed to investigate the effect of DLEU7-AS1on the tumorigenesis and progression of gastric cancer and its mechanism. Methods: The public database the Cancer Genome Atlas (TCGA) was used to analyze the expression of DLEU7-AS1 in gastric cancer tissues and the correlation between its expression and the survival of gastric cancer patients. Then real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) was performed to verify the expression of DLEU7-AS1 in gastric cancer tissues and gastric cancer cell lines. Gastric cancer cell lines were treated with 5-aza-2’-deoxycytidine (DAC) and trichostatin A (TSA) to explore whether epigenetic regulation participated in DLEU7-AS1 transcription. SiRNA was used to down-regulate the expression of DLEU7-AS1 in HGC-27 and AGS cells, and recombinant plasmid was used to up-regulate the expression of DLEU7-AS1 in MGC-803 and MKN-45. The effect was verified by RTFQ-PCR. Cell biological experiments, such as cell counting kit-8 (CCK-8) cell proliferation toxicity test, transwell chamber assay, plate colony formation assay and flow cytometry were used to investigate the effect of DLEU7-AS1 on the proliferation, migration, apoptosis and cell cycle progression of gastric cancer cells. RNA sequencing (RNA-seq) was used to analyze downstream signal pathways after silencing DLEU7-AS1 and tested by RTFQ-PCR and Western blot. And RNA Co-immunoprecipitation (RIP) was used to explore the regulatory mechanism of DLEU7-AS1 on downstream signal molecules. Results: The results of public database analysis and RTFQ-PCR demonstrated that DLEU7-AS1 was up-regulated in gastric cancer tissues compared with normal tissues. DLEU7-AS1 expression was negatively correlated with the survival of gastric cancer patients. DLEU7-AS1 was up-regulated in gastric cancer cell lines treated with DAC and TSA, indicating that its expression was epigenetically regulated. DLEU7-AS1 downregulation inhibited gastric cancer cells proliferation and migration and promoted cell apoptosis, while overexpression of DLEU7-AS1 promoted cell proliferation and metastasis and inhibited cell apoptosis. The results of RNA-seq showed that the downregulation of DLEU7-AS1 expression led to a significant decrease in moesin (MSN) expression, which was confirmed by RTFQ-PCR and Western blot. Rescue experiment results further verified that MSN overexpression could partially restore the inhibition effect of knockdown of DLEU7-AS1 on the proliferation and migration of gastric cancer cells. Considering that DLEU7-AS1 mainly located in the nucleus, DLEU7-AS1 binding to P300 and H3K27 highly enriched near the MSN promoter, it was proposed that DLEU7-AS1 might regulate the expression of MSN by recruiting P300, thus contributing to the proliferation and migration of gastric cancer cells. Conclusion: LncRNA DLEU7-AS1 is abnormally up-regulated in gastric cancer and negatively correlated with survival of gastric cancer patients. DLEU7-AS1 may promote the proliferation and migration of gastric cancer by recruiting P300 to regulate the transcription of MSN, which provides a new idea for the diagnosis and treatment of gastric cancer.
[Key words] Gastric cancer; DLEU7-AS1; Moesin; Epigenetic regulation; Proliferation; Migration
胃癌作为第五大常见的恶性肿瘤,2020年全球新增确诊病例达1 089 103人,由于胃癌确诊时间较晚,死亡率在所有恶性肿瘤中位居第四,累计达768 793人[1]。胃癌高发于东亚、东欧和南美[2],在中国的发病率和死亡率也很高,每10万人中有20.6人患有胃癌,15.9人死于胃癌[3]。近年来胃癌的发病率和死亡率逐年下降[4],预计2022年新增胃癌病例51万,死亡病例40万[5]。尽管化疗、放疗和手术技术在胃癌治疗方面取得了重要进展,胃癌患者的生存率仍不令人满意。胃癌是一种分子和表型高度异质的疾病,因此研究与胃癌发生、发展相关的分子机制对胃癌的治疗预后有着重要作用。分子生物标志物的缺乏和胃镜检查的依从性差,导致大多数胃癌患者在晚期才被诊断,错过了治疗性手术的最佳机会。因此,新的分子标志物的发现对于该疾病的早期检测和预后预测至关重要。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 bp,绝大部分不参与编码蛋白的RNA分子。近年来,越来越多的研究[6-10]表明,lncRNA在基因表达的各个阶段发挥重要的调控作用。细胞核内lncRNA参与调控染色质结构、基因的转录和RNA的剪切[6]。LncRNA输出到细胞质后,参与调控mRNA的降解和运输以及蛋白质的翻译、稳定和组装等[6]。不仅如此,lncRNA与肿瘤[7-8]、心血管疾病[9]、神经退行性疾病[10]等疾病的发生、发展及预后也有着密切联系。
DLEU7-AS1(全长1 824 bp)是lncRNA分子中的一员,有研究表明其在肿瘤的发生、发展中发挥重要的作用。DLEU7-AS1可能是Wnt/β-catenin信号转导通路的重要分子,进而促进结直肠癌的增殖、侵袭和迁移[11];DLEU7-AS1可以通过沉默miR26a-5p/coronin-3轴来调节肾癌的生长和转移[12];此外,DLEU7-AS1还是急性髓系白血病(acute myeloid leukemia,AML)患者总生存期的独立预后因素[13]。本研究旨在通过运用分子生物学、细胞生物学等方法探讨DLEU7-AS1对胃癌发生、发展的影响和机制,为胃癌的辅助诊断和临床治疗提供新思路。
1 材料和方法
1.1 主要试剂和实验仪器
细胞用的DMEM高糖培养基、F-12/DMEM 1∶1培养基购自美国Hyclone公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,青-链霉素溶液(×100)、胰酶购自广州吉诺生物科技有限公司,1×磷酸缓冲盐溶液(phosphate-buffered saline,PBS)购自北京兰杰柯科技有限公司,LipofectamineTM3000转染试剂购自美国Thermo Fisher公司,Annexin V/7-AAD 凋亡试剂盒、细胞周期试剂盒购自美国BD公司,TRIzol Reagent购自美国Invitrogen公司,逆转录试剂盒购自日本TaKaRa公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自中国翌圣生物科技(上海)股份有限公司,十二烷基硫酸钠(sodium dodecylsulphate, SDS)蛋白裂解液、一抗稀释液、蛋白酶抑制剂购自中国碧云天生物技术有限公司。本研究所用到的抗体:膜突蛋白(moesin,MSN)抗体购自英国Abcam公司,β-actin抗体购自美国Sigma公司,ZO-1、ZEB-1、N-cadherin、vimentin、 β-catenin、claudin-1购自美国CST公司,二抗IRDye 800CW(抗兔IgG)和IRDye 680CW(抗鼠IgG)购自美国Li-COR Biosciences。小干扰RNA(small interfering RNA,siRNA)由上海吉玛制药技术有限公司合成,RTFQ-PCR引物由铂尚生物技术(上海)有限公司合成。
无菌超净台购自泰事达机电设备(上海)有限公司,高速离心机购自美国Eppendorf公司,细胞培养箱购自中国Heal Force公司,倒置显微镜购自日本Nikon公司,FACS Canto Ⅱ流式细胞仪购自美国BD公司,垂直电泳仪及膜转移装置购自美国Bio-Rad公司,Odyssey双色红外荧光成像系统购自美国LI-COR,PCR仪购自美国ABI公司,NanoDrop分光光度计购自美国Thermo Fisher公司。
1.2 胃癌细胞株及组织标本
胃癌细胞系BGC-823、SGC-7901、MGC-803、HGC-27、MKN-45、AGS均为上海交通大学医学院附属新华医院实验室保存细胞株。除AGS培养于F12/DMEM 1∶1培养基外,其他所有细胞系均使用含有10% FBS及1%青-链霉素溶液的DMEM高糖培养基培养,置于37℃、CO2体积分数为5%的细胞培养箱中培养。
胃癌组织及癌旁组织标本均来自上海交通大学医学院附属新华医院普外科接受手术的胃癌患者。收取新鲜的胃癌组织和对应癌灶5 cm以外的癌旁组织,并立即放入液氮中保存。该研究方案由上海交通大学医学院附属新华医院伦理委员会批准。该项研究获得了所有参与者的知情同意。
1.3 实验方法
1.3.1 数据库分析
利用癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库得到胃癌患者资料,分析DLEU7-AS1在32例正常组织及373例胃癌组织中的表达情况。利用Kaplan-Meier Plotter数据库(http://kmplot.com)分析DLEU7-AS1与胃癌患者预后的关系。
1.3.2 组织RNA提取
将保存在液氮中的胃癌/癌旁组织放入装满液氮的研钵中研磨;将研磨成粉末的组织放入15 mL离心管中,加入3 mL TRIzol,剧烈摇匀。加入600 μL氯仿,剧烈摇匀15 s,室温静置约5 min后,4℃、12 000 r/min离心15 min。吸取上清液至新的离心管,加入异丙醇1.5 mL,轻轻颠倒混匀5次,室温静置10 min后4℃、12 000 r/min离心10 min,弃上清液。加入3 mL 75%焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)乙醇,4℃、12 000 r/min离心5 min,弃上清液。根据沉淀量加入一定量的DEPC水,冰上溶解。使用NanoDrop分光光度计检测溶解后RNA的D260 nm/280 nm(1.8~2.0),记录浓度。立即置于-80℃或液氮保存,或者立即逆转录成cDNA保存。
1.3.3 细胞RNA提取
去除细胞板中的培养液,向12孔细胞板每孔加入1 mL TRIzol裂解细胞,充分吹打细胞,5 min后吸入1.5 mL Eppendorf试管中。向Eppendorf试管中加入200 μL氯仿,剧烈摇匀15 s,静置5 min后4℃、12 000 r/min离心15 min。将上清液移至新的Eppendorf试管,加入500 μL异丙醇,轻轻颠倒混匀5次,静置10 min后4℃、12 000 r/min离心10 min,弃上清液。加入1 mL 75%DEPC乙醇,4℃、12 000 r/min离心5 min,弃上清液。根据沉淀量加入一定量的DEPC水,冰上溶解。使用NanoDrop分光光度计检测溶解后RNA的D260 nm/280 nm(1.8~2.0),记录浓度。立即置于-80℃或液氮保存,或者立即逆转录成cDNA保存。
1.3.4 RTFQ-PCR
逆转录及RTFQ-PCR步骤严格按照产品说明书。使用PrimeScript逆转录试剂盒(日本TaKaRa公司),逆转录反应条件为37℃ 15 min;85℃ 5 s;4℃。使用Hieff PCR SYBR Green Master Mix试剂[中国翌圣生物科技(上海)股份有限公司],PCR反应条件为95℃预变性30 s;95℃ 5 s,60℃ 20 s,循环40次。每组设2个复孔,管家基因GAPDH作为内参。使用2-ΔΔCT进行不同组间基因表达差异比较。检测的基因包括DLEU7-AS1、MSN、GAPDH。引物序列见表1。

1.3.5 siRNA和质粒转染
采用siRNA沉默DLEU7-AS1,siRNA及对照序列见表2,由上海吉玛制药技术有限公司(中国)合成。转染前一天,将待转染的胃癌细胞株铺板于12孔板,转染时按LipofectamineTM3000试剂盒说明书配制转染混合液。去除原培养基,加入不含抗生素的培养液,然后加入转染混合液,充分混匀后放入37℃、CO2体积分数为5%的恒温培养箱中培养过夜。转染48 h后收集细胞进行后续实验。
过表达DLEU7-AS1用过表达质粒,由上海吉凯基因医学科技股份有限公司(中国)构建,插入DLEU7-AS1全长序列1 846 bp,载体名称GV417。转染步骤同siRNA。

1.3.6 细胞计数试剂盒(cell counting kit-8, CCK-8)细胞增殖毒性检测实验
将转染好的细胞(MGC-803、MKN-45、HGC-27、AGS)分至96孔板中,每孔2 500个细胞,每个细胞4个复孔。待细胞贴壁完全以后,每孔加入10 μL CCK-8,放入37℃、CO2体积分数为5%的恒温温箱中温育1 h后用酶标仪检测在450 nm处的吸光度(D)值。
1.3.7 平板克隆形成
将转染好的细胞消化、重悬、计数。按每孔1×104个细胞铺于6孔板中。待细胞完全贴壁后,按细胞类型加入不同浓度的遗传霉素(geneticin,G418)(美国Gibco公司)。2~3周以后待细胞形成肉眼可见的克隆后,采用4%的多聚甲醛进行固定,结晶紫染色、晾干并拍照。
1.3.8 Transwell小室迁移实验
将转染后的细胞消化并计数,重悬于1 mL 1% FBS DMEM培养液中(每毫升10万个细胞)。向transwell小室(需用DMEM free预处理30 min)中加入5×104个细胞,24孔板的小孔中加入700 μL含有10% FBS DMEM培养液。培养48 h后,用4%的多聚甲醛室温固定20 min,1×PBS冲洗1次。结晶紫染色30 min,1×PBS冲洗1次。倒去小室中培养液,用平底棉签轻轻擦去小室中未迁移到下方的细胞。200×显微镜下拍照计 数。
1.3.9 流式细胞术分析细胞凋亡和增殖
细胞周期分析使用BD Cycletest Plus DNA试剂盒(美国),细胞转染48 h后,用胰酶消化细胞,1×PBS冲洗2次,并进行细胞计数,取1×106个细胞加入到流式试管中。加入125 μL A液轻轻混匀,室温温育10 min;加入100 μL B液轻轻混匀,室温温育10 min;加入2~8℃的C液,避光冰上温育10 min。3 h内上机,以PI为横坐标,细胞数为纵坐标,在流式细胞仪上计数细胞G0/G1、S、G2/M期的数量。
细胞凋亡分析使用BD AnnexinⅤ/FITC凋亡检测试剂盒(美国),转染48 h后,胰酶消化细胞,1×PBS洗2次,并进行细胞计数,用1×结合缓冲液制备1×106/mL单细胞悬液。100 μL细胞悬液转移到新的流式专用管,并加入5 μL PE AnnexinⅤ和7 μL 7-AAD轻轻摇匀室温避光15 min。每管加入400 μL 1×结合缓冲液,并在1 h内上机检测。
1.3.10 5-氮杂-2’ -脱氧胞苷(5-aza-2 ’-deoxycytidine,DAC)和曲古抑菌素A (trichostatin A,TSA)处理胃癌细胞株
将胃癌细胞株MGC-803和MKN-45分为4个组:对照组、甲基转移酶抑制剂DAC处理组、组蛋白去乙酰化酶抑制剂TSA处理组以及DAC和TSA联合处理组。DAC处理48 h,TSA处理24 h后,进行RNA抽提,RTFQ-PCR验证。
1.3.11 蛋白质印迹法(Western blot检测)
将转染48 h后的细胞用SDS蛋白裂解液提取蛋白,加入上样缓冲液后金属浴100℃ 5~10 min。以恒压110 V进行电泳80 min。将聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜用甲醇活化30 s后,连同转膜滤纸、电泳胶浸泡在转膜液中,从下到上按海绵垫、滤纸、胶、PVDF膜、滤纸、海绵垫的顺序放置,恒流300 mA 1 h后,用封闭液封闭30~60 min。一抗4℃温育过夜,二抗室温温育1 h。用Odyssey采用RNA免疫共沉淀实验(co-immunoprecipitation,RIP)探讨DLEU7-AS1对下游信号分子的调控机制,Odyssey双色红外荧光成像系统扫描成像。
1.3.12 统计学处理
采用GraphPad Prism 5.0 软件进行统计分析。无特殊说明均采用Student’s t检验进行比较。P<0.05 为差异有统计学意义。
2 结 果
2.1 DLEU7-AS1在胃癌中高表达且与不良预后有关
为了研究DLEU7-AS1在胃癌中的表达情况,首先对TCGA数据库中STAD数据进行差异分析,结果发现DLEU7-AS1在胃癌组织中的表达量较癌旁正常组织明显上调(图1A,P <0.001)。采用RTFQ-PCR验证从上海交通大学医学院附属新华医院普外科获得的胃癌和癌旁组织中DLEU7-AS1的表达情况,结果与TCGA数据库结果一致(图1B)。另外,对胃癌细胞进行DLEU7-AS1表达量检测发现其在AGS和HGC-27胃癌细胞系中高表达(图1C),且主要分布于细胞核中(图1D)。
为了探讨 DLEU7-AS1 在胃癌中异常高表达的原因,采用甲基转移酶抑制剂DAC和组蛋白去乙酰化酶抑制剂TSA处理胃癌细胞株SGC-7901和MGC-803。结果显示,DAC和TSA均能上调DLEU7-AS1的表达,且经过DAC和TSA共同处理后,DLEU7-AS1的表达明显上调,呈协同效应(图2),说明表观遗传学调控可能参与 DLEU7-AS1在胃癌中的异常表达。
为了进一步研究DLEU7-AS1与胃癌患者预后的关系,本研究通过Kaplan-Meier Plotter网站(https://kmplot.com/)分析胃癌患者的生存期,发现高表达DLEU7-AS1的胃癌患者较低表达DLEU7-AS1的胃癌患者有更短的无疾病进展生存期(图3A)和进展后生存期(图3B),说明DLEU7-AS1与胃癌的不良预后有关。综上所述,DLEU7-AS1在胃癌中高表达,且会导致胃癌患者生存期明显缩短。
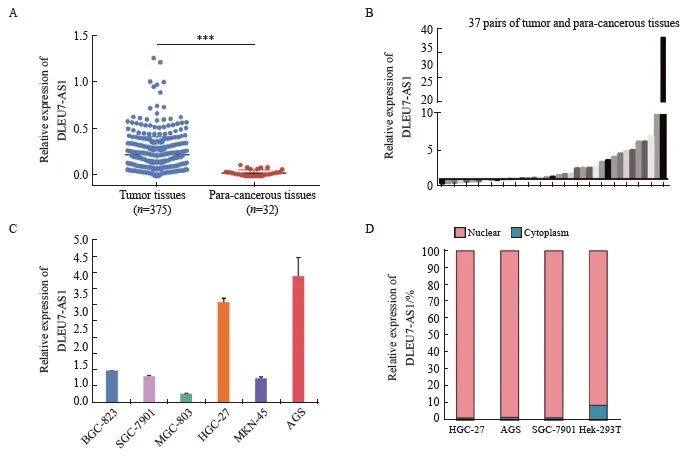
图1 DLEU7-AS1在胃癌中的表达情况
Fig. 1 The expression of DLEU7-AS1 in gastric cancer
A: Analysis of DLEU7-AS1 expression in normal and gastric tumor tissues using TCGA database; B: The result of RTFQ-PCR in 37 pairs of gastric cancer tissues and para-cancerous tissues from Xinhua Hospital; C: The relative expression of DLEU7-AS1 in 6 gastric cancer cell lines; D: The distribution of DLEU7-AS1 in cells. ***: P<0.001, compared with control group.
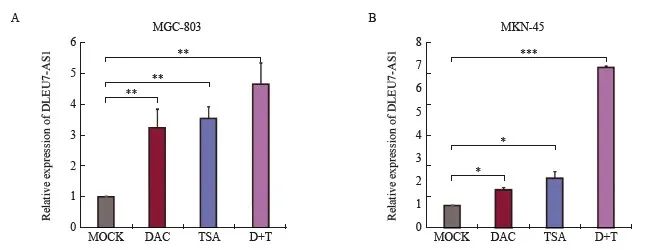
图2 DAC和TSA处理后胃癌细胞中DLEU7-AS1的表达情况
Fig. 2 Expression of DLEU7-AS1 in gastric cancer cells treated with DAC and TSA
*: P<0.05, compared with mock; **: P<0.01, compared with mock; ***:P<0.001, compared with mock, Student’s t test. D+T: DAC and TSA.
2.2 DLEU7-AS1促进胃癌细胞增殖
我们将根据细胞内源性DLEU7-AS1的表达情况进行DLEU7-AS1沉默或过表达研究其对胃癌细胞增殖的影响,即在DLEU7-AS1低表达的MKN-45和MGC-803细胞中过表达DLEU7-AS1, DLEU7-AS1高表达的AGS和HGC-27中沉默内源性DLEU7-AS1。干扰效果及过表达效果均用RTFQ-PCR 进行验证。
设计并合成针对DLEU7-AS1的siRNA(si-491、si-1602),对DLEU7-AS1表达相对较高的2个胃癌细胞株HGC-27、AGS进行DLEU7-AS1沉默。两个siRNA沉默效果见图4A,DLEU7-AS1表达量明显降低。运用CCK-8细胞增殖实验连续监测DLEU7-AS1沉默后胃癌细胞的增殖情况,结果发现si-491、si-1602转染后的细胞较转染si-NC后的细胞增殖能力显著降低(图4B)。
构建DLEU7-AS1过表达质粒,在DLEU7-AS1表达相对较低的MKN-45、MGC-803中进行DLEU7-AS1过表达,转染后DLEU7-AS1表达量显著上调(图5A)。采用CCK-8细胞增殖实验和平板克隆实验发现DLEU7-AS1过表达促进胃癌细胞的增殖(图5B和图5C)。因此,DLEU7-AS1可促进胃癌细胞增殖。
为了探究DLEU7-AS1促进胃癌细胞增殖的机制,采用流式细胞术检测DLEU7-AS1过表达后对胃癌细胞凋亡的影响。结果表明,沉默DLEU7-AS1后能使凋亡细胞数增加(图6A),而过表达DLEU7-AS1后则能使凋亡细胞数明显减少(图6B),说明DLEU7-AS1可以调控胃癌细胞的凋亡,从而起到促进胃癌细胞增殖的作用。
本研究采用流式细胞术检测DLEU7-AS1过表达后对胃癌细胞周期的影响。结果表明,过表达DLEU7-AS1后能使处于S期的细胞增加(图7),说明DLEU7-AS1可能可以调控胃癌细胞的周期,从而起到促进胃癌细胞增殖的作用。
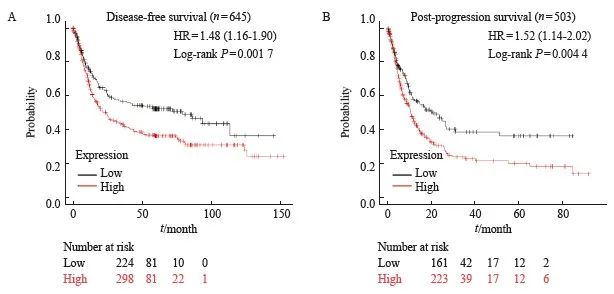
图3 DLEU7-AS1的表达量与胃癌患者生存期的关系
Fig. 3 The correlation between the expression of DLEU7-AS1 and the survival of gastric cancer patients
A: The disease-free survival of gastric cancer patients with low and high expression of DLEU7-AS1; B: The post-progression survival of gastric cancer patients with low and high expression of DLEU7-AS1.
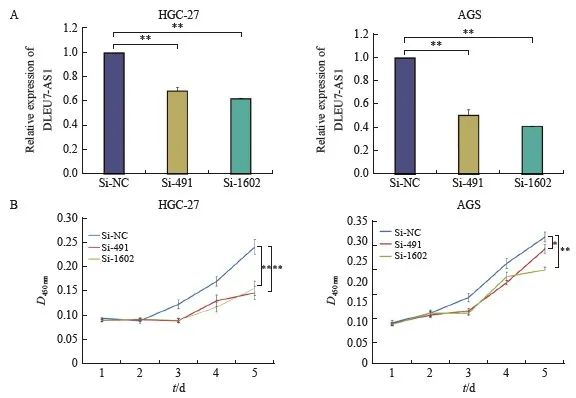
图4 沉默DLEU7-AS1 抑制胃癌细胞增殖
Fig. 4 DLEU7-AS1 silence inhibited proliferation of gastric cancer cells
A: The expression of DLEU7-AS1 after transfecting siRNA into HGC-27 and AGS; B: Monitoring gastric cancer cells proliferation by CCK-8 after knockdown DLEU7-AS1. *: P<0.05, compared with si-NC; **: P<0.01, compared with si-NC, Student’s t test.
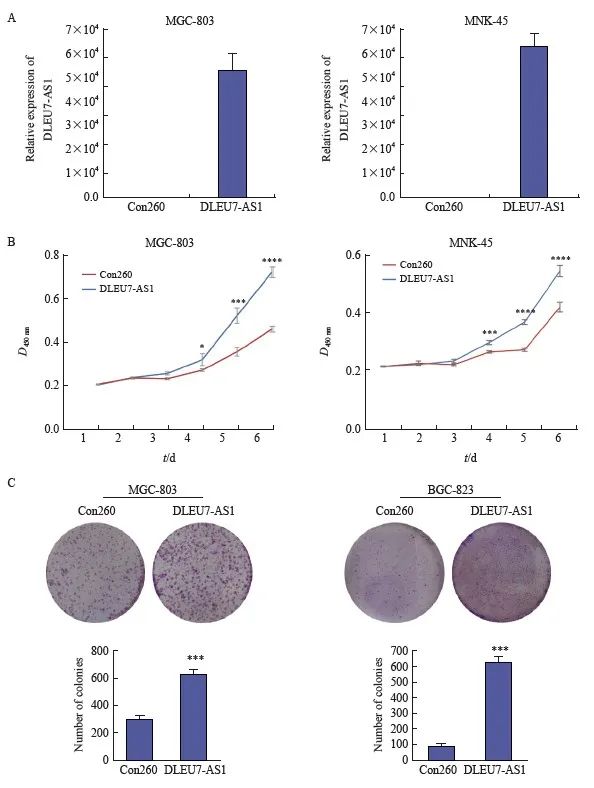
图5 DLEU7-AS1过表达促进胃癌细胞增殖
Fig. 5 DLEU7-AS1 promoted proliferation of gastric cancer cells
A: The expression of DLEU7-AS1 after transfecting DLEU7-AS1 plasmids into MGC-803 and MKN-45; B: Monitoring gastric cancer cells proliferation by CCK-8 after DLEU7-AS1 overexpression; C: Monitoring gastric cancer cells proliferation by colony formation assay after DLEU7-AS1 overexpression. *:P<0.05, compared with Con260; **:P<0.01, compared with Con260; ***: P<0.001, compared with Con260; ****:P<0.000 1, compared with Con260; Student’s t test.
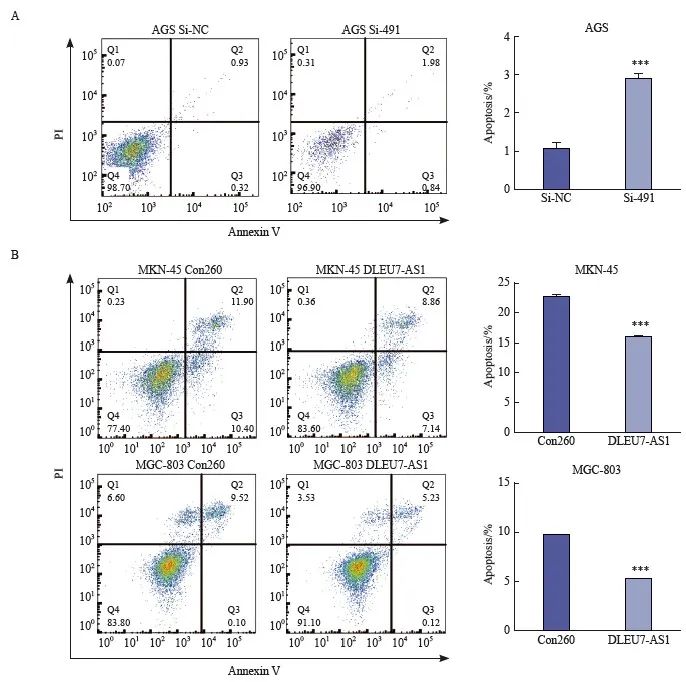
图6 DLEU7-AS1可以抑制胃癌细胞凋亡
Fig. 6 DLEU7-AS1 inhibited gastric cancer cell apoptosis by flow cytometry analysis
***: P<0.001, compared with Con260; ***: P<0.001, compared with si-NC, Student’s t test.
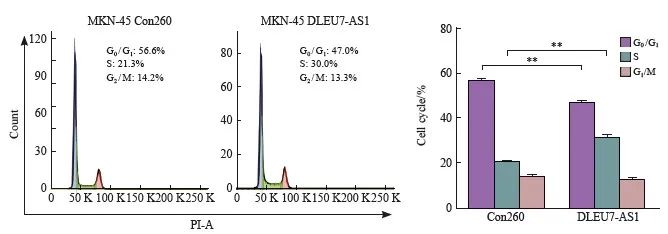
图7 DLEU7-AS1可以促进胃癌细胞周期进展
Fig. 7 DLEU7-AS1 promoted the progression of cell cycle by flow cytometry analysis
**:P<0.01, compared with Con260, Student’s t test.
2.3 DLEU7-AS1促进胃癌细胞体外迁移
采用transwell小室迁移实验分析DLEU7-AS1沉默后胃癌细胞的迁移情况,结果发现si-491、 si-1602转染后的细胞较转染si-NC后的AGS和HGC-27细胞迁移能力显著降低(图8)。
采用transwell小室迁移实验分析DLEU7-AS1过表达后对胃癌细胞的迁移的影响。结果显示,与对照组相比,过表达质粒上调DLEU7-AS1后的胃癌细胞株迁移能力明显增强(图9)。由此可见,DLEU7-AS1可在体外促进胃癌细胞转移。
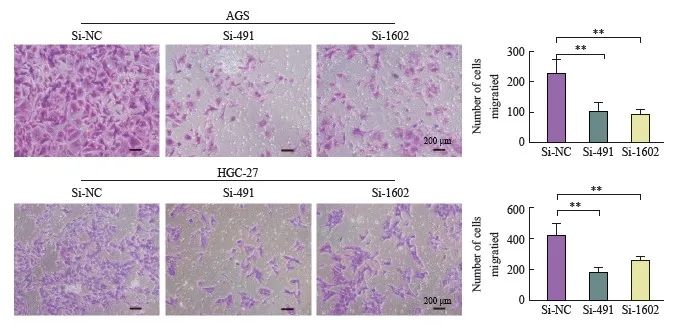
图8 沉默DLEU7-AS1抑制胃癌细胞体外迁移
Fig. 8 DLEU7-AS1 knockdown inhibited gastric cancer cells migration in vitro
**: P<0.01, compared with si-NC, Student’s t test.
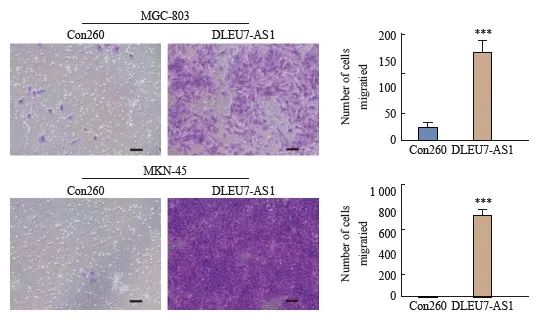
图9 DLEU7-AS1过表达促进胃癌细胞迁移
Fig. 9 DLEU7-AS1 overexpression promotes gastric cancer cells migration in vitro
***: P<0.001, compared with Con260, Student’s t test.
2.4 DLEU7-AS1参与调控MSN的表达
前期工作已经证明DLEU7-AS1在胃癌中表达上升且具有促进胃癌恶性表型的作用。为了阐明DLEU7-AS1在胃癌中发挥作用的分子机制,本研究采用RNA-seq分析si-491和对照si-NC处理胃癌细胞HGC-27后转录组表达的差异,设置 |log2FC|≥0.5,Q value≤0.05时,得到差异基因10个,其中上调的有2个,下调的有8个(图10A)。在这些差异基因中,膜突蛋白MSN的下调差异最显著。
本研究结果发现,沉默DLEU7-AS1表达抑制MSN在mRNA水平和蛋白水平的表达(图10B和图10D),DLEU7-AS1过表达则促进MSN在mRNA水平的表达(图10C),提示DLEU7-AS1可以调控MSN的表达。
为了进一步验证DLEU7-AS1对MSN可能存在的调控作用,本研究设计了rescue实验。采用siRNA干扰DLEU7-AS1的表达,同时过表达MSN,采用CCK-8细胞增殖毒性实验、transwell小室迁移实验,证明过表达MSN可部分恢复干扰DLEU7-AS1对胃癌细胞增殖和迁移的抑制作用(图11A和图11B),进一步证实DLEU7-AS1可以通过调控MSN的表达促进胃癌细胞的增殖和迁移。
本研究采用在线的数据库(GENPIA2)分析发现MSN在胃癌组织中表达上调且随着胃癌分期进展表达上调(图12A和图12B)。为了进一步研究MSN与胃癌患者预后的关系,本研究通过Kaplan-Meier Plotter网站(https://kmplot.com/)分析胃癌患者的生存期,发现高表达MSN的胃癌患者较低表达MSN的胃癌患者有更短无疾病进展生存期(图12C)和进展后的生存期(图12D),说明MSN在胃癌中的高表达与胃癌的不良预后有关,与DLEU7-AS1的作用一致。
DLEU7-AS1主要定位在细胞核中。UCSC基因组浏览器上ENCODE项目显示了通过ChIP-seq分析确定的基因组中H3K27Ac组蛋白标记的富集水平,表明MSN基因启动子周围的区域被H3K27Ac修饰标记(图13A)。我们利用RPIseq在线软件预测DLEU7-AS1与P300的结合情况,结合的可能性为0.7(>0.5为阳性)。RIP结果发现,P300蛋白可以把DLEU7-AS1共沉淀,验证了二者能够结合(图13B)。因此,我们假设DLEU7-AS1可能通过招募P300来调节MSN表达进而调控胃癌细胞的增殖和迁移。
已有研究表明MSN可以参与调控肿瘤的上皮-间质转化(epithelial-mesenchymal transition, EMT),本研究采用Western blot分析胃癌中DLEU7-AS1是否可以调控EMT。实验结果提示沉默DLEU7-AS1的表达,可以抑制EMT相关蛋白的表达包括ZEB-1、N-cadherin、vimentin和β-catenin(图14A)。而过表达DLEU7-AS1则可以促进胃癌细胞的EMT相关蛋白的表达,包括ZEB-1、N-cadherin、vimentin和β-catenin;并且抑制紧密连接跨膜蛋白claudin-1的表达(图14B)。这些研究结果提示DLEU7-AS1可能通过MSN调控EMT促进胃癌细胞的迁移和浸润。
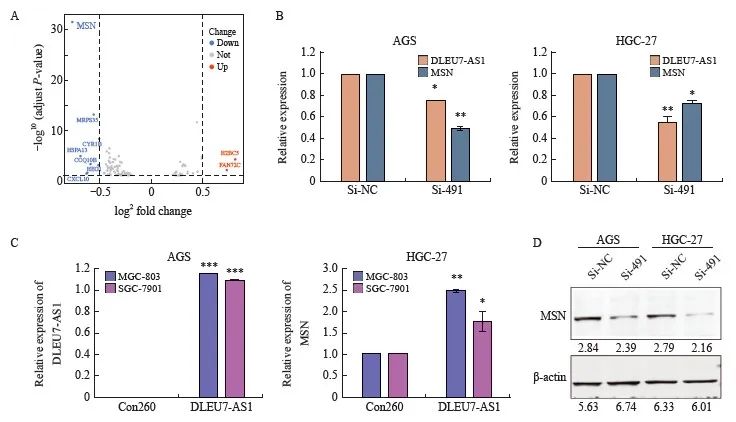
图10 DLEU7-AS1调控MSN的表达
Fig. 10 DLEU7-AS1 regulated MSN expression
A: Volcano plot of differential genes by RNA-seq analysis of HGC-27 transfected with si-491 and si-NC; B: RTFQ-PCR analysis of MSN mRNA level after transfection of si-RNA and si-491 in AGS and HGC-27; C: RTFQ-PCR analysis of MSN mRNA level after DLEU7-AS1 overexpression in MGC-803 and SGC-7901; D: Western blot analysis of MSN protein expression level after transfection of si-RNA and si-491 in AGS and HGC-27. *: P<0.05, compared with si-NC/Con260; **: P<0.01, compared with si-NC/Con260; ***: P<0.001, compared with si-NC/Con260.
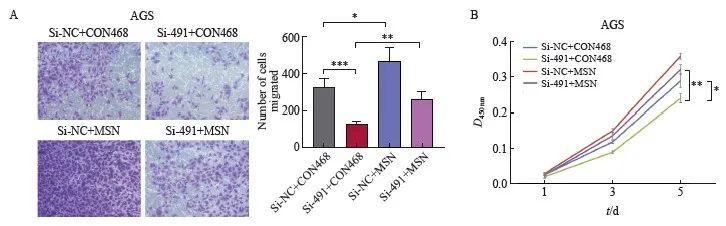
图11 MSN作为DLEU7-AS1下游效应分子
Fig. 11 MSN acted as downstream effector of DLEU7-AS1
A: Transwell chamber assay after knockdown of DLEU7-AS1 and overexpression of MSN; B: CCK-8 cell proliferation toxicity test after knockdown of DLEU7-AS1 and overexpression of MSN. ***:P<0.001, si-NC + CON468 compared with si-491 + CON468; *: P<0.05, si-NC + CON468 compared with si-NC + MSN; **: P<0.01, si-491 + CON468 compared with si-491 + MSN; **: P<0.01, si-491 + CON468 compared with si-491 + MSN; *:P<0.05, si-NC + CON468 compared with si-491+CON468, Student’s t test.
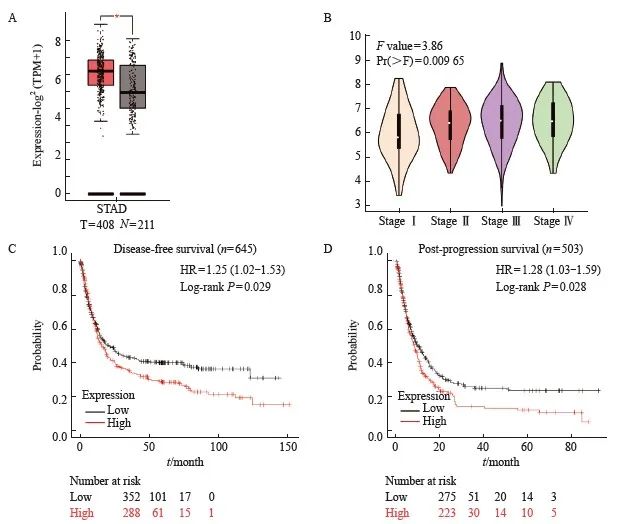
图12 MSN在胃癌中的表达上升及其表达量与胃癌患者生存期的关系
Fig. 12 The expression of MSN in gastric cancer and the correlation between the expression of MSN and the survival of gastric cancer patients
A and B: Analysis of MSN expression in normal and gastric tumor tissues using GEPIA2 database; C: The disease-free progressive survival of gastric cancer patients with low and high expression of MSN; D: The post-progression survival of gastric cancer patients with low and high expression of MSN. *: P<0.05, compared with control.
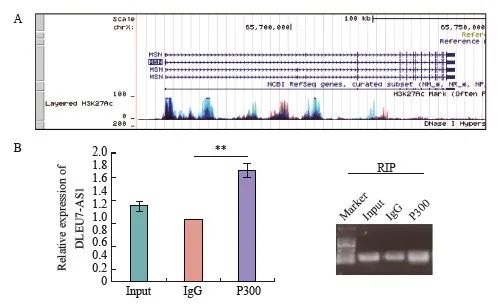
图13 DLEU7-AS1可以结合P300调控MSN的转录表达
Fig. 13 DLEU7-AS1 recruited P300 to regulate transcription of MSN
A: The area around CDC42 promoter was marked with H3K27Ac modification from UCSC; B: Analyze the binding of DLEU7-AS1 between P300 by RIP. **: P<0.01, compared with IgG.
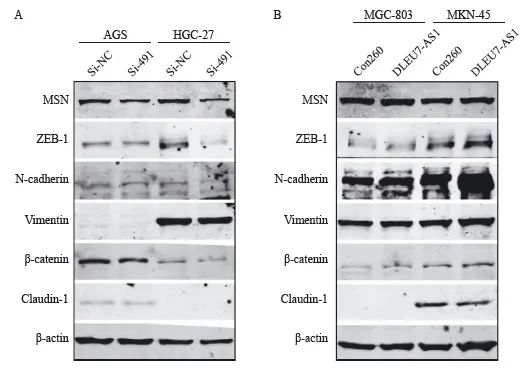
图14 DLEU7-AS1促进胃癌细胞EMT
Fig. 14 DLEU7-AS1 promoted gastric cancer cells EMT
3 讨 论
基因芯片和高通量RNA测序技术的出现和应用推动了数量和功能丰富的lncRNA的发现。人类基因组中75%发生转录,但是只有2%的基因转录成具有蛋白翻译功能的编码mRNA,而绝大多数的基因转录形成lncRNA[14]。LncRNA通常根据它们相对于蛋白质编码基因的转录位点进行分类,包括增强子lncRNA、启动子lncRNA、反义lncRNA、基因间lncRNA和环状lncRNA (circRNA)。
lncRNA参与细胞的多项生命活动,不管是生长发育还是疾病发生 [15-17]。LncRNA,如LINREP、BC069792、AGPG、LINRIS、YIYA 等,在调节代谢相关基因的转录、翻译以及翻译后修饰等方面发挥着重要的功能作用,最终导致癌症代谢重编程,进而影响癌症进展[8,18-19]。不仅如此,lncRNA如HOTAIR、MALAT-1、lncROR、MIR100HG等,在维持肿瘤干细胞干性以及调节EMT过程起着重要作用,从而促进肿瘤的侵袭和转移[20-21]。
多种lncRNA已经被证明在胃癌的增殖、转移、铁死亡、胃癌的干性的维持、化疗耐药等恶性表型进展中发挥重要作用[22-23]。然而,还有更多的lncRNA在胃癌中的功能有待深入研究。
本研究通过数据库分析和临床胃癌组织标本研究发现胃癌组织的DLEU7-AS1表达水平显著高于癌旁正常组织,并且高表达DLEU7-AS1的胃癌患者有较短的无疾病生存期和进展后生存期。我们进一步研究DLEU7-AS1在胃癌中的功能,发现其能促进胃癌肿瘤的增殖与转移,并抑制胃癌细胞的凋亡,说明DLEU7-AS1在胃癌中扮演着癌基因的角色。
膜突蛋白MSN是埃兹蛋白-根蛋白-膜突蛋白(ezrin-radixin-moesin,ERM)家族中的一员,可以通过调节肌动蛋白细胞骨架重塑从而调节细胞黏附、迁移和形态发生[24-24]。MSN在肿瘤中的作用具有双面性。在肺腺癌中,MSN可以促进免疫淋巴细胞的浸润从而改善患者预后[26];在乳腺癌中,MSN与CD44相互作用可能参与抑制乳腺癌干细胞从而起到抗肿瘤作用[27]。但在大部分肿瘤中,MSN具有癌基因的功能。MSN是雌激素受体阳性的乳腺癌患者不良预后的标志物[28];在肺癌中EMT过程中,P-糖蛋白的活化也是由MSN过表达导致,进而导致了肺癌患者紫杉醇耐药[29];MSN还是雌激素受体阳性的乳腺癌患者的独立预后因素[28]。我们将沉默DLEU7-AS1的胃癌细胞HGC-27进行RNA-seq,测序结果表明,DLEU7-AS1的表达量减少后, MSN的表达也显著降低,该结论也通过Western blot和RTFQ-PCR实验进行验证,提示DLEU7-AS1可能通过诱导MSN的表达,从而促进胃癌细胞的增殖和转移。
大多数的lncRNA的功能与他们相互结合的核酸和RNA结合蛋白(RNA-binding protein,RBP)密切相关。本研究发现DLEU7-AS1定位于胃癌细胞的细胞核内,利用在线数据库预测DLEU7-AS1可与P300结合,并通过RIP实验进行验证。结合UCSC基因组浏览器上ENCODE项目显示MSN启动子周围的区域被H3K27Ac修饰标记,而H3K27ac与基因激活有关,H3K27的乙酰化几乎完全被CBP/p300乙酰化。因此,我们假设DLEU7-AS1可能通过招募P300来调控MSN表达进而调控胃癌细胞的增殖和迁移。有关具体的调控机制我们将进一步深入研究。
总之,本研究结果表明,DLEU7-AS1在胃癌中发挥着促癌基因的作用,可以促进胃癌的增殖和转移。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. The Lancet, 2020, 396(10251): 635-648.
[3] QIU H B, CAO S M, XU R H. Cancer incidence, mortality, and burden in China: a time-trend analysis and comparison with the United States and United Kingdom based on the global epidemiological data released in 2020[J]. Cancer Commun, 2021, 41(10): 1037-1048.
[4] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA A Cancer J Clin, 2016, 66(2): 115-132.
[5] XIA C F, DONG X S, LI H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants[J]. Chin Med J (Engl), 2022, 135(5): 584-590.
[6] HERMAN A B, TSITSIPATIS D, GOROSPE M. Integrated lncRNA function upon genomic and epigenomic regulation[J]. Mol Cell, 2022, 82(12): 2252-2266.
[7] HUARTE M. The emerging role of lncRNAs in cancer[J]. Nat Med, 2015, 21(11): 1253-1261.
[8] T A N Y T , L I N J F , L I T , e t a l . L n c R N A - m e d i a t e d posttranslational modifications and reprogramming of energy metabolism in cancer[J]. Cancer Commun (Lond), 2021, 41(2): 109-120.
[9] JUSIC A, THOMAS P B, WETTINGER S B, et al. Noncoding RNAs in age-related cardiovascular diseases[J]. Ageing Res Rev, 2022, 77: 101610.
[10] SUN P, HAMBLIN M H, YIN K J. Non-coding RNAs in the regulation of blood-brain barrier functions in central nervous system disorders[J]. Fluids Barriers CNS, 2022, 19(1): 27.
[11] LIU X B, HAN C, SUN C Z. Long non-coding RNA DLEU7-AS1 promotes the occurrence and development of colorectal cancer via Wnt/β-catenin pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(1): 110-117.
[12] WANG X J, CHEN L, XU R, et al. DLEU7-AS1 promotes renal cell cancer by silencing the miR-26a-5p/coronin-3 axis[J]. Clin Kidney J, 2022, 15(8): 1542-1552.
[13] WANG C Z, MA B B, XU Z J, et al. Reduced expression of lncRNA DLEU7-AS1 is a novel favorable prognostic factor in acute myeloid leukemia[J]. Biosci Rep, 2022, 42(5): BSR20212078.
[14]ENCODE PROJECT CONSORTIUM. An integrated encyclopedia of DNA elements in the human genome[J]. Nature, 2012, 489(7414): 57-74.
[15] HUANG W X, LI H, YU Q S, et al. LncRNA-mediated DNA methylation: an emerging mechanism in cancer and beyond[J]. J Exp Clin Cancer Res, 2022, 41(1): 100.
[16] L I K , WA N G Z Q . l n c R N A N E A T 1 : k e y p l a y e r i n neurodegenerative diseases[J]. Ageing Res Rev, 2023, 86: 101878.
[17] NOJIMA T, PROUDFOOT N J. Mechanisms of lncRNA biogenesis as revealed by nascent transcriptomics[J]. Nat Rev Mol Cell Biol, 2022, 23(6): 389-406.
[18] LIU J, LIU Z X, WU Q N, et al. Long noncoding RNA AGPG regulates PFKFB3-mediated tumor glycolytic reprogramming[J]. Nat Commun, 2020, 11(1): 1507.
[19] JI X S, LIU Z H, GAO J J, et al. N6-Methyladenosine-modified lncRNA LINREP promotes glioblastoma progression by recruiting the PTBP1/HuR complex[J]. Cell Death Differ, 2023, 30(1): 54-68.
[20] MCCABE E M, RASMUSSEN T P. lncRNA involvement in cancer stem cell function and epithelial-mesenchymal transitions[J]. Semin Cancer Biol, 2021, 75: 38-48.
[21] LIU H, LI D X, SUN L N, et al. Interaction of lncRNA MIR100HG with hnRNPA2B1 facilitates m6A-dependent stabilization of TCF7L2 mRNA and colorectal cancer progression[J]. Mol Cancer, 2022, 21(1): 74.
[22] LI Z, LANG Z Q, WANG T, et al. LncRNA SNHG22 promotes gastric cancer progression by regulating the miR-101-3p/e2f2 axis[J]. Cell Cycle, 2023, 22(3): 347-360.
[23] LIN Z H, SONG J L, GAO Y K, et al. Hypoxia-induced HIF-1α/lncRNA-PMAN inhibits ferroptosis by promoting the cytoplasmic translocation of ELAVL1 in peritoneal dissemination from gastric cancer[J]. Redox Biol, 2022, 52: 102312.
[24] MANGEAT P, ROY C, MARTIN M. ERM proteins in cell adhesion and membrane dynamics[J]. Trends Cell Biol, 1999, 9(5): 187-192.
[25] DEGRYSE B, BRITTO M, SHAN C X, et al. Moesin and merlin regulate urokinase receptor-dependent endothelial cell migration, adhesion and angiogenesis[J]. Int J Biochem Cell Biol, 2017, 88: 14-22.
[26] LI Y Q, ZHENG Z, LIU Q X, et al. Moesin as a prognostic indicator of lung adenocarcinoma improves prognosis by enhancing immune lymphocyte infiltration[J]. World J Surg Oncol, 2021, 19(1): 109.
[27] SUN X, LI K X, HASE M, et al. Suppression of breast cancerassociated bone loss with osteoblast proteomes via Hsp90ab1/ moesin-mediated inhibition of TGFβ/FN1/CD44 signaling[J]. Theranostics, 2022, 12(2): 929-943.
[28] YU L F, ZHAO L, WU H Z, et al. Moesin is an independent prognostic marker for ER-positive breast cancer[J]. Oncol Lett, 2019, 17(2): 1921-1933.
[29] KAMIOKA H, TOMONO T, FUJITA A, et al. Moesin-mediated P-glycoprotein activation during snail-induced epithelialmesenchymal transition in lung cancer cells[J]. J Pharm Sci, 2020, 109(7): 2302-2308.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)