首页 > 医疗资讯/ 正文
肿瘤基因组中的体细胞突变可以产生突变蛋白,当这些蛋白被分解为肽片段并呈现在主要组织相容性复合体(MHC)分子上时,会引发抗肿瘤免疫反应。这些突变肽通常被称为“新抗原”,对抗肿瘤免疫至关重要,已被认为是有前景的治疗靶点。目前的新抗原分析主要集中于单核苷酸变异(SNV)和插入/缺失(Indel)突变,忽视了普遍存在的结构变异(SV)。SV在约94.9%的肿瘤中广泛分布,有潜力产生具有较低自相似性和较高免疫原性的新抗原,因此是新抗原的一个大量来源。但目前还没有对SV的新抗原潜能进行全面的泛癌分析。
近日,北京大学席瑞斌教授团队在Genome Biology上发表了题为“Comprehensive analysis of neoantigens derived from structural variation across whole genomes from 2528 tumors”的文章。席瑞斌团队开发了一种名为NeoSV的计算方法,该方法将SV注释、蛋白质片段化和MHC结合预测相结合,从而能够预测SV衍生的新抗原。研究人员通过对30种癌症类型2528个全基因组的SV衍生新抗原进行分析,发现SV对新抗原库在数量和质量上都有显著贡献。该研究证明了基因突变相关的新抗原负荷,能够比肿瘤新抗原负荷更好地描述肿瘤与免疫的相互作用,并可能改善患者对免疫治疗的选择。该研究填补了目前新抗原库的空白,为癌症疫苗的开发提供了宝贵资源。

文章发表在Genome Biology上
首先,研究团队开发了一种名为Neosv的计算框架,来预测来自体细胞SV的MHC I限制性新抗原。NeoSV首先过滤在基因区域有断点的SV,以及“错误”的SV,这些SV不能产生功能性转录本。然后,NeoSV组装SV衍生的新转录本,并将其翻译成蛋白质,并获得所有可能的短肽。最后,NeoSV预测其获得的短肽与MHC分子的结合,并报告最终候选新抗原。
通过Neosv算法,研究团队分析了来自ICGC的全基因组泛癌分析(PCAWG)项目和癌症基因组图谱(TCGA)中30种癌症类型2528个肿瘤基因组数据,发现不同癌症类型的SV衍生新抗原的中位数差异很大(图1b),SV新抗原主要富集于染色体不稳定性较高的癌种,包括卵巢癌和乳腺癌、食管腺癌和胃腺癌。相反,血液系统恶性肿瘤和脑肿瘤(胶质母细胞瘤除外)很少产生SV衍生的新抗原,因为它们的基因组相对稳定。
研究人员根据SV衍生新抗原的基因组和功能特征对其进行了进一步分类,大多数产生新抗原的SV大小在1kb到1Mb之间。与预期一致,移码SV占新抗原的82.4%(图1c)。近68%的新抗原是由不平衡基因组事件产生的,例如缺失和重复(图1d)。值得注意的是,除了跨越两个不同基因的SV外,通常被基因融合分析忽略的单基因重排占新抗原的41.2%(图1e)。
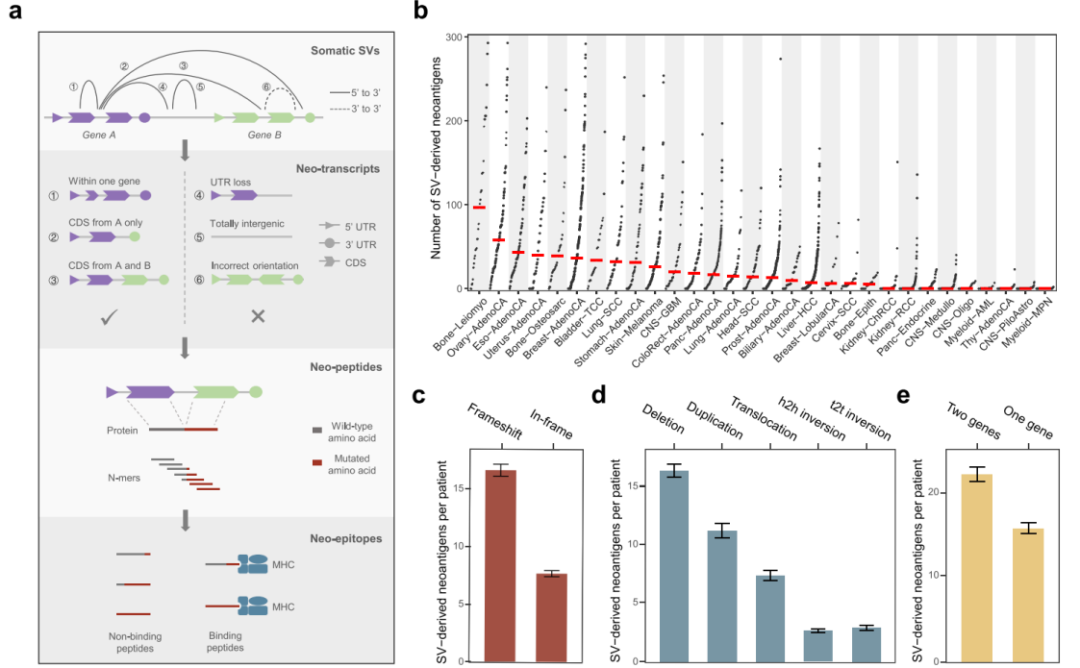
图1.SV衍生新抗原的泛癌图谱
除SV外,SNV和Indel也是新抗原的另外两个基因组来源。研究人员比较了不同类型的新抗原,发现SV、SNV和Indel产生的新抗原几乎是互斥的(图2a)。总体而言,每位患者的SV衍生新抗原数量与Indel衍生新抗原的数量相当,但远低于SNV衍生新抗原(图2b)。由于SV对ORF的破坏作用,SV新抗原率显著高于SNV和Indel(图2c)。值得注意的是,SV是平滑骨肌瘤(61.6%)和骨肉瘤(49.1%)中新抗原的主要来源,也对乳腺癌(37.7%)和卵巢癌(37.1%)有显著影响(图2d),表明SV在这些癌症中的作用不可忽视。
接下来,研究人员比较了SV、Indel和SNV新抗原的几种表位相关指标。结果显示,不同突变类型之间的结合亲和力、结合稳定性和疏水性分数没有明显差异,SV衍生新抗原更有可能与具有不同T细胞受体的T细胞结合。
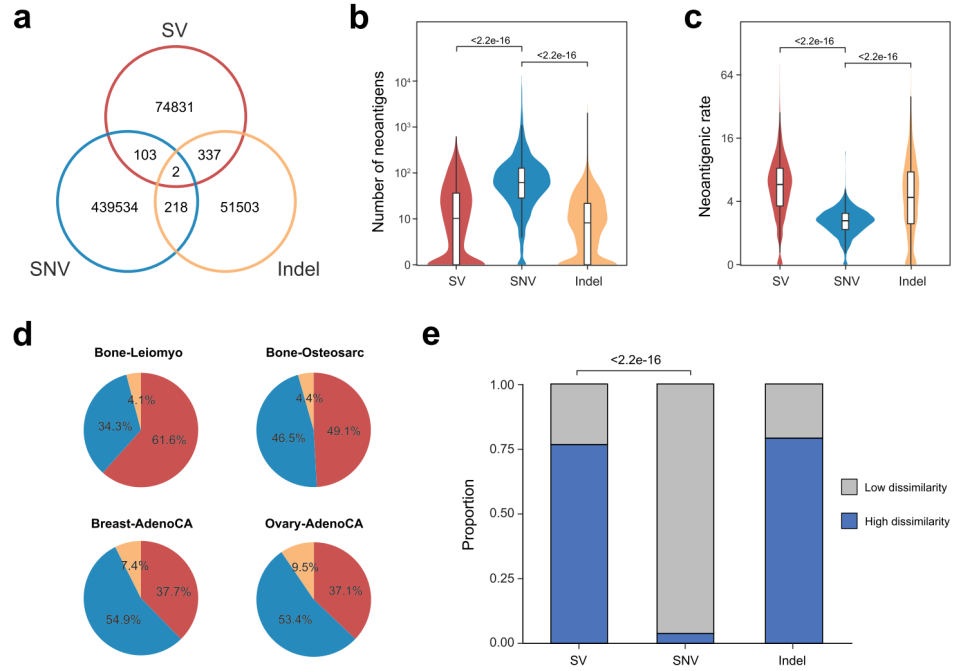
图2.来自SV与SNV和Indel的新抗原库比较
研究人员计算了PCAWG中每个SV衍生新抗原发生率(图3a),以了解SV的共享新抗原。结果显示,在人群中高频出现的共享新抗原,主要位于染色体脆性位点(图3c),例如LRP1B、MACROD2、WWOX和PARK2等基因。
研究人员观察到一些SV衍生的新肽在患者之间是共享的,但不由MHC呈递,因此在PCAWG中未被鉴定为共享的新抗原。但是如果这些新肽能够与其他MHC等位基因结合,则具有作为治疗靶点的价值。因此,研究人员收集了135个MHC等位基因,并研究了它们与这些共享新肽的相互作用,证明了共享SV衍生新抗原的存在,并表明开发针对特定癌症的疫苗潜力巨大。

图3.肿瘤中共享的SV衍生新抗原
此外,研究发现,与那些仅产生新肽但不能由MHC呈递的基因相比,可以作为新抗原呈递的基因具有较低的表达(图4a)。SV衍生的新抗原可能由于来自免疫细胞的负选择压力而受到适度的表达减少,致癌SV受到免疫监测的限制,往往表现不佳。
新抗原瘤内异质性(ITH)可能影响抗肿瘤免疫和对ICB的反应。研究人员使用亚克隆SV衍生新抗原来估计新抗原ITH,发现SV衍生新抗原的ITH中位数与SNV相当,但显著高于Indel(图4d)。76%的肺鳞状细胞癌具有更高的SV衍生新抗原ITH,而60%的前列腺腺癌显示出更高的SNV衍生新抗原ITH(图4e)。表明不同类型的新抗原可能在肿瘤进展的不同阶段出现,并承受来自免疫系统的不同选择压力。相比于其他SV,产生新抗原SV的对应基因表达水平呈下降趋势。此外,SV新抗原主要产生于肿瘤发展后期,即肿瘤产生免疫逃逸能力后。
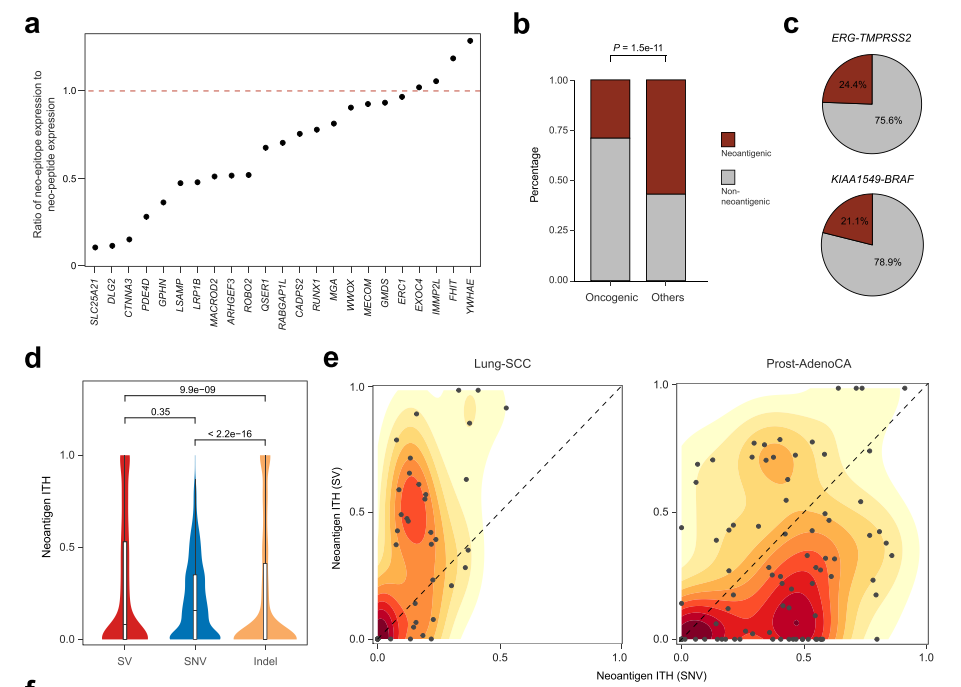
图4.SV衍生新抗原的负选择压力
最后,研究人员提出了基因组改变相关的新抗原负荷(GANB),将来自SNV、Indel和SV的新抗原整合在一起,以完全捕获肿瘤的免疫基因组特征。研究发现有相当比例的肿瘤新抗原负荷(TNB)低患者具有足够的新抗原,如20.6%的食道腺癌、18.7%的肺鳞状细胞癌、17.4%的卵巢腺癌和13.2%的乳腺腺癌(图5b),可能受益于抗PD-1治疗。相较于被广泛应用的TMB,GANB与免疫浸润的相关性更好,可以更全面、更直接地反映TNB。
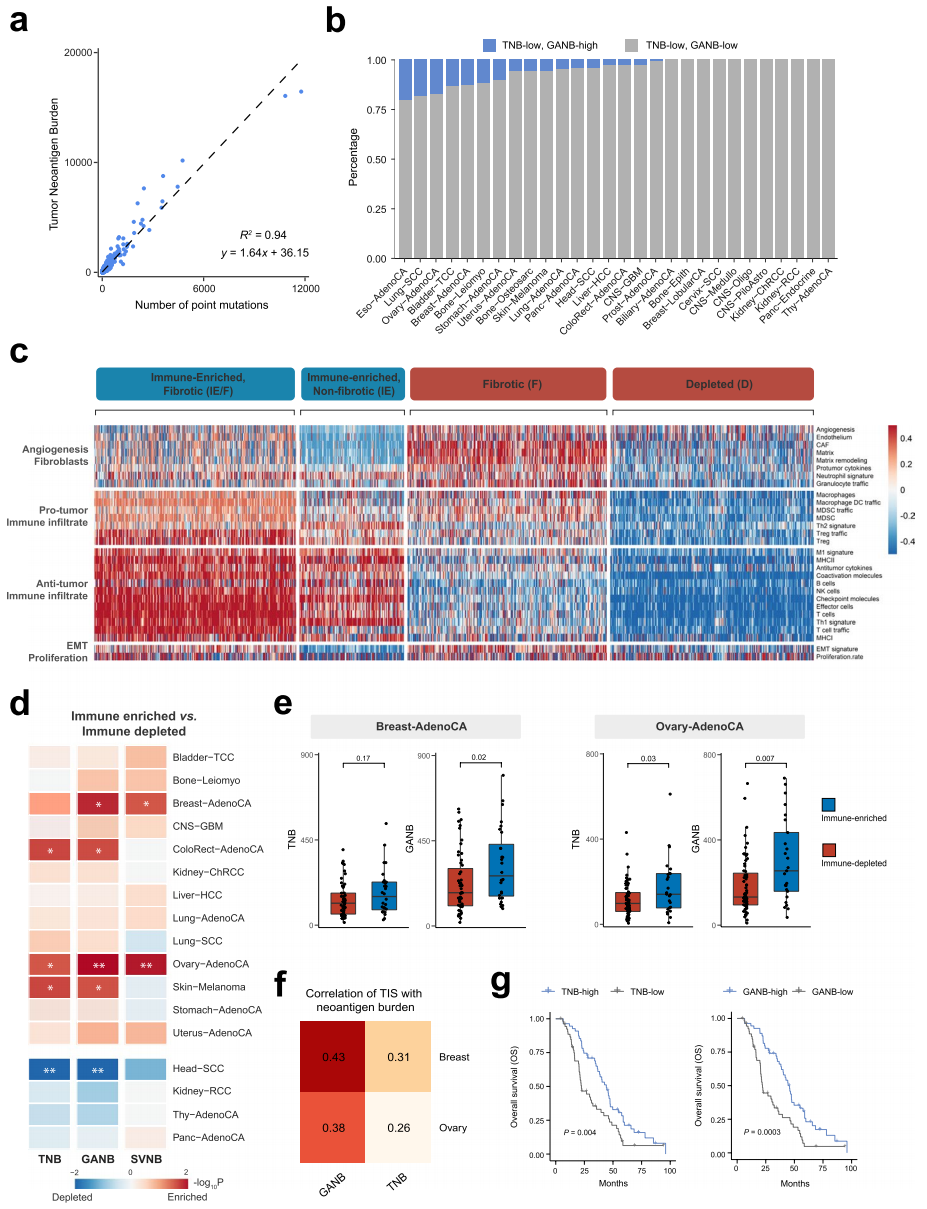
图5.GANB比TNB更全面地表征肿瘤的免疫基因组特征
综上所述,研究团队开发了一个计算工作流程NeoSV,可以预测SV衍生新抗原,并描绘了2528个全基因组的SV衍生新抗原图谱,证明SV是肿瘤新抗原的重要来源。该研究探究了SV衍生新抗原的发生和表达与TME、致癌作用和克隆进化的关系,揭示了SV的免疫原性特性。该研究结果进一步完善了人类肿瘤新抗原图谱,为生物标志物和癌症疫苗靶点选择提供了新的视角。
参考资料:
Shi, Y., Jing, B. & Xi, R. Comprehensive analysis of neoantigens derived from structural variation across whole genomes from 2528 tumors. Genome Biol 24, 169 (2023). https://doi.org/10.1186/s13059-023-03005-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)