首页 > 医疗资讯/ 正文
小胶质细胞作为大脑免疫系统的重要组成部分,除了发挥免疫监视的作用以外,还可以通过清除细胞碎片、吞噬突触、分泌营养因子维持神经元功能。
高血压是一个重要的全球健康问题。尽管高血压的病因各不相同,但大多数原发性高血压患者存在交感神经活动(SNA)升高,这加剧血压升高,而在去肾交感神经支配后可降低血压。
下丘脑室旁核(PVN)是位于第三脑室附近,可控制交感神经输出。投射到脑干延髓前外侧 (RVLM) 的 PVN 前交感神经元(后续简称PVN-RVLM神经元)功能障碍会引起高血压和肥胖症。

2022年7月21日浙江大学医学院史鹏研究团队揭示了小胶质细胞调节外周血压的机制:小胶质细胞配体(血小板衍生生长因子)-神经元受体(血小板衍生生长因子受体)的互作模式。
1 敲除小胶质细胞血压升高,钾离子电流障碍
研究人员通过基因工具小鼠特异性敲除小胶质细胞后小鼠外周血清去甲肾上腺素(NE)和肾上腺素升高,表明交感神经过度激活。此外,小鼠基础心率增加,收缩动脉压明显升高。
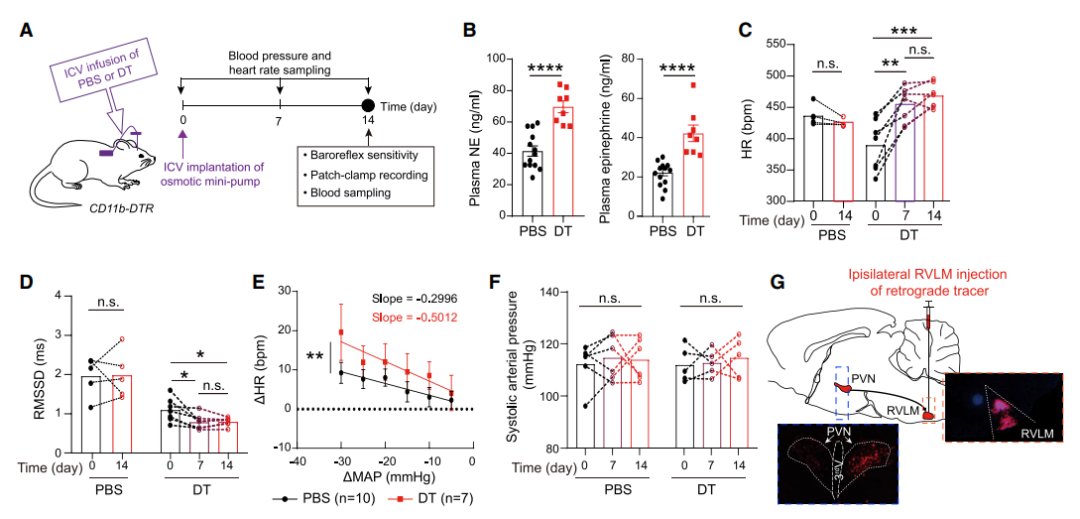
图1:敲除小胶质细胞后小鼠交感神经激活、血压升高
电生理实验发现在正常生理状态下65.4%PVN-RVLM神经元处于不放电状态,剩余进行自发放电活动,但在敲除小胶质细胞后56.9% PVN-RVLM神经元处于放电状态,表明过度兴奋。
在众多离子通道中,钾离子通道是控制产生神经兴奋性的必要因素。在敲除小胶质细胞后低压激活的 A 型钾离子电流和高压激活延迟整流钾离子电流均减弱。单细胞测序技术发现在敲除小胶质细胞后PVN-RVLM神经元编码钾离子通道的基因差异性富集表达,其中Kcnd3基因表达下调较为明显。
选择性抑制Kcnd3基因编码的蛋白Kv4.3可明显阻断低压激活的 A 型钾离子电流,这就表明小胶质细胞可通过表达在神经元上的Kv4.3调控PVN-RVLM神经元放电活动。
2 小胶质细胞来源的PDGF介导钾离子电流障碍
已有研究表明Pdgfb是编码血小板衍生生长因子(PDGF)β亚基的基因可调控少突胶质细胞的钾离子电流,其在小胶质细胞上富集表达,敲除小胶质细胞后Pdgfb表达明显降低。此外,特异性敲除小胶质细胞上的Pdgfb或给与Pdgfb抑制剂可降低Kv4.3在PVN-RVLM神经元上的表达。
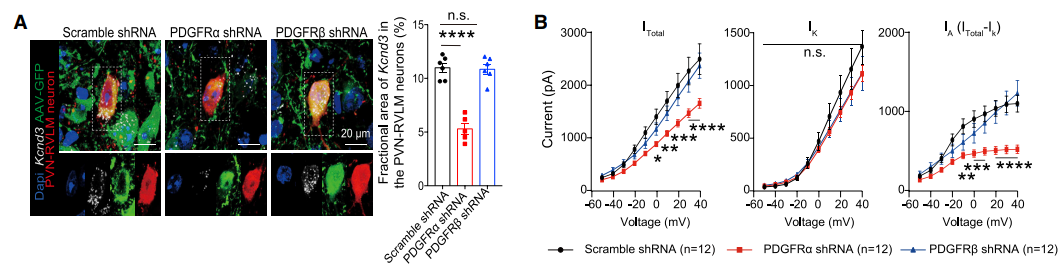
图2:受体PDGFRα 促进Kv4.3蛋白表达
Pdgfb可与两种受体PDGFRα 和PDGFRβ进行结合。离体细胞实验发现PDGFRα拮抗剂可降低小胶质细胞表达Kv4.3,但PDGFRβ拮抗剂则不发挥这种效应。此外,病毒特异性降低PVN-RVLM神经元Pdgfb受体Pdgfbα后能够引起小鼠血压升高,钾离子电流降低,可模拟出敲除小胶质细胞的效应。
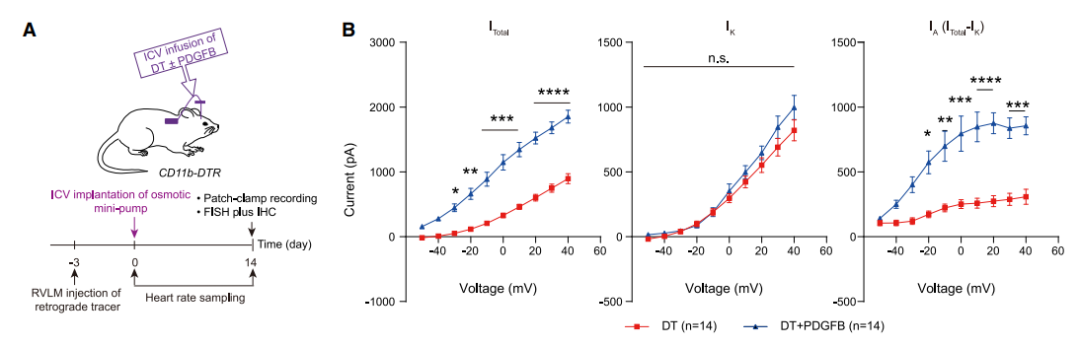
图3:中枢给予Pdgfb可缓解敲除小胶质细胞引起的血压升高
通过侧脑室注射Pdgfb或增加PVN-RVLM神经元Kv4.3表达后能够明显逆转敲除小胶质细胞引起钾离子电流障碍,降低血压。这些结果表明小胶质细胞来源的Pdgfb维持PVN-RVLM神经元钾离子电流。
总的来说,本文揭示了小胶质细胞来源的Pdgfb激活交感神经元的受体PDGFRα促进Kv4.3表达,进而调控钾离子电流介导的交感神经元活性,发挥调节外周血压的功能。
原始出处:
Qianqian Bi, et al. Microglia-derived PDGFB promotes neuronal potassium currents to suppress basal sympathetic tonicity and limit hypertension. Immunity, 2022.
猜你喜欢
- “小问题”碾成“问题”这种心脏病“亲睐”年青人
- 婚前性行为调查惊人结果 细数过早性生活四大危害
- 夫妻之间如何调情才会更有激情
- 女性处女膜修复术是怎样的?女性处女膜修复手术大致分两种
- Lancet Haematol:信迪利单抗联合P-GEMOX一线治疗晚期ENKTL的多中心、单臂、2期研究
- 蒸米饭常犯3个错,学会一招让米饭更好吃
- 读书报告 | 特瑞普利联合化疗围手术期治疗局部晚期胃癌和胃-食管结合部癌的II期临床研究
- 世卫称肺炎疫情致90%国家出現环境卫生服务项目终断吁慎重解除限制
- Am J Rhinol Allergy:度普利尤单抗显著改善阿司匹林加重性呼吸道疾病患者生活质量:真实世界研究揭示长期疗效
- 怎么治疗淋病合并症精囊炎呢,淋病合并症精囊炎有什么表现
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)