首页 > 疾病防控/ 正文
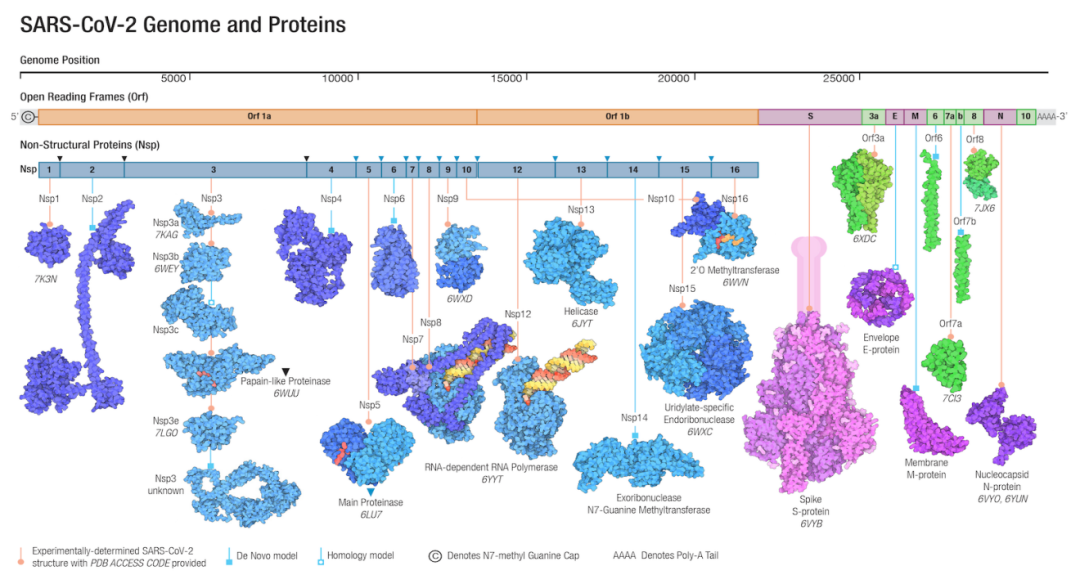
我和大家汇报的是「新冠抗病毒小分子药物临床研发进展」,新冠肺炎已经整整两年了,疫情不断发展、病毒不断变异,截至2022年2月8日,全球接近4亿患者确诊,死亡人数超过570万;作为呼吸科医生,面对的困难和挑战仍然非常大,病毒全基因组在2020年1月初被鉴定出来,在全世界公布之后,科学家对它的基因组和主要蛋白都做了解析,蛋白质组学鉴定出1707个靶蛋白,少部分的蛋白被用于药物的研发。
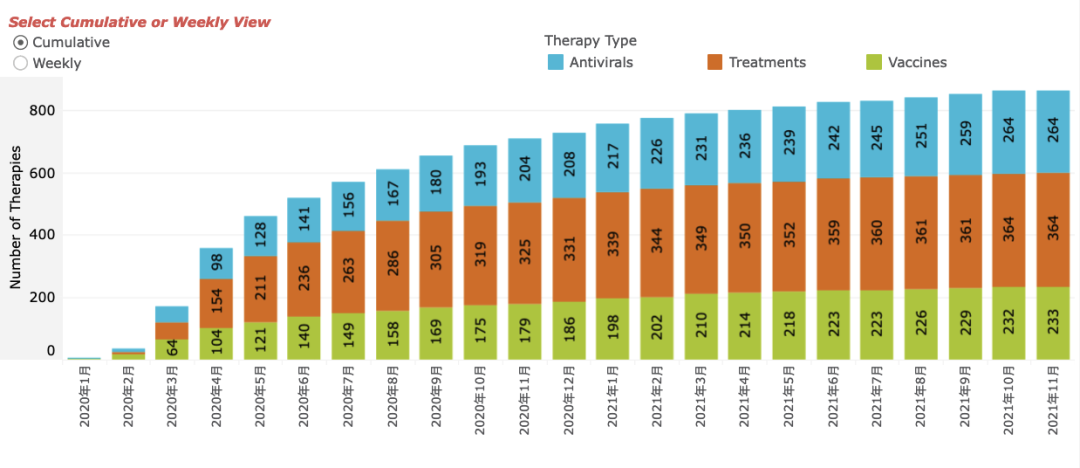
截止到2021年11月,COVID-19新药研发管线还是很多的,有264个抗病毒候选药物,我们可以分成三大类,一、疫苗类药物,二、抗新冠病毒的蛋白类药物,三、小分子药物。
我这么区分是有原因的,因为这三大类药物的成药机会不一样,疫苗研发成功率较高,最容易成功上市,单克隆抗体药物次之(已有61个候选药物靶向阻止病毒复制),而小分子药物研发难度大。当然我们也不能忘记传统中药,我国中医专家开发出三方三药,在新冠疫情的控制当中起到非常重要的作用。
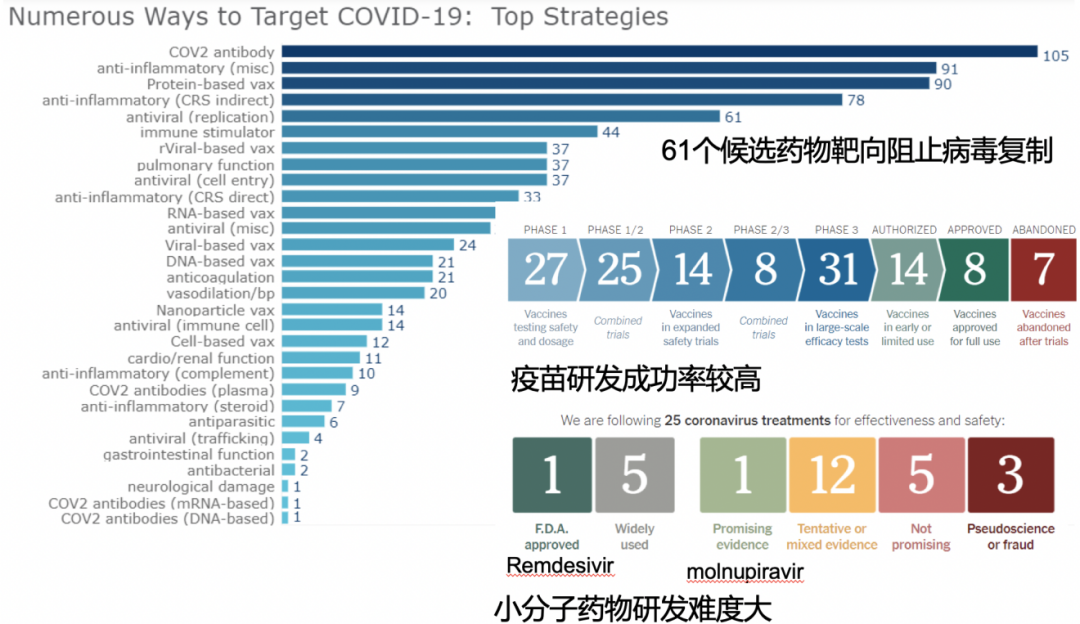
(图注:MISC=Multisystem inflammatory syndrome in children;CRS=cytokine release syndrome;VAX=vaccine)
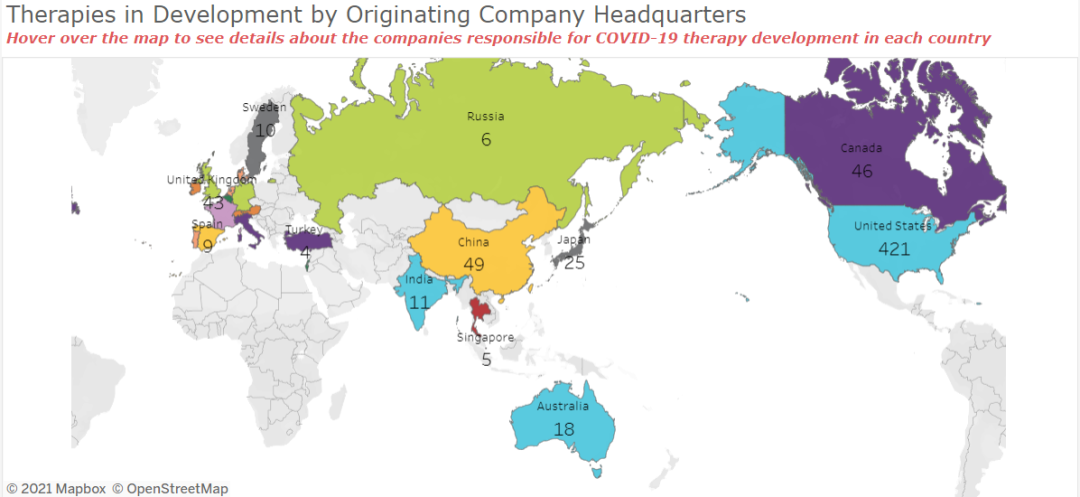
按照地区来划分的话,药物的研发重心在北美,美国的研发产品、创新企业远远高于世界上其他国家和地区。
口服药物具有无可比拟的优势:大部分的小分子药物可以口服,给药方便(相比之下绝大部分的生物技术产品都采用注射类给药方式,患者依从性差),可以用在门诊轻症患者身上,方便轻症患者治疗,包括感染后、暴露前、暴露后等治疗,它可作用于细胞内,包括细胞核内靶点与细胞外的靶点,且小分子药物对储存环境的敏感性相对较低,储存运输方便。另外,几乎没有免疫原性,所以过敏反应几乎可以忽略不计。而且具有相对成熟的靶点,若进行的微小改动可能有意想不到的效果。
现在小分子抗病毒药物主要靶点有两个,一个是RdRp类似物,另一个是Mpro (3CL)。
疾病严重程度由病毒感染和宿主反应共同决定
我们谈到COVID-19的时候,说的其实是一种「疾病」,而不只是一种「病毒」,病毒和人的相互作用称为感染,前10年,我们对感染性疾病的认知是关注病原体识别、清除病原体,但我们现在越来越认识到「疾病严重程度由病毒感染和宿主反应共同决定」,对于宿主的干预也是非常重要的,包括抗炎、免疫调节、对脏器损伤的保护,在未来10年或更长时间,这一点是关注感染性疾病的医生需要特别重视的。
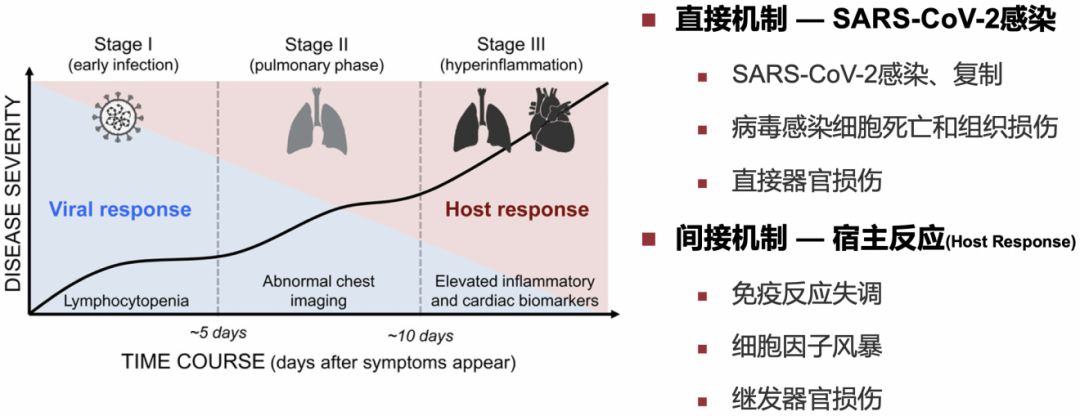
在COVID-19疾病不同阶段,用药也不同。早期主要是病毒复制阶段,抗病毒药物(包括单克隆抗体)在这个阶段会起到作用;在病毒载量已经达到峰值,或已经开始下降时,免疫调节和器官保护将是治疗的主要手段。

这张图列出来了现在已知的COVID-19潜在治疗靶点:
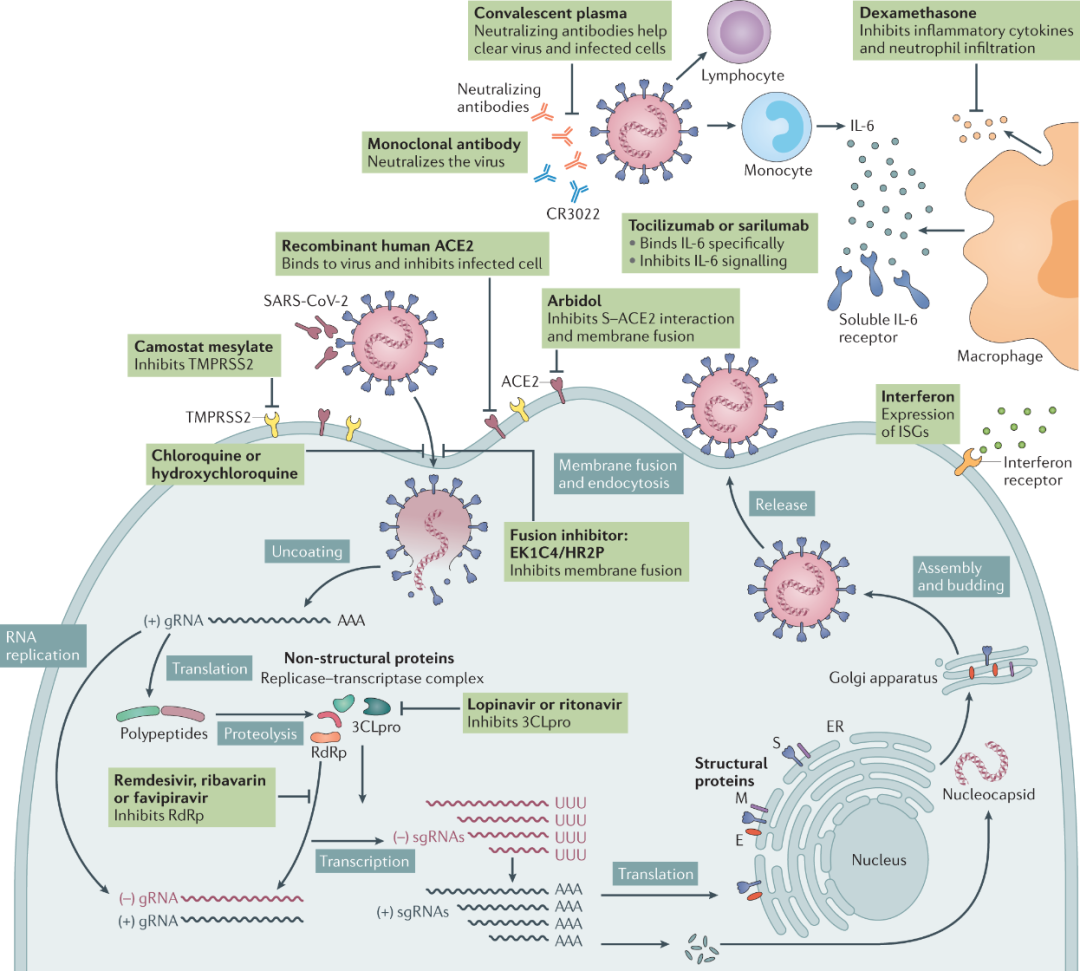
潜在治疗靶点和在研药物总体来说是可以分成这三大类,一、抑制病毒复制(瑞德西韦、Molnupiravir、PF-07321332、AT-527、法匹拉韦),二、阻断病毒进入细胞(羟氯喹、抗雄激素药物、阿比多尔),三、免疫调节(糖皮质激素、JAK抑制剂、阿奇霉素、秋水仙碱),我来和大家逐一分析。
第一类:抑制病毒复制
1、瑞德西韦:
瑞德西韦是一种具有广谱抗RNA病毒效果的核苷类似物前体,其进入细胞经磷酸化后生成的活性代谢物(remdesivir triphosphate)可通过与病毒RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)结合而抑制病毒复制。
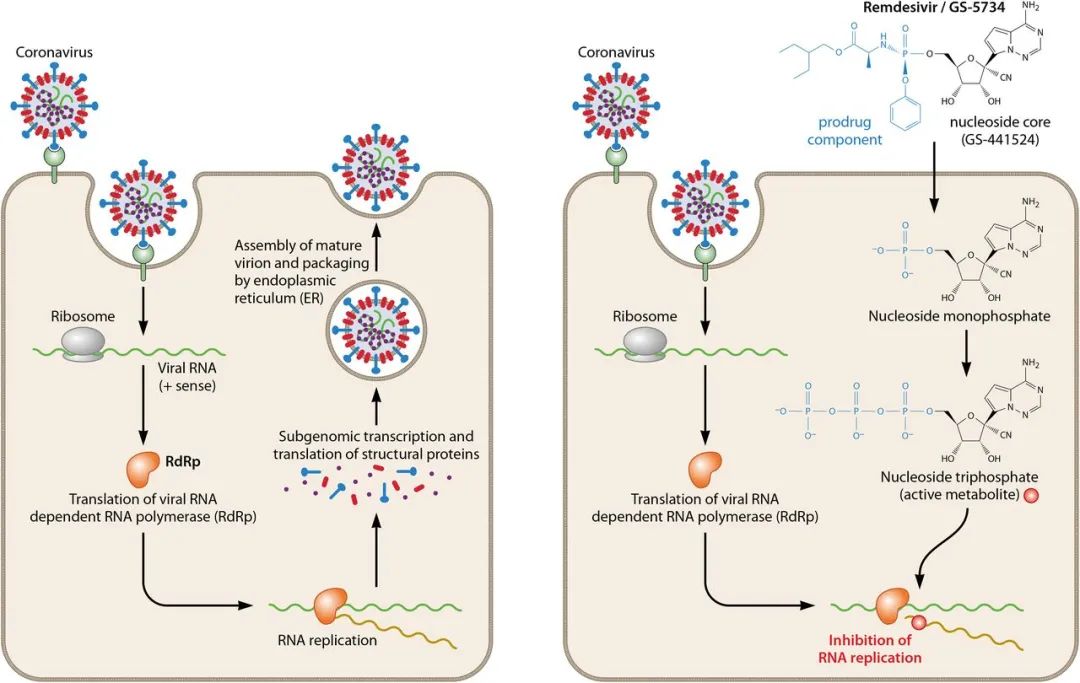
最早启动瑞德西韦临床研究是2020年2月5日,之前我们在阅读文献时发现,早期体外实验中,瑞德西韦是体外抗冠状病毒——MERS-CoV(下图左)、SARS-CoV-2(下图右)活性最强的抗病毒药物。
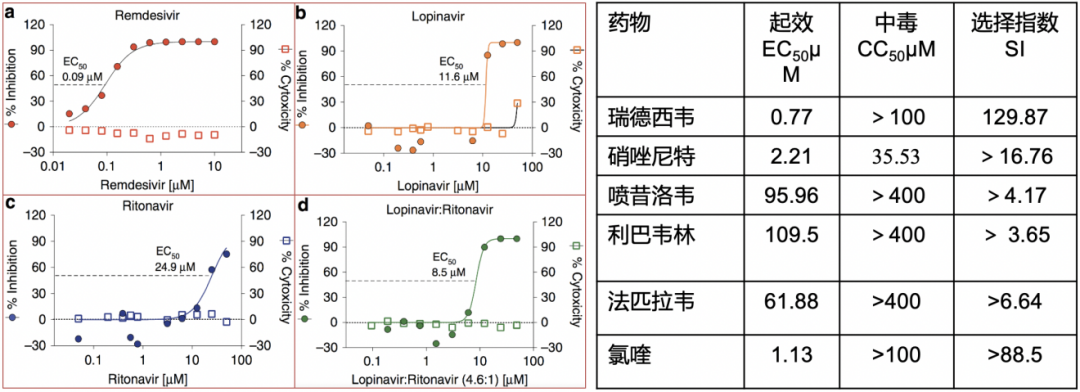
2020年3月1日,WHO推荐了亟待评价的COVID-19药物。
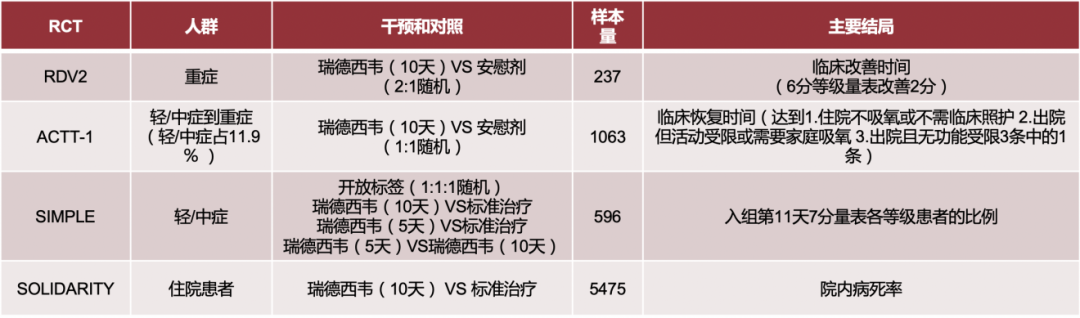
瑞德西韦排在第一位,我们团队也牵头完成了全世界第一项关于静脉使用瑞德西韦治疗重症新冠的临床研究,RDV2的研究,样本量为237例,瑞德西韦(10天)VS 安慰剂(2:1随机)。但这个研究结果并没有发现它能够降低重症患者病死率,临床改善时间也不明显(6分等级量表改善2分)。
分析一下原因,我们这项研究中患者发病到入组的平均时间为12天,在做亚组分析的时候,发现从发病到入组的时间如果在10天以内,相对于安慰剂的对照组,治疗组患者的症状是能够得到显著改善的。
后来,美国国立卫生研究院(NIH)牵头了ACTT-1的研究,他们采用的研究方案和我们类似、样本量比我们的研究大,为1063例,入选的人群为轻/中症到重症,其中轻/中症占11.9%,瑞德西韦(10天)VS 安慰剂(1:1随机),他们认为临床恢复时间有缩短的(达到1、住院不吸氧或不需临床照护;2、出院但活动受限或需要家庭吸氧;3、出院且无功能受限3条中的1条)。
另一项WHO牵头的OLIDARITY研究的样本量更大,有5475例,瑞德西韦(10天) VS 标准治疗,但也没有发现有降低院内病死率的作用。
BMJ网状meta分析显示:瑞德西韦在病死率 OR 0.90 [95%CI 0.70-1.12];临床改善时间 Mean Difference(MD) -2.0天 [95%CI -4.2天,0.9天];机械通气风险OR 0.68 [95%CI 0.41-1.00]等方面均无显著临床获益。
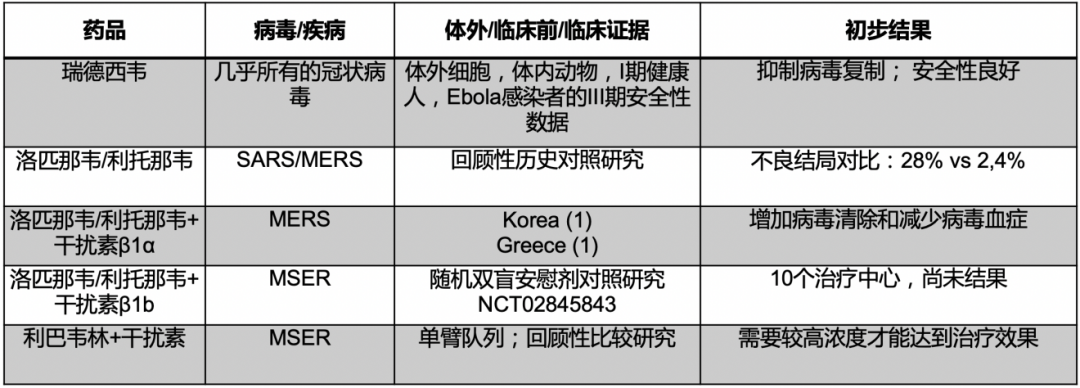
所以目前,世界不同的学术机构对瑞德西韦的推荐是这样的基于ACTT-1研究的亚组分析,NIH指南推荐在「住院需要低流量氧疗,但未接受机械通气」的患者中使用瑞德西韦。而WHO COVID-19药物动态指南目前不推荐对住院COVID-19患者使用瑞德西韦。
总体来说,瑞德西韦对住院人群的临床使用尚有争议:不同指南制定专家组考虑证据的角度不同,尚无早期用药的证据发表(抗病毒药物用药的最佳时机尚不确切)。
2、Molnupiravir:
Molnupiravir(MK4482 /EIDD-2801)是一种口服核苷类似物的前体药物,最初是在研发治疗委内瑞拉马脑炎病毒(VEEV)的治疗药物时被发现,后被证明有抗流感病毒、冠状病毒等多种RNA病毒活性。
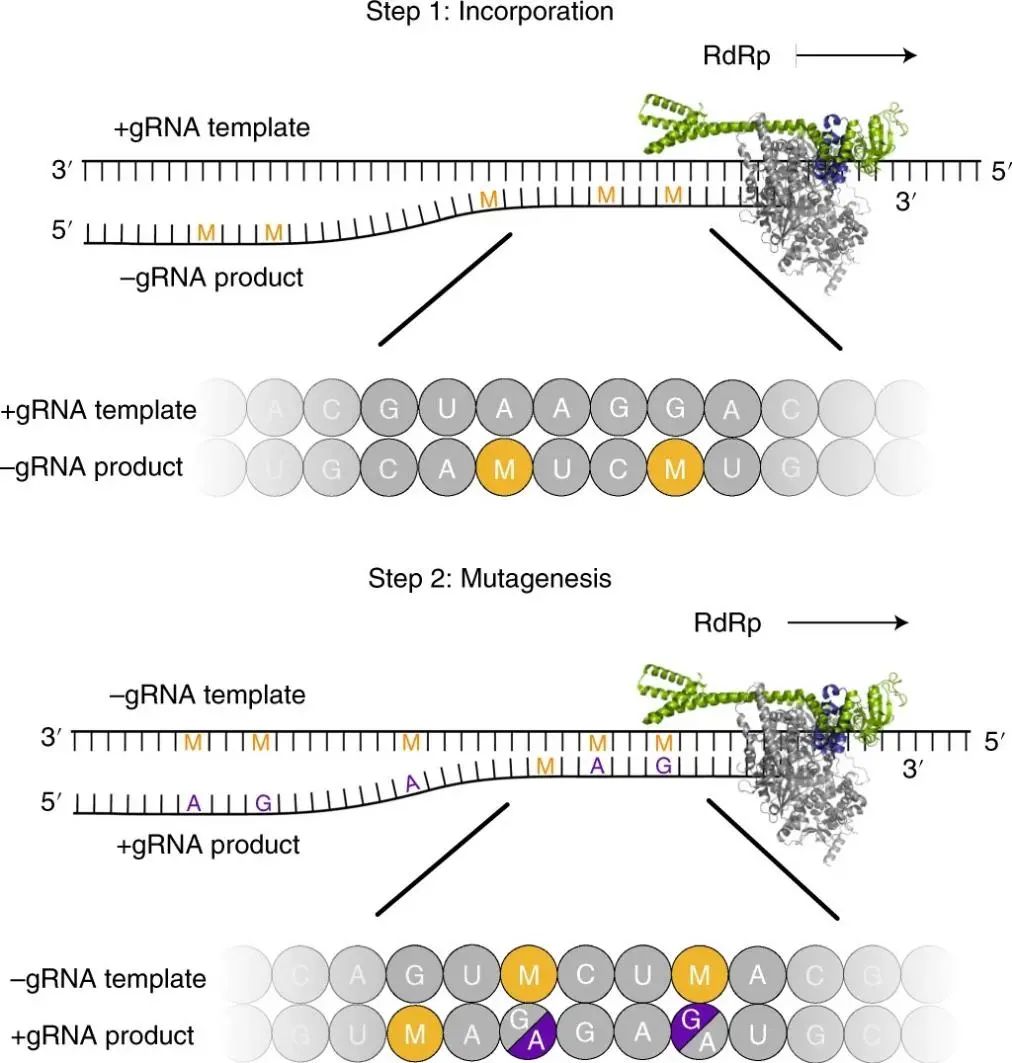
Molnupiravir在体内可以被转化成核苷酸类似物β-d-N4-hydroxycytidine(NHC),NHC的三磷酸形式MTP与CTP和UTP的结构类似,可以代替它们与RdRp结合,且NHC与碱基G和A均能形成稳定的碱基对。当RdRp使用正链基因组RNA作为模板合成负链基因组RNA时,大量的C和U被M替代。当使用含有M的负链RNA作为模板合成正链基因组RNA时,由于G和A均可以与M配对,会随机产生大量的G→A突变和A→G突变。正链RNA产物发生突变,无法形成完整的子代病毒。
在体外细胞实验中,人肺上皮细胞系Calu-3细胞中应用Molnupiravir的活性形式NHC,以剂量依赖的形式抑制SARS-CoV-2的复制,且不影响细胞的存活率,说明它既有抗病毒活性,又有一定的安全性:
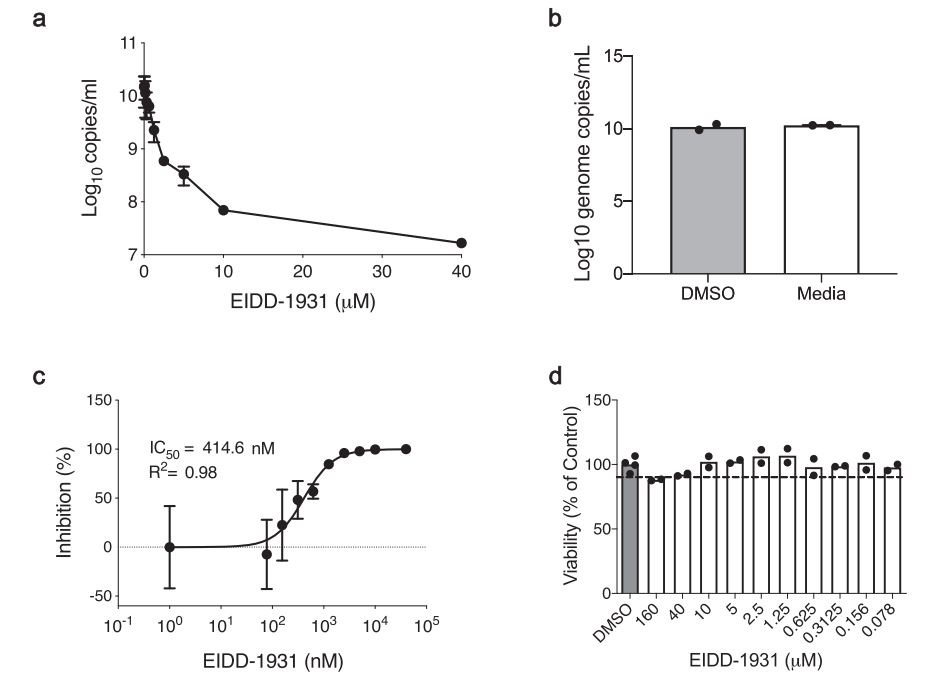
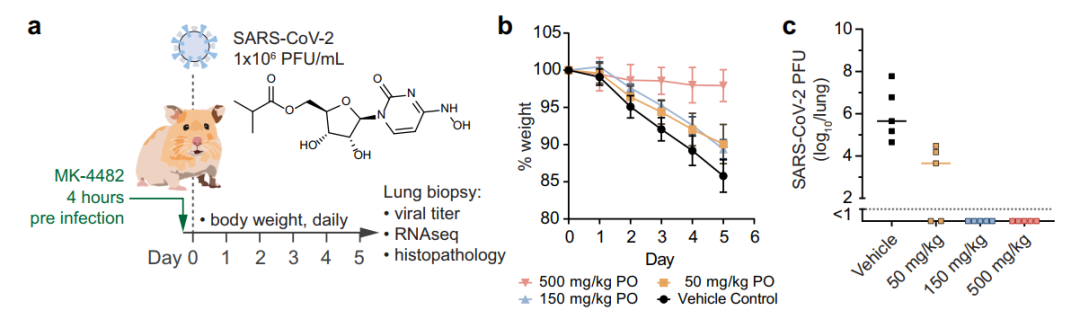
在动物实验中,叙利亚仓鼠(Syrian hamsters)经鼻感染SARS-CoV-2前应用口服Molnupiravir,可以以剂量依赖的形式预防体重下降、降低肺中病毒载量、减少免疫细胞浸润:
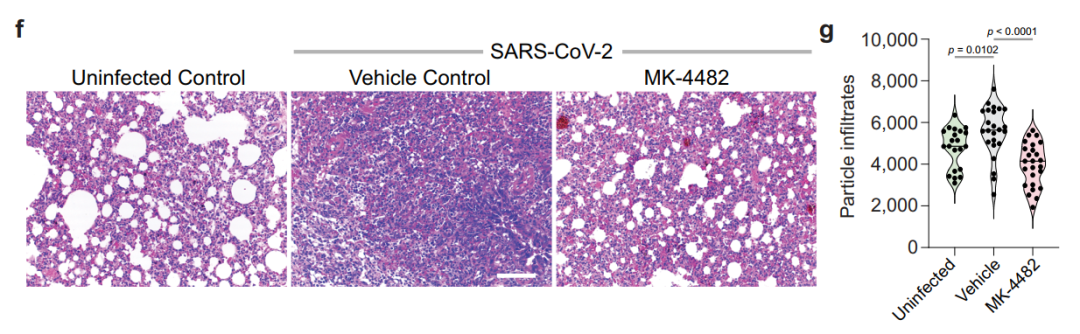
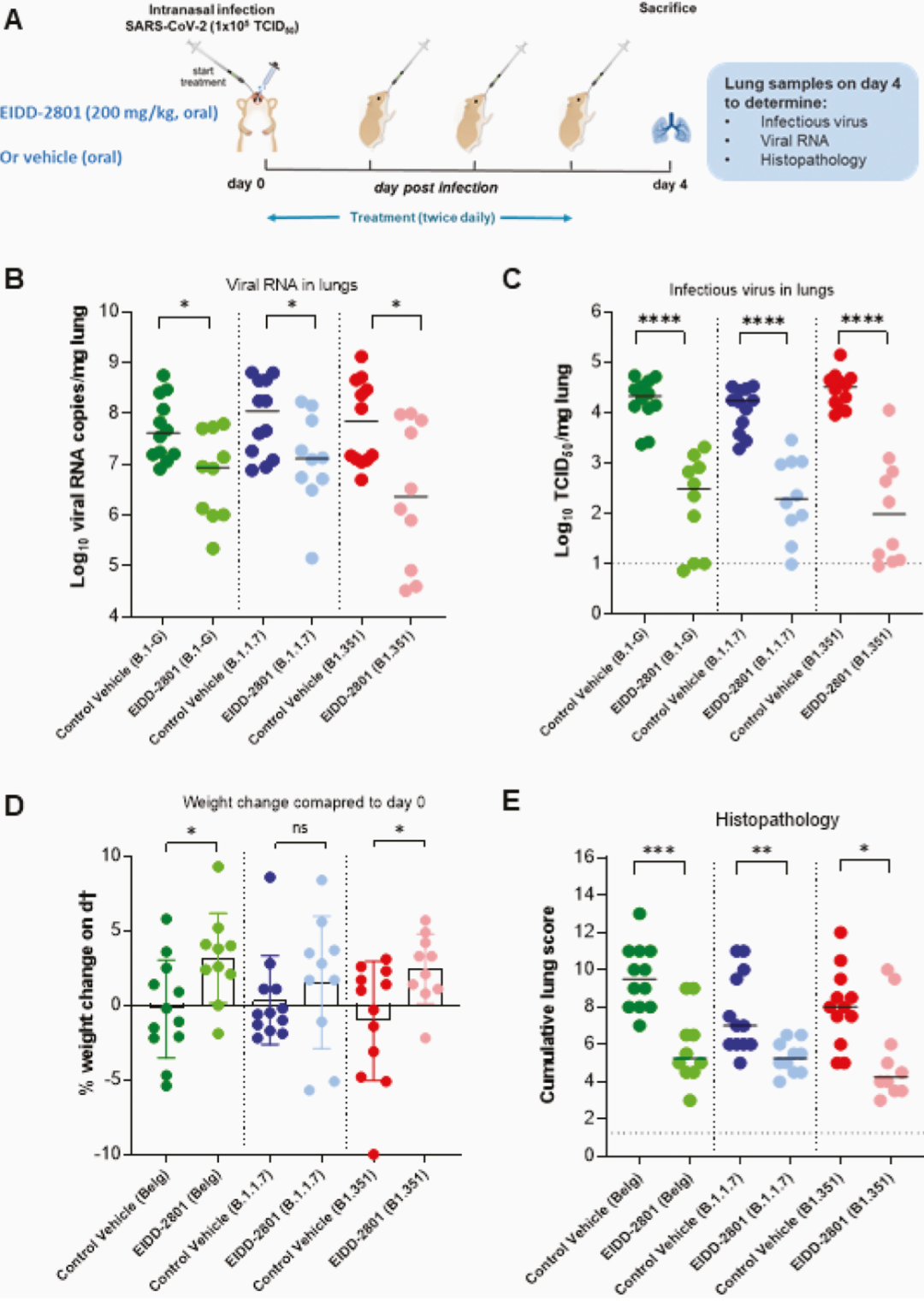
叙利亚仓鼠用三株不同SARS-CoV-2分别经鼻感染后,治疗性地应用口服Molnupiravir均可以降低肺中的病毒载量、减轻肺部病理改变、阻止仓鼠体重下降:
Molnupiravir的IIa期临床试验是希望看到它能不能降低病毒载量,纳入202例发病7天内的非住院COVID-19患者(800mg组n=55,400mg组n=62,200mg组n=23,安慰剂组n=62),主要结局:核酸转阴时间;次要结局:鼻咽拭子无法分离到具有感染力的病毒的时间(time to infectious virus elimination from nasopharyngeal swabs);结果发现,800mg组核酸转阴时间显著缩短,第3天/第5天鼻咽拭子分离到活病毒的比例显著下降(下图左),800mg组病毒载量下降最快(下图右),这为Molnupiravir开展III期临床试验提供了信息。
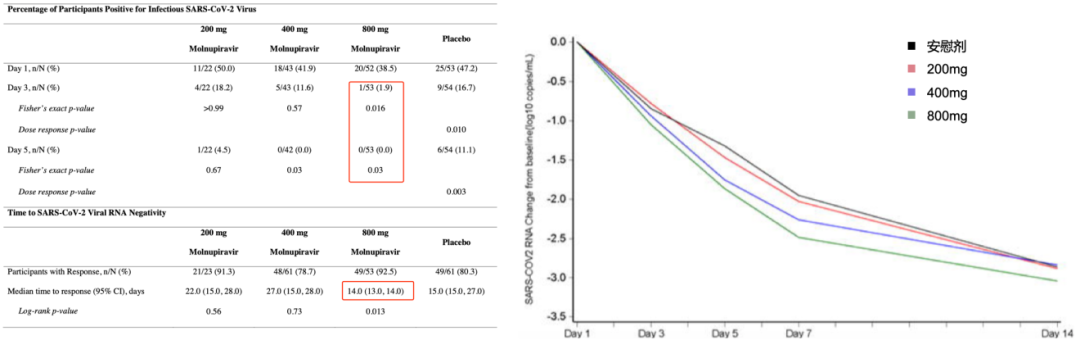
III期临床试验中,研究者牵头了两项研究,一个是门诊MOVe-OUT试验,另一个是住院MOVe-IN试验。其中MOVe-IN因为入组发病10天以内的住院患者,根据第一阶段结果,住院患者获益可能性较小,相关试验已终止。(III期临床试验研究均为Press Release状态,无详细数据,需等待结果正式发表)
目前,英国第一个紧急授权使用(非获批),EMA和FDA审评中。
3、PF-07321332
PF-07321332 是一种口服的Mpro(main protein,蛋白主酶,又称3CLPro)抑制剂,这种药物作用机制是这样的:SARS-CoV-2入侵细胞后,会立即利用细胞内的物质合成自身复制必需的两条超长复制酶多肽(pp1a和pp1ab),Mpro在复制酶多肽上存在至少11个切割位点,只有当这些位点被正常切割后,这些病毒复制相关的「零件」才能顺利组装成复制转录机器,启动病毒的复制。
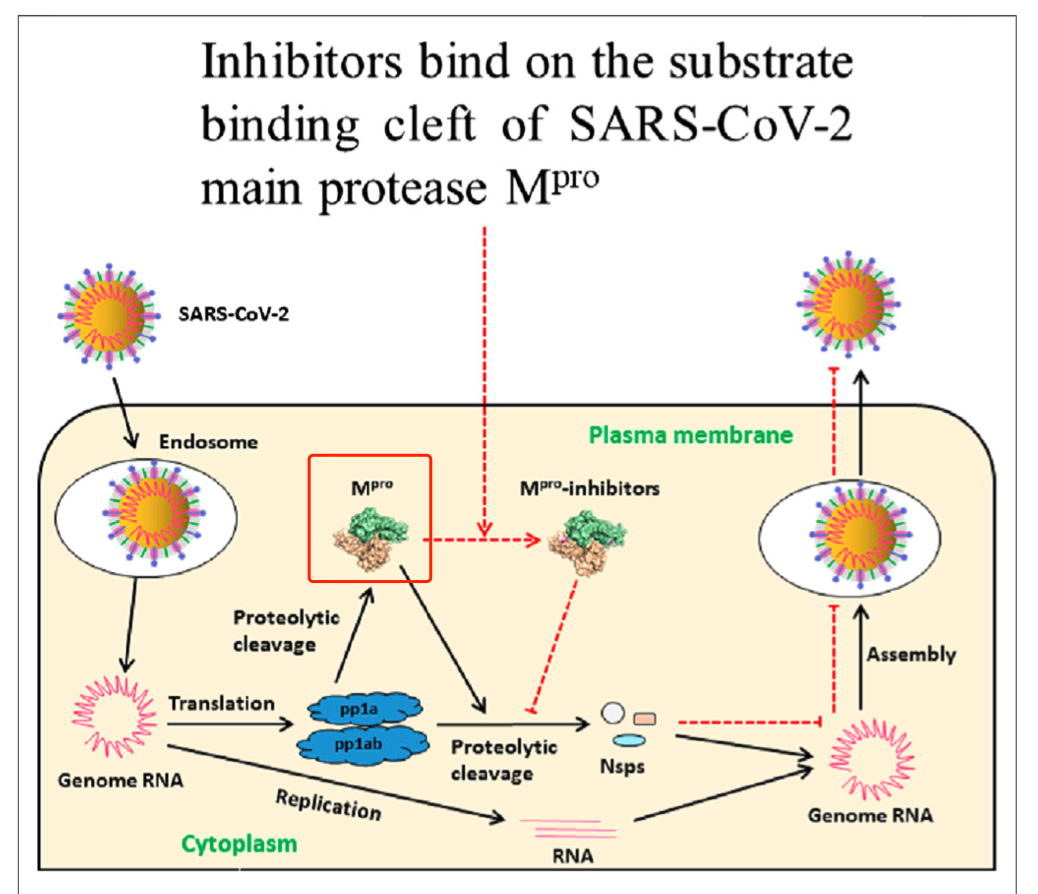
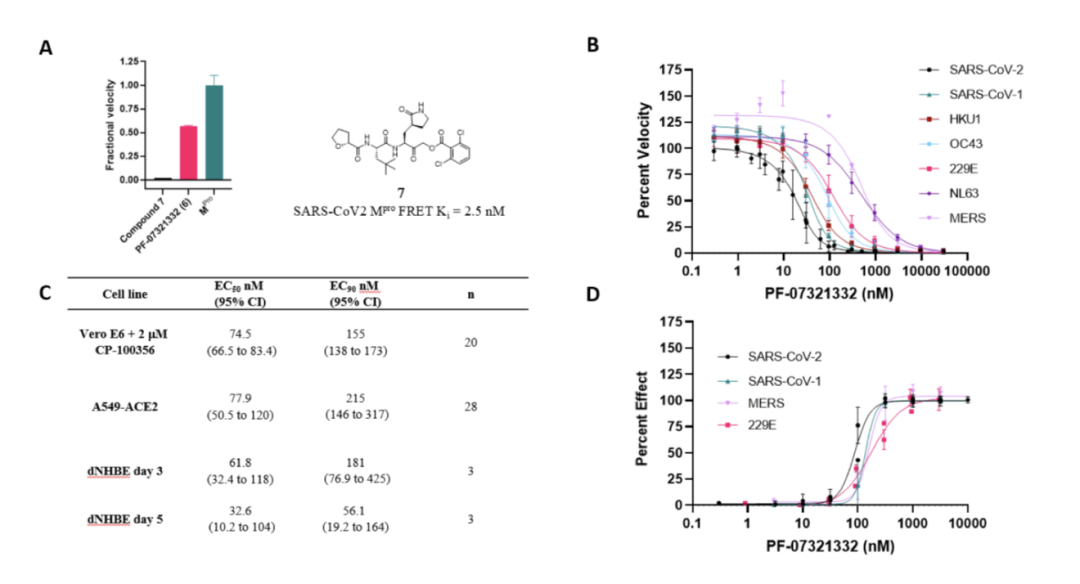
所以,如果是有一种药物能够阻断主要的蛋白酶,也将起到抑制病毒复制的作用。PF-07321332在体外有良好的抗病毒活性:
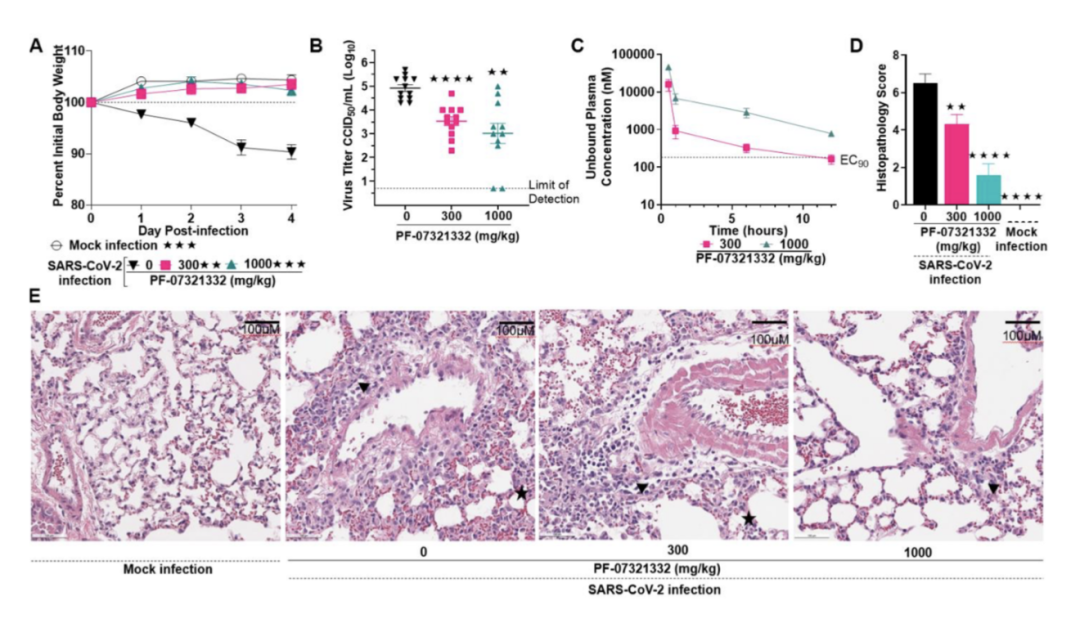
另外,在动物实验中,小鼠模型提示,PF-07321332可以减轻小鼠体重降低和肺部组织损伤:
但这种药有个问题是它在肝脏代谢非常快,所以药物研发时,研究人员在I期临床试验做了尝试,发现与单独应用相比,PF-07321332 和CYP3A4抑制剂利托那韦联用可以更好的维持血药浓度:
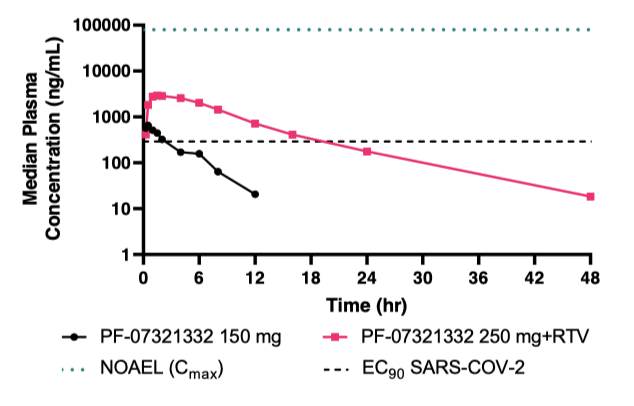
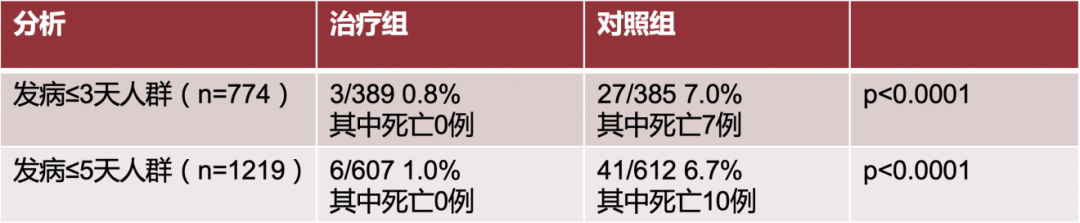
最后成药时,PF-07321332/利托那韦联合用药有了商品名PAXLOVID,针对它的II/III期临床试验,一项针对高危门诊患者(EPIC-HR),一项针对低危门诊患者(EPIC-SR),一项为暴露后预防研究(EPIC-PEP)。EPIC-HR III期临床试验的研究人群是高危轻症,即COVID-19成人非住院患者、发病≤ 5天、至少一个高危因素,主要终点为发生住院/死亡的比例(28天)。
中期分析结果显示,治疗组住院/死亡的比例显著低于对照组,降低幅度超过80%,所有研究人群的28天随访显示,PF-07321332/ritonavir未报告死亡患者,安慰剂组报告10(1.6%)的死亡事件。
经DSMB讨论和美国FDA咨询,因突出疗效EPIC-HR临床试验停止招募。
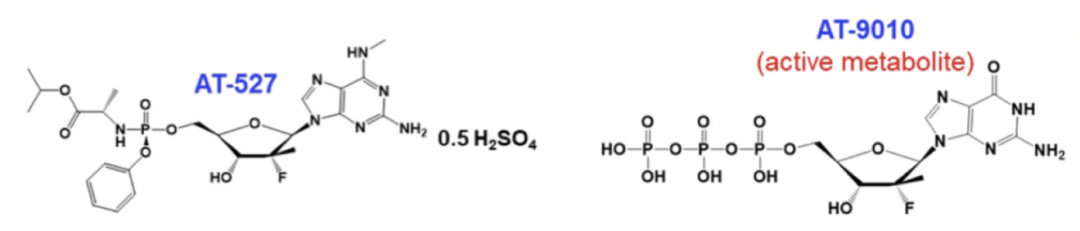
4、AT-527:
AT-527是一种口服的核苷类似物的前体药物,其活性形式AT-9010可以具有双靶点的作用,通过与RdRp和NiRAN(核苷酸转移酶)结合抑制SARS-CoV-2复制。
门诊II期试验(MOONSONG)的研究设计纳入了发病五天内的门诊COVID-19患者,这个研究的主要终点和其他试验不太一样,它主要是想观察病毒载量的变化。其实这也很容易理解,因为药物是一个抗病毒药物,如果应用后没有看到病毒载量下降,大家心中会存疑。
这项研究干预组n=21,对照组n=20纳入m在总人群中,两个用药诅的病毒核酸载量相比安慰剂组无明显下降,没有达到主要结局在有危险因素的高危门诊人群中(样本量较低),在第7天观察到550mg组(n=7)相对安慰剂组(n=11)有显著下降(预先设置的亚组分析);1100mg组(n=14)相对安慰剂组(n=7)有显著下降(事后亚组分析)。
但是由于II期的样本量较小,且入组患者疫苗注射状态、感染的突变株变化很大,可能无法准确的评估药物的疗效。
5、法匹拉韦
我们熟知的法匹拉韦是一个抗流感的二线药物,但它本质上也是一种RdRp抑制剂,可能抑制SARS-CoV-2的复制。
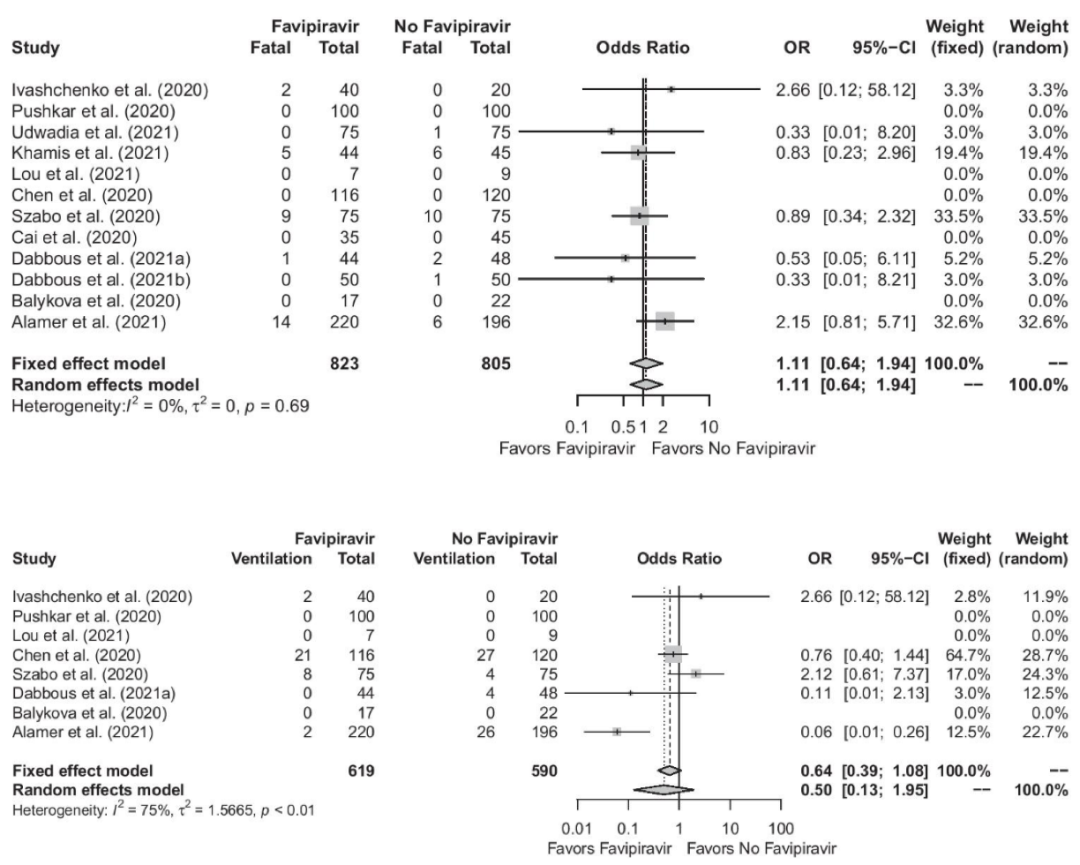
纳入12项RCT约1600例患者的meta分析提示,法匹拉韦对COVID-19患者的病死率无显著影响(RR 1.11 95%CI [0.64-1.94]);纳入8项RCT约1600例患者的meta分析提示,法匹拉韦对COVID-19患者的机械通气风险无显著影响(RR 0.64 95%CI [0.39-1.08]),大家越来越觉得它应用于COVID-19治疗的希望不是特别明显。
第二类:阻断病毒进入细胞
1、羟氯喹:
羟氯喹是一种抗疟及抗炎药物,部分研究报道,羟氯喹在体外对SARS-CoV-2有抗病毒作用,潜在机制包括:通过抑制宿主受体的糖基化干扰病毒-宿主受体的结合以及升高endosome的PH抑制膜融合(membrane fusion),从而抑制病毒进入细胞。疫情早期部分观察性研究、小样本临床试验提示羟氯喹可能有临床获益。
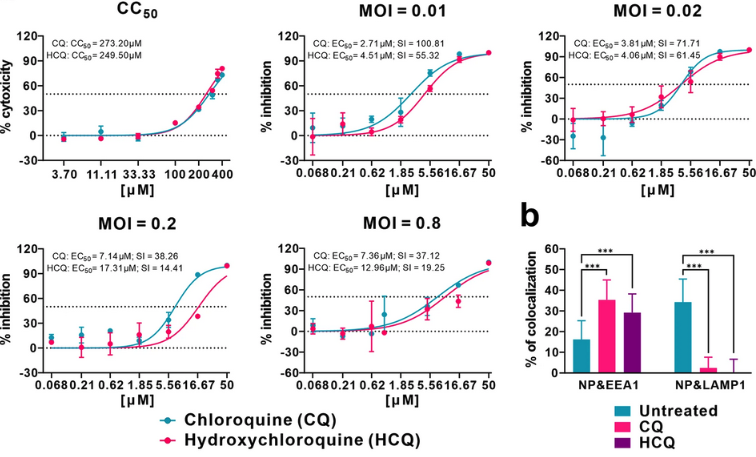
美国FDA2020年3月28日就对羟氯喹发布了紧急使用授权,它在世界范围的COVID-19患者中被Off-label使用。
但是随后多项RCT及RCT的meta分析证明,在降低病死率、加速临床恢复、缩短住院时长等重要临床结局方面,羟氯喹治疗并不能使患者获益,甚至可能增加不良事件的发生率。美国FDA于2020年6月15日撤回了羟氯喹的紧急使用授权,之后更新的各国指南已不推荐使用羟氯喹。
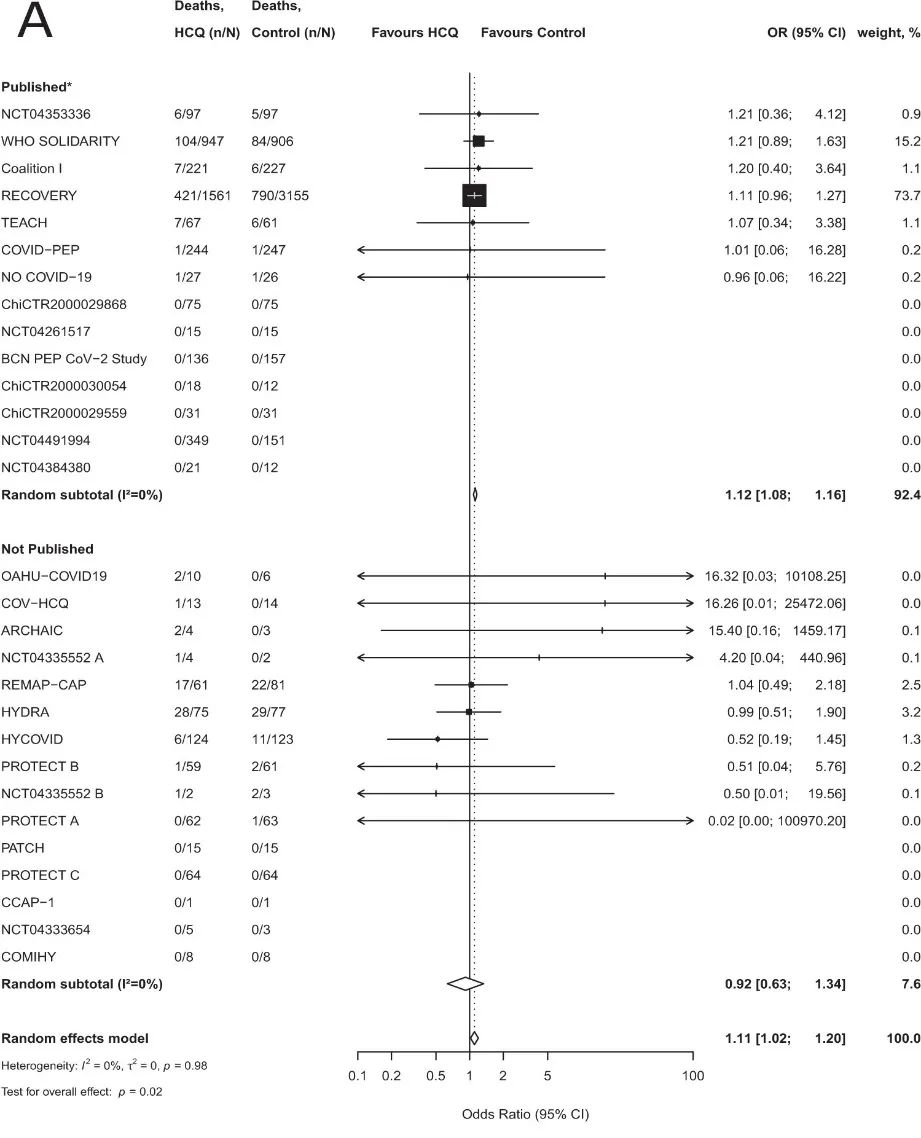
一项2021年4月发表,纳入26项RCT的meta分析发现,羟氯喹治疗COVID-19可能使患者「病死率升高」(OR 1.11, 95%CI [1.02, 1.20])。
2、抗雄激素药物
雄激素(androgen)调控ACE2以及TMPRSS2相关基因的转录和表达,雄激素拮抗剂可能调低ACE2、TMPRSS2的表达从而抑制SARS-CoV-2进入细胞。
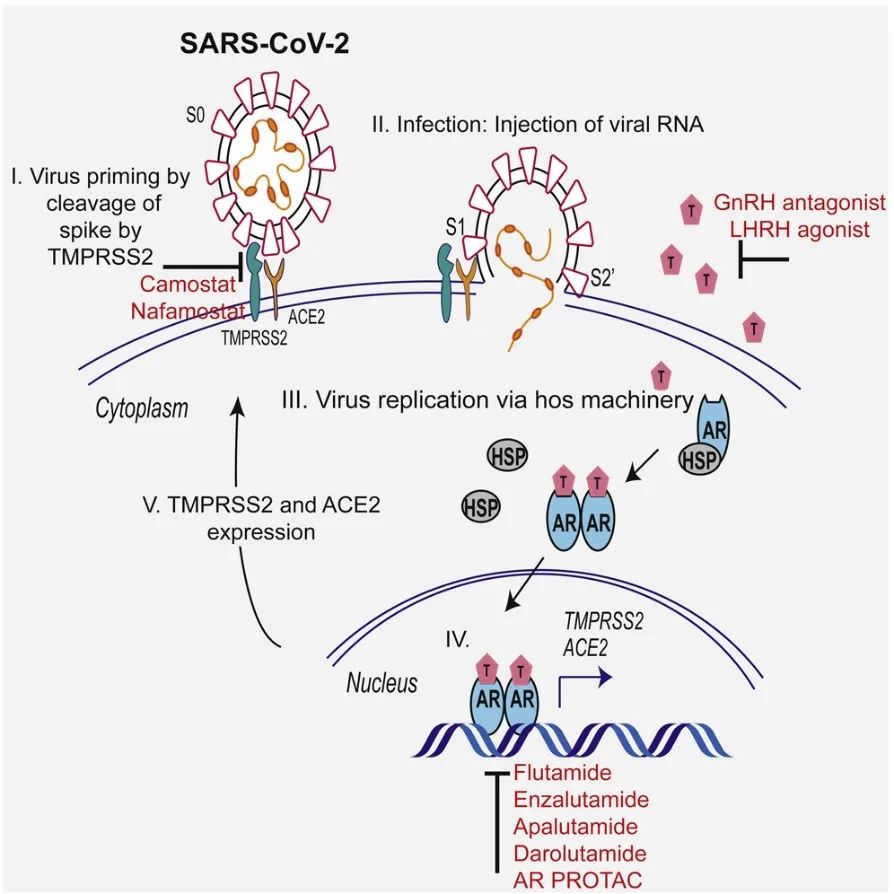
现在已经进入临床试验的是Proxalutamide,是一种雄激素受体拮抗剂,一项纳入214例男性门诊COVID-19患者的双盲RCT提示, Proxalutamide可以显著降低患者的住院率(2.2% vs 26%,p<0.001,RR 0.09 95%CI[0.03-0.27])(下图左)。一项纳入236例门诊轻中度COVID-19患者(108女,128男)的双盲RCT提示, Proxalutamide可以显著加快病毒清除和临床恢复(下图右)。
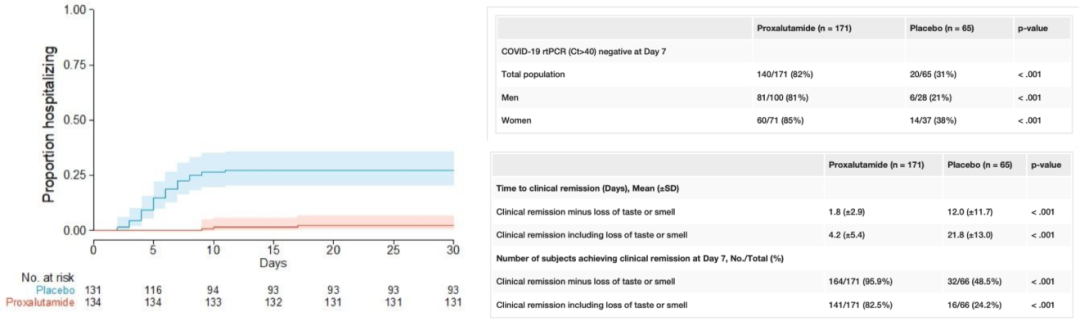
另外对于重症患者也做了临床观察,纳入645例住院且未接受机械通气的COVID-19的患者试验组,中位8等级量表评分显著低于对照组、试验组14天恢复率与28天病死率显著低于对照组。但是这个结果还没有正式发表。
3、阿比多尔:
阿比多尔是一种血凝素抑制剂,最初作为抗流感病毒药物被临床使用,它可能抑制病毒S蛋白和ACE2受体的结合,抑制膜融合(membrane fusion),从而抑制病毒进入细胞。但Meta分析提示,阿比多尔与对照组相比无显著临床获益。
第三类:免疫调节
图为细胞因子风暴在重症COVID-19发病机制:
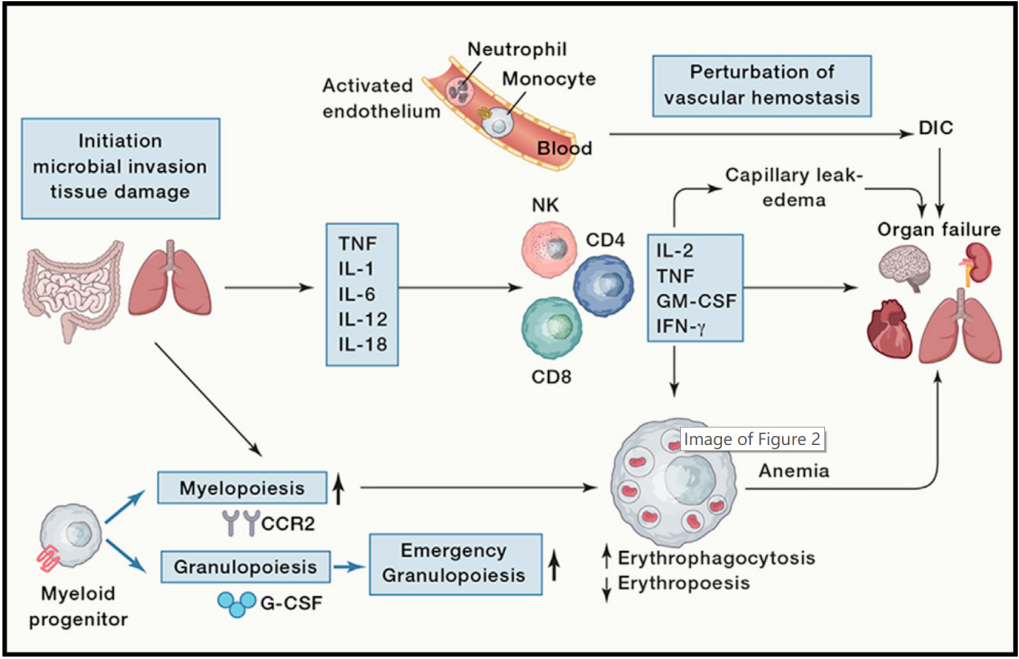
1)感染造成受累细胞(包括免疫细胞)死亡;2)致病微生物感染可以直接刺激骨髓,主要进行髓系造血;3)在这个过程中,G-CSF自然增多(所以补充G-CSF无益,甚至有害);4)单核/巨噬细胞增多,产生一定程度的嗜血,造成贫血;5)如果存在血管损伤(例如:COVID-19内皮炎),DIC几乎难以避免;6)凝血障碍激活补体系统,进一步造成细胞损伤;7)特别当存在内皮细胞损伤的时候,外周血淋巴细胞附壁,是临床观察到的「淋巴细胞减少」假象的重要原因;8)贫血、微循环障碍和细胞死亡共同作用下,产生多器官功能障碍(衰竭)。
1、糖皮质激素
它被证明有一定的临床疗效,因为糖皮质激素是一类强效的小分子抗炎药物,非常广谱、作用多靶点。自COVID-19疫情暴发,糖皮质激素能否治疗COVID-19这一临床问题受到了广泛的讨论,RECOVERY试验地塞米松臂提供了决定性证据。
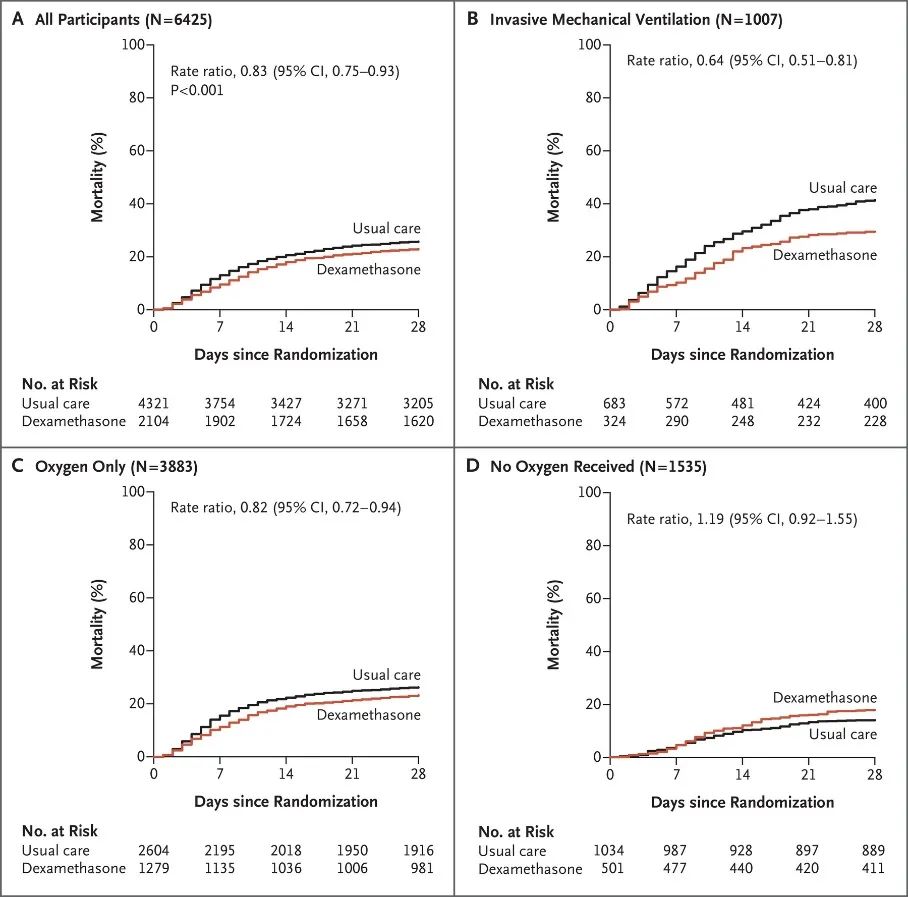
图:RECOVERY研究—COVID-19多臂、多中心、开放标签RCT
其中,需要氧疗但不需要有创通气的患者28天病死率降低18%(RR 0.82 95%CI [0.72, 0.94]),机械通气患者28天病死率降低36%(RR 0.64 95%CI [0.51, 0.81]),地塞米松成为首个被确认能够降低住院COVID-19患者病死率的药物。
WHO工作组主导的meta分析进一步证实,糖皮质激素能够显著降低重症COVID-19患者的28天病死率(OR 0.66,95%CI [0.53,0.82])。
目前,小剂量、短疗程糖皮质激素已成为COVID-19重症患者的标准治疗手段之一。
2、JAK-STAT通路抑制剂:
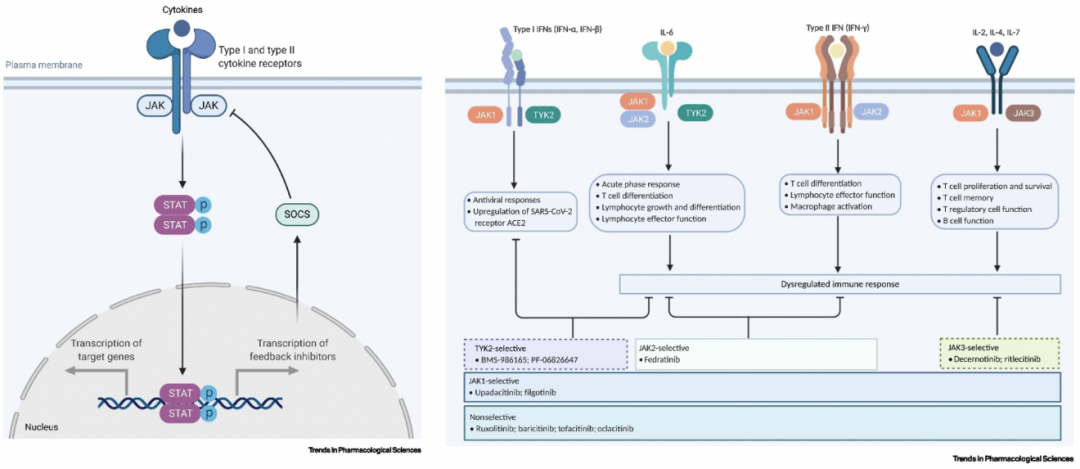
Janus激酶(JAKs)是与受体相关的酪氨酸激酶家族,由JAK1、JAK2、JAK3和TYK2组成。它们可以传递来自许多促炎细胞因子的细胞外信号,以激活信号转导和转录激活因子(STATs),如左图所示。COVID-19细胞因子风暴相关的多个细胞因子、干扰素均可激活JAK-STAT通路,参与机体的免疫应答,理论上,JAK抑制剂可能通过阻断JAK-STAT通路,抑制细胞因子风暴,如右图所示。
有研究纳入2项RCT(ACTT-2和COV-BARRIER),2000余例患者的meta分析提示,baricitinib可以显著降低住院COVID-19患者的病死率(RR 0.64 95%CI [0.50-0.83]),亚组分析提示,需要氧疗(RR 0.62 95%CI [0.41-0.95])或者HFNC/无创通气的患者获益最大(RR 0.59 95%CI [0.42-0.85])纳入8项针对多种JAK抑制剂的临床研究(含观察性研究),3000余例患者的meta分析提示,JAK抑制剂可能显著降低COVID-19患者的病死率(RR 0.58 95%CI [0.46-0.73])。
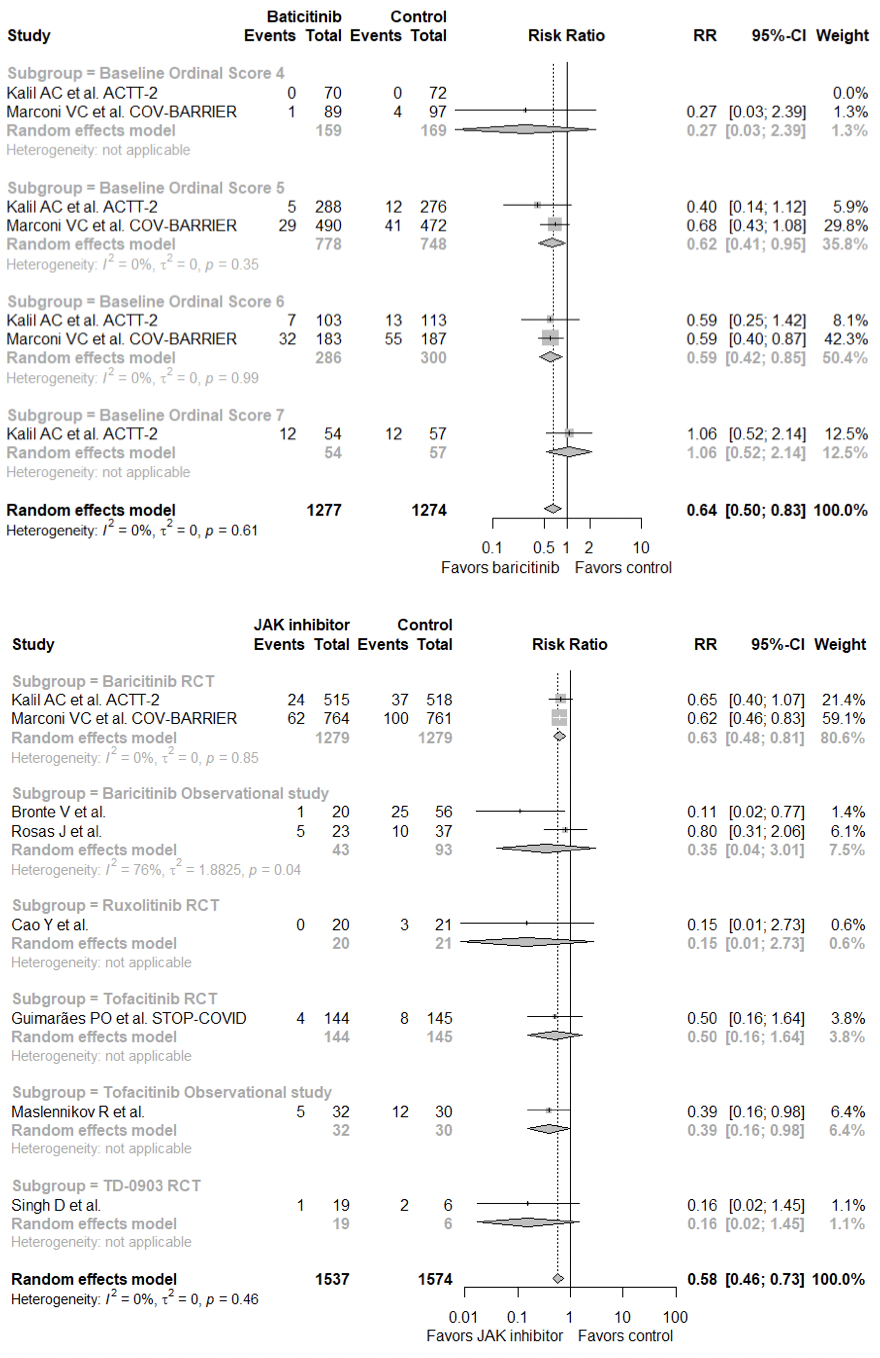
但是,这些研究是基于「患者可能同时合并使用糖皮质激素」的前提下,目前NIH指南建议,对于需要氧疗或者HFNC/无创通气,且炎症因子升高的患者,可考虑在糖皮质激素的基础上使用baricitinib;大部分国际指南尚未更新,尚待进一步的证据。对其未来研究的方向,对于有创通气患者的效果尚不确定、Baricitinib之外的其他JAK抑制剂的RCT证据较少,样本量低,需进一步开展临床试验。
3、阿奇霉素:
阿奇霉素是一种大环内酯类抗生素,近年来其免疫调节作用逐渐被认识到,目前在支气管扩张症等多种慢性呼吸道疾病中作为免疫调节剂被使用。
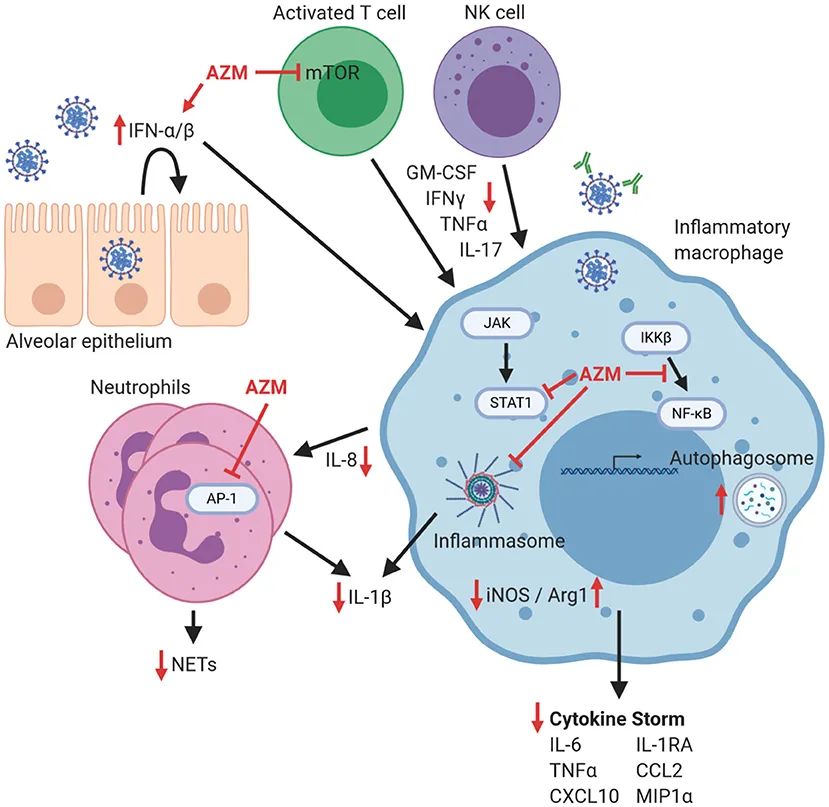
阿奇霉素对COVID-19患者免疫调节的可能机制包括:1)改善I型干扰素反应延迟;2)抑制巨噬细胞产生细胞因子和趋化因子等炎性介质;3)通过影响趋化因子的产生和直接抑制 AP-1 信号,导致 NET 形成和 IL-1β 产生减少,抑制中性粒细胞流入;4)抑制 mTOR 信号传导以及通过增加巨噬细胞产生精氨酸酶 1(从而消耗 T 细胞增殖所需的精氨酸)来抑制活化的 T 淋巴细胞的增殖。
它作为一个辅助药物,在新冠疫情中也被研究者关注。一项纳入3项RCT约1600例患者的meta分析提示,阿奇霉素对门诊COVID-19患者的住院/死亡(复合结局)风险无显著影响,RR 0.83 95%CI [0.54-1.29],另一项纳入2项RCT约8000例患者的meta分析提示,阿奇霉素对住院COVID-19患者的28天病死率无显著影响,RR 0.97 95%CI [0.89-1.06],目前尚无临床指南推荐阿奇霉素。

4、秋水仙碱
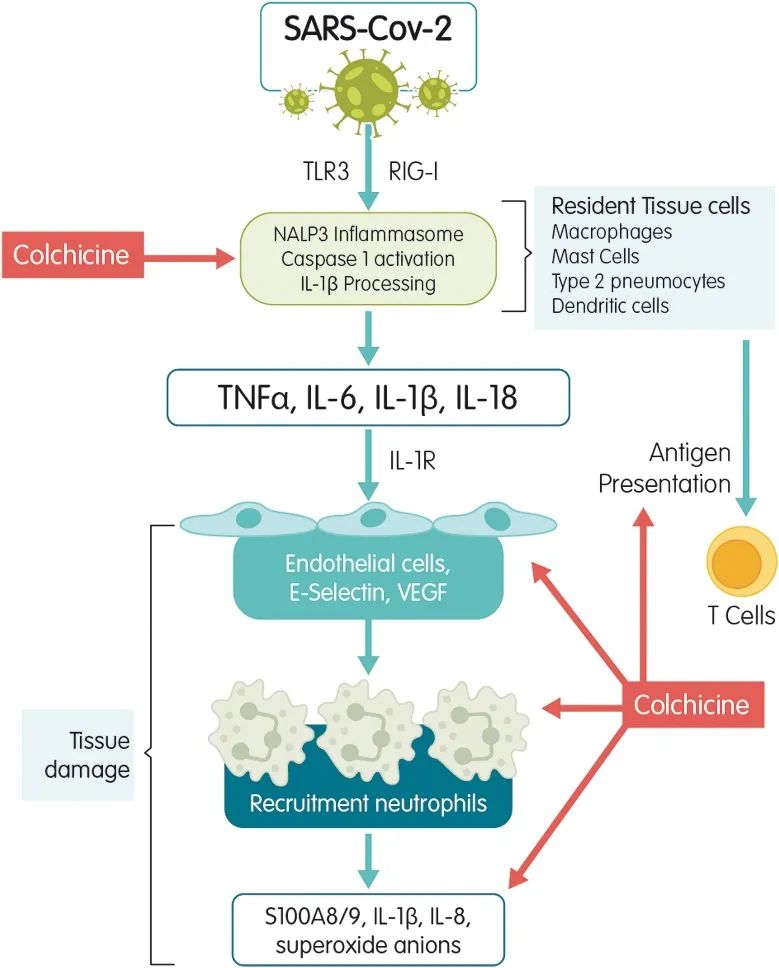
秋水仙碱是一种抗炎药物,被用于治疗痛风等疾病,可能通过抑制NLRP3炎症小体抑制COVID-19的炎症反应。
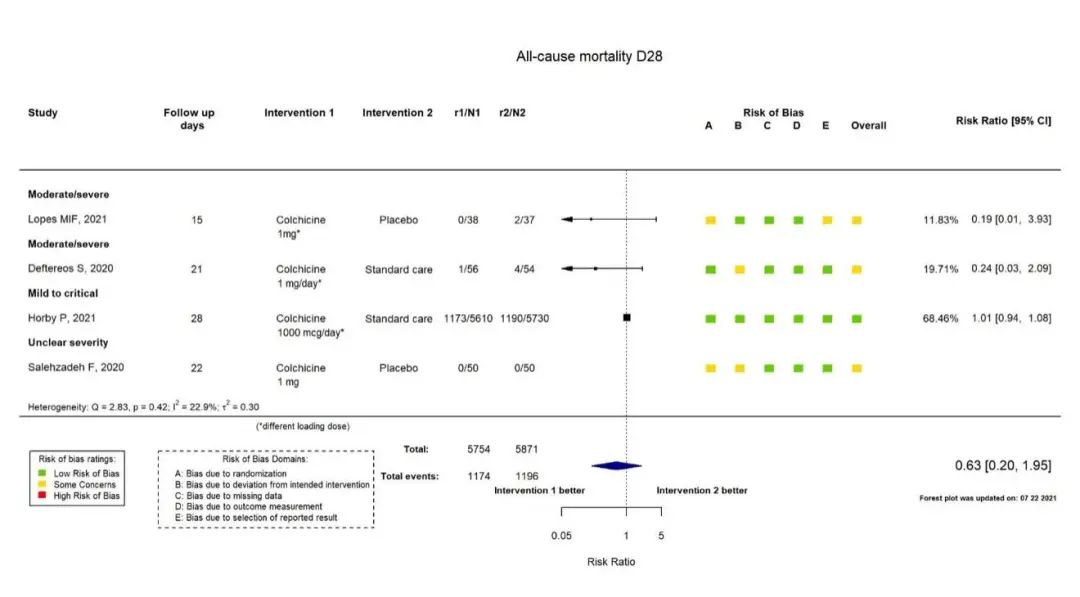
纳入4项RCT约11500例患者的meta分析提示,秋水仙碱对住院COVID-19患者的28天病死率无显著影响,(RR 0.63 95%CI [0.20-1.95])。RECOVERY试验是上述4项研究中样本量最大的研究,总样本量约11000例,提示秋水仙碱治疗不改变患者的疾病加重风险和28天出院比例。
COLCORONA试验是一项针对社区(非住院)高危患者的III期临床试验,纳入了40岁以上,且至少有1个高危因素的COVID-19患者(实验室诊断或临床诊断),主要结局是住院或死亡总人群(ITT人群):4.7% vs 5.8% 无显著差异(OR 0.79 95%CI [0.61-1.03]);核酸确诊人群:4.6% vs 6.0% 风险显著下降(OR 0.75 95%CI [0.57-0.99])。
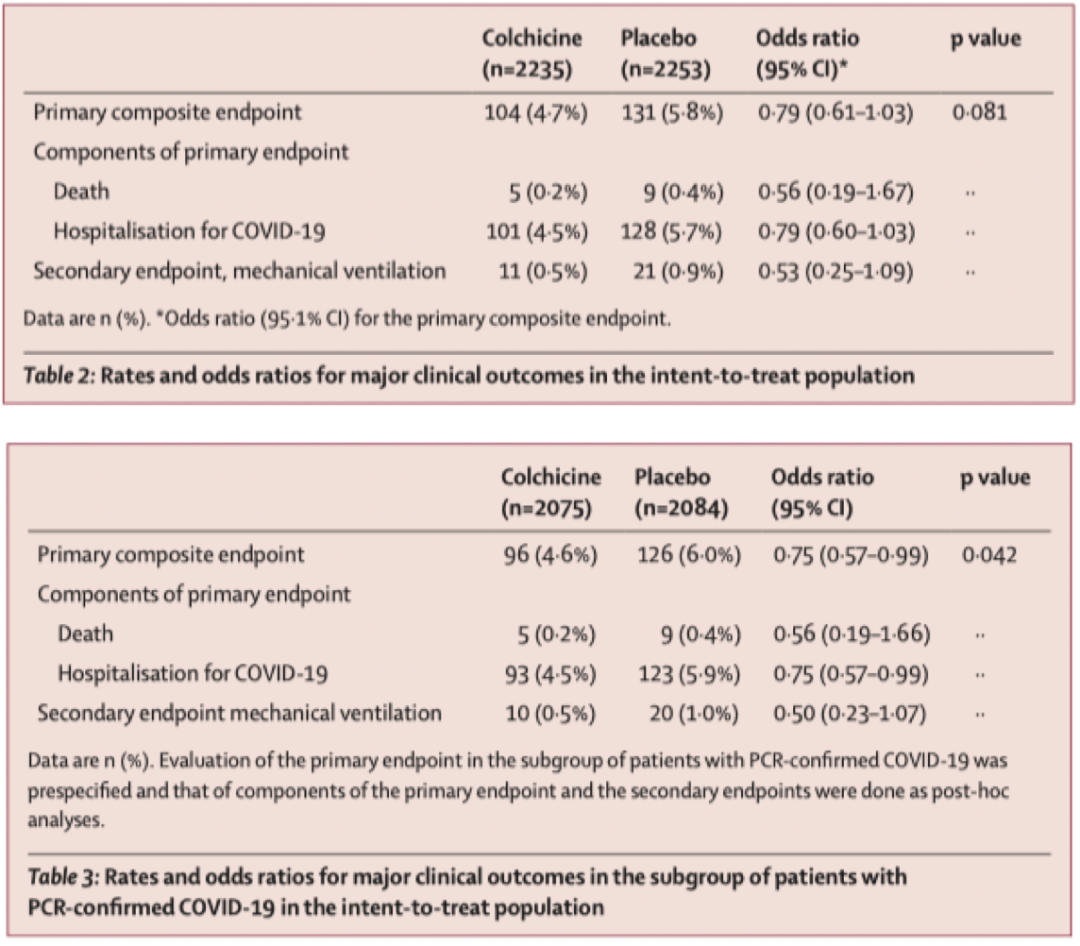
由于这项研究没有达到主要终点,PCR确诊人群亚组的结果仅有提示意义,需要进一步研究明确门诊人群的获益。
总结与展望
确定有效:糖皮质激素(住院重症患者,需要吸氧或者机械通气);
很可能有效:巴瑞替尼、瑞德西韦、Molnupiravir、PF-07321332/ritonavir(PAXLOVID);
可能有效:秋水仙碱(门诊患者)、抗雄激素药物;
很可能无效:阿比多尔;
确定无效:羟氯喹、阿奇霉素。
口服抗病毒药物上市后预计有广泛的应用前景,因为其使用方便、临床获益证据比较充分。小分子药物开发周期非常长,而且我们这两年通过跟踪药物临床实验,有这样体会:「体外有效不代表体内一定有效」、「理论有效的临床实验结果也可能是阴性」,这种情况屡见不鲜,所以我们认为规范研究流程、开展高质量的RCT研究是保证药物研发成功的一个根本因素。
药物的研发不能着急,中国有一句古话叫「欲速则不达」,COVID-19疫情很严重,大家都很着急,但在科学容不得着急,一步一步规范研究其实是最省时间的,跳跃式、拔苗助长式的研究,反而适得其反。
参考文献 (可上下滑动浏览)
[1] https://www.who.int/
[2] https://www.rcsb.org/news?year=2020&article=5e74d55d2d410731e9944f52&feature=true
[3] https://www.bio.org/policy/human-health/vaccines-biodefense/coronavirus/pipeline-tracker
[4] Akbarshakh Akhmerov et al. Circ Res. 2020;126:1443–1455
[5] Matthew Zirui Tay et al. Nat Rev Immunol. 2020;20:363‐374
[6] Kanta Subbarao et al. Immunity. DOI:10.1016/j.immuni.2020.05.004
[7] Hu B, et al. Nat Rev Microbiol. 2021;19(3):141-154
[8] Malin JJ, et al. Clin Microbiol Rev. 2020;34(1):e00162-20
[9] Sheahan TP et al. Nat Commun. 2020;11(1):222.
[10] Manli Wang et al. Cell Res.2020, 30 (3), 269-271
[11] WHO | Novel Coronavirus R&D
[12] BMJ 2020 370:m2924; BMJ 2020;370:m2980
[13] Lancet 2020 395(10236) 1569-1578;
[14] http://covid19treatmentguidelines.nih.gov
[15] JAMA 2020 DOI:10.1001/jama.2020.16349
[16] N Engl J Med 2020 DOI: 10.1056/NEJMoa2007764
[17] N Engl J Med 2020; DOI: 10.1056/NEJMoa2023184
[18] BMJ 2020;371:m4475
[19] https://www.gilead.com/news-and-press/press-room/press-releases/2021/9/veklury-remdesivir-significantly-reduced-risk-of-hospitalization-in-highrisk-patients-with-covid19
[20] Kabinger F, et al. Nat Struct Mol Biol. 2021; doi:10.1038/s41594-021-00651-0
[21] Rosenke K, et al. Nat Commun, 2021; doi: 10.1038/s41467-021-22580-8.
[22] Bakowski MA, et al. Nat Commun, 2021; doi: 10.1038/s41467-021-23328-0.
[23] Abdelnabi R, et al. J Infect Dis, 2021; doi:10.1093/infdis/jiab361.
[24] William Fischer, et al. medRxiv, 2021; doi: 10.1101/2021.06.17.21258639
[25] https://www.merck.com/news/merck-and-ridgeback-biotherapeutics-provide-update-on-progress-of-clinical-development-program-for-molnupiravir-an-investigational-oral-therapeutic-for-the-treatment-of-mild-to-moderate-covid-19/
[26] https://www.businesswire.com/news/home/20211001005189/en/
[27] https://www.businesswire.com/news/home/20211126005279/en/
[28] Mengist HM, et al. Front Pharmacol. 2021;11:630500
[29] Dafydd R. Owen, et al. medRxiv. 2021;2021.07.28.21261232
[30] https://clinicaltrials.gov/ct2/show/NCT05011513
[31] https://clinicaltrials.gov/ct2/show/NCT04960202
[32] https://www.pfizer.com/news/press-release/press-release-detail/pfizers-novel-covid-19-oral-antiviral-treatment-candidate (Accessed November 2021).
[33] Good SS, et al. Antimicrob Agents Chemother. 2021;65(4):e02479-2
[34] https://www.globenewswire.com/news-release/2021/10/19/2316323/0/en/Atea-Pharmaceuticals-Provides-Update-and-Topline-Results-for-Phase-2-MOONSONG-Trial-Evaluating-AT-527-in-the-Outpatient-Setting.html
[35] Özlüşen B, et al. Eur J Clin Microbiol Infect Dis. 2021; doi:10.1007/s10096-021-04307-1
[36] Rizk JG, et al. Drug Discov Today. 2021;26(2):593-603
[37] Rodrigo C, et al. Clin Microbiol Infect. 2020;26(8):979-987
[38] Liu J, et al. Cell Discov, 2020;6:16
[39] White NJ, et al. PLoS Med, 2020;17(9):e1003252
[40] Ariel Izcovich, et al. medRxiv. 2020.11.16.20232876
[41] Axfors C, et al. Nat Commun. 2021;12(1):2349
[42] Siemieniuk RA, et al. BMJ. 2020;370:m2980
[43] Deng Q, et al. iScience. 2021;24(3):102254
[44] Qiao Y, et al. Proc Natl Acad Sci U S A. 2020;118(1):e2021450118
[45] McCoy J, et al. Front Med (Lausanne). 2021;8:668698
[46] Cadegiani FA, et al. Cureus. 2021;13(2):e13492
[47] Cadegiani FA, et al. medRxiv; doi: 10.1101/2021.06.22.21259318
[48] Amani B, et al. Immun Inflamm Dis. 2021;10.1002/iid3.502
[49] Nilam Mangalmuti and Christopher A. Hunter. Immunity. 2020;53(1):19-25
[50] The RECOVERY Collaborative Group. N Engl J Med 2020; DOI: 10.1056/NEJMoa2021436
[51] WHO REACT Working Group. JAMA. 2020;324(13):1330-1341
[52] Wei Luo et al. Trends Pharmacol Sci. 2020; DOI: 10.1016/j.tips.2020.06.007
[53] Xueyang Zhang et al. Unpublished Data
[54] COVID-19 Treatment Guidelines Panel. https://www.covid19treatmentguidelines.nih.gov/. access date:2021-7-26
[55] Venditto VJ, et al. Front Immunol. 2021;12:574425
[56] https://covid-nma.com/living_data/index.php?comparison=31 access date: 2021-8-18
[57] Montealegre-Gómez G, et al. Reumatol Clin. 2021;17(7):371-375
[58] Tardif JC, et al. Lancet Respir Med. 2021;9(8):924-932

曹彬
主任医师,教授,博士研究生导师,教育部长江学者特聘教授,国家杰出青年科学基金获得者。中日友好医院副院长,呼吸中心常务副主任,中国医学科学院呼吸病学研究院副院长。中华医学会呼吸病学分会候任主任委员,中华医学会呼吸病学分会感染学组副组长 等,享受国务院政府特殊津贴。国家发明专利1项。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)