首页 > 疾病防控/ 正文
CRISPR-Cas9是对微生物、动植物,以及人类基因组进行修饰的强有力工具。在医疗保健领域,CRISPR-Cas9基因编辑为治愈遗传病、癌症,乃至心脏病等重大疾病带来了前所未有的希望。但这一切的前提是DNA被正确的修饰,而没有产生意外的变化。
在进行CRISPR基因编辑时,脱靶性是一个重点关注的问题,因为这可能会破坏其他功能基因从而带来严重后果。此外,在目标位点附近导致基因组产生较大结构突变(包括较大片段的缺失、插入、重排,乃至染色体碎裂),同样是一个令人担忧的问题。
迄今为止,已经在细胞层面对CRISPR基因编辑的这些潜在风险进行了许多研究,但其对生物个体的影响仍然了解有限。
近日,瑞典乌普萨拉大学的研究人员在 Nature 子刊 Nature Communications 发表了题为:CRISPR-Cas9 induces large structural variants at on-target and off-target sites in vivo that segregate across generations 的研究论文。
该研究证实,CRISPR-Cas9基因编辑会导致DNA发生不可预见的结构突变,而且这些结构突变可以被下一代遗传。 这项研究再次提醒了我们,将CRISPR-Cas9应用于临床治疗前要谨慎和仔细验证。

为了更好地了解非预期的CRISPR-Cas9基因组编辑结果对个体水平的影响,尤其是基因组结构变异,研究团队通过显微注射RNP(gRNA+Cas9)对斑马鱼的受精卵进行基因编辑,然后对这些编辑后的第一代斑马鱼和它们的下一代进行基因组测序。

基因编辑后的验证,通常使用短读长或桑格测序进行,这些方法能够检测到小片段的插入或缺失,这也是CRISPR-Cas9基因编辑最常见的结果,但可能无法检测到更大的基因组结构变异,而长读长的纳米孔测序可以更好地发挥作用。
研究团队使用长读长纳米孔测序对两代共1100多条斑马鱼进行基因组测序,以验证CRISPR-Cas9对目标位点附近和其他脱靶位点产生的编辑情况,结果发现了大量各种类型的意外基因突变。
具体来说,CRISPR-Cas9基因编辑的第一代斑马鱼中大约6%出现了基因组结构变异(插入或缺失片段≥50bp),这些结构变异既有位于目标位点的,也有位于脱靶位点的。
此外,该研究还发现,第一代斑马鱼出现的这些无法预料的基因组突变,遗传给了后代,第二代斑马鱼中有26%携带了脱靶突变,9%携带了结构突变。
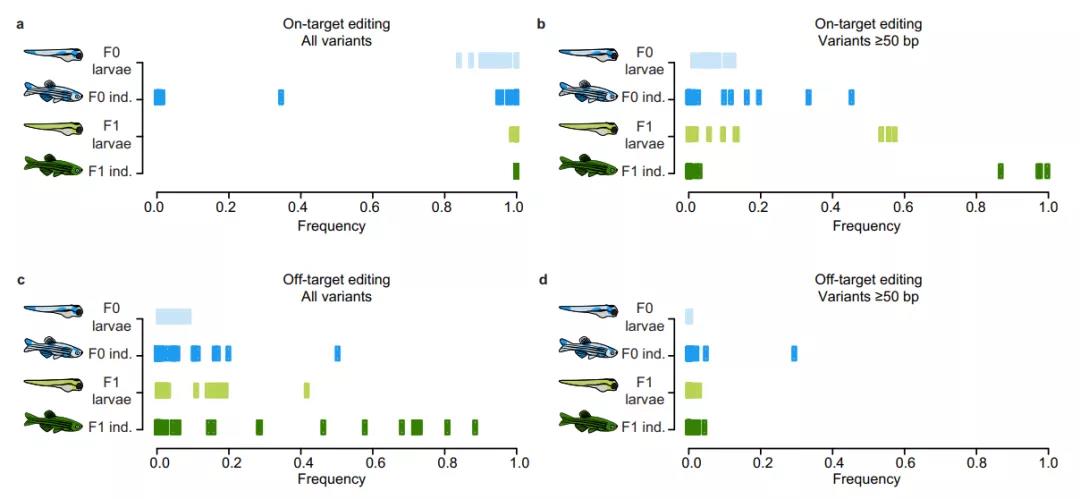
这项研究还有一个重要发现,这些经过CRISPR-Cas9基因编辑的第一代斑马鱼是嵌合型的,它们产生的生殖细胞同样也是嵌合型的,而它们是在受精卵的单细胞阶段进行的基因编辑,理论上不应该是嵌合型,这可能是由于受精卵后续分裂中继续受到了基因编辑,或分裂产生的细胞产生了不同水平的DNA修复,从而导致了这种结果。
研究团队表示,知道CRISPR-Cas9导致的这些意外突变是可遗传的很重要,因为这些突变可能会对后代的生长产生长期影响。但需要指出的是,只有在对胚胎或生殖细胞进行基因编辑时才会出现这种情况,目前的CRISPR基因编辑临床试验都是对特定的组织或器官进行基因编辑,不涉及胚胎和生殖细胞。
CRISPR-Cas9基因编辑在医疗保健领域具有重要价值,但我们需要把潜在风险降至最低。该研究提出了使用长读长纳米孔测序技术来验证基因编辑结果的新策略,这是降低CRISPR-Cas9临床应用风险的重要一步。
原始出处:
Hijer, I., Emmanouilidou, A.,stlund, R. et al. CRISPR-Cas9 induces large structural variants at on-target and off-target sites in vivo that segregate across generations. Nat Commun 13, 627 (2022). https://doi.org/10.1038/s41467-022-28244-5.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)