首页 > 医疗资讯/ 正文
CAR T
CAR T细胞疗法在一系列复发性/难治性 (r/r)B 细胞恶性肿瘤(甚至初治患者)中观察到了具有前景的抗肿瘤疗效,包括大 B 细胞淋巴瘤 (LBCL)、多发性骨髓瘤 (MM)、套细胞淋巴瘤 (MCL)、滤泡性淋巴瘤 (FL) 和 B 细胞前体急性淋巴细胞白血病 (BCP-ALL)。CD19 是第一个成功的靶抗原,但 BCMA和 GPRC5D CAR-T 治疗对 RRMM 和 CD22 治疗对 r/r BCP-ALL 的疗效可以证明,其他靶抗原同样可以发挥抗肿瘤疗效。
部分患者在 CAR T 细胞治疗后获得了持久缓解,但也有相当数量的患者从未达到分子学缓解,或最终复发。有学者撰文提供了关于宿主相关、肿瘤固有、微环境和 CAR T 细胞相关耐药的当前见解,描述了预防复发和克服耐药性的潜在策略,并讨论了 CAR-T 后复发患者的当前治疗选择。文章近日发表于美国移植和细胞治疗学会(ASTCT)的官方期刊《Transplantation and Cellular Therapy》。

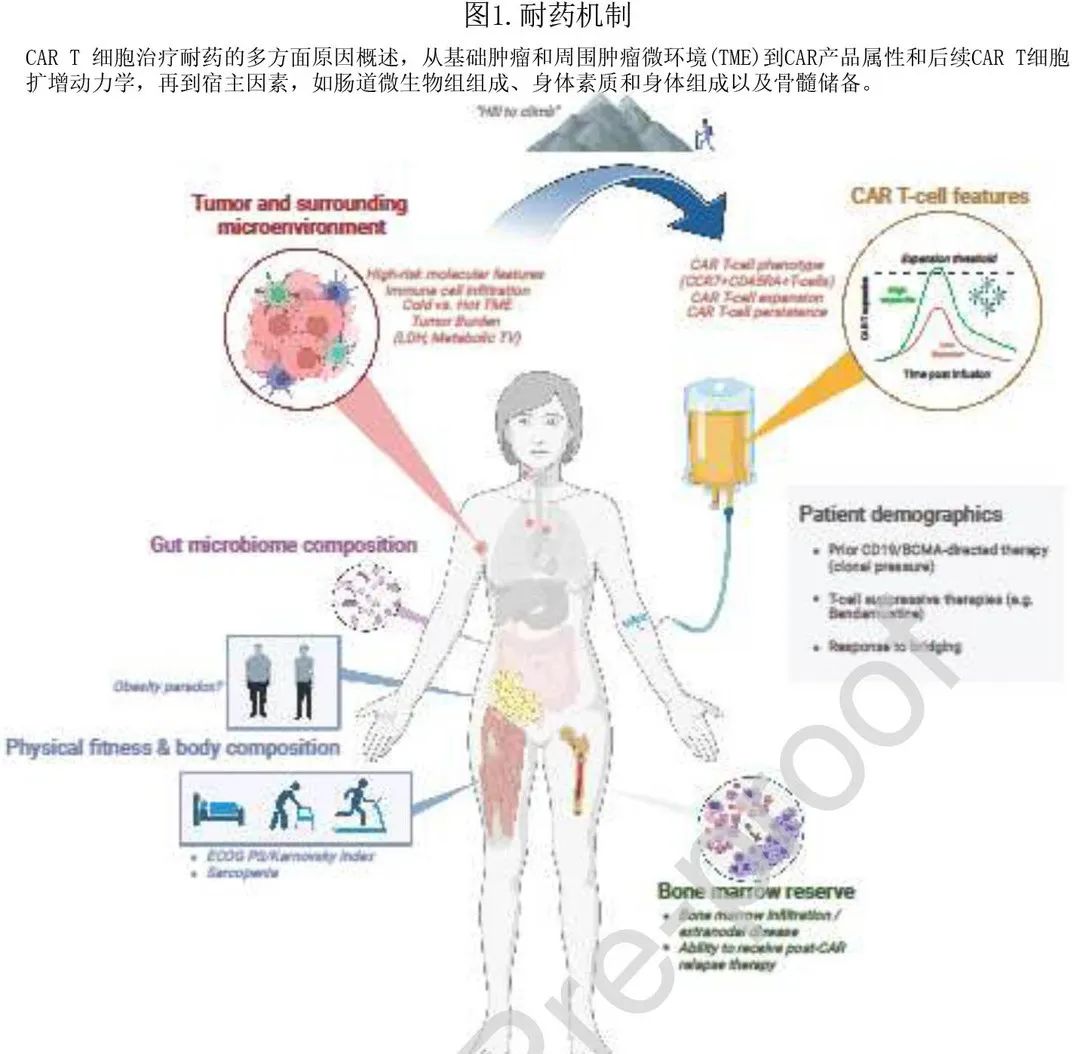
 耐药机制
耐药机制
宿主相关因素
种族可能影响预后,女性患者结局也有改善的趋势,与淋巴瘤患者基于人群的大型研究一致。与经典的细胞毒性治疗相比,年龄似乎不是治疗反应的决定因素,而身体素质和体能状态在临床上更有意义,尤其是对于长期生存指标,如总生存期 (OS)。事实上肌肉减少症和恶病质与 CD19 CAR T 细胞治疗后的不良治疗结局密切相关。虽然肥胖与临床结局无关,但 BMI 对脂肪组织的不同免疫原性可产生广泛影响。值得注意的是,内脏脂肪组织 (VAT) 程度较高的 CAR-T 患者发生 CRS 的时间更早、更严重;高 VAT患者也表现出较高的 IL-6 峰值水平,与脂肪细胞和脂肪组织巨噬细胞的 IL-6 分泌功能一致。有趣的是,在接受 CD19 CAR-T 治疗难治性 B 细胞恶性肿瘤的患者中,腹部脂肪沉积增加也与更优的 PFS/OS 独立相关,表明脂肪组织可能通过“代谢”过程发挥促免疫原性抗淋巴瘤作用,其中脂肪组织可转化为炎性内分泌器官,由于 M1 极化巨噬细胞、T细胞和其他免疫细胞浸润,能够分泌促炎性细胞因子(例如IL-6、TNF-α和IL-1β)。此外,这些数据表明,“肥胖悖论”是指多余脂肪组织与免疫治疗疗效之间的非预期关系,可能扩展至接受现代细胞治疗的患者。这些身体组成因素也可能影响氟达拉滨(清淋预处理的重要组分)的药代动力学/动力学,最近的证据表明体重和肾功能(而非 BMI 或BSA)作为氟达拉滨暴露最佳预测因素的重要性。宿主造血功能也是淋巴瘤和多发性骨髓瘤的相关 CAR-T 预后因素,因为血细胞减少可以反映潜在的骨髓浸润和不良疾病特征。最后,越来越多的证据强调了完整的肠道微生物组对 CAR T 细胞疗效的重要性,具体而言,在治疗前4周内使用广谱抗生素(“PIM”:哌拉西林/他唑巴坦、亚胺培南/西司他丁、美罗培南)与生存率较差和神经毒性增加相关。
肿瘤因素
LBCL:在 DLBCL 患者中,血清 LDH 水平作为肿瘤负荷的极佳替代标志物具有预后意义。在接受 CAR T 细胞治疗的患者中LDH和肿瘤体积增加也是强效不良风险标志物。这些标志物也与 18FDG-PET/CT的代谢性肿瘤体积 (MTV) 密切相关,其捕获肿瘤团块内和全身的所有代谢活性区域,因此推测为恶性区域,可准确确定肿瘤负荷。MTV 还可以提高风险预测工具的预测能力,正如国际代谢预后指数 (IMPI)的性能优于IPI,并在 CD19 CAR-T 中有望实现。肿瘤负荷同样与 CAR-T 前可检测到的循环肿瘤 DNA 量相关,ctDNA量越高,CAR-T耐药性越大。在一定程度上,肿瘤负荷就像山顶,需要 CAR T 细胞扩增和持续的抗淋巴瘤活性来“攀爬”(图1,原图就不清晰,请谅解)。原发性难治性疾病(例如免疫化疗耐药)患者接受 CAR-T 治疗后的结局尤其差;并且无论是在一线治疗,还是在 CAR-T 输注前以桥接治疗无应答,均可观察到免疫化疗无响应的不良预后效应。最终,肿瘤负荷和原发性进展均可根本性地反映出淋巴瘤的基础疾病生物学和基因组组成。例如肿瘤细胞可上调抗凋亡分子或失调 Fas/TRAIL 通路,作为逃避 T 细胞介导杀伤的手段。最近的研究揭示了淋巴瘤抗 CD19 CAR-T 治疗失败的复杂基因组特征:第一项研究利用49例患者的51个肿瘤样本的全面全基因组测序 (WGS),CD19突变与耐药性相关但并不常见,从而提示存在其他基因组机制,治疗前存在复杂的结构变异(如双微体、染色体断裂)、APOBEC突变标记、RHOA肿瘤抑制因子的缺失以及活性氧引起的基因组损伤可预测 CD19 CAR-T 的耐药性。另一项研究利用 CAR-T 前无细胞 DNA (cfDNA) 的低通 WGS 完善基因组危险分层,表示基因组不稳定的高局灶性拷贝数异常(CNA) 是与3个月反应相关的最显著的治疗前变量;有趣的是,10q23.3缺失导致 FAS 死亡受体的缺失与生存率低密切相关;这种微创检测可以进一步与传统的肿瘤负荷标志物结合,以增强基线时的风险预测。第三项研究中,动态风险评估整合了 ctDNA 的收缩和 CAR cfDNA 随时间的增加,发现影响 B 细胞同一性 (PAX5,IRF8) 和免疫调节 (PD-L1,TMEM30A) 的 ctDNA 基因突变与更大的治疗失败相关。最后,Shouval等证实 TP53 基因组改变是 LBCL 患者接受 CD19 CAR-T 治疗后生存结局较差的独立不良风险标志物,原因是 CAR T 细胞毒性相关通路失调,包括干扰素和死亡受体信号通路,以及CD8+ T细胞肿瘤浸润减少。
多发性骨髓瘤:多发性骨髓瘤的一种相关肿瘤固有耐药机制是抗原下调或丢失,但 BCMA与 CD19 CAR-T 相比真正的基因病变发生频率要低得多,而 BCP-ALL 患者中发现的抗原丢失率最高。但特定的病例可溶性BCMA(MM肿瘤负荷和抗原负荷的可靠标志物)在 CAR-T 复发后没有增加。在 DNA 水平上,似乎需要双等位基因 BCMA (TNFRSF17) 缺失形式的二次打击才能产生对 CAR-T 的耐药性;但只有7%的抗 BCMA 初治患者存在杂合 BCMA 缺失,因此只有一小部分骨髓瘤患者存在这种分子耐药机制的风险。此外在接受针对替代抗原靶点(如GPRC5D)的 CAR-T 的骨髓瘤患者中,抗原丢失是否普遍存在仍有待确定。尽管如此,多发性骨髓瘤细胞的特征是拷贝数异常的频率高,包括编码免疫治疗假定靶标的基因缺失,因此不止认为抗原损失与 BCMA 相关。重要的是在晚期 B 细胞恶性肿瘤患者中,即使没有基因改变的证据也可能发生抗原低介导的复发。在这种情况下,由于对靶抗原的持续压力导致克隆选择过程,BCMA下调可作为随后逃逸的储存库。同样,cilta-cel也能够在既往接受过非细胞抗 BCMA 治疗的患者中诱导临床缓解,表明 CAR-T 可克服部分患者中 BCMAlow 骨髓瘤细胞的克隆压力。骨髓瘤细胞不依赖于靶抗原丢失而逃避 CAR-T 介导的免疫杀伤的其他方式,在于肿瘤细胞表达抑制性配体(如PD-L1)和/或缺乏共刺激配体(如CD58)的表达,或通过调整细胞内部凋亡机制赋予内在的肿瘤细胞耐药性。综上所述,肿瘤内在基因组改变是决定 CAR T 细胞疗效与耐药性因素复杂相互作用的重要组成部分。
肿瘤微环境
肿瘤微环境 (TME) 是 CAR T 细胞促进抗肿瘤作用的重要挑战,因为它可以限制 CAR T 细胞向肿瘤细胞的转运,负面影响 CAR T 细胞代谢功能,并且产生促进 CAR T 细胞耗竭的免疫抑制环境。CAR T 细胞浸润淋巴瘤组织的物理屏障可能是细胞外基质和异常的肿瘤相关脉管系统。免疫抑制性 TME 跨越广泛的细胞网络和细胞因子,关键因素包括破骨细胞、成纤维细胞、内皮细胞、肿瘤相关巨噬细胞(TAMs,特别是 M2 巨噬细胞)、髓源性抑制细胞 (MDSCs) 和调节性 T 细胞 (Tregs)。例如基线时 TAM 浸润增加对 B-NHL 患者的缓解状态可产生负面影响,已证实 TAM 通过 STAT3 活化支持浆细胞生长并损害 MM 的抗肿瘤免疫。在 LBCL 无应答者中,干扰素信号的肿瘤表达通过上调多个检查点配体调节TME。加上外周血中高水平的单核细胞MDSCs,这种形式的全身炎症和免疫失调能够钝化随后的 CAR T 细胞扩增。这些数据表明,CAR T细胞输注前存在的免疫结构可影响随后的缓解,正如在接受 axi-cel 治疗的患者中进行的一项优雅的单细胞研究所证明,其中 TME 富集趋化因子(CCL4和CCL22)、γ-链受体细胞因子(IL-15、IL-7 和IL-21)和干扰素调节分子与 T 细胞浸润和活性标志物相关。最终,这些机制性结果为临床可测量的血清标志物(包括CRP、IL-6和铁蛋白)在接受 CAR-T 治疗的 LBCL 和骨髓瘤患者中的预后效用提供了证据。
CAR产品和扩增-免疫功能障碍、衰竭和抗CAR免疫
上述因素可影响用于生产的 T 细胞的质量和fitness,以及后续有效根除肿瘤细胞所需的CAR T 细胞扩增动力学。产品属性可确定 r/r LBCL 中的 axi-cel 结局,尤其是输注的CD8+和CCR7+CD45RA+ T细胞数量。CAR T 细胞fitness和记忆样特征与治疗成功广泛相关。CAR T 细胞产物的表型组成在这方面起重要作用,应答者倾向于在输注前具有更高多功能性的 T 细胞。输注后T细胞分化较低(即初始或早期记忆)的患者表现出体内扩增增加,最有可能是由于其较强的增殖潜力和对耗竭的抵抗力。最大 CAR T 细胞扩增(早在第+7天)可作为应答的独立和动态风险预测因子。
值得注意的是,肿瘤、周围微环境和应用的 CAR T 细胞之间的交互作用可促进 CAR T 细胞耗竭,这一过程首次描述为免疫系统未能对慢性病毒感染产生有效应答。在慢性抗原刺激后,CD8+ T细胞分化可被颠覆为耗竭状态(以效应功能丧失和增殖能力下降为特征),这种低反应性 T 细胞状态可导致效应细胞因子表达降低和抑制性免疫检查点受体(如PD-1、TIM-3、LAG-3和TIGIT)上调。耗尽的 T 细胞状态进一步表现为显著的表观遗传重组和独特的转录组学特征。因此,抗原刺激需求(可促进活化和扩增)和紧张性信号之间似乎存在错综复杂的平衡,对 CAR T 细胞持久性产生负面影响,并导致活化诱导的细胞死亡 (AICD)。在抗原特异性 CAR-T 活化的情况下,未能维持对 CD19 CAR-T 的长期应答也与辅助性 T 细胞2功能缺陷相关。此外CAR T细胞在体内并不独立发挥作用,而是依赖于细胞因子介导的与 TME 的持续交互(通过IFN-γ和IL12)来维持长期活性。最后,最近的数据将表达 CAR 的调节性 T 细胞 (CAR Tregs) 的输注后扩增与总体 CAR-T 细胞扩增抑制和抗肿瘤疗效降低相关联,但还需要进一步的研究来了解促进 CAR Treg 亚群扩增的肿瘤微环境和系统性细胞因子。
除了 CAR T 细胞扩增不充分和随着时间的推移不断耗竭外,抗 CAR 免疫和随后的免疫介导的排斥反应也可能会影响 CAR-T 的持久性。对于大多数市售产品而言,CAR构建体的 scFv 结构域为非人源性(最常见的为鼠源性),因此可引发针对 CAR T 细胞的体液和/或细胞免疫应答。例如在 B 细胞恶性肿瘤中重复输注相同的 CAR 产品与相对较低的完全缓解 (CR) 率 (< 25%) 相关,引起了对 CAR T 细胞免疫原性的关注;有报道重复给予鼠间皮素 CAR T 细胞诱导1例患者发生过敏反应。在一项考察靶向 BCMA 的双表位 CAR-T 治疗RRMM的探索性试验中,所有达到完全缓解后复发的患者随后均产生了抗 scFV 非人序列的抗 CAR 抗体,这与循环 CAR T 细胞数量下降并行。Axi-cel 和 tisa-cel 也报告了体液抗 CAR 免疫,它们均含有来源于鼠 FMC63 的scFv。已在不同疾病中描述了抗 CAR 抗体。此外,针对 CAR T 细胞的细胞免疫应答可能来自外源序列的加工和 MHC 依赖性交叉呈递,因此细胞外源性 CAR 肽(通常包括鼠序列)由抗原呈递细胞显示,可导致 CAR 特异性细胞毒性 T 细胞的启动,随后过继转移 T 细胞的免疫排斥可能促进治疗失败。值得注意的是,检测对 CAR 具有特异性的细胞毒性 T 细胞与 CAR T 细胞扩增较差相关。综上所述,抗 CAR 免疫暗示了内源性免疫系统和CAR T 细胞之间的关键相互作用,但还需要进一步的研究来阐明对长期安全性和疗效的具体影响。
预防复发和克服耐药的策略预防复发和克服 CAR-T 细胞治疗耐药的策略遵循上文讨论的耐药机制(图2)。
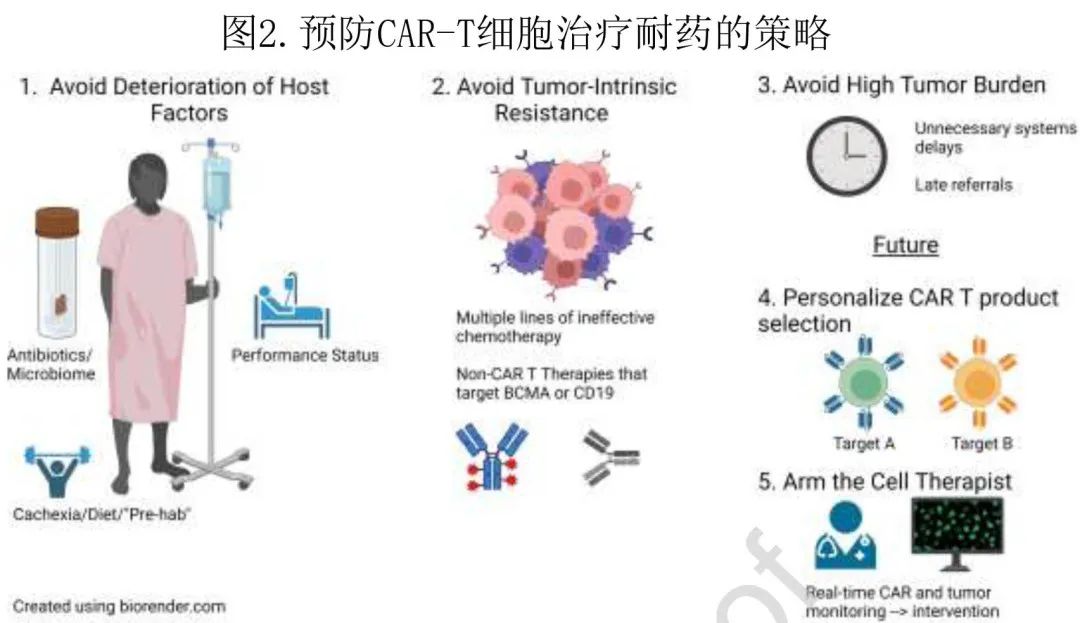
1)避免宿主恶化:与 CAR T 细胞预后不良相关的患者特征包括恶病质、抗生素破坏微生物组、体能状态不良和骨髓功能不良导致的造血储备低,其中许多问题可以通过有效的医疗保健系统和治疗早期治疗线患者来改善。延迟获得 CAR-T 细胞疗法会导致在等待 CAR-T 细胞输注期间需要更多地使用过渡治疗,包括在等待转诊和保险授权时在白细胞单采前给予的暂停治疗,以及在白细胞单采和开始清淋化疗之间给予的桥接治疗。此类过渡治疗存在感染(需要抗生素)、骨髓抑制(如化疗)以及食欲不振和体能状态风险,因此努力实行抗生素管理和计划“戒烟前”以改善或维持身体功能可能有助于避免(对临床结局重要的)宿主因素恶化。此外,使用预防性万古霉素调节肠道微生物组可能对 CAR T 细胞扩增产生积极影响。CAR T 细胞治疗进入早期治疗线也可缓解这种情况。
2)避免肿瘤固有耐药和靶点丢失:基因组复杂性和肿瘤微环境耐药机制可能随着各线治疗而增加,因此避免过渡治疗和在早期治疗线治疗患者可能会避免化疗和 CAR-T 细胞治疗之间共享的耐药机制的演变。此外,与 CAR-T 细胞结合相同靶点的抗体、抗体药物偶联物和双特异性抗体等治疗可能会降低靶点表达并增加肿瘤对后续 CAR-T 治疗的耐药性,因此应尽可能避免;此外这些治疗还可能通过突变或剪接变体来促进携带低靶抗原密度的亚克隆的克隆生长(例如低CD19或低BCMA)。在 BCMA CAR-T中,γ分泌酶抑制剂可能增加骨髓瘤细胞上的靶抗原表达,从而防止抗原逃逸。调节靶抗原密度的其他治疗策略也正在积极研究。在 CAR-T 细胞疗法的疗效优于相似靶向抗体疗法的情况下,考虑到较高的总体和缓解深度以及较长的 CAR 后无治疗间期,建议首先使用 CAR-T 细胞疗法。此外转换靶点(例如BCMA后的GPRC5D)是另一个重要的研究领域。
3)避免高肿瘤负荷:高肿瘤负荷的患者在 CAR-T 细胞治疗后毒性和复发风险增加。避免延迟(延迟给药可能导致肿瘤不受控制的生长),或使用有效的过渡疗法来减轻肿瘤负荷而无明显毒性,可能有助于避免 CAR-T 细胞输注时的高肿瘤负荷。
4)CAR-T细胞产品选择:如果有多个 CAR-T 细胞产品可用时,目前还没有明确的指导原则来选择哪种产品。但随着改进的 CAR设计和多个靶点变得可用,数据将以最佳方式演变,将 CAR-T 细胞产品的选择个性化呈现给个体患者。新型 CAR T 细胞结构的广泛目的是增强免疫细胞fitness、激活内源性免疫、通过肿瘤微环境武装细胞来抵抗抑制、并调节抗原密度阈值。免疫增强/优化 CAR T 细胞工程的突出例子包括删除CD3δ免疫受体酪氨酸活化基序 (ITAM)、Boolean逻辑门控和调节周围微环境的所谓装甲 CAR T 细胞。为防止 CAR T 细胞产生免疫原性,可使用全人源结合结构域替代鼠源 scFv 结构域,或将 CAR scFv 的鼠源序列人源化。
5)使医生成为“细胞治疗师”:目前治疗医生无法在个体患者中“驱动”CAR,治疗管理对临床状态有反应。通过改进的实时监测和干预工具,未来的细胞治疗师能够主动滴定或分馏细胞剂量,瞬时“休息”或刺激CAR,改变或添加靶点,并利用其他策略来预防患者的毒性和耐药性。
CAR-T后复发的治疗路径
LBCL
长期血细胞减少和低 CD4 T 细胞计数可能是接受CAR-T 复发后有效治疗的较大障碍。临床医生可以使用 ctDNA 和/或早期 18FDG-PET/CT 进行动态风险预测,从而可以在早期时间点检测复发并实现早期指导治疗。在一项大型美国 axi-cel 进展者研究中,在进展时约30%的病例中观察到 CD19 丢失,在多变量分析中与较差的生存结局无独立相关性。总体而言后线治疗的反应较差,中位 PFS 仅55天。在治疗策略方面,免疫检查点抑制剂 (ICI) 治疗的缓解率最高,其次是放射治疗 (RT) 和免疫调节剂(如来那度胺)。最近一项小型 I/IIa 期研究表明,使用帕博利珠单抗在部分 r/r LBCL 患者中耐受良好且有效,且使用 CyTOF 的深度免疫分析显示 CAR T 细胞耗竭减少。另一方面,一项96例接受 ICI 患者的多中心真实世界研究结果令人失望,仅在少数患者 (5%) 中观察到持久缓解,而优势主要限于 PMBCL 患者。其他欧洲研究致力于 CAR 后最佳复发治疗的问题,但结果各不相同。法国 DESCAR-T研究154例患者接受挽救治疗,结果观察到来那度胺的 OS 获益,从而提高了免疫激活和刺激持续性 CAR-T 细胞可能会降低总进展率的可能性。相反,Iacoboni等报告了基于维泊妥珠单抗的治疗方案(ORR/CR率62%/38%)和双特异性抗体(ORR/CR率48%/33%)的令人鼓舞的结果,但它可能正反映了该队列中 CAR-T 输注前Pola 桥接治疗使用不足的现状。这些研究的一个统一特征在于,基于化疗的基石成功率较差,因此突出了其化疗难治性。令人鼓舞的是,双特异性抗体的结果似乎很有前景,最近报告接受 CD20/CD3 双特异性抗体 glofitamab 和 epcoritamab 的患者的 CR 率分别约为35%。未来的研究可能会评估最佳排序和联合方案,以此利用双重靶点和增强 CAR T 细胞持久性的优势。异基因干细胞移植是有可用供者的合格患者的进一步策略。最后,重复输注 CAR T 细胞在临床上是可行的,能够诱导缓解,尤其是在使用氟达拉滨和增加 CAR T 细胞剂量的情况下。
多发性骨髓瘤
BCMA CAR T 细胞治疗后复发的骨髓瘤患者随后可对挽救治疗产生应答,包括既往治疗失败的药物联合治疗。值得注意的是,最近的两项研究(分别为n=42和79)证实,BCMA CAR-T治疗后进展的患者的总生存期可延长至15-18个月。重复 BCMA CAR T 细胞治疗或后续 T 细胞衔接治疗均可获得有利缓解,事实上这种使用不同双特异性抗体或 CAR T 细胞的序贯 T 细胞重定向治疗确实能够促进RRMM 单抗治疗复发后的深度和持久缓解。另一方面,抗 CD38 抗体、烷化剂、蛋白酶体抑制剂 (PI) 和免疫调节药物 (IMiD) 的前景较差,表明尽管患者可能对既往难治的治疗产生应答,但难以出现持久应答。此外,接受 BCMA抗体药物偶联物 (ADC) belantamab mafodotin 的患者结局特别令人沮丧,这与一个事实相反,那就是之前接受过非细胞抗 BCMA 治疗的患者在接受 cilta-cel 后能够产生临床反应,从而强调了 BCMA 靶向治疗的顺序重要性(CARTITUDE-2研究,C队列)。未来,BCMA CAR-T复发后的最佳策略可能包括结合多种作用机制的组合或序贯策略,或使用模块化 CAR-T 结构或双特异性 T 细胞衔接器双重靶向其他候选抗原,如SLAMF7、GPRC5D或FcRH5。
总结
虽然细胞治疗在难治性 B 细胞恶性肿瘤中取得了令人印象深刻的进展,但在单个患者中 CAR T 细胞治疗的成功仍存在很多重大障碍。如上所述,不仅与潜在的淋巴瘤和周围微环境有关,还与 CAR 产物属性和新出现的宿主因素如身体组成、肠道微生物组和骨髓储备有关,了解这些特征之间复杂的相互作用对于有效解决 CAR-T 失败至关重要。应在多中心研究网络和跨学科合作的基础上进一步努力探索 CAR-T 耐药的复杂机制,而不仅仅是单个部分的总和。虽然疾病之间可能存在耐药性的共同点,但也可能存在反映淋巴瘤与多发性骨髓瘤独特生物学基础的重大差异。重要的是,CAR-T失败后的治疗效果仍然较差,疾病往往会迅速进展,为此阐明生物学机制的系统转化研究是开发克服 CAR T 细胞治疗耐药的新型治疗策略的基础
参考文献
Kai Rejeski, Michael D Jain, Eric L Smith.Mechanisms of resistance and treatment of relapse after CAR T-cell therapy for large B-cell lymphoma and multiple myeloma.Transplant Cell Ther . 2023 Apr 17;S2666-6367(23)01238-1.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)