首页 > 医疗资讯/ 正文
纳米技术的发展为癌症治疗带来了新的希望。纳米粒子可以利用其小尺寸和表面修饰的优势,实现药物的靶向递送,从而提高治疗效果并减少副作用。然而,传统的纳米粒子系统在临床转化中仍面临挑战,如靶向效率低和组织穿透能力不足。为克服这些限制,可注射纳米机器人应运而生。这类纳米机器人能够将周围能量(如化学能、光能、超声能和磁能)转化为机械运动,从而实现自主运动,克服生物屏障,提高药物递送的精准性。
武汉理工大学官建国、罗明等人总结了可注射纳米机器人在推进机制、设计和制造方面的最新进展,并详细探讨了纳米机器人在循环、靶向、穿透、内化、释放和治疗(CTPIRT过程)中的动态表现。相关内容以“Injectable nanorobots for precision cancer therapy: motion-enhanced drug delivery”为题发表在《Chemical Society Review》上。

【主要内容】
推进机制的最新进展
外部场驱动
外部场驱动的纳米机器人主要依赖于外部能量源(如光、超声、磁场)来实现运动控制。这些纳米机器人可以通过精确应用外部场来导航和定位,从而实现对肿瘤的精准靶向。
光驱动:光驱动纳米机器人利用光子动量传递、光催化或光热效应来实现运动。例如,某些半导体材料(如二氧化钛、氧化锌)在光照下可以产生光催化反应,生成化学梯度或电场,从而推动纳米机器人运动。光热驱动的纳米机器人则利用材料(如贵金属、聚多巴胺等)将吸收的光能转化为局部热梯度,通过热泳力推动纳米机器人前进。这种驱动方式在浅表或浅层病理部位特别有效,因为光的穿透深度有限。
超声驱动:超声驱动纳米机器人利用超声波产生的机械效应(如声流、辐射力、气泡振荡)来实现运动。这些纳米机器人可以在生物组织中实现较深的穿透,平均深度可达10-20厘米。超声驱动的优势在于其深度穿透能力和非侵入性成像能力,但精确的时空控制仍然是一个挑战。
磁驱动:磁驱动纳米机器人利用外部磁场来实现运动控制。这些纳米机器人通常包含铁磁性或超顺磁性材料,可以通过应用可控的磁场来精确操纵其运动行为。磁驱动纳米机器人不仅可以实现深度组织穿透,还可以通过磁场介导的粒子间相互作用形成动态可重构的群体,展现出集体行为,如协调运动、层次空间组织和协同任务分配。这些集体智能显著扩展了它们的生物医学应用范围。
化学驱动
化学驱动的纳米机器人依赖于内源性燃料(如尿素、葡萄糖、过氧化氢等)来实现自主运动。这些纳米机器人可以在复杂的生物环境中自主导航,特别适合于靶向不确定或转移性肿瘤。
尿素驱动:尿素是一种在血液中广泛分布的代谢产物,其生理浓度范围为1.8-7.1 mM。尿素驱动的纳米机器人通过脲酶催化尿素水解生成二氧化碳和氨,产生离子梯度,从而推动纳米机器人运动。这种驱动方式在血液循环系统中特别有效,但需要优化纳米机器人的结构以提高其在生理尿素浓度下的运动性能。
葡萄糖驱动:葡萄糖是血液中的主要代谢底物,其生理浓度范围为3.9-6.1 mM。葡萄糖驱动的纳米机器人通常利用葡萄糖氧化酶(GOx)催化葡萄糖氧化生成葡萄糖酸和过氧化氢,再通过过氧化氢分解产生氧气,推动纳米机器人运动。这种驱动方式在血液循环系统中有效,但在肿瘤微环境中的葡萄糖浓度较低,限制了其应用。
过氧化氢驱动:过氧化氢在肿瘤微环境中过表达,浓度可达50-100 μM。过氧化氢驱动的纳米机器人利用过氧化氢酶(CAT)或类似酶的纳米酶(如铂、银、二氧化锰等)分解过氧化氢生成氧气,推动纳米机器人运动。这种驱动方式在肿瘤微环境中特别有效,但需要优化纳米机器人的结构以提高其在低浓度过氧化氢下的运动性能。
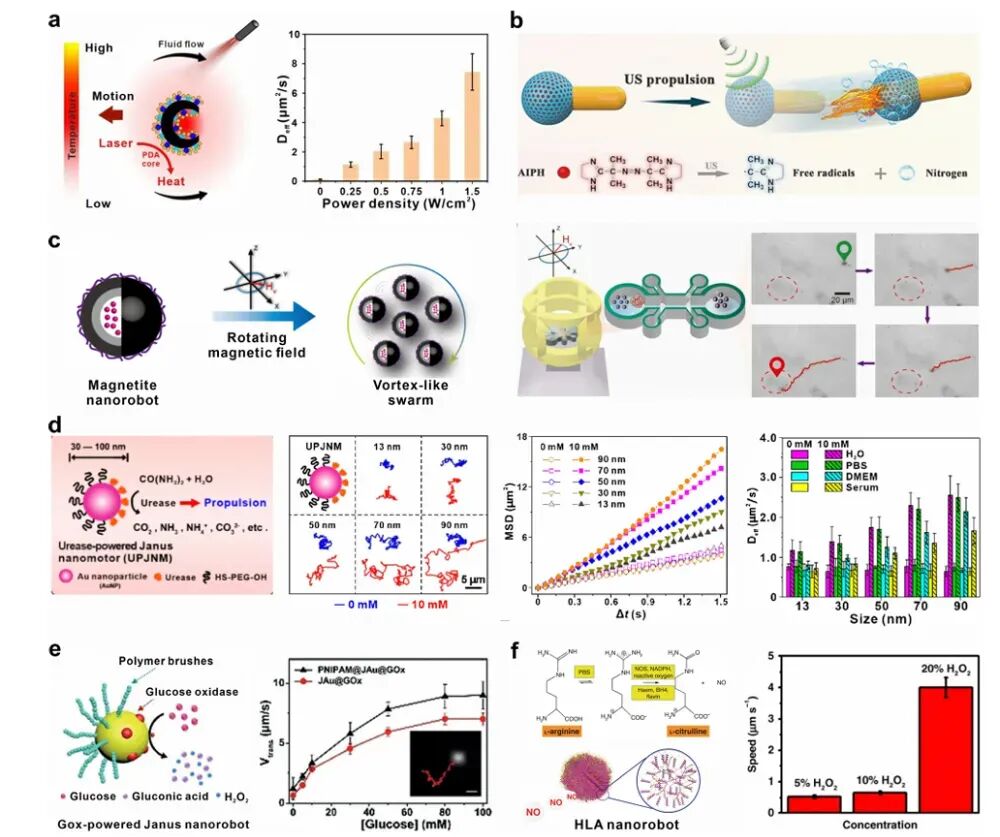
图1 代表性外部场/化学驱动的可注射纳米机器人
设计和制造的最新进展
物理气相沉积(PVD)
PVD是一种在真空或部分真空环境中沉积薄膜的技术,特别适合制造具有不对称结构(如Janus结构)的纳米机器人。例如,通过斜角沉积技术,可以在铂纳米颗粒表面沉积金层,制造出30 nm和60 nm的椭圆形Pt-Au Janus纳米机器人。然而,PVD技术存在一些局限性,如难以精确控制纳米机器人的形状、大小和组成,且设备成本高、操作复杂、难以大规模生产。
胶体化学方法
胶体化学方法通过化学反应在溶液中合成纳米机器人,具有更高的产率和功能多样性。这些方法可以分为缺陷主导型、Janus型和空心几何结构型。例如,通过在mSiO2纳米颗粒表面吸附小纳米颗粒,可以制造出具有不对称结构的纳米机器人。另一种方法是通过种子介导生长法,在Au纳米颗粒表面选择性生长聚苯乙烯,然后通过化学偶联制造出13-90 nm的尿素驱动Janus纳米机器人。这些纳米机器人是目前报道的最小的化学驱动纳米机器人,展示了在生理尿素浓度下的高效运动能力。
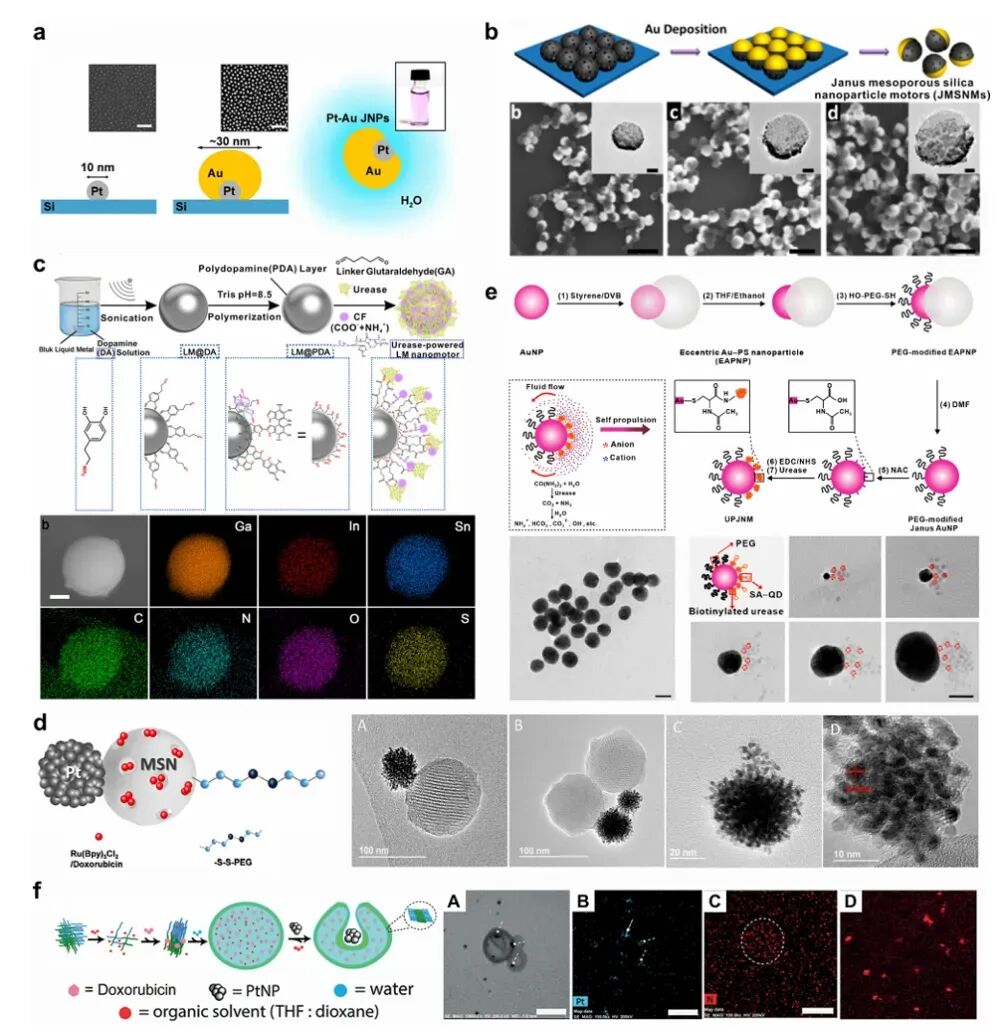
图2 代表性小尺寸纳米机器人的制备方法
CTPIRT过程中的动态表现
循环(Circulation)
纳米机器人在血液循环系统中的循环能力对其治疗效果至关重要。纳米机器人的大小应控制在30-200 nm之间,以平衡有效肿瘤积累和最小化清除。此外,纳米机器人需要克服肾脏、肝脏和脾脏的清除作用,以及血清蛋白吸附形成的蛋白冠,这些都会影响其在体内的循环时间和生物分布。
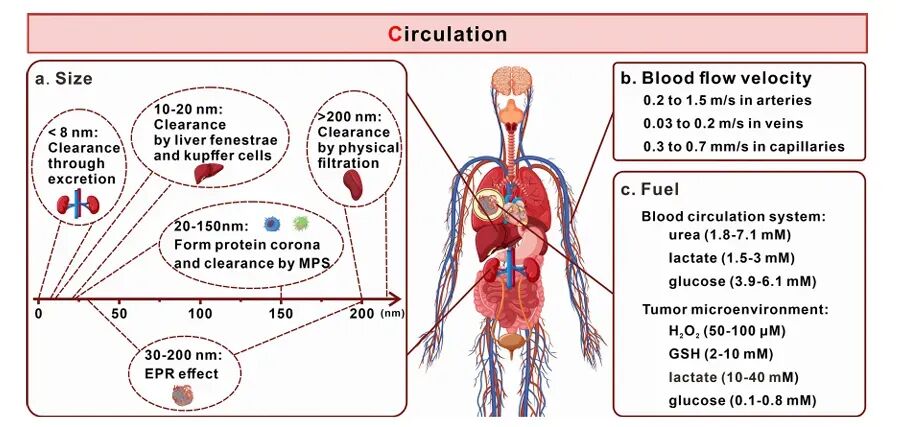
图3 可注射纳米机器人在血液循环中的生理屏障示意图
靶向(Targeting)
纳米机器人通过外部场操纵或化学趋化机制实现对肿瘤的靶向。例如,光驱动的Cu2-xSe@Au-聚合物纳米机器人在NIR光照射下可以实现运动,显著提高肿瘤靶向效率。化学驱动的纳米机器人则通过感知肿瘤微环境中的特定化学信号(如过氧化氢、乳酸)实现自主导航和靶向。这些纳米机器人在体外和体内模型中均展现出显著的肿瘤靶向能力。
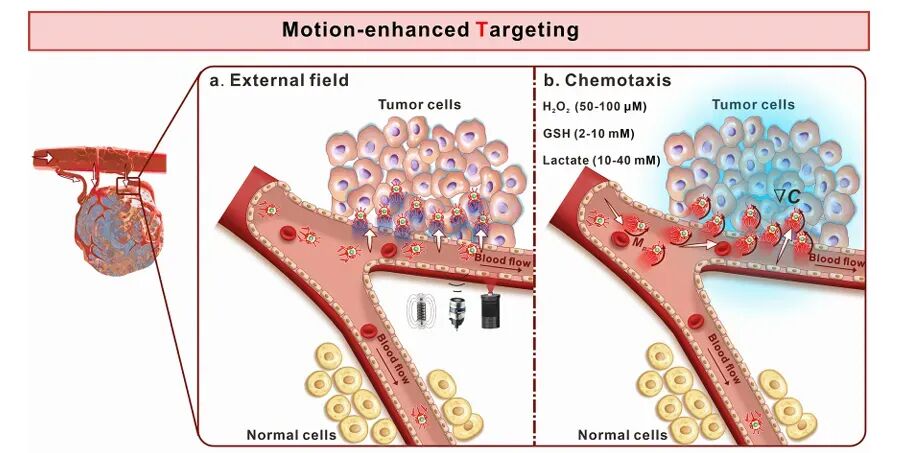
图4 可注射纳米机器人用于精准肿瘤靶向的示意图
穿透(Penetration)
纳米机器人在肿瘤组织中的穿透能力对其治疗效果同样重要。外部场驱动的纳米机器人可以通过机械力或热效应破坏肿瘤结构,促进药物释放和细胞内化。例如,光驱动的PDA包覆的纳米机器人在NIR光照射下可以产生热效应,破坏细胞膜,显著提高细胞内化效率。化学驱动的纳米机器人则通过运动增强的内吞作用和胞吐作用,提高细胞内化和药物传递效率。
内化(Internalization)
纳米机器人在肿瘤细胞中的内化能力是其治疗效果的关键因素之一。外部场驱动的纳米机器人可以通过机械力或热效应促进细胞内化。例如,磁驱动的纳米机器人在磁场作用下可以显著提高细胞内化效率。化学驱动的纳米机器人则通过运动增强的内吞作用和胞吐作用,提高细胞内化和药物传递效率。
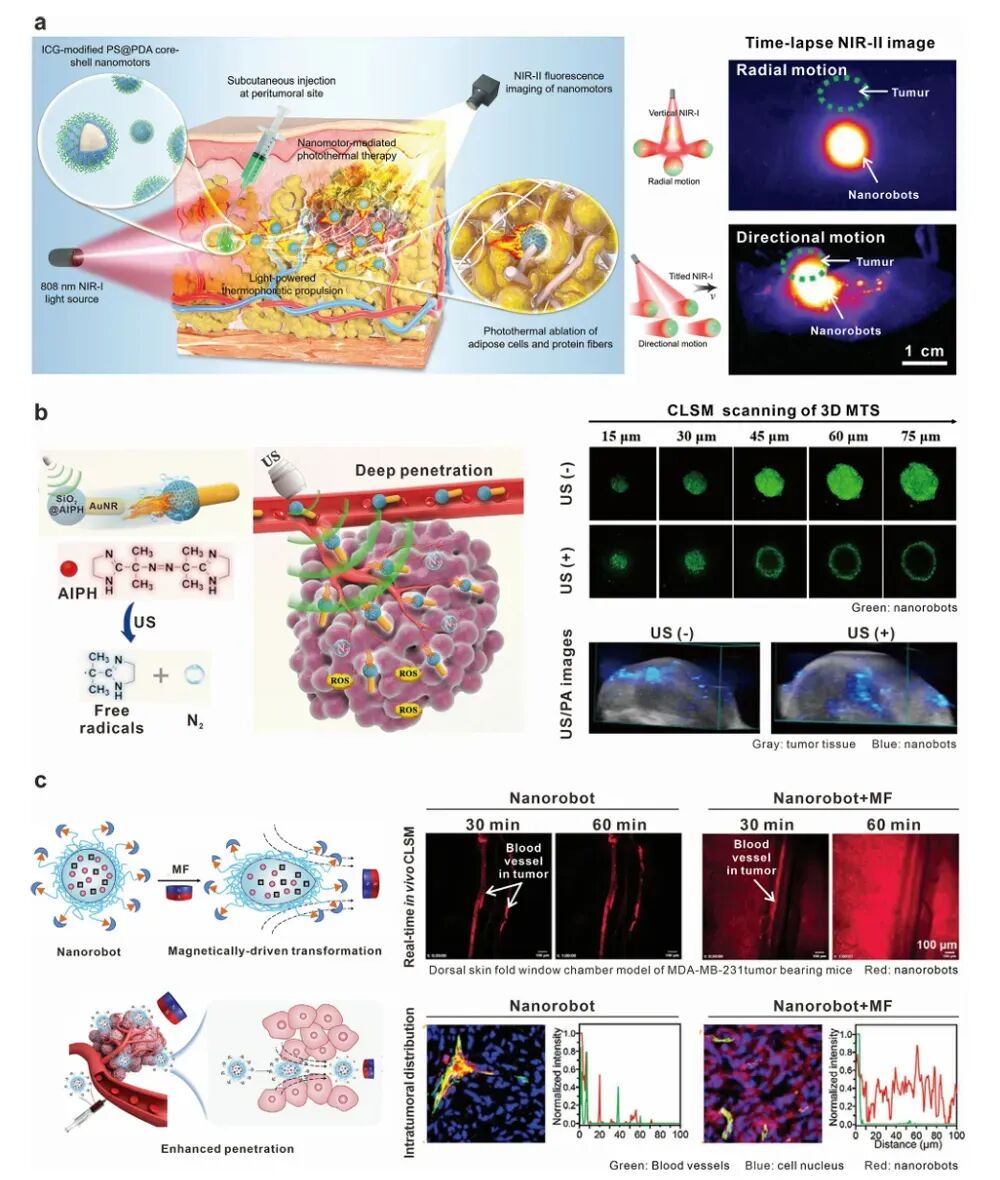
图5 代表性可注射外部场驱动纳米机器人用于增强肿瘤穿透和细胞内化
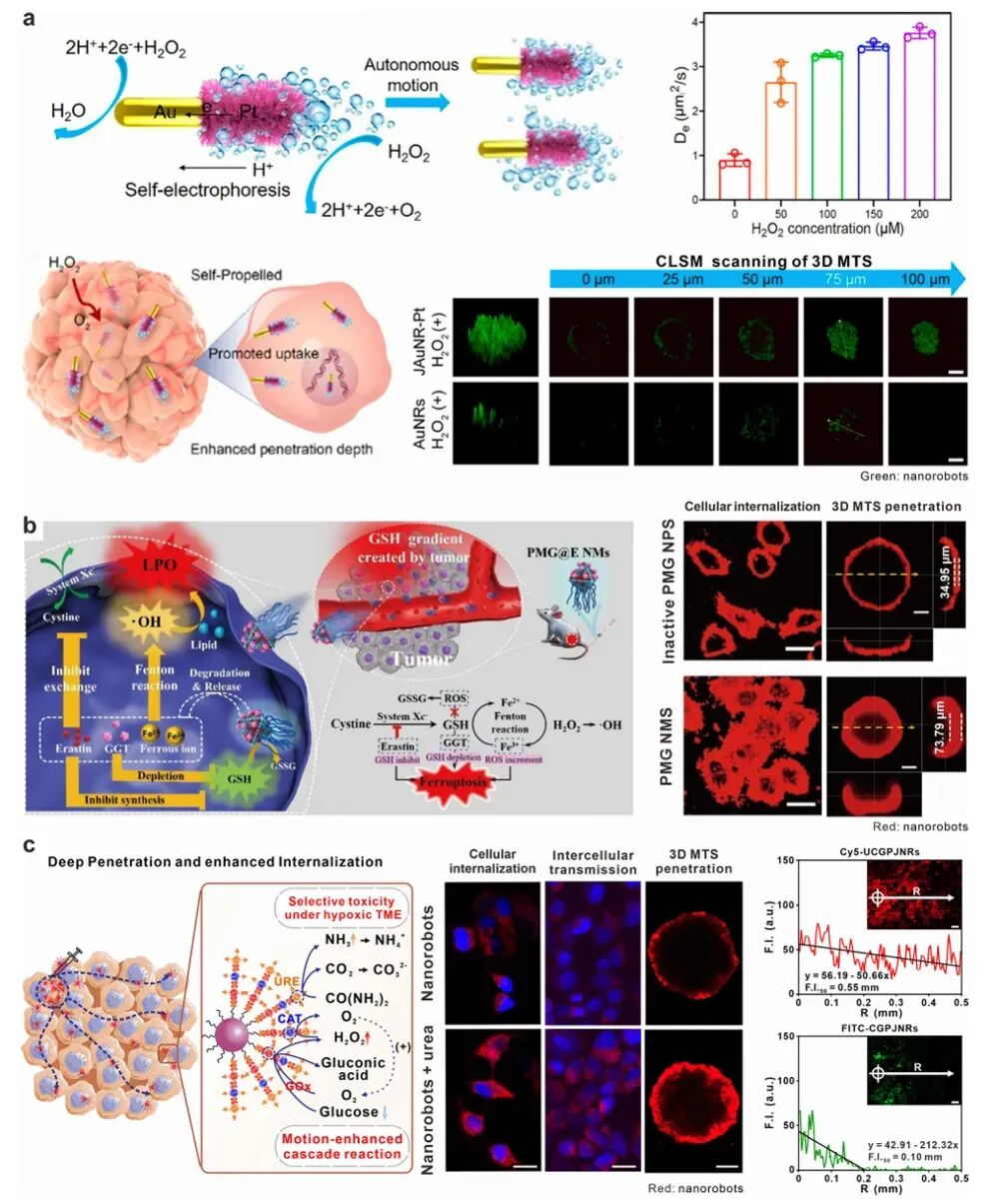
图6 代表性可注射化学驱动纳米机器人用于增强肿瘤穿透和细胞内化
释放(Release)
纳米机器人在肿瘤微环境中的药物释放能力对其治疗效果至关重要。外部场驱动的纳米机器人可以通过热效应或机械力实现药物的精准释放。例如,光驱动的纳米机器人在NIR光照射下可以产生热效应,促进药物释放。化学驱动的纳米机器人则可以通过响应肿瘤微环境中的特定化学信号(如过氧化氢、谷胱甘肽)实现药物的精准释放。
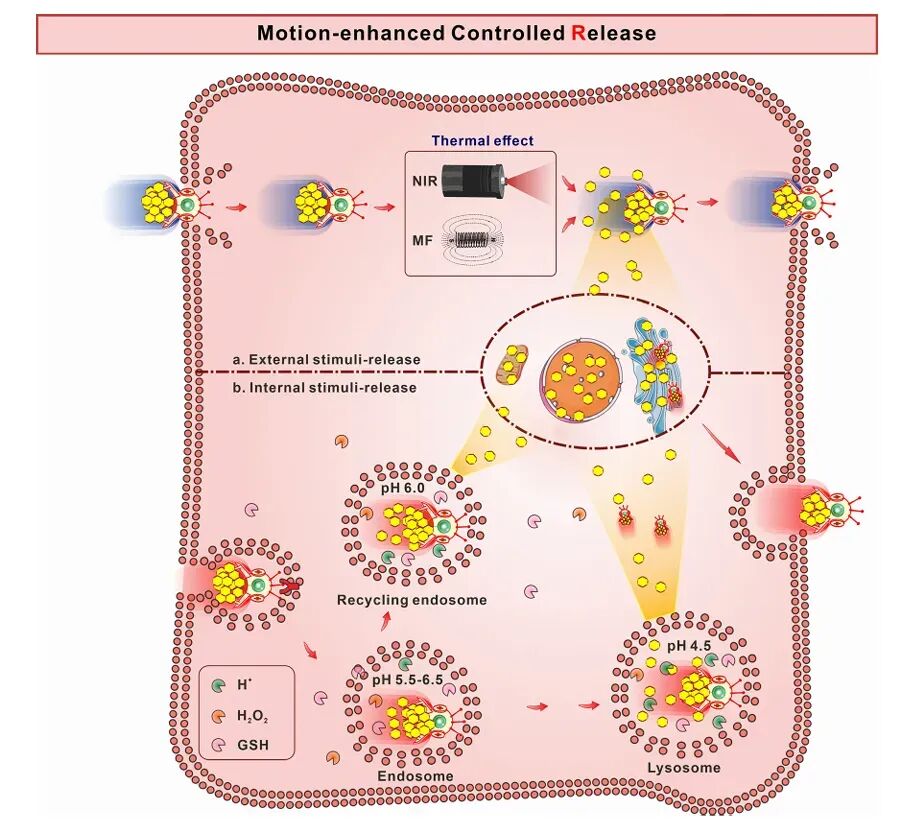
图7 代表性可注射纳米机器人用于由外部刺激触发的药物释放
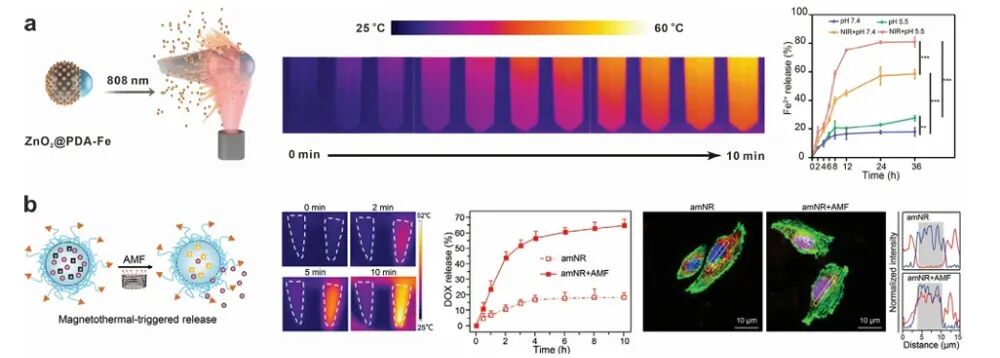
图8 代表性可注射纳米机器人用于由外部刺激触发的药物释放
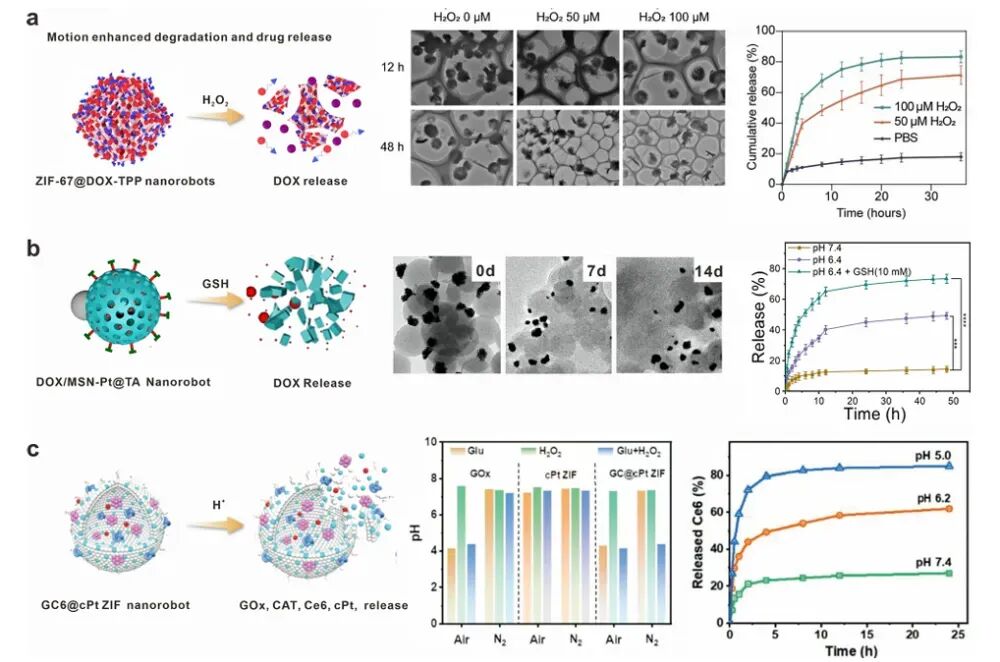
图9 代表性可注射纳米机器人用于由内部刺激触发的药物释放
治疗(Treatment)
纳米机器人在肿瘤治疗中的应用效果是其最终目标。通过整合多种治疗策略(如化疗、光热治疗、免疫治疗),纳米机器人可以实现协同治疗效果,显著提高肿瘤治疗效果。例如,某些纳米机器人在体内模型中展现出显著的肿瘤生长抑制效果,提高了患者的生存率。
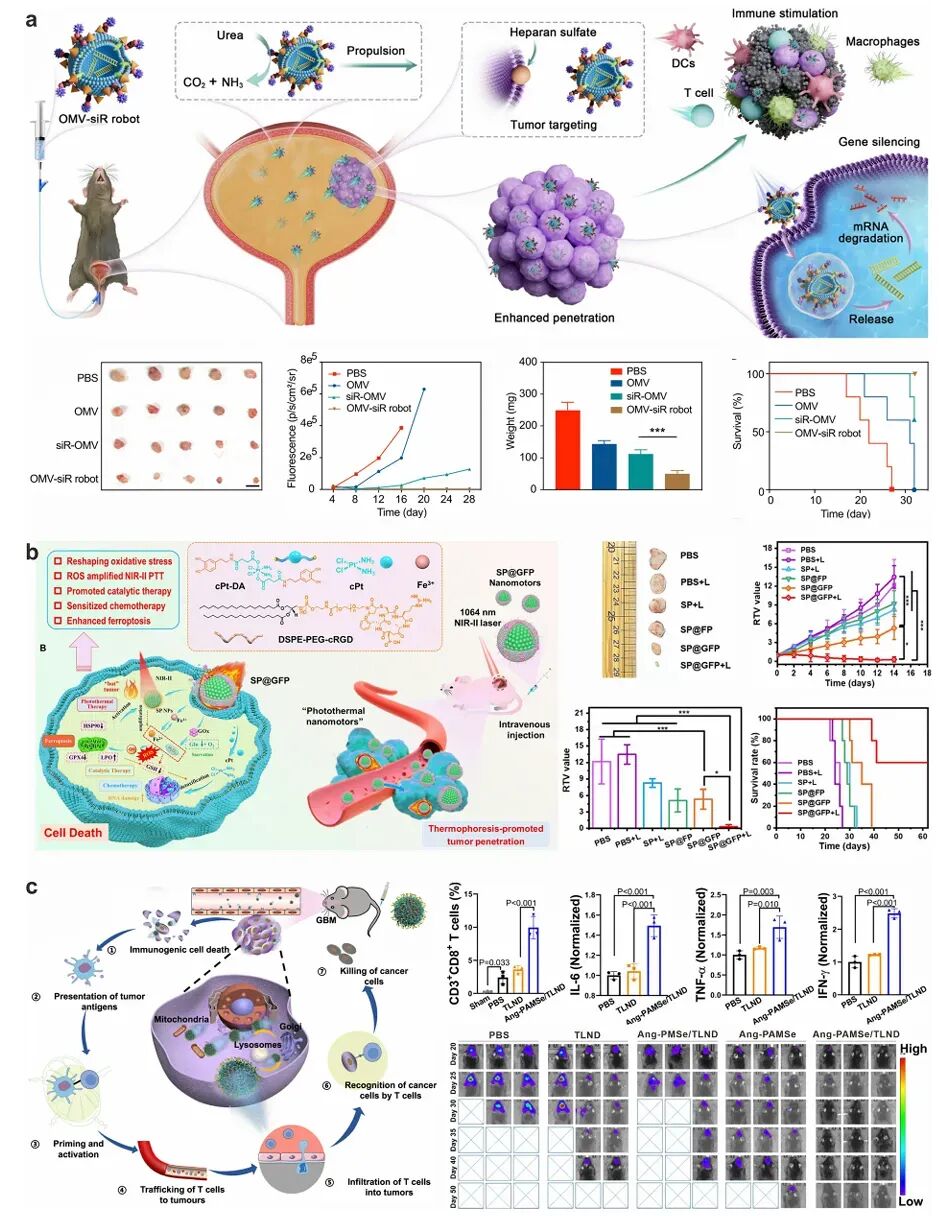
图10 代表性可注射纳米机器人用于增强抗肿瘤治疗效果
【全文总结】
本文系统总结了可注射纳米机器人在推进机制、设计和制造方面的最新进展,并详细探讨了纳米机器人在循环、靶向、穿透、内化、释放和治疗(CTPIRT过程)中的动态表现。这些进展为开发下一代智能纳米机器人提供了理论基础,并为推动纳米机器人从实验室研究向临床应用转化提供了重要的参考。
原文链接:
https://doi.org/10.1039/D5CS00596E
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)