首页 > 医疗资讯/ 正文
【论著】
本研究应用四血管阻断法建立大鼠脑缺血再灌注损伤(CIRI)模型,探讨电针治疗对CIRI的神经保护机制,并探索与钙/钙调蛋白依赖性蛋白激酶激酶2(CaMKK2)/单磷酸腺苷活化蛋白激酶信号通路相关的作用机制,为改善CIRI提供新思路。
1 材料与方法
1.1 实验动物及分组
SPF级雄性SD大鼠,6~8周龄,体重200~250 g。大鼠被随机分笼(每笼5只),置于温度20℃~24℃、湿度50%~55%、每天光照12 h的环境中,自由进食消毒后的饲料和水,饲养1周。取40只大鼠按随机数字表法将大鼠分为4组(每组10只):对照组、模型组、电针组、抑制剂组。
1.2 模型制备
参考文献,模型组、电针组、抑制剂组大鼠均采用四血管阻断法建立CIRI模型,对照组大鼠仅暴露双侧椎动脉和双侧颈总动脉。1%戊巴比妥钠40 mg/kg腹腔注射进行麻醉,将麻醉成功的大鼠俯卧位固定,在枕骨后切开皮肤暴露第1颈椎两侧的翼孔,将0.5 mm的电凝器插入翼孔,烧灼双侧的椎动脉,造成永久性闭塞。将大鼠仰卧位固定,颈部消毒备皮后,暴露并分离双侧颈总动脉,穿线备用并逐层闭合颈部切口。允许大鼠恢复24 h,24 h后采用微动脉夹夹闭双侧颈总动脉15 min诱导大鼠全脑缺血,然后开放双侧颈总动脉恢复灌注。术中维持大鼠体温在37 ℃。造模成功标准:夹闭双侧颈总动脉30 s内,大鼠出现意识丧失、角膜反射和对光反射消失、翻正反射消失。本研究造模成功率为60%~70%,因造模失败及大鼠死亡致样本量减少时,随机选择同一批次、同等条件下饲养的大鼠重新进行模型制备,补足样本量。
1.3 干预措施
电针组、抑制剂组大鼠于开放颈总动脉后开始再灌注,分别于再灌注24、48、72、96、120、144、168 h进行电针治疗。参考《实验针灸学》及《实验针灸穴位图谱》定位大鼠神庭穴、百会穴,采用直径0.3 mm的针灸针进行针刺,经皮刺入穴位2~3 mm,连接神经刺激器(型号:SDZ‑V,苏州华拓医疗器械有限公司),给予疏密波、频率2/12 Hz、强度1~3 mA电刺激,以肌肉产生轻度收缩为标准,每次持续时间30 min。抑制剂组于每次电针治疗前腹腔注射STO‑609工作液[STO‑60910 μmol/L溶于NaOH,配成20 mmol/L∶100 mmol/L储备液,后与生理盐水稀释成STO‑609工作液(1∶2 000)]10 μmol/L,电针组于大鼠每次电针治疗前腹腔注射同体积生理盐水。对照组和模型组大鼠造模成功后进行同等时间的抓取刺激,不进行其他处理。
1.4 检测指标
1.4.1 神经功能评分
在再灌注168 h最后一次电针治疗后,根据盲法原则,由一名不知具体实验分组的研究人员记录每只大鼠神经功能缺陷评分(NDS)。
1.4.2 组织切片制备及组织染色观察病理学改变
NDS后,每组随机选取5只大鼠,1%戊巴比妥钠40 mg/kg腹腔注射,麻醉后剪开胸腔,暴露心脏区域,以生理盐水约200 ml行升主动脉灌注冲洗后,采用4%多聚甲醛(pH 7.2~7.4)200 ml灌注固定。灌注完毕后立即断头处死,取完整脑组织于4%多聚甲醛中固定。固定完成后常规脱水浸蜡包埋,制成4 μm冠状切片,以备后续苏木精‑伊红(H‑E)染色、尼氏染色、原位末端转移酶标记法染色(TUNEL)染色观察组织病理学改变。
H‑E染色:每组每只大鼠随机选取3张海马组织切片,将切片经过常规脱蜡梯度脱水后,H‑E染色,水中浸泡,乙醇梯度脱水,透明封片。由一位不清楚分组情况的研究人员,每张切片随机选取5个海马CA1区椎体层细胞视野,在光镜下评估各组大鼠组织病理学改变程度。
尼氏染色:每组每只大鼠随机选取3张海马组织切片,将切片经过常规脱蜡梯度脱水后,室温下浸入0.5%甲酚紫溶液10 min,冰醋酸乙醇分化,乙醇梯度脱水,透明封片。由一位不清楚分组情况的研究人员,每张切片随机选取5个海马CA1区椎体层细胞视野,在光镜下观察切片,计算每个视野下尼氏染色阳性细胞数并取平均值。尼氏体呈深蓝色,细胞核呈淡蓝色。
TUNEL染色:每组每只大鼠随机选取3张海马组织切片,将切片经过常规脱蜡梯度脱水。切片稍干后用组化笔在组织周围画圈,圈内滴加蛋白酶K工作液,37 ℃孵育20 min。随后加入磷酸盐缓冲液(PBS)漂洗3次,每次5 min。按照说明书配置TUNEL荧光反应液。切片表面滴加TUNEL荧光反应液,37 ℃避光孵育60 min。后加入PBS漂洗3次,每次5 min彻底洗去反应液。切片表面稍干后加入4',6‑二脒基‑2‑苯基吲哚反应液,室温下孵育10 min后重复PBS漂洗3次,每次5 min。封片,在荧光显微镜下观察。由一位不清楚分组情况的研究人员,每张切片选取5个海马CA1区椎体层细胞视野,在光镜下观察TUNEL阳性细胞个数,并计算细胞凋亡率,取平均值。凋亡率=凋亡细胞数(TUNEL阳性细胞数)/细胞总数×100%。
1.4.3 免疫印迹法(Western blot)检测大鼠海马相关蛋白水平
NDS后,每组剩余5只大鼠断头处死,取同侧海马组织,加入放射免疫沉淀分析缓冲液裂解液后置入匀浆机中充分研磨,于冰上孵育30 min充分裂解蛋白。将裂解后组织4 ℃、12 000 转/min,离心10 min(离心半径8 cm),并提取上清液。每个样本取40 μg蛋白质,用12%十二烷基硫酸钠‑聚丙烯酰胺凝胶电泳分离。用湿式转印法将蛋白质从凝胶电转移到聚偏二氟乙烯膜(PVDF)膜上,室温下将膜放入5%脱脂奶粉中封闭1 h。封闭结束后,将PVDF膜用Tris缓冲盐溶液‑Tween 20(TBST)清洗约2 min。弃去TBST,加入半胱天冬酶‑3(caspase‑3)一抗(1∶1 000)、剪切的胱天蛋白酶‑3(cleaved‑caspase‑3)一抗(1∶1 000)、Bcl‑2相关X蛋白(Bax)一抗(1∶500)、CaMKK2一抗(1∶500)、磷酸化AMPK(p‑AMPK)一抗(1∶2 000)、AMPK一抗(1∶1 000),置于4 ℃冰箱内的摇床上,孵育过夜。回收一抗,将PVDF膜用TBST清洗,清洗3次,每次8~10 min。弃去TBST,加入配制好的二抗稀释液(1∶10 000),置于摇床上,室温孵育2 h。回收二抗,将PVDF膜用TBST清洗,清洗3次,每次8~10 min。使用化学发光法进行条带显影,以β‑actin为内参。使用Image J软件进行条带灰度值分析,以目的蛋白与内参的比值表示目的蛋白水平。
2 结果
2.1 各组大鼠NDS比较
与对照组比较,模型组、电针组、抑制剂组NDS较高(均P<0.05);与模型组比较,电针组NDS较低(P<0.05);与电针组比较,抑制剂组NDS较高(P<0.05)。见表1。

2.2 各组大鼠海马组织病理学改变比较
H‑E染色显示:对照组海马组织结构完整,神经细胞形态规则、细胞核清晰可见。与对照组比较,模型组、电针组、抑制剂组海马组织部分呈疏松的网状结构,细胞呈空泡状,细胞破裂坏死,核溶解;与模型组比较,电针组病理损伤缓解,间质水肿减轻;与电针组比较,抑制剂组细胞缩小变性、细胞核固缩、碎裂。
尼氏染色显示:对照组神经细胞排列整齐紧密,尼氏体数量丰富。与对照组比较,模型组、电针组、抑制剂组神经细胞丢失、染色质固缩、尼氏体数量较少(均P<0.05);与模型组比较,电针组神经细胞数目增加、尼氏体数量较多(P<0.05);与电针组比较,抑制剂组神经细胞排列紊乱、尼氏体数量较少(P<0.05)。见图1、表2。
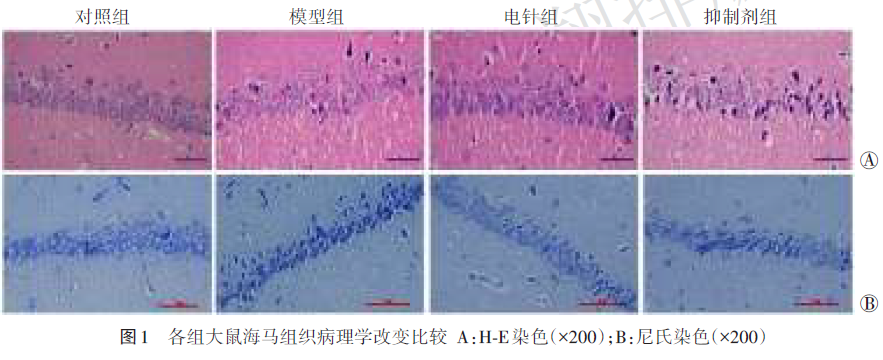

2.3 各组大鼠海马组织细胞凋亡情况比较
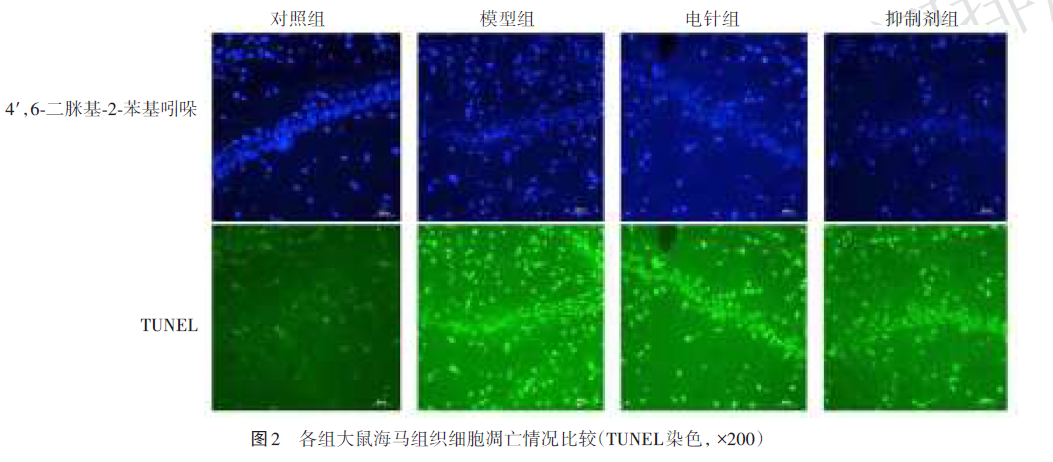
与对照组比较,模型组、电针组、抑制剂组神经细胞破坏严重、细胞缩小、核固缩明显;与模型组比较,电针组神经细胞排列较为规整,染色减轻;与电针组比较,抑制剂组神经细胞排列松散、细胞内染色质凝聚。见图2。
与对照组比较,模型组、电针组、抑制剂组细胞凋亡率较高(均P<0.05);与模型组比较,电针组细胞凋亡率较低(P<0.05);与电针组比较,抑制剂组细胞凋亡率较高(P<0.05)。见表3。
2.4 各组大鼠caspase‑3、Bax、CaMKK2、p⁃AMPK水平及p‑AMPK/AMPK比较
与对照组比较,模型组、电针组、抑制剂组caspase‑3、Bax水平较高,CaMKK2、p‑AMPK水平及p‑AMPK/AMPK较低(均P<0.05);与模型组比较,电针组caspase‑3、Bax水平较低,CaMKK2、p‑AMPK水平及p‑AMPK/AMPK较高(均P<0.05);与电针组比较,抑制剂组caspase‑3、Bax水平较高,CaMKK2、p⁃AMPK水平及p‑AMPK/AMPK较低(均P<0.05)。见表4、图3。

3 讨论
本研究以四血管阻断法建立CIRI模型,发现电针治疗可以上调CaMKK2/AMPK信号通路,减轻CIRI诱导的海马组织细胞凋亡,这为电针治疗CIRI提供了初步的病理基础。
本研究中,与对照组比较,模型组NDS较高,海马CA1区脑组织病理学改变明显、神经细胞破坏严重,尼氏体数量较少,海马组织细胞凋亡率较高,提示大鼠CIRI模型建模成功。
本研究中,与模型组比较,电针组海马caspase‑3、Bax水平较低,病理学改变较轻,海马组织细胞凋亡率较低,提示电针治疗可以抑制CIRI诱导的促凋亡蛋白Bax表达上调,使caspase‑3活化减少进而抑制海马神经细胞凋亡,在CIRI中发挥神经保护作用。
本研究发现,与模型组比较,电针组海马组织中CaMKK2、p⁃AMPK水平及p⁃AMPK/AMPK较高,caspase‑3、Bax水平较低,提示电针治疗可以通过上调CaMKK2表达促进AMPK磷酸化增加,进而抑制凋亡蛋白Bax、caspase‑3表达,减轻神经细胞凋亡。使用CaMKK2抑制剂干预后,与电针组比较,除CaMKK2、p⁃AMPK水平及p⁃AMPK/AMPK较低外,抑制剂组NDS较高,海马组织病理学改变较重,神经细胞破坏较重,尼氏体较少,caspase‑3、Bax水平较高,海马组织细胞凋亡率较高,进一步验证在大鼠CIRI模型中,电针治疗可以通过调控CaMKK2/AMPK信号通路来抑制海马组织神经细胞凋亡,进而发挥神经保护作用。
本研究仍存在一定局限性: ① 并未使用CaMKK2过表达进一步验证假设; ② 只讨论电针治疗通过调控CaMKK2/AMPK信号通路抑制细胞凋亡在CIRI中的作用,其在炎症反应、氧化应激、线粒体自噬等其他病理机制方面是否产生影响有待进一步研究。
国际麻醉学与复苏杂志,2025,46(10):1020-1026 .
DOI:10.3760/cma.j.cn321761-20240827‑01352
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)