首页 > 医疗资讯/ 正文
1代谢相关脂肪性肝病(MAFLD)和慢性肾病(CKD)的流行病学
1.1 MAFLD的流行病学
MAFLD已成为全球重大公共卫生挑战。流行病学数据显示,全球MAFLD患病率从1990年的17.6%大幅增长至2025年的33.6%。中国MAFLD的发病率及患病率增幅均居全球首位,目前已取代病毒性肝炎的传统主导地位,成为我国第一大慢性进展性肝病。MAFLD的疾病发展谱呈现明确的阶段性特征,依次为代谢相关脂肪肝(MAFL)、代谢相关脂肪性肝炎(MASH)以及继发性纤维化和肝硬化。MAFLD不仅增加肝硬化、终末期肝病及肝细胞癌等肝脏相关并发症风险,还与心血管疾病(CVD)、慢性肾病(CKD)、某些类型的肝外癌症等多种肝外并发症密切相关。鉴于其重大疾病负担,近期MAFLD已被纳入《健康中国战略之慢病综合管理蓝皮书(2025年)》,作为代谢性疾病防控的重点对象,并强调实施早筛查、早诊断和早防治的三级预防策略。
1.2 MAFLD相关CKD的流行病学
2025年5月,在第78届世界卫生大会上,世界卫生组织(WHO)将肾疾病确立为全球疾病防治优先领域。最新数据显示,CKD影响全球数亿人,给各国公共卫生体系带来沉重负担。截至2021年,美国肾脏学会、欧洲肾脏协会和国际肾脏学会联合声明指出,全球超过8.5亿人患有某种形式的肾疾病。代谢性疾病如糖尿病、高血压等是全球范围内CKD的主要致病因素,而MAFLD与糖尿病、高血压、肥胖等疾病存在双向因果关系,且已被证实为CKD的独立危险因素,经多因素调整后的风险比(HR)为1.80(95%CI:1.73~1.86)。基于德国大型回顾性队列研究(n=184 450)的10年随访数据显示,MAFLD患者CKD累积发病率显著高于非MAFLD人群(19.1% vs 11.1%),且风险随着肝纤维化程度递增显著升高,其中显著纤维化(≥F2)和晚期纤维化(≥F3)患者的HR分别升至2.15和3.01。最新研究对肝活检确诊的MAFLD患者进行随访及二次肝活检后发现,肝纤维化进展人群的肾功能会逐渐减退;进一步采用二次谐波/双光子激发荧光显微镜成像技术联合人工智能分析,对肝活检白片实现连续自动纤维化定量评估,结果证实中央静脉周围区和中央静脉区纤维化进展比例更高的患者更易出现肾损伤。
尽管MAFLD与CKD的密切关联已得到证实,我国成人CKD的防治仍面临严峻挑战:2018—2019年成人CKD患病率为8.2%(约8 200万例),但知晓率仅为10%,反映出显著的诊断不足问题。同时,多学科交叉研究欠缺、对高危人群的分层管理和精准干预经验有限等关键问题较为突出。基于MAFLD与CKD的共病特性,早期防控和治疗至关重要。本文将从危险因素、早期双向筛查策略及综合管理策略3个维度系统阐述,旨在优化临床实践、改善疾病的管理现状。
2MAFLD与CKD的危险因素
2.1 代谢异常
肥胖、高血糖、高血压、高血脂、胰岛素抵抗(IR)、慢性炎症状态等是MAFLD与CKD的共同危险因素。这些因素在肝脏可促进脂肪变性、诱导炎症反应及加速纤维化进程;在肾脏则可通过影响血流动力学、促进肾小球硬化、加速肾小管间质纤维化等机制导致损伤。英国生物样本库的最新研究证实,在脂肪性肝病患者中,单一代谢综合征特征与多重代谢综合征特征聚集均会显著增加CKD风险。具体而言,高血压单独存在可使CKD风险升高35%[比值比(OR)=1.35,95%CI:1.35~1.72,P<0.05],糖尿病单独存在则可导致CKD风险上升89%(OR=1.89,95%CI:1.06~3.38,P<0.05);当患者同时具备≥3种代谢综合征特征时,CKD风险进一步增加(OR=1.94,95%CI:1.75~2.15,P<0.001)。上述结果充分表明,代谢异常不仅能作为独立因素促进MAFLD和CKD的发生发展,还能通过与MAFLD的协同作用加速CKD的进展。
2.2 遗传易感性
多项研究证实,特定基因遗传多态性在MAFLD和CKD的发病机制及疾病进展中发挥着重要作用,主要包括patatin样磷脂酶域3(PNPLA3)、17β-羟基类固醇脱氢酶13型(HSD17B13)、跨膜6超家族成员2(TM6SF2)、膜结合O-酰基转移酶结构域7(MBOAT7)、葡萄糖激酶调节因子(GCKR)等基因。一项纳入23项病例对照研究的荟萃分析表明,携带PNPLA3基因G等位基因的人群MAFLD发病风险显著增加。PNPLA3基因在肝脏、脂肪组织和肾脏中均为高表达,其编码的具有脂肪酶活性的蛋白质不仅通过参与肝脏脂质代谢调控干预MASLD进程,基因变异时还可引发脂质肾毒性,导致肾纤维化、肾小球硬化等病变。近年来,相关临床研究显示,PNPLA3基因变异与eGFR(估算肾小球滤过率)降低、蛋白尿异常及CKD患病率升高显著相关。
须注意,HSD17B13基因变异可表现出保护作用。研究证实,该基因的特定变异可减轻肝脏纤维化和炎症反应。基于MAFLD和CKD间的遗传关联性,一项纳入684名肥胖儿童的研究显示,HSD17B13罕见A等位基因对肥胖患者的eGFR具有保护作用。进一步研究发现,在经活检确诊的MAFLD患者中,携带HSD17B13 rs72613567的A等位基因者发生白蛋白尿的风险显著下降,即使在校正已确定的肾脏危险因素及MAFLD组织学严重程度后,仍具有统计学意义(校正OR=0.16,P=0.001)。上述发现共同证实遗传因素在MAFLD及相关肾损伤中的重要性。
2.3 活性代谢物
肠道微生物组的稳态对维持机体健康具有关键作用。近年来提出的“肠-肝-肾轴”理论揭示,肠道微生物群及肠道屏障的完整性与MAFLD和CKD的发病机制存在潜在关联。肠道微生物群构成一个高度多样化且动态的生态系统,对宿主多种生理过程具有重要调节作用。研究表明,肠道菌群、肠道微生物和胆汁酸代谢产物之间存在相互依存、相互制约的复杂关系,共同影响肠道的微环境与宿主健康。肠道菌群失调可导致肠道屏障功能受损、通透性增加,细菌及其衍生的活性代谢产物易进入血液循环,激活肝脏Kupffer细胞和肝星状细胞,触发炎症级联反应,诱导肝细胞脂肪蓄积、肝细胞损伤及肝纤维化,从而加速MAFLD的进展,同时,引起肾损伤。例如,三甲胺N-氧化物(TMAO)在MAFLD和CKD患者血浆中的水平显著上调,其介导的肠道微生物群与宿主串扰可促进MASH相关的肝纤维化进程,并加剧肝脂肪变性;同时,促进肾小管间质纤维化和胶原蛋白沉积,加速肾功能障碍的进展。此外,胆汁酸代谢循环受肠道菌群的影响,肝脏合成的初级胆汁酸经肠道菌群代谢转化为次级胆汁酸。研究证实,MAFLD患者中的总胆汁酸、初级胆汁酸和次级胆汁酸水平显著高于健康对照组。作为胆汁酸信号通路的关键受体,法尼醇X受体(FXR)已被确立为MASH的药理学靶点,初步证据亦支持FXR激活可能具有修复肾组织损伤及预防肾脏病理进程的潜力。某些循环胆汁酸与果糖摄入量增加、维生素D缺乏及肠道微生物群落改变,也可能通过多种机制影响MAFLD和CKD的进展。
2.4 其他共同危险因素
除上述因素,年龄与疾病家族史亦是不容忽略的共同风险因素。某些特定疾病状态同样可能构成威胁,例如阻塞性睡眠呼吸暂停低通气综合征既是MAFLD的促成因素,也是CKD的已知危险因素,提示这些疾病间可能存在共同的病理生理机制。在分子机制层面,5'-腺苷单磷酸激活的蛋白激酶、缺氧诱导因子1α及哺乳动物雷帕霉素靶点等细胞代谢传感器的失调,已逐步证实与MAFLD和CKD的发病机制密切相关。此外,血小板活化与肾素-血管紧张素-醛固酮系统激活在肝、肾器官的损伤机制中同样发挥重要作用。
3MAFLD与CKD相互筛查策略
3.1 MAFLD的筛查
MAFLD的筛查及终末期肝病风险个体的识别仍是当前亟待解决的关键问题。截至目前,肝活检虽为诊断MAFLD的金标准,但其侵入性和高成本特性使临床应用受限。因此,血清生物标志物及无创成像技术的应用在该领域具有重要的临床意义。肝脂肪含量检测包括:肝脏超声(操作简便)、瞬时弹性成像受控衰减参数(CAP)(灵敏度较高)、磁共振质子密度脂肪分数(MRI-PDFF)及CT(准确性较高);肝纤维化检测包括:瞬时弹性成像肝硬度值(LSM)(快速无创)、磁共振弹性成像(准确性较高)、血清生物标志物(无创且成本较低)及声辐射力脉冲成像(无创)。其中,瞬时弹性成像检测的CAP和LSM、肝纤维化-4指数(FIB-4)评分、MAFLD活动评分、MRI-PDFF等无创工具与评分,在MAFLD筛查与评估中具有重要的应用价值。此外,由性别、年龄、2型糖尿病状态、AST/ALT比值、血小板计数及LSM组合的Agile评分,以及基于FibroScan的CAP、LSM和AST组合的FAST评分,在MAFLD的筛查与评估中亦较常用。《代谢相关(非酒精性)脂肪性肝病防治指南(2024年版)》推荐,MAFLD患者应每3~6个月检测1次肝肾功能、血脂、血糖等生化指标,每6~12个月进行1次全血细胞计数及上腹部和颈动脉超声显像检查。此外,在肝脏纤维化进展监测方面,建议每年至少评估1次FIB-4评分或进行LSM检查。这些定期监测措施有助于及时发现和管理疾病的进展,从而改善患者的长期预后。
3.2 MAFLD患者的CKD相关筛查
《代谢相关(非酒精性)脂肪性肝病防治指南(2024年版)》推荐,鉴于CKD在MAFLD患者中的高发生率,精确评估肾功能状态对其临床预后具有重要意义,建议MAFLD患者常规筛查CKD及亚临床动脉硬化,并进行全面的CVD风险评估。流行病学研究揭示,MAFLD患者中CKD的患病率显著高于非MAFLD人群(17.52% vs 11.06%,P<0.001);同时,MAFLD作为CKD发生的独立危险因素,可使CKD风险升高35%。基于慢性肾脏病流行病学协作组(CKD-EPI)公式计算的eGFR是当前评估肾功能的核心指标,其包含2021年CKD-EPI肌酐方程、2012年CKD-EPI胱抑素C方程及2021年CKD-EPI肌酐-胱抑素C方程。单独使用肌酐估算eGFR时,结果主要受肌肉量、饮食等因素影响;单独使用胱抑素C估算eGFR时,则会受某些疾病状态干扰。尽管研究表明,胱抑素C与eGFR的相关性(r=0.82)优于传统肌酐,且在早期肾损伤筛查中具有显著优势,但联合使用肌酐和胱抑素C可实现优势互补,从而使eGFR更准确,尤其在肾损伤早期或肾功能变化较快的情况下,能更及时、准确地反映肾小球滤过功能的变化,减少单一标志物检测带来的误差。研究显示,MAFLD患者eGFR水平普遍低于非MAFLD人群。CKD的严重程度与eGFR的下降幅度和速度呈正相关,eGFR在2年内下降30%~40%或每年下降速度超过5 mL·min-1·1.73 m-2均与CKD并发症、终末期肾病进展及死亡风险显著相关。因此,采用肌酐-胱抑素C联合方程式计算eGFR,是MAFLD患者筛查肾功能的优选方案。
在肾功能筛查指标中,尿白蛋白/肌酐比值(UACR)也占据重要地位。UACR作为早期肾损伤的敏感指标,通常在eGFR下降前出现异常(≥30 mg/g),提示肾单位及血管内皮损伤,对早期CKD进展及心血管风险预测具有重要意义。2024年,改善全球肾病预后组织制定的CKD评估和管理临床实践指南(以下简称《指南》)建议,MAFLD患者应每年进行eGFR和UACR筛查,合并糖尿病或FIB-4≥1.30的高危人群需缩短至每6个月监测1次;对于合并高血压或糖尿病的MAFLD患者,推荐每3个月复查UACR以排除一过性干扰因素。因此,对于合并胰岛素抵抗、高血压等代谢风险因素的MAFLD患者,需按《指南》建议定期监测肾功能相关指标,以实现CKD的早期诊断。糖尿病作为代谢功能障碍的关键表现形式,相关共识已明确指出,UACR和eGFR是糖尿病合并CKD患者预后评估的关键指标,但二者评估蛋白尿的可靠性仍需通过大规模前瞻性研究验证,以促进其在临床实践中的广泛应用。
3.3 MAFLD与CKD的联合筛查
多种检测手段与无创工具可用于MAFLD与CKD的联合筛查。在MAFLD的诊断及病情监测中,FIB-4评分具有重要的临床意义,其不仅与MAFLD活动评分显著相关,可用于精准监测疾病动态变化,还在筛查合并CKD风险方面展现出潜在应用价值。日本一项针对MAFLD和糖尿病患者的队列研究显示,FIB-4指数≥1.30是CKD发展的独立危险因素,提示FIB-4指数偏高的患者应定期监测肾功能。一项针对6 567例非孕妇成人MAFLD患者CKD患病率的研究发现,LSM与CKD独立相关,当LSM值高于8.61 kPa时,CKD风险增加,提示LSM可作为MAFLD患者筛查CKD的重要指标。针对CKD患者的临床研究系统评估了多种代谢相关指标与CKD及MAFLD的关联,发现血压、血脂、血糖及BMI等指标在白蛋白尿和CKD正常组与异常组间存在显著差异,提示这些代谢指标可能在CKD及MAFLD疾病进展中发挥重要作用,有望成为联合筛查的潜在生物标志物。对于代谢指标异常的CKD患者,同样需全面评估其MAFLD发病风险,并采取针对性预防及治疗措施以优化整体健康状况。MAFLD患者若存在胰岛素抵抗或肝纤维化表现,应加强CKD的筛查力度;CKD患者也应密切监测代谢指标与肝功能,以便早期发现潜在MAFLD病变。为提高筛查效能,可采用多模态非侵入性检测手段联合应用的策略。例如,先运用FIB-4等血液生物标志物进行初步风险分层,再结合瞬时弹性成像等先进影像学技术进一步明确诊断,有助于精准识别MAFLD与CKD共病患者,实现早期诊断及有效疾病管理,改善患者远期预后。
4MAFLD与CKD的综合管理及多学科协作
MAFLD与CKD常伴随多系统并发症,其综合管理需采用多学科协作模式,整合临床药师、营养师、运动生理学家等专业人员,可显著降低MAFLD患者的心血管事件风险。MAFLD与CKD共病患者的综合管理需整合肝病科、肾内科、内分泌科、心血管科等多学科专家协作,制订涵盖疾病监测、治疗方案选择及生活方式干预的全面管理计划。在治疗MAFLD时,必须考虑治疗措施对肾功能的潜在影响;而治疗CKD时,也需密切关注肝功能及代谢状态。通过多学科协作实现对患者整体健康状况的综合管理,可优化治疗效果并改善患者预后。具体代谢指标控制目标如下:(1)血糖管理:糖化血红蛋白控制目标为≤7.0%;(2)血压控制:目标值为≤130/80 mmHg;(3)血脂调控:低密度脂蛋白胆固醇目标值2.6 mmol/L;(4)体质量管理:建议减重,减重3%~5%可逆转脂肪肝,7%~10%可缓解MASH,≥10%可逆转纤维化。
研究证实,对糖尿病患者同步进行血糖、血压和血脂的综合控制,可显著降低其肾功能恶化的风险。
4.1 MAFLD与CKD的生活方式干预
基于代谢-炎症-器官交互病理生理轴设计的多维度生活方式干预,是MAFLD与CKD管理的重要基础。研究表明,低热量饮食与规律体力活动相结合的干预措施,在改善MAFLD和CKD方面效果显著。对于MAFLD和CKD患者,饮食干预具有显著的治疗效果。采用低碳水化合物饮食、低脂饮食、间歇性禁食或地中海饮食等模式,均可有效减轻体质量,并带来代谢、心血管及肝脏方面的多重获益。具体而言,每天减少2 092~4 184 kJ的热量摄入,逐步降低体质量,减少肝脂肪含量,改善IR,以及恢复转氨酶水平,对肝功能产生积极影响,从而降低相关并发症的风险。地中海饮食模式通过多不饱和脂肪酸占比20%总热量和膳食纤维(30 g/d)的协同作用,可显著降低MRI-PDFF和尿白蛋白排泄(MRI-PDFF下降18.7%,P<0.001;UACR下降22 mg/g,P=0.008),其机制可能与调节肠道菌群(如双歧杆菌丰度增加3倍)及抑制肾素-血管紧张素醛固酮系统活性相关。作为生活方式干预的重要组成部分,运动干预在MAFLD管理中具有显著效果。研究显示,每周进行3~5 d、累计时长超135 min的中等强度有氧运动,可有效改善MAFLD患者的心肺功能,并减少肝脂肪含量。近期一项多中心研究进一步证实,MAFLD患者握力每增加1 kg,其CKD发生风险降低4%(OR=0.96,95%CI:0.92~0.99,P=0.004)。综合现有证据,健康的生活方式对MAFLD与CKD患者均有益,可延缓疾病进展并降低并发症风险。建议采取的生活方式包括合理饮食(如增加水果、蔬菜摄入,保持适宜的植物蛋白与动物蛋白比例,控制钠摄入)、适度运动、戒烟限酒、维持健康体质量等。
4.2 MAFLD与CKD的药物治疗策略
在MAFLD(尤其是MASH)和CKD的药物治疗领域,胰高血糖素样肽1受体(GLP-1R)激动剂、二肽基肽酶4(DPP4)抑制剂和钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂已应用于“肝肾”共治。随着研究深入,成纤维细胞生长因子21(FGF21)类似物、甲状腺激素受体β(THR-β)激动剂、过氧化物酶体增殖物激活受体(PPAR)激动剂、FXR激动剂及胰高血糖素样肽-1受体/胰高血糖素受体/葡萄糖依赖性胰岛素分泌多肽受体(GLP-1R/GCGR/GIPR)三重激动剂等药物展现出良好的应用前景。其中,GLP-1R激动剂(如司美格鲁肽、利拉鲁肽等)表现出显著疗效,可有效改善CKD患者的eGFR下降趋势,降低UACR,并提高MAFLD的疾病缓解率。2.4 mg剂量的司美格鲁肽可使MAFLD缓解率达62.9%,且不加剧肝纤维化;1.0~2.4 mg司美格鲁肽可显著改善肾脏结局,在肥胖合并心血管疾病患者中,104周内可延缓eGFR下降0.75 mL·min-1·1.73 m-2,并使UACR升高幅度降低10.7%;在2型糖尿病合并CKD患者中,可进一步减缓eGFR年下降率达1.16 mL·min-1·1.73 m-2。动物实验中,新型GLP-1R/GIPR/GCGR三重激动剂瑞他鲁肽改善肾功能、降低肾脏炎症和纤维化指标的效果优于利拉鲁肽和替尔泊肽,并在改善肝脂肪含量方面效果显著,24周内12 mg剂量组实现86%的正常肝脂肪含量。在MAFLD治疗领域,2024年美国食品药品监督管理局批准的THR-β激动剂瑞司美替罗具有里程碑意义,标志着MAFLD治疗进入疾病特异性治疗时代;其Ⅲ期MAESTRO-NASH临床试验显示,治疗52周后,瑞司美替罗组中MASH消退且纤维化不进展的比例显著高于安慰剂组(29.9% vs 9.7%,P<0.001),同时LSM显著降低(LSM下降≥2 kPa的比例:24.2% vs 14.2%)。此外,PPAR激动剂、FGF21类似物等药物也处于审批过程中。CKD治疗的传统方法涵盖针对蛋白尿和高血压的非特异性治疗,以及针对糖尿病、肾病等特定病因的治疗。近年来,研发中的新兴药物聚焦于炎症、免疫反应、纤维化及Nrf2转录因子等靶点。对于共病患者,药物选择需兼顾对肝脏和肾脏的影响。例如,SGLT-2抑制剂除控制血糖外,在MAFLD和CKD患者中也显示出器官保护作用,但需密切监测肝肾功能。这些新药通过调节能量代谢、减轻炎症和纤维化等机制,为MAFLD和CKD的联合治疗带来新希望,但多数仍处于临床试验阶段,其长期安全性和有效性有待验证,未来有望拓展“肝肾”共管的临床选择。
4.3 MAFLD与CKD的管理目标分层与长期随访
MAFLD与CKD的管理需实施目标分层策略。MAFLD的分层主要依据疾病严重程度,包括肝纤维化程度、炎症活动度等。治疗目标基于分层结果进行相应调整:轻度患者以生活方式干预为核心,辅以定期监测肝功能和代谢指标;中重度患者则需在生活方式干预的基础上联合药物治疗,并增加随访频率。CKD的管理依据肾功能分期和蛋白尿水平进行分层:早期患者侧重于危险因素控制以延缓肾功能恶化,晚期患者则需评估肾脏替代治疗等措施的必要性。对于MAFLD合并CKD的患者,长期随访至关重要,可系统监测病情变化,及时发现肾功能和肝功能异常,通过早期干预改善患者预后。
5小结与展望
MAFLD与CKD紧密关联,新型靶向药物和生活方式干预具有重要临床价值,但目前仍存在临床筛查不足和共病管理碎片化问题。未来需强化高危人群的早期分层筛查,优化代谢指标与肝纤维化的动态监测网络,推动跨学科诊疗平台的规范化建设;同时,应深入探索遗传变异与活性代谢物的靶向调控机制,以开发个体化干预方案,最终实现MAFLD与CKD共病管理的精准化和系统化(图1)。
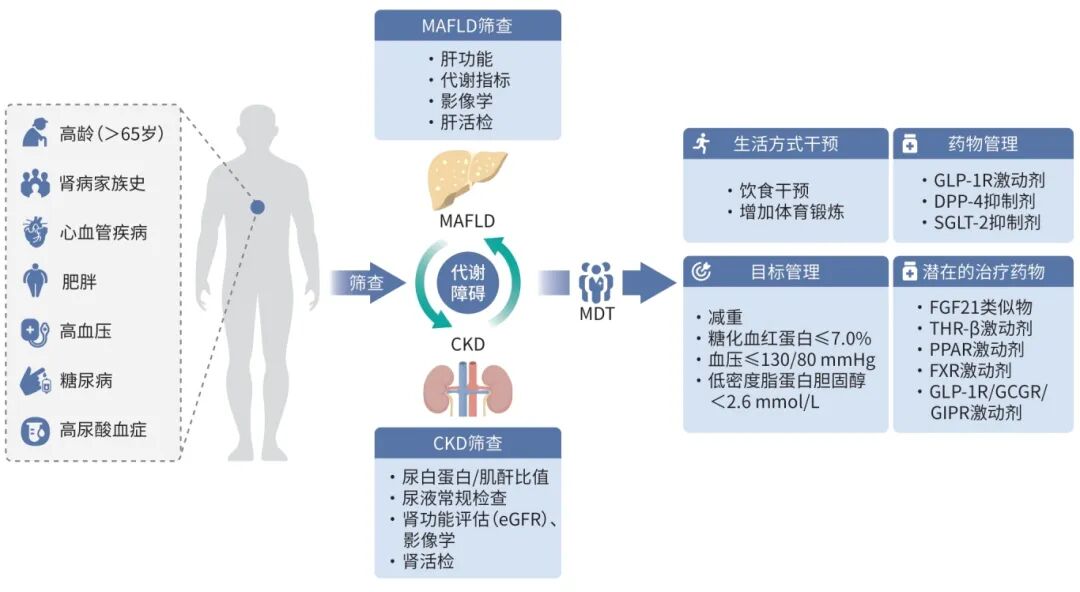
图1 MAFLD和CKD的共病管理
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH250905

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)