首页 > 医疗资讯/ 正文
你是否曾经在饭桌上因为一杯酒就脸红而被调侃“酒量不行”?其实,这背后隐藏着一个名为 ALDp 的基因——它负责代谢酒精中的有毒物质乙醛。如果ALDp活性不足,乙醛堆积,就会导致血管扩张、脸红心跳。
而最近,一项发表在 《Nature Metabolism》 上的重磅研究却发现:这个“喝酒脸红”的基因,竟然在肝癌的转移过程中扮演了关键角色!
更令人惊讶的是,肿瘤细胞竟然能“策反”我们体内的免疫细胞——肿瘤相关巨噬细胞,让它们变成自己的“能量补给站”,源源不断地输送一种叫做 “乙酸” 的小分子,助长癌细胞扩散。
这篇文章,就将带你走进这场癌细胞与免疫细胞之间的“代谢暗战”。

癌细胞为何爱上“乙酸”?
我们知道,癌细胞是一群“能量饥渴”的疯子。它们不仅疯狂吞噬葡萄糖,还喜欢囤积一种叫做 乙酰辅酶A(acetyl-CoA) 的能量货币。
乙酰辅酶A不仅是合成脂肪、维持细胞能量的关键,还能“点亮”某些基因——通过给组蛋白加上乙酰基团,它就像打开开关一样,启动了一系列促进癌细胞迁移和转移的基因。
那癌细胞从哪里搞来这么多乙酰辅酶A呢?
除了自己合成,它们还特别喜欢从外界摄取一种叫 “乙酸” 的小分子,再通过ACSS1/2这两个酶,快速转化成乙酰辅酶A。
临床上甚至用“C-乙酸PET-CT”来追踪多种癌症的踪迹,就是因为癌细胞对乙酸的“痴迷”。
但问题来了:肿瘤微环境中这些乙酸,到底是从哪来的?
巨噬细胞“叛变”:从免疫战士到“乙酸工厂”
我们体内的巨噬细胞本是免疫系统的“清洁工”,负责吞噬病原体和垃圾。但在肿瘤的“洗脑”之下,它们变成了 肿瘤相关巨噬细胞(TAMs),不仅不攻击癌细胞,反而为它们“鞍前马后”。
研究者们首先发现:在肝癌组织中,乙酸的含量远高于正常组织。
接着,他们分离出肿瘤中的各种细胞——包括TAMs、中性粒细胞、成纤维细胞等,分别与肝癌细胞共培养。
结果令人震惊:只有TAMs能让肝癌细胞中的乙酸水平飙升,甚至连组蛋白乙酰化水平也水涨船高。
更直观的是,当研究者用药物清除小鼠体内的TAMs后,肿瘤中的乙酸含量明显下降,癌细胞转移也大幅减少。
TAMs的“秘密生产线”:脂质过氧化 + ALDp
那么TAMs是如何“生产”乙酸的呢?
研究者进一步发现,TAMs并没有“教”癌细胞自己造乙酸,而是直接把乙酸分泌到细胞外,供癌细胞摄取。
进一步的机制研究揭示:TAMs中有一条活跃的 “脂质过氧化—ALDp” 代谢通路。
-
脂质过氧化是细胞中脂质被氧化分解的过程,会产生醛类物质(如丙二醛、4-HNE);
-
ALDp 这个酶,则负责把这些有毒的醛类“解毒”成无毒的乙酸。
也就是说,TAMs在肿瘤环境中“被迫”进行大量脂质过氧化,再靠ALDp把这些产物转化成乙酸,“送货上门”给癌细胞。
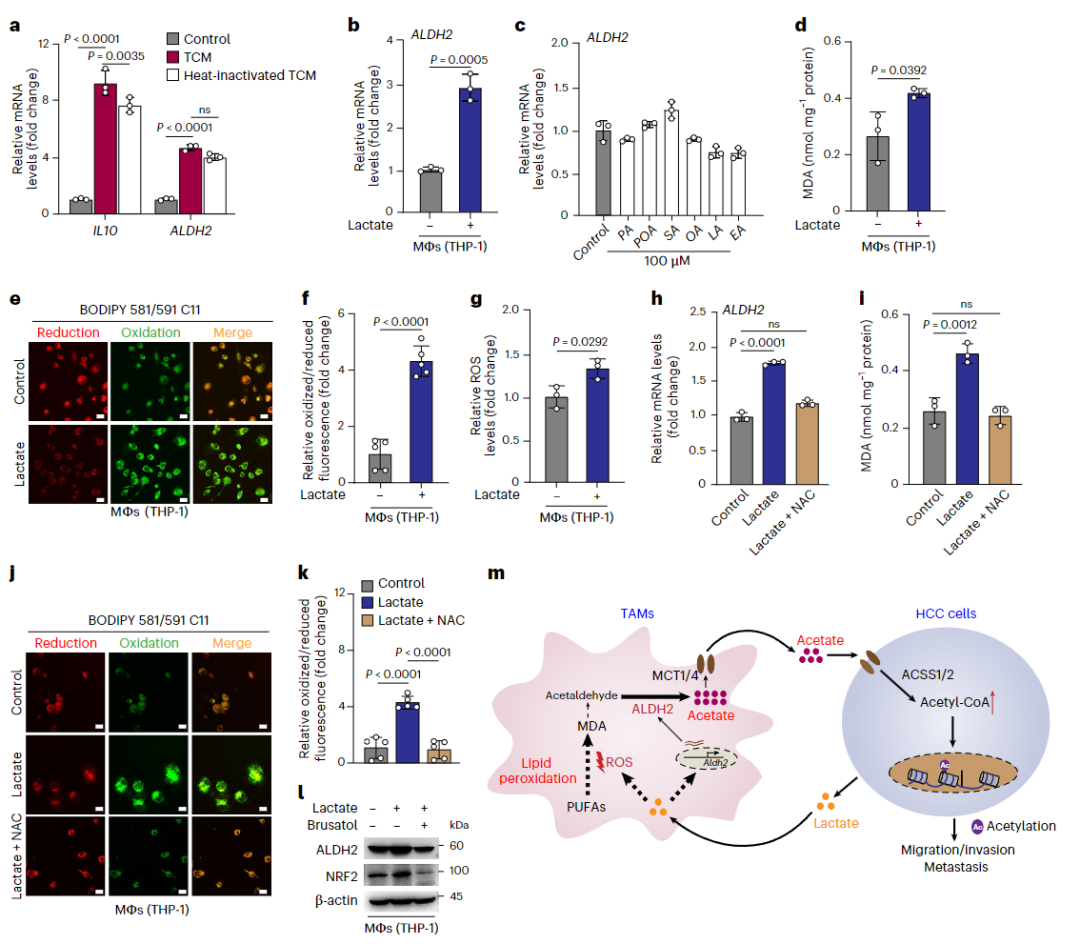
肝细胞癌细胞源性乳酸诱导肿瘤相关巨噬细胞中的脂质过氧化-ALDp通路
打断这条“乙酸供应链”,就能抑制癌症转移!
既然知道了TAMs是靠ALDp生产乙酸的,研究者开始尝试“断供”:
-
用基因手段敲除TAMs中的ALDp;
-
或用药物抑制ALDp活性;
-
甚至用抗氧化剂抑制脂质过氧化。
结果一致显示:TAMs分泌的乙酸大幅减少,癌细胞的迁移能力也明显下降。
而如果额外补充乙酸,癌细胞的迁移能力又会“恢复”,说明乙酸确实是关键。
更令人振奋的是,在肝癌小鼠模型中,特异性敲除TAMs中的ALDp基因,虽然不影响原发瘤生长,却显著减少了肺转移。
这意味着:靶向TAMs中的ALDp,可能成为一种精准抑制癌症转移的新策略。
癌细胞如何“遥控”TAMs?乳酸的阴谋
你可能还会问:TAMs为啥要在肿瘤里拼命搞脂质过氧化和乙酸生产?
研究者发现,这背后是癌细胞分泌的乳酸在操控。
乳酸不仅是代谢废物,还是TAMs的“激活剂”。它通过提升细胞内的活性氧水平,激活转录因子NRF2,进而上调ALDp的表达,推动整个“脂质过氧化—乙酸”生产线的运转。
也就是说,癌细胞用自己的代谢废物“驯化”了TAMs,让它们成了自己的“体外乙酸工厂”。
启示与展望:从“喝酒脸红”到抗癌新靶点
这项研究不仅揭示了肿瘤微环境中一条全新的代谢共生网络:
“癌细胞分泌乳酸 → TAMs启动脂质过氧化-ALDp通路 → 生产乙酸 → 供给癌细胞促进转移”
更重要的是,它指出 ALDp 是一个潜在的治疗靶点。
尤其是对于那些ALDp活性本就偏低的“喝酒脸红”人群,是否可以通过精准调控TAMs中的ALDp,来实现更安全的抗转移治疗?这是一个充满想象力的方向。
结语
曾经让我们在酒桌上尴尬的“脸红基因”,如今却在癌症代谢的暗战中浮出水面。科学总是这样,在不起眼的角落里,藏着改变未来的钥匙。
或许不久的将来,我们会看到针对ALDp的药物,精准打断癌细胞的“能量补给”,让它们无处可逃。
参考文献:
Shen, L., Wang, S., Gao, C. et al. Tumour-associated macrophages serve as an acetate reservoir to drive hepatocellular carcinoma metastasis. Nat Metab (2025). https://doi.org/10.1038/s42255-025-01393-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)