首页 > 医疗资讯/ 正文
2025年6月,中华人民共和国国家卫生健康委员会发布了《第二批罕见病目录》中86个病种的诊疗指南,旨在进一步提高我国罕见病诊疗规范化水平,本文特摘录其中关于α1-抗胰蛋白酶缺乏症(AATD)的相关内容,供临床参考。
1概述
AATD是一种由SERPINA1基因突变导致的常染色体共显性遗传疾病,可引起新生儿期黄疸和儿童及成人的慢性肝病,以及早发型慢性阻塞性肺病(COPD)和肺气肿。本病的诊断主要基于血清α1-抗胰蛋白酶(AAT)浓度筛查、基因检测,以及等电聚焦凝胶电泳发现AAT迁移率表型改变。AATD相关肝病的主要治疗是生活方式改变(如戒酒、降低体质量、控制糖尿病等)及对症支持治疗,当出现终末期肝病时需肝移植治疗;AATD相关肺病的主要治疗是戒烟、AAT补充疗法,当出现严重肺气肿时可进行肺移植治疗。
2病因和流行病学
AAT由位于第14号染色体长臂上(14q31-32.3)的SERPINA1基因编码,主要在肝脏合成,是丝氨酸蛋白酶抑制剂SERPIN家族的典型代表。AAT的血浆半衰期大约5天,每天生成量为34 mg/kg体质量,其中每天有33%在血管池中降解。在生理情况下,AAT发挥丝氨酸蛋白酶抑制剂功能,抑制中性粒细胞弹性蛋白酶;此外,AAT也是强力的中性粒细胞趋化因子。目前已发现SERPINA1基因有超过150种突变,其中最常见的正常等位基因被命名为“M”等位基因,而最常见(可见于95%的AATD患者)的致病性等位基因包括“S”“Z”等位基因。可根据突变等位基因的组合对个体的基因型进行分类,如PI*ZZ基因型(携带两个相同的Z等位基因的纯合突变),可引起经典的严重AATD;PI*SZ基因型(携带S等位基因和Z等位基因的复合杂合突变),可引起较轻型AATD;以及PI*MZ基因型(携带M等位基因和Z等位基因的杂合突变),其本身多不引起疾病,但增加吸烟者发生COPD的风险,以及饮酒、肥胖及糖尿病者肝脏疾病进展的风险。
AATD在北欧血统人群中相对常见,可累及1/1 600~1/2 000活产新生儿。但在东亚地区AATD罕见,据日本2013年开展的一项全国性流行病学调查显示,AATD的患病率大约为1.9/1 000万。白种人的PI*Z型等位基因携带率约1/25,出现PI*ZZ基因型的频率约1/2 000,PI*SZ基因型的频率约1/500,PI*MZ基因型的频率约1/30。据2012年发表于Therapeutic Advances In RespiratoryDisease的一项遗传流行病学研究资料估计,在亚洲人群中,如中国、日本、蒙古国等,PI*Z型等位基因罕见,PI*S型等位基因频率为0~1/1 000;推测中国PI*MS基因型人群总数最高可达250万,但其致病性尚不清楚。
AATD的主要发病机制是突变的AAT发生错误折叠并形成多聚体而储积在肝细胞内,从而引起肝细胞凋亡、炎症坏死及纤维化,最终可进展为肝硬化或肝细胞癌。同时,分泌入血循环的AAT分子数量减少,无法对抗中性粒细胞弹性蛋白酶等溶组织酶的活性,导致肺泡破坏,形成COPD和肺气肿。另外,有的基因突变导致完全不产生AAT,所以仅引起COPD而不引起肝脏疾病。
3临床表现
AATD可表现为肝病或肺病,或二者皆有。PI*ZZ基因型者,明确诊断时,61.4%表现为肺病,5.4%表现为肝病,20.1%二者皆有,13.1%无疾病表现;而PI*SZ基因型者,47.1%表现为肺病,12.4%表现为肝病,12.7%二者皆有,27.9%无疾病表现。
AATD患者的肝病表现差异很大,可无肝病或仅有缓慢进展的肝病。PI*ZZ基因型者,多数可在新生儿期出现转氨酶升高,大多持续12个月,仅少部分持续至12岁;少部分患儿可出现胆汁淤积性黄疸,大约持续6个月;大多数患儿的临床症状通常在2岁时可以缓解。在儿童或成人期,可出现慢性肝炎、肝纤维化、肝硬化及门静脉高压的表现,甚至出现肝衰竭、肝细胞癌。瑞典的一项全国性新生儿筛查及长期随访研究(随访至45岁)发现,在200 000名新生儿中,127名为PI*ZZ基因型,在新生儿中的病死率为2%~3%,所有存活者在12岁时均无肝病临床症状。欧洲一项应用无创技术评估肝纤维化的大规模研究发现,20%~36%成人AATD患者存在临床显著肝纤维化。目前认为,AATD成人患者发生进展期肝纤维化的危险因素包括男性、年龄50岁、代谢综合征及肥胖。
AATD相关肺病的典型临床表现为早发型COPD、下叶为主的全腺泡型肺气肿。AATD所致肺气肿,与普通COPD类似,但发病年龄较轻,吸烟也多不严重。最常见症状为慢性呼吸困难,可伴咳嗽、咳痰及难以控制的哮喘,还可伴有上呼吸道感染。自发性气胸可以是AATD的首发表现或并发症。重度患者还可出现支气管扩张。
此外,极少数AATD患者(0.1%~0.9%)还可有坏死性脂膜炎(panniculitis)的表现,PI*ZZ、PI*MZ、PI*SS和PI*MS等多种基因均可发生脂膜炎,但是50%以上的病例见于PI*ZZ基因型患者。表现为皮肤和皮下组织的炎性病变,中位发病年龄为39岁,多为自发性,也可在皮肤外伤后出现,表现为发热、触痛的红色结节或斑块,甚至是溃疡性皮肤损害,伴油性黄色渗出物,可出现在面部、四肢或躯干部皮肤。皮肤深度活检的特征性病理学改变包括下层网状真皮的小叶脂肪坏死和大量中性粒细胞浸润,以及正常脂肪与坏死脂膜混合。本症虽然罕见,但很严重,如未经治疗,病情常快速进展甚至导致死亡。
4辅助检查
4.1 肝脏生化检查和肝脏影像学检查
可见不同程度的转氨酶升高、谷氨酰转肽酶升高或胆红素升高,随疾病进展,可有白蛋白降低、血小板减少、凝血酶原活动度降低。肝脏影像学检查可见慢性肝病征象,如肝脏质地不均匀等;严重者可见肝硬化(如肝脏缩小、表面不规则、肝实质结节样等)及门静脉高压表现(如门静脉和脾静脉增宽、脾大、食管胃静脉曲张及门体侧支循环形成等)。
4.2 肺功能检查和胸部影像学检查
肺功能检查可见第一秒用力呼气量(FEV1)和肺一氧化碳弥散量(DLCO)明显降低。胸部影像学检查可见全腺泡型肺气肿(多见于下叶,但亦可见于上叶)及支气管扩张等表现。
4.3 血清AAT水平测定
常用比浊法测定。由于AAT是一种急性时相蛋白,同时测定C反应蛋白(CRP)有助于排除炎症对于AAT的影响。CRP增高时,AAT检测结果不予采纳;CRP正常时,AAT水平方可用于诊断AATD。大多数PI*ZZ基因型血清AAT水平0.5 g/L,PI*SZ、PI*MZ及PI*MS基因型血清AAT水平介于0.5~1.4 g/L。以血清AAT水平1.1 g/L作为界值,可识别出绝大多数AATD患者,其灵敏度、特异度分别为73.4%、88.5%。值得注意的是,在其他原因导致的严重慢性肝病或蛋白丢失性肠病时,AAT水平也可降低。另一方面,有些基因变异所致的AATD不一定有血清AAT水平降低。因此,不能仅凭血液AAT水平来确诊或完全除外AATD。
4.4 AAT表型
根据主要变异体在等电聚焦电泳中的迁移率,从低等电位点到高等电位点,以字母顺序为AAT基因变异分配一个字母。例如,最常见的正常变异,迁移到中间等电位点,被命名为M;最常见的严重缺陷等位基因变异迁移到高等电位点,被命名为Z。应注意,有些突变并未导致AAT的电泳迁移率改变(即仍表现为M型),或当患者体内AAT含量比较低甚至血中根本没有AAT时,其电泳迁移率表型无法测定,此时需进一步行基因分析才能确定诊断。
4.5 AAT基因分析
测试样本可包括口腔拭子或外周血。提取DNA,对PCR扩增反应产物进行自动测序,可确定常见的AAT致病突变基因型,如PI*MM、PI*MS、PI*MZ等和PI*ZZ等。当针对特异性等位基因的基因分型分析未检出已知致病基因突变时,需对SERPINA1全部外显子甚至全基因组进行直接测序,以鉴定少见或新的致病突变。
4.6 肝活检
肝活检病理检查是评估肝脏损伤程度和纤维化程度最可靠的方法,也对病因诊断和鉴别诊断有很大帮助。对AATD患者,肝活检可能不是必需的检查手段,但仍是诊断AATD相关肝病的金标准。其病理改变包括不同程度的炎症坏死和纤维化,其典型特征为经二酯酶消化后过碘酸Schiff试剂染色(PAS-D)可见肝细胞内紫色圆形包涵体;采用针对AATZ的单克隆抗体进行免疫组化染色,可更敏感地识别含有AATZ的包涵体。
5诊断
AATD的诊断需结合慢性肝病和COPD的临床表现及相关辅助检查异常,血清AAT水平、AAT表型及基因型来综合判断。诊断AATD的AAT水平的最佳界值为1.1 g/L,其区分正常基因型PI*MM与至少携带1个缺陷等位基因PI*MS或PI*MZ的灵敏度、特异度分别为73.4%、88.5%,但不能仅凭血清AAT水平来确诊或完全除外AATD。AAT表型分析或基因型分析是诊断AATD的金标准,而肝活检PAS-D染色发现肝细胞内包涵体是诊断AATD所致肝病的金标准。
6鉴别诊断
6.1 AATD相关肝病
需与其他原因导致的肝病相鉴别,包括病毒性肝炎、酒精性肝病、非酒精性(代谢相关性)脂肪性肝病、药物性肝损伤、自身免疫性肝病,以及肝豆状核变性、遗传性血色病和囊性纤维化等其他遗传性疾病。
6.2 AATD 相关肺病
需与支气管哮喘、吸烟相关的COPD、支气管扩张、变应性支气管肺曲霉菌病等呼吸道疾病,以及其他遗传性疾病(如原发性纤毛运动障碍、囊性纤维化)相鉴别。
7治疗
7.1 AATD相关肝病的治疗
(1)一般治疗:主要采取支持性措施,以预防或减少慢性肝脏疾病并发症。戒酒、降低体重、控制糖尿病等,以延缓肝脏疾病进展。如已发生肝硬化、门静脉高压,可参考相关诊治指南妥善预防和处理腹水、食管胃静脉曲张出血和肝性脑病等并发症。为筛查和监测肝细胞癌,应每6个月检查血清甲胎蛋白和肝脏超声。
(2)肝移植:对于进入终末期肝病的AATD患者,肝移植是唯一有效的治疗手段。对于AATD所致终末期肝脏疾病成人患者,肝移植的5年生存率为85%。有研究显示,采用PI*MZ杂合突变的供体也有很好的安全性和临床疗效。肝移植术后注意事项:①需长期服用以他克莫司为基础的抗排异药物。他克莫司具有剂量依赖的肾毒性,需监测他克莫司血药浓度、肾功能。②密切监测肝功能,以及早识别排斥反应。③由于大量使用免疫抑制剂,容易发生感染,感染对移植者生命威胁很大,尤其在移植后第1个月发生的感染危险性最大;因此,对移植者应选择适当抗生素预防感染是很有必要的,包括抗真菌预防性治疗。
(3)新兴治疗手段:目前正在研发多种针对AATD肝病的基因或细胞治疗手段,以抑制突变AAT的表达,促进AAT的分泌、降解或自噬。其中,如基于小干扰RNA技术的Fazirsiran多中心开放Ⅱ期临床试验显示,对PI*ZZ AATD肝纤维化患者有良好的安全性,并能降低肝脏和血液中AATZ的水平;因其只能通过抑制AATZ的表达而减少其细胞内贮积所导致的肝损害,对于同时有肺部受累者,可能需同时给予AAT补充治疗。
7.2 AATD相关肺病的治疗
(1)支持治疗和标准药物治疗:遵循COPD治疗指南,戒烟;采用支气管扩张剂,吸入性或口服糖皮质激素;肺康复治疗适用于运动耐量下降患者;合并呼吸道感染者,尽早予抗感染治疗;接种流感疫苗、肺炎球菌疫苗。
(2)AAT补充治疗:AAT补充治疗是目前提高血液及肺间质AAT水平最直接、最有效的方法。美国食品药品监督管理局唯一批准的AAT给药方案为每周1次输注血浆来源的AAT 60 mg/kg。批准的依据是根据药代动力学和生化指标的改善,包括血液AAT浓度、肺泡AAT浓度及其抑制中性粒细胞弹性酶的活性。RAPID研究显示,与安慰剂对比,本疗法可以延缓肺CT密度丢失。其他研究还显示AAT补充疗法可减少COPD发作频率,延缓FEV1下降速度,提高患者生存率。
其治疗适应证,即符合以下所有条件的患者:①年龄≥18岁;②从不吸烟或已戒烟者;③存在符合重度AATD的PI*ZZ基因型;④血清AAT水平较低(11 μmol/L或57 mg/dL);⑤肺功能检查存在气流受限证据(FEV1为35%~65%预测值)。
其禁忌证:①年龄18岁;②IgA缺乏;③对AAT药物成分过敏;④对血容量增加不耐受。
(3)肺移植:应遵循针对其他晚期肺病患者的指南,选择接受肺移植的AATD患者。
7.3 AATD相关脂膜炎的治疗
(1)口服药物氨苯砜可作为一线治疗,50~100 mg/d。作用机制:可能为调节活性氧产生、中性粒细胞黏附等。注意事项:用药前需排除葡萄糖-6-磷酸脱氢酶缺乏症,以避免诱发溶血性贫血。
(2)静脉输注纯化AAT,使用剂量大于肺气肿的批准治疗剂量,为90~120 mg/kg。作用机制:基于推测的无拮抗蛋白水解的病理生理机制,AAT补充疗法可恢复抗蛋白酶活性。优点:治疗应答率高,可用于氨苯砜治疗失败的病例。缺点:价格昂贵,属超适应证使用,医疗保险不能报销费用。
(3)需要注意的是,目前临床观察发现局部和全身性糖皮质激素给药对治疗该病没有帮助。
7.4 患者自我管理
(1)避免吸烟或戒烟。吸烟可显著降低AATD患者的生存率。有研究显示,从未吸烟的AATD患者与正常人寿命相同。所以,避免吸烟或戒烟应作为AATD患者自我管理的关键。
(2)避免接触粉尘等。职业暴露,例如矿物粉尘和某些烟雾,与AATD患者肺功能损害和呼吸疾病症状的增加有关。
(3)从预防肝脏疾病角度,推荐接种甲型肝炎疫苗、乙型肝炎疫苗;限制饮酒;保持健康生活方式,避免超重或肥胖。
(4)监测肺部并发症。定期检查肺功能,胸部CT。
(5)监测肝脏并发症。至少每年1次肝脏相关检查,包括血常规、肝脏生化检查、凝血指标。如已进展至肝硬化阶段,建议每半年检查1次甲胎蛋白、腹部超声。
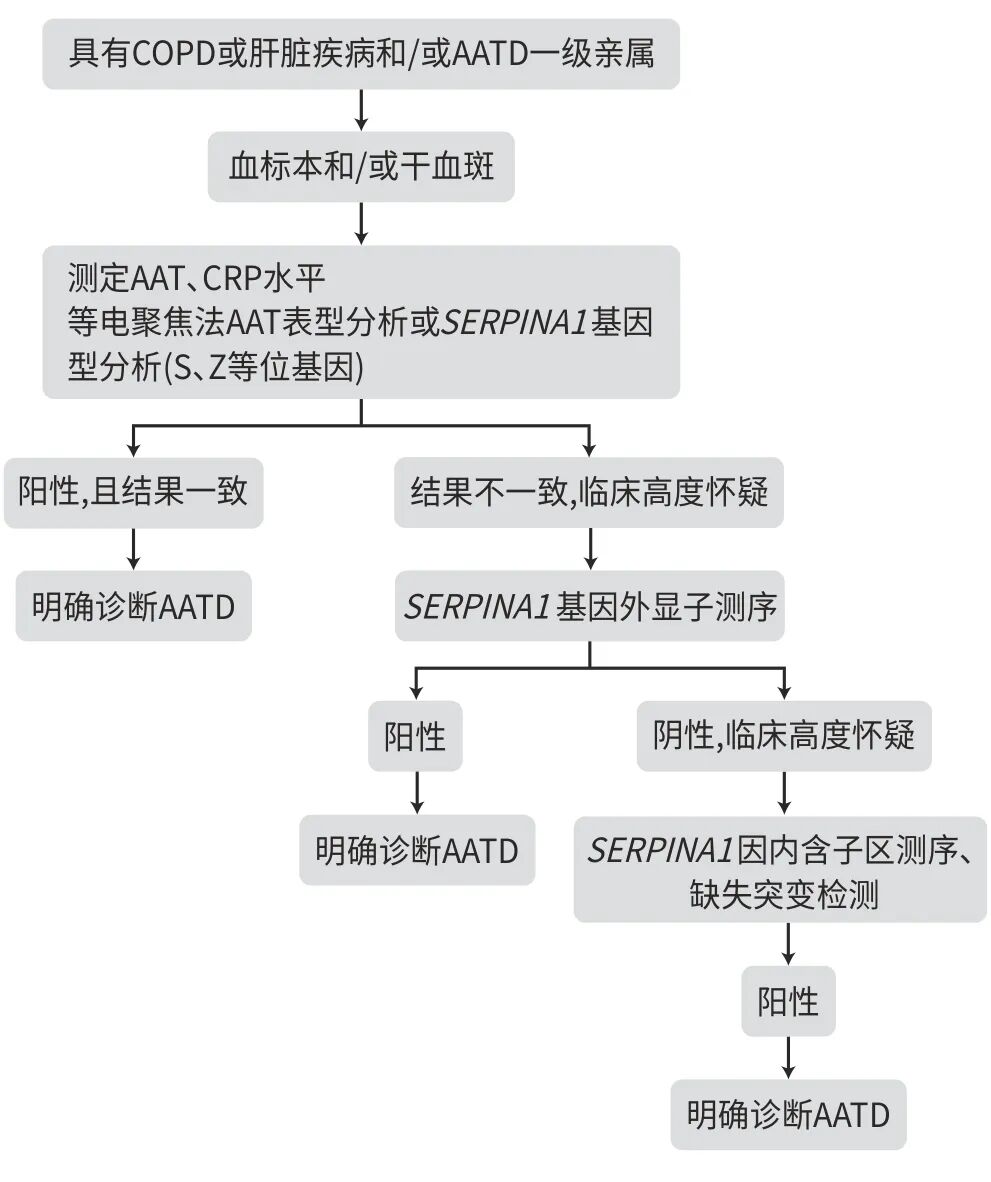
图1 AATD的实验室诊断流程
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50906

猜你喜欢
- 盘点2023 | 2023年度肿瘤临床管理学研究领域进展
- 11岁双胞胎上完课走失:要吃的睡路边度过6天
- 复旦大学附属儿科医院
- Lupus Sci Med:中国学者揭示职业与生活环境暴露对系统性红斑狼疮的影响
- 《特战荣耀》穆青结局是什么?特战荣耀穆青最后牺牲了吗?
- 脑炎患儿被宜兴市人民医院输错药后死亡 已介入调查
- 运动真能延寿吗?最新研究:久坐不动和大量运动都会加速衰老;大吃大喝后,运动抵消不了高脂饮食的伤害,反而造成心脏受损
- 香菇烧鸭的做法-家常味炖菜谱
- 冬季吃山药好吗?5大功效防病治病
- 传染病疫苗研发全国重点实验室夏宁邵/郑子峥团队提出预防RSV感染的候选策略:靶向RSV pre-F保守表位的广谱高效中和抗体
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)