首页 > 医疗资讯/ 正文
氧化应激作为癌细胞的关键标志之一,在肿瘤发生、发展及治疗抵抗中扮演着复杂而重要的角色。近日,来自中南大学湘雅医院神经外科程全,南方医科大学珠江医院肿瘤科罗鹏,江西省人民医院老年医学研究所黄少荣,湖南师范大学附属航天医院神经内科夏志伟的研究团队在Molecular Cancer(中科院一区,影响因子33.9)上发表题为《Oxidative stress in cancer: from tumor and microenvironment remodeling to therapeutic frontiers》的重磅综述,系统阐述了氧化应激在肿瘤生物学中的核心作用及其治疗前景。

氧化应激是活性氧(ROS)异常升高引起的病理状态,伴随氧化还原信号失衡和生物分子氧化损伤。作为癌症的核心特征之一,它与肿瘤增殖调控及微环境重塑紧密关联。尽管针对氧化应激的治疗策略开发备受关注,但由于其调控网络复杂且存在肿瘤异质性,相关研究仍面临挑战,亟需系统解析氧化应激作用机制以寻求突破。本文系统梳理了肿瘤细胞内氧化应激的生成与调控网络,探讨其对肿瘤细胞及微环境的影响,总结现有治疗策略并重点评述新兴临床应用,为靶向氧化应激的疗法提供最新见解。尤其值得关注的是,该类策略与免疫治疗、纳米医学的交叉融合为整合多重抗肿瘤效应创造了契机,展现出显著潜力。本文深入剖析了氧化应激在癌症生物学中的功能及治疗价值,通过整合现有知识与前沿跨领域策略,凸显靶向氧化应激的治疗前景。未来研究应聚焦克服耐药性、开发兼容性治疗平台,以实现多种手段的协同,为最终攻克癌症开拓新路径。
内源性ROS生成途径
过氧化氢(H₂O₂)可产生于内质网和过氧化物酶体。内质网中的NADPH氧化酶NOX4能直接感应氧分压,并可不经超氧阴离子(O₂•⁻)歧化直接生成H₂O₂。此外,内质网还存在其他氧化还原酶系统参与ROS生成,如细胞色素P450(CYP)和内质网氧化还原蛋白1(ERO1)。CYP在自氧化过程中因底物不完全氧化而发生解耦联,生成O₂•⁻和H₂O₂;ERO1则通过将电子从二硫键异构酶转移至氧气产生H₂O₂。过氧化物酶体代谢酶(如酰基辅酶A氧化酶、D-天冬氨酸氧化酶等)也积极参与ROS的生成。
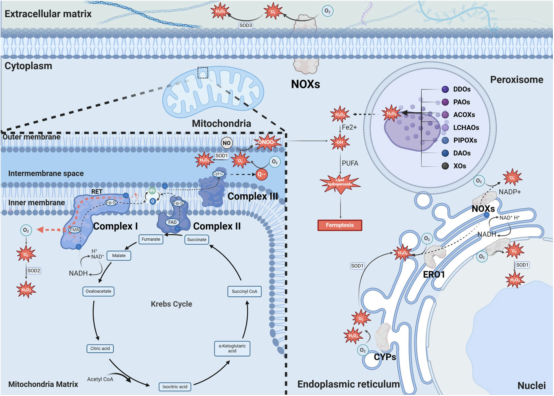
本示意图展示线粒体电子传递链、内质网、过氧化物酶体、细胞核及细胞质中的ROS生成途径。实线箭头代表激活作用,虚线箭头表示粒子流向,红色虚线箭头特指反向电子传递(RET)过程。
细胞抗氧化网络对ROS的调控机制
多种抗氧化酶通过编码基因转录表达,协同维持氧化还原稳态。谷胱甘肽(GSH)系统在其中起核心作用:GCLC和GCLM编码的谷氨酸半胱氨酸连接酶(GCL)催化合成γ-谷氨酰半胱氨酸,进而由GSS编码的谷胱甘肽合成酶转化为GSH。GSH可直接清除ROS或作为谷胱甘肽过氧化物酶(GPXs)等酶的辅因子还原过氧化物。谷胱甘肽S-转移酶(GSTs)能催化GSH与亲电底物结合,促进脂质过氧化物等毒性物质的清除。GSH在反应后被氧化为GSSG,再由谷胱甘肽还原酶(GSR)利用NADPH还原再生。肿瘤细胞通过Warburg效应激活磷酸戊糖途径,合成NADPH以维持GSH库及氧化还原平衡。
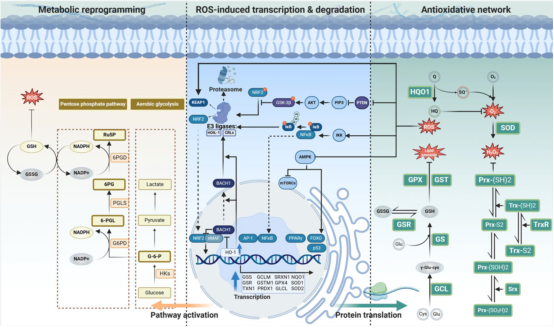
高ROS水平可触发转录因子核转位,启动抗氧化酶表达,同时诱导代谢重编程以生成抗氧化底物。图中实线箭头表示激活/转化,抑制箭头表示抑制作用,虚线箭头表示易位过程;“P”和“Ub”分别代表磷酸化与泛素化修饰;双向箭头表示可逆反应。
ROS调控肿瘤细胞恶性表型的机制
ROS通过氧化信号蛋白(如半胱氨酸残基)激活多条促肿瘤通路。H₂O₂可氧化PTP1B的Cys215,抑制其磷酸酶活性,进而促进PI3K/AKT和JAK/STAT3通路活化,增强癌细胞克隆形成能力。类似地,氧化修饰的PTPs能阻止EGFR去磷酸化,激活下游信号。ROS还可通过形成二硫键或聚合激活Src家族激酶(SFKs)及其下游ERK通路,进而调控细胞周期与凋亡相关蛋白。硫氧还蛋白(Trx)氧化后释放ASK-1,激活JNK/p38通路;H₂O₂亦能激活PLCγ,诱导钙释放及ERK通路活化。此外,ROS通过抑制PTEN、激活Akt促进肿瘤生长,并通过调控NF-κB亚基p50/p65及磷酸化p53影响其DNA结合活性,最终增强增殖与存活能力。这些通路的交叉对话使肿瘤细胞整合促生存信号,推动肿瘤进展。
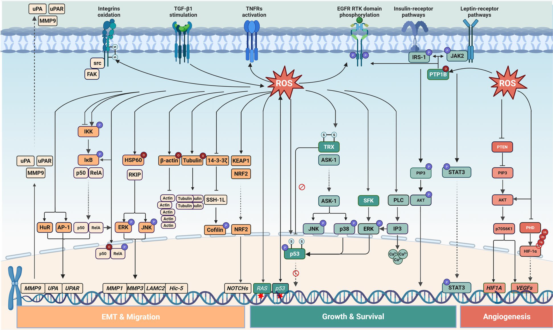
ROS通过双向调控受体激活与细胞内信号通路,影响上皮间质转化(EMT)、迁移、生长、存活及血管生成。实线箭头表激活,抑制箭头表抑制,虚线箭头表易位;红色禁止符号表示通路阻断;“P”“O”“Ub”“S”分别代表磷酸化、氧化、泛素化与巯基修饰;红色星标为突变位点。
ROS对肿瘤微环境(TME)细胞的影响
ROS及氧化应激反应在肿瘤细胞与微环境相互作用中发挥关键作用,显著影响肿瘤进展。
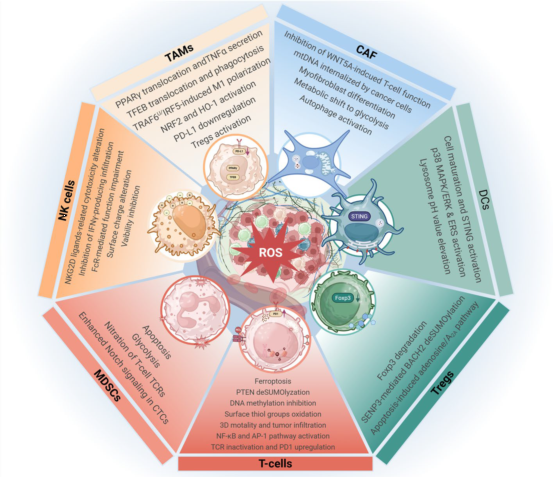
TME中的ROS通过调控树突状细胞(DCs)、T细胞、Tregs、MDSCs、NK细胞、TAMs和CAFs等细胞,塑造免疫抑制微环境。
靶向氧化应激的癌症治疗策略
鉴于ROS在肿瘤发生中的重要作用,抗氧化剂防癌策略曾广受关注。然而,其疗效存在争议:部分研究显示抗癌潜力,另一些却提示可能促进转移。在化疗中,抗氧化剂的作用亦未明确,可能与种类、剂量、细胞浓度及模型差异有关。本文汇总了通过调控ROS进行肿瘤干预的实验与临床证据,以深化对氧化应激防癌机制的理解。
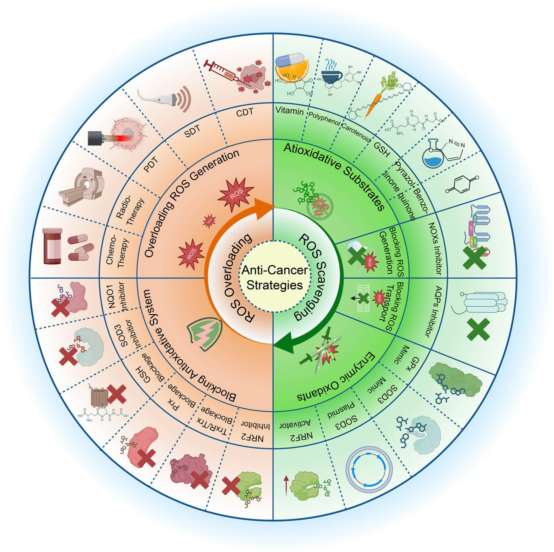
当前ROS调控策略分为两类:ROS过载法(抑制抗氧化系统或增加ROS生成)与ROS清除法(补充抗氧化剂、使用酶类清除剂或阻断ROS产生)。
靶向TME中氧化应激的综合策略
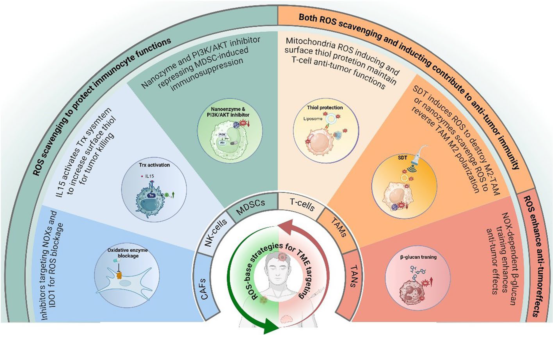
通过多种抗氧化策略——如保护T细胞巯基、激活NK细胞Trx系统、抑制CAFs氧化酶、阻断MDSCs的PI3K/Akt通路及清除巨噬细胞ROS——可增强免疫细胞毒性、逆转免疫抑制。同时,ROS诱导策略(如β-葡聚糖训练中性粒细胞、声动力疗法调控M2巨噬细胞)也能有效抑制肿瘤进展。
结论
氧化应激参与多种癌症特征性进程,已成为重要治疗靶点。然而,肿瘤细胞与TME中ROS来源多样、调节因子丰富,其动态复杂性制约了单一干预策略的发展。本文系统阐述了内源性ROS的生成与调控网络:线粒体电子传递链(复合体I/III生成O₂•⁻,进而转化为H₂O₂或ONOO⁻)、内质网、过氧化物酶体及NOXs均为ROS重要来源,为靶向治疗提供了多维度切入点。值得注意的是,靶向TME中ROS水平可增强CD8⁺ T细胞和NK细胞毒性,缓解免疫抑制,但需注意不同细胞对ROS敏感性差异可能带来的不确定性。结合纳米技术的ROS靶向疗法能提升药物肿瘤富集度,增强疗效并降低毒性,还可通过氧释放提高ROS生成,诱导免疫原性细胞死亡或重塑TME。该平台为联合治疗(如耗竭GSH、降解乳酸)提供了可能,并与免疫检查点阻断(ICB)疗法协同增强抗PD-L1疗效。成像技术与人工智能模型有望实现氧化应激无创监测与抗氧化剂高效筛选。尽管靶向氧化应激的策略不断涌现,其调控网络的高度互联性仍要求更多基础与临床研究,以精准评估不同治疗策略的潜力。
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-025-02375-x
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)