首页 > 医疗资讯/ 正文
SARM1(Sterile α and TIR motif containing 1)蛋白在神经损伤后的轴突退化中扮演着关键角色。它通过其TIR结构域的NADase活性耗竭细胞内的NAD+,导致代谢失败和轴突片段化。尽管SARM1在正常情况下处于自抑制状态,但在轴突损伤时会被激活,然而其激活的具体机制尚不清楚。此外,SARM1的激活与多种神经退行性疾病相关,如化疗诱导的周围神经病变(CIPN)、创伤性中枢和周围神经损伤以及青光眼等。因此,深入研究SARM1的激活机制对于理解神经退行性疾病的病理生理学和开发新的治疗策略至关重要。
清华大学王晓东、郑三多研究团队探究SARM1(Sterile α and TIR motif containing 1)蛋白在轴突退化中的作用机制。SARM1是一种关键的轴突退化执行蛋白,通过其TIR结构域的NADase活性导致NAD+耗竭,进而引发轴突退化。研究揭示了SARM1激活的两步过程,以及SARM1抑制剂可能的激活副作用,为神经退行性疾病的治疗提供了新的视角。相关内容以“SARM1 activation promotes axonal degeneration via a two-step phase transition”为题发表在《Nature Chemical Biology》。

【主要内容】
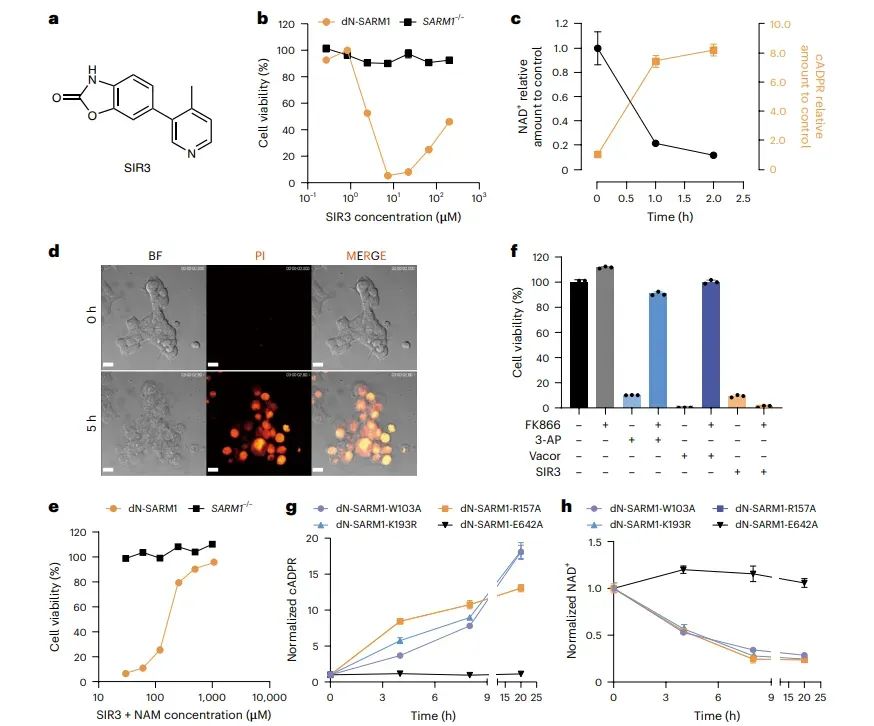
图1 SIR3诱导SARM1依赖的细胞死亡
图中展示了SIR3(一种吡啶类化合物)在不同浓度下对SARM1依赖的细胞死亡的影响。与NMN类似物不同,SIR3诱导的细胞死亡呈现出“U”形剂量反应曲线。SIR3处理的细胞显示出NAD+水平下降和cADPR水平上升,表明SARM1的NADase活性被激活。此外,SIR3处理的细胞形态表现为坏死,与NMN类似物处理的细胞相似。这些结果表明SIR3通过激活SARM1的NADase活性诱导细胞死亡。
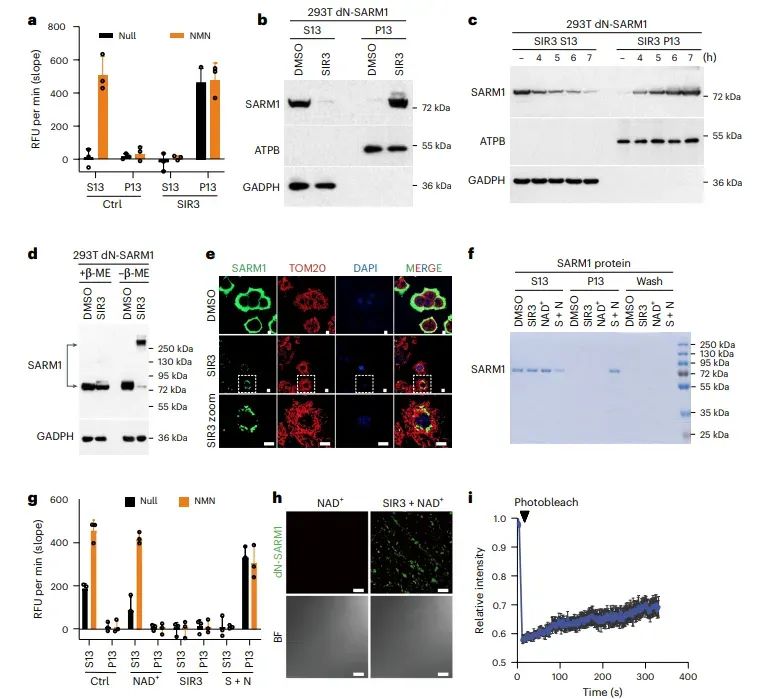
图2 SIR3促进SARM1的相分离
通过细胞裂解和差速离心实验,发现SIR3处理的细胞中SARM1从可溶性部分(S13)转移到不溶性部分(P13),表明SIR3诱导SARM1沉淀。与NMN类似物不同,SIR3处理的细胞中SARM1形成明显的细胞内聚集点,这些聚集点不与线粒体、溶酶体或细胞核标记物共定位。这些结果表明SIR3通过促进SARM1的相分离激活SARM1。
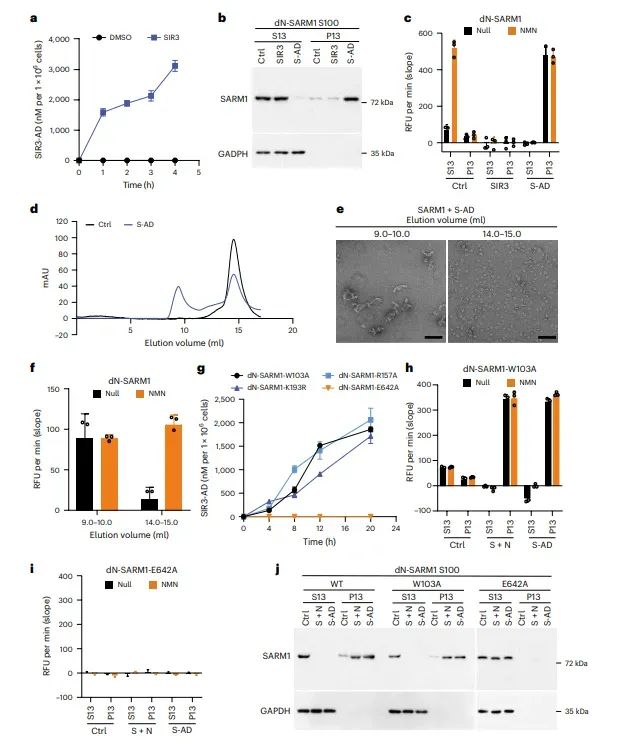
图3 SIR3-ADPR是SARM1的直接激活剂
研究发现SIR3与NAD+反应生成的SIR3-ADPR共轭物可以直接激活SARM1。在体外实验中,SIR3-ADPR能够诱导SARM1的相分离和激活,且这一过程不依赖于NMN。此外,通过冷冻电镜技术解析了SARM1-TIR结构域与SIR3-ADPR复合物的结构,揭示了SIR3-ADPR如何促进SARM1超螺旋丝状结构的组装。
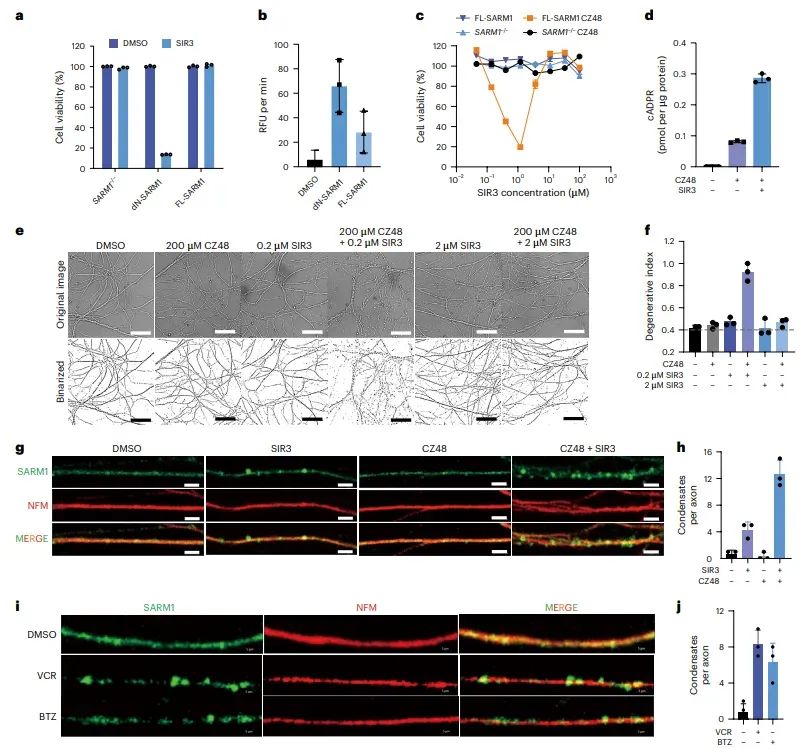
图4 SIR3诱导的细胞死亡和轴突退化需要预激活
研究发现,与表达dN-SARM1的细胞不同,表达全长SARM1(FL-SARM1)的细胞需要预激活才能被SIR3诱导细胞死亡。预激活可以通过NMN类似物CZ48或3-AP实现,这些预激活剂与SIR3联合使用时,能够显著诱导细胞死亡和轴突退化。此外,研究还发现SARM1在受损轴突中的激活需要预激活步骤,以产生足够的SIR3-ADPR共轭物。
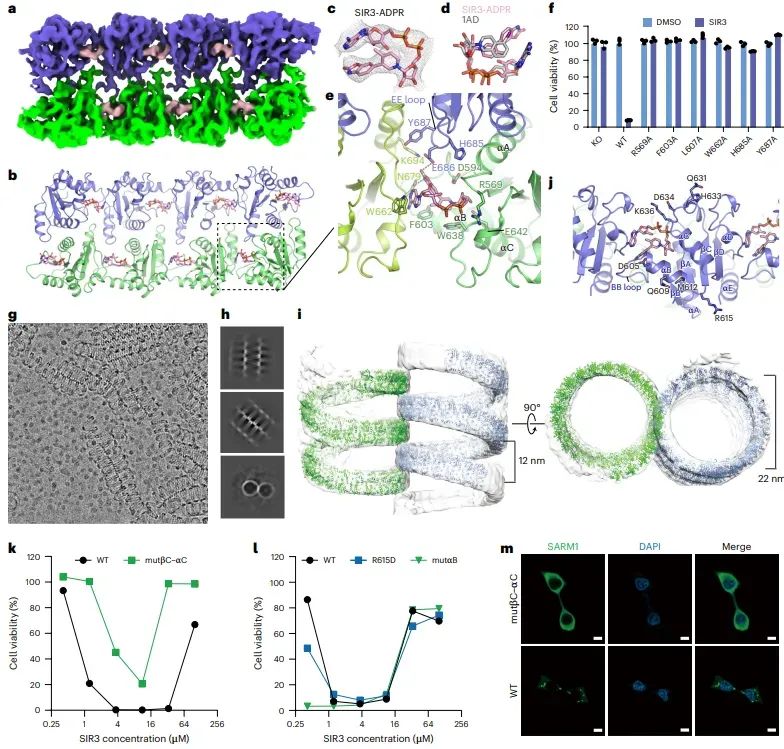
图5 SARM1凝聚体形成平行、交织的超螺旋结构
通过冷冻电镜技术,研究者解析了SARM1-TIR结构域与SIR3-ADPR复合物形成的超螺旋结构。这些结构由两条平行的、交织的超螺旋组成,每个超螺旋由48个TIR单体组成。这种结构的形成有助于SARM1的相分离和激活,进一步揭示了SARM1激活的分子机制。
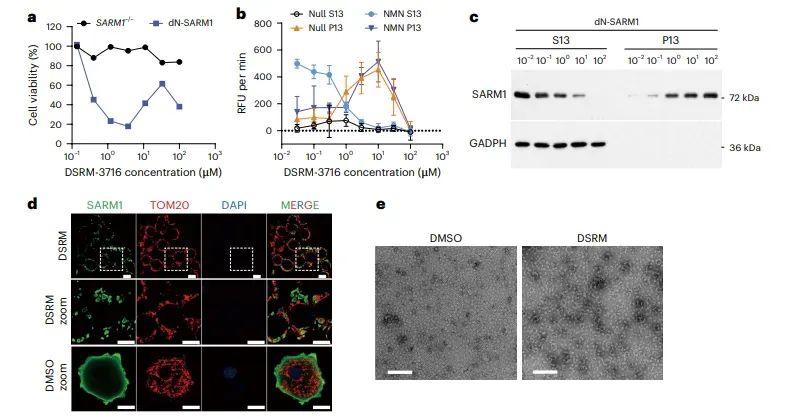
图6 SARM1-TIR结构域抑制剂通过相分离激活NADase活性
研究发现,一些针对SARM1 TIR结构域的临床阶段抑制剂,如DSRM-3716、NB3和NB7,也能形成ADPR共轭物,意外地促进SARM1的激活。这些抑制剂在特定浓度下诱导SARM1依赖的细胞死亡,并通过相分离激活SARM1的NADase活性。这些结果表明,这些抑制剂可能在治疗神经退行性疾病时产生意外的副作用。
【全文总结】
本研究揭示了SARM1激活的两步过程及其分子机制。首先,NMN激活SARM1的基础交换活性,生成ADPR共轭物。这些共轭物作为分子胶,促进SARM1超螺旋丝状结构的组装,导致TIR结构域处于活性构象。其次,研究发现一些临床阶段的SARM1抑制剂,如DSRM-3716、NB3和NB7,也能形成ADPR共轭物,意外地促进SARM1的激活。通过冷冻电镜技术,研究者解析了SARM1-TIR结构域与SIR3-ADPR复合物的结构,揭示了SIR3-ADPR如何促进SARM1超螺旋丝状结构的组装。这些发现不仅为理解SARM1在轴突退化中的作用提供了新的视角,还为开发针对SARM1的治疗策略提供了重要的结构基础。
原文链接:
https://www.nature.com/articles/s41589-025-02009-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)