首页 > 医疗资讯/ 正文
导读
单细胞技术正迅速革新我们对肝脏疾病发生与修复机制的理解,尤其在解析细胞异质性、揭示病理动态等方面展现出前所未有的优势。近日,来自美国德克萨斯大学休斯敦健康科学中心Cynthia Ju教授和Yankai Wen博士在eGastroenterology发表了题为"New insights into liver injury and regeneration from single-cell transcriptomics"的综述文章,全面回顾了近年来单细胞转录组技术在急性肝损伤(acute liver injury, ALI)与肝再生研究中的应用进展与突破。本综述不仅总结了该技术在多种肝损伤模型中的应用成果,更揭示了多个此前尚未被发现的细胞亚群及修复机制,为肝病治疗打开了新的靶点窗口。

从宏观到微观:单细胞转录组技术打开肝损伤研究“显微镜”
传统的肝损伤研究依赖整体组织水平的分析方法,难以识别组织内部不同细胞群体的动态变化。而单细胞转录组技术打破了这一限制,可将肝脏组织分解至“单个细胞”的尺度,精确描绘每种细胞在损伤及修复过程中的基因表达图谱,揭示其独特功能和信号路径。
尤其是在以对乙酰氨基酚(acetaminophen, APAP)中毒为代表的急性肝损伤模型,以及以部分肝切除术后为代表的肝脏再生模型中,研究者借助单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)和空间转录组(spatial transcriptomics, ST)技术,首次可视化了肝细胞在不同区域和时间点的修复响应。该技术不仅揭示了多种“亚型”细胞的存在,还追踪了它们在肝脏修复过程中的行为轨迹。
技术亮点一:单细胞技术平台全面改进,推动肝脏研究多样化
单细胞转录组技术的发展主要分为两大类:基于完整细胞的scRNA-seq和基于细胞核的单细胞核RNA测序(single-nucleus RNA sequencing, snRNA-seq)。前者对新鲜组织的要求较高,更适合研究免疫细胞;后者对样本保存的要求更为宽松,特别适用于人类冷冻肝组织样本和稀有细胞检测。
小知识:scRNA-seq和snRNA-seq的联系与区别
联系:两种技术均以捕获单细胞水平的基因表达信息为目标,可揭示细胞类型、细胞状态、发育轨迹及功能异质性。核心流程包括单细胞/单核分离、mRNA捕获、反转录、扩增及测序等基本步骤。无论是scRNA-seq还是snRNA-seq,后续数据处理流程如归一化、降维(如PCA与UMAP)、聚类分析、差异表达分析以及伪时序分析等基本一致。
区别(见下表):
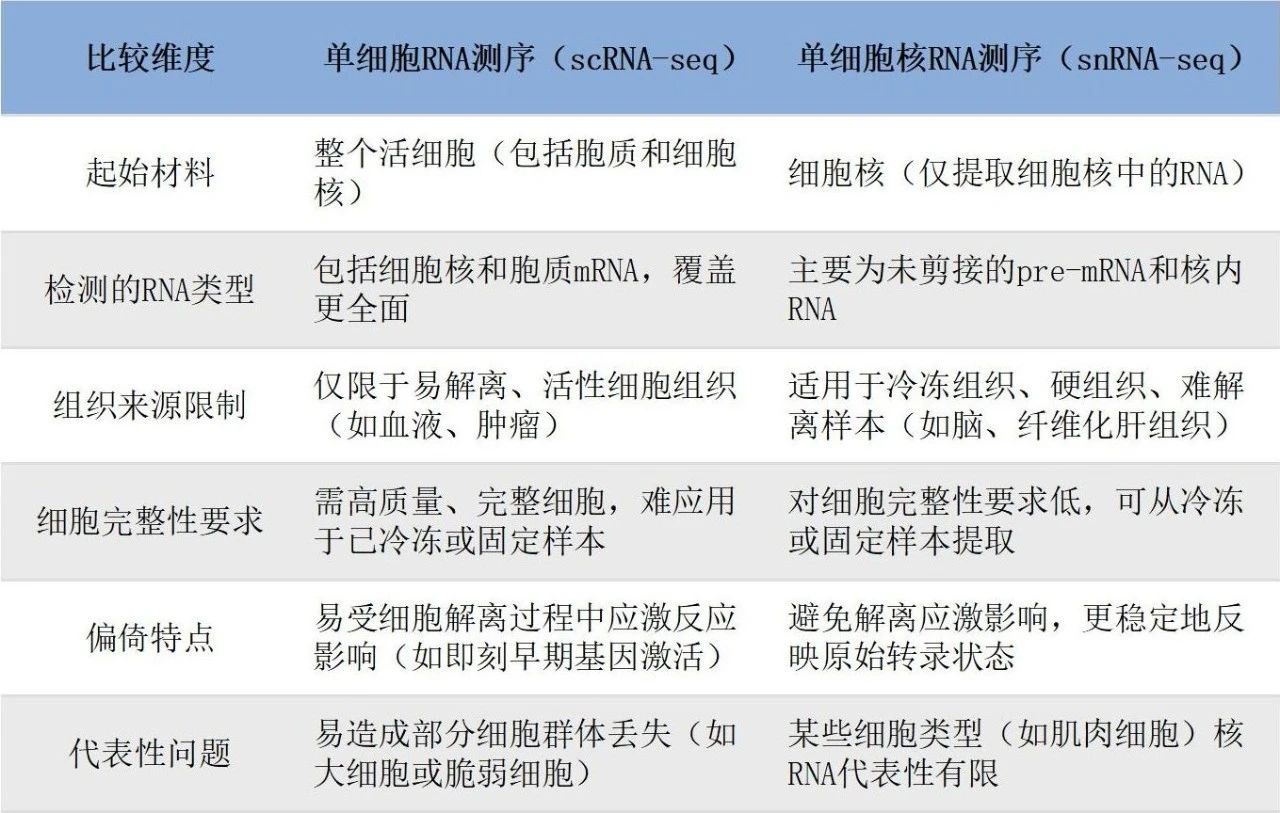
目前主流的droplet微流控平台(如10x Chromium和MGI DNBelab)具备高通量和商业化优势。而platewell重力捕获技术(如BD Rhapsody和Singleron SCOPE-chip)更适合对脆弱细胞(如嗜酸性粒细胞)进行温和处理。此外,ST转录组技术也实现跃迁——10x Visium HD、Stereo-seq等新一代ST平台,分辨率已从百微米级提升至微米级,可实现真正意义上的“单细胞空间定位”。
技术亮点二:从组织到细胞——制备流程与细胞富集策略优化
scRNA-seq实验的首要步骤是组织消化。小鼠实验中可通过体内灌注法以完整获取肝实质细胞与非实质细胞,而在人体活检或局灶性损伤模型中,体外胶原酶消化法更为常用。本综述中强调了细胞富集手段的优化作用。流式细胞术(fluorescence-activated cell sorting, FACS)可高效纯化细胞群体,但存在压力大、转录组易受损等问题;磁珠分选(magnetic-activated cell sorting, MACS)虽纯度稍低,但对脆弱细胞更温和,适合下游转录组分析。
单细胞转录组技术深度揭示肝脏损伤修复机制
研究亮点一:首次发现“迁移型”肝细胞和“胎儿型”再生机制
传统观点认为,肝再生依赖成熟肝细胞的增殖。但在APAP中毒模型中,研究者通过scRNA-seq发现,坏死区域边缘可检测到两类特殊肝细胞:
-
胎儿型肝细胞(Afp+Cdh17+Spp1+):具有类似间充质细胞的迁移特性,可启动蛋白合成与降解机制,为区域修复提供材料;
-
Anxa2+迁移型肝细胞:首次在人类及小鼠肝损伤模型中被识别,并通过体内外实验证实,Anxa2是调控肝细胞迁移的关键因子,敲除该基因可显著延长伤口愈合周期。
这些发现提示,肝细胞在修复过程中具有“可塑性”,可逆转为胎儿发育状态,以适应损伤修复的需求。
研究亮点二:肝星状细胞的“多重身份”被揭示
肝星状细胞(hepatic stellate cells, HSCs)在肝纤维化中的致病作用早已明确。但本综述指出,HSCs在急性损伤中不仅通过表达Acta2等应激纤维基因发挥促损伤作用,还能在修复期表达Col1a1、Col1a2等细胞外基质重塑基因,支持肝细胞迁移和再生。
尤其是在部分肝切除模型中,HSCs是肝细胞生长因子的主要分泌来源,其表达高峰出现在术后24小时,提示其在肝再生中发挥核心驱动作用。
研究亮点三:肝血管内皮细胞是肝细胞修复的“信号源”
通过ST分析,研究者发现肝窦内皮细胞(liver sinusoid endothelial cells, LSECs)是Wnt2和Wnt9b等信号分子的主要来源,主导肝细胞分区及修复进程。例如,APAP损伤后第2天,Wnt2在肝中央血管内皮细胞中的表达显著上升,而Wnt9b集中表达于LSECs。这些信号的激活可能与剪切应力诱导的HB-EGF分泌相关,进而激活YAP1通路并促进修复。
研究亮点四:巨噬细胞的功能异质性与新靶点——Trem2+
肝巨噬细胞,包括库普弗细胞(Kupffer cells, KCs)和单核来源巨噬细胞(monocyte-derived macrophages, MoMFs),在损伤与修复中角色复杂。scRNA-seq揭示:
-
Trem2+ MoMFs与修复性Ly6Clow巨噬细胞高度一致,表达吞噬与清除死亡细胞相关基因;
-
Trem2缺失会导致修复延迟,提示其在损伤后的“垃圾清除”过程中不可或缺;
-
与之相比,Trem2+ KCs主要源自胚胎期KCs,尽管具有吞噬能力,但在肝修复中的作用较小。
这些研究为巨噬细胞“亚群靶向”治疗提供了理论基础。
面向未来:挑战与机遇并存
虽然单细胞技术在肝脏研究领域中取得了丰硕成果,但Ju教授团队也指出了几大亟待解决的问题:
-
细胞类型覆盖不均:粒细胞、淋巴细胞在肝损伤中的作用有待深入解析;
-
平台异构性:不同实验室的组织处理方式与测序平台差异较大,导致数据整合难度高;
-
多组学整合不足:目前数据主要限于转录层面,未来需进一步整合蛋白组、代谢组等单细胞层级信息;
-
人工智能赋能:AI在细胞类型注释中的潜力巨大,如scBERT、GPTCelltype等工具正逐步提高罕见细胞识别率。
结语:精准肝病治疗的新图谱已徐徐展开
随着单细胞转录组和空间组学技术的日益成熟,肝脏这一复杂器官的修复“密码”正逐步被破解。这些技术不仅深化了我们对ALI发病机制及肝脏修复动态的认知,也为临床制定更精准、更个体化的治疗策略提供了坚实基础。未来,单细胞“图谱”有望成为肝病治疗的新导航仪。
引证本文
Yankai Wen, Cynthia Ju - New insights into liver injury and regeneration from single-cell transcriptomics: eGastroenterology 2025;3:e100202.
https://doi.org/10.1136/egastro-2025-100202
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)