首页 > 医疗资讯/ 正文
造血干细胞(HSC)在获得体细胞突变、拷贝数变化或其他提供竞争优势的体细胞事件后会发生克隆扩增,这种现象被称为克隆性造血(Clonal Hematopoiesis, CH),该过程与干细胞池的多样性降低有关。尽管CH通常被认为是良性的,但在某些情境下也可与血液恶性肿瘤风险增加以及实体瘤患者的全因死亡率升高有关。通过对大规模患者队列的下一代测序(NGS)、基于机制的数学建模以及小鼠模型研究,我们已经获得了一些关于潜在机制、风险因素和干预机会的见解。尽管CH研究的数量不断增加,但仍然缺乏对促进CH和增加癌症风险因素的完整认识。因此,研究CH与癌症之间的双向相互作用对于全面理解这种关系的临床意义至关重要。
《Nature Cancer》近日发表综述,阐述了血液恶性肿瘤和实体瘤中驱动CH的分子学机制,回顾了用于阻断CH的策略,并考察了它们对实体瘤靶向治疗(包括免疫刺激疗法)的影响。

CH 的发现与定义
体细胞嵌合现象在许多器官系统中都有明确报道。早期证据包括通过基于RNA的检测方法,在女性血液中识别出克隆性X染色体失活模式,利用单核苷酸多态性(SNPs)进行检测。几年后,二代测序(NGS)在血液学正常但年龄较大的个体中检测到TET2突变。在这些报告之后,大规模的基因组分析迅速扩展了这一领域。对血液和/或骨髓细胞进行单核苷酸多态性阵列分析和全外显子测序,揭示了在包括有无血液病理的个体在内的广泛人群中存在CH。先进的纠错NGS在大多数成年人中检测到CH,并确定其患病率随年龄增长而增加,将CH定义为一种与年龄相关的状况。通过分析国家数据登记处以及专注于2型糖尿病和心脏病的大型联盟研究的数据,有助于准确评估CH的患病率及其临床影响。此外,《癌症基因组图谱》(The Cancer Genome Atlas)作为一个多参数基因组信息的丰富来源,提供了CH的一些最早证据。后续研究证实,CH突变细胞不仅限于血液,突变的白细胞还可以在肿瘤组织的基质中被检测到。这种浸润程度如此显著,以至于当不进行匹配血液细胞测序时,CH相关基因中的突变可能会被误认为是肿瘤来源的体细胞突变,而且治疗相关CH(下文描述)曾被误认为是生殖系肿瘤易感性等位基因。
对实体瘤患者的配对肿瘤-血液样本进行深度覆盖的NGS检测发现,在25%的肿瘤患者中检测到CH(变异等位基因频率[VAF]>1%),并且CH与随后血液恶性肿瘤发病率增加以及患者生存期缩短有关。然而,并非所有CH形式都显示出与肿瘤死亡率或血液恶性肿瘤风险相似的关联,从生物学衰老到肿瘤治疗等一系列选择性压力都会推动不同个体中的CH。不出所料,一系列基因突变为这些选择性压力提供了适应性。最常见的体细胞突变包括DNMT3A、TET2、ASXL1、JAK2、TP53和SF3B1,这些突变也见于骨髓增生异常综合征、骨髓增殖性肿瘤和急性髓系白血病(AML)。这种关联使得它们被区分为“白血病驱动”突变。这与髓系或淋巴系恶性肿瘤中未报告的 CH 体细胞突变形成对比,包括BAX、CCL22、SPRED2、ZBTB33和ZNF234。CH驱动突变在造血干细胞(HSCs)中具有多种作用模式,包括增强自我更新能力、促进细胞存活以及影响细胞分化潜力,从而相对于其他HSC克隆提供选择性优势。潜能未定的CH(CHIP)是CH的一个严格定义的亚群,其特征为在没有血液疾病或血细胞减少症的情况下,存在VAF≥2%,该数值超过标准测序的错误率。与普通人群相比,携带CHIP的个体患髓系恶性肿瘤的风险增加。已经定义了若干标准和预测模型,用于评估CH个体患AML或髓系肿瘤的风险。在本综述中,当原始文献在克隆扩增现象和癌前克隆之间有实质性区分时,将有时会提及CHIP。与讨论相关的是,专注于白血病驱动突变的靶向测序研究低估了由其他等位基因驱动的CH的患病率以及由非遗传因素引起的CH。治疗相关CH(通常与TP53、PPM1D和CHEK2的突变相关)是接受过化疗或放疗的个体的术语,与治疗相关髓系肿瘤(t-MNs)的概念相对应。
在肿瘤背景下驱动CH的分子机制
CH的定义是血液中存在体细胞突变,这也引发了两个关键问题:(1)初始突变的来源是什么?(2)相对于非突变细胞,突变细胞扩增的机制是什么?下面讨论突变发生的潜在来源和机制,以及在肿瘤背景下推动CH克隆相对扩增的环境因素和选择性压力(图1)。
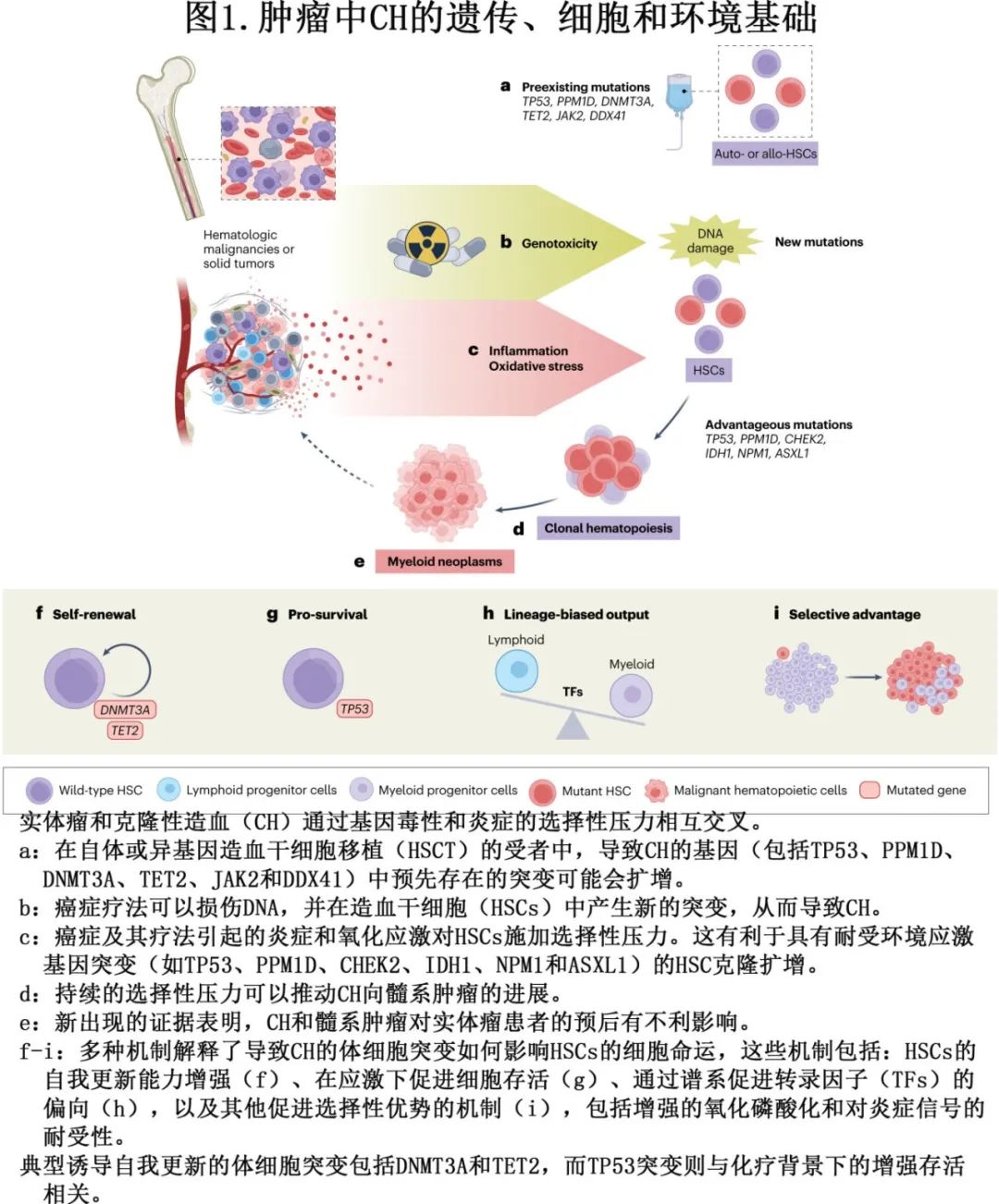
CH突变的来源
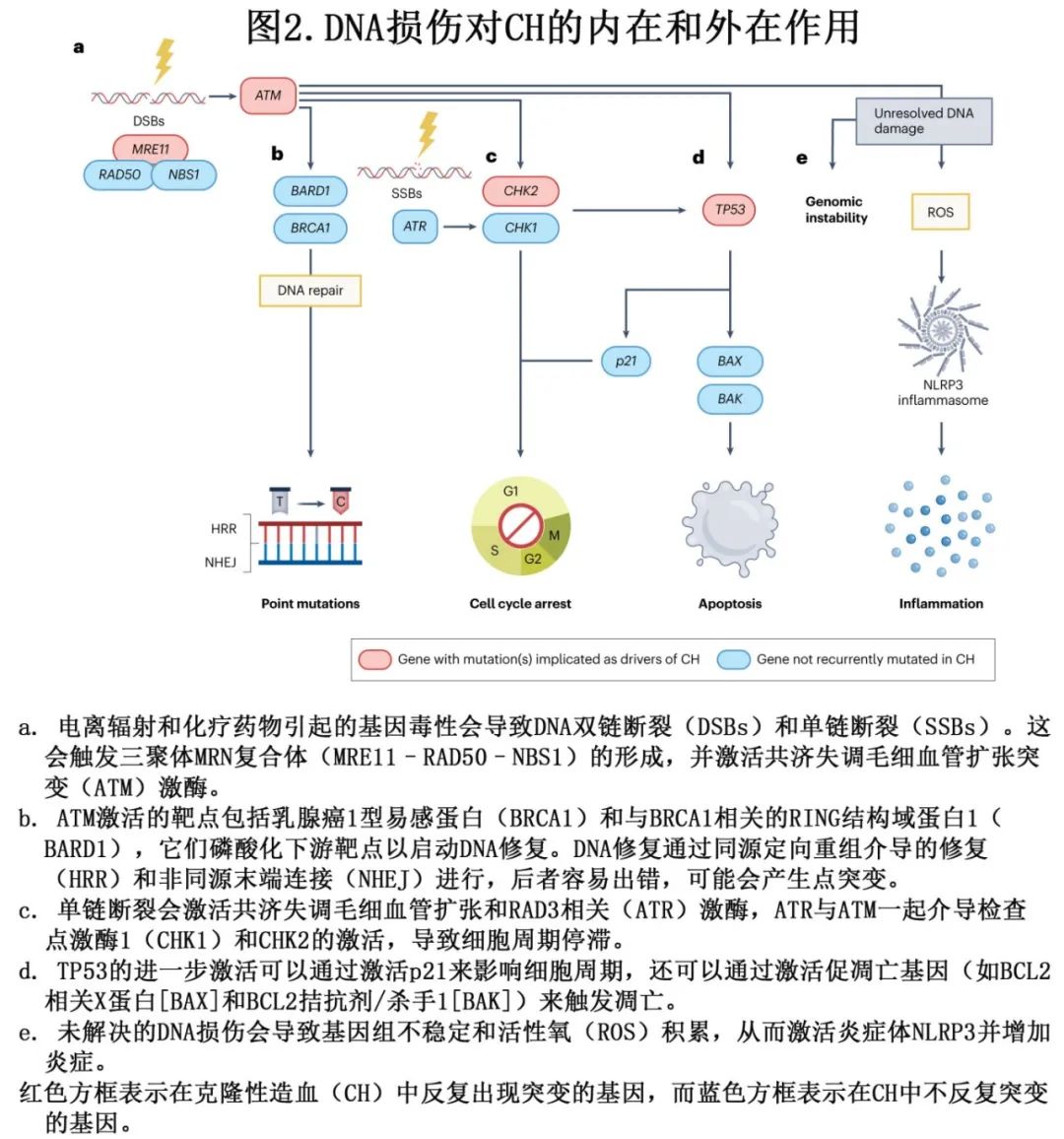
估计造血干细胞和祖细胞(HSPCs)中的体细胞突变发生在胎儿发育期间,并在出生后以每年17个突变的速度进行积累。CH可以在未经治疗的肿瘤患者中被检测到,表明CH突变可以在治疗诱导的突变发生之外发生。衰老过程也会导致体细胞突变的积累。5-甲基胞嘧啶的自发脱氨基转变为胸腺嘧啶是CH中最常见的点突变之一,也是在体细胞组织和癌症中经常观察到的与年龄相关的单碱基替换突变模式。假设导致DNA错配的自发脱氨基速率以及DNA修复效率在时间上是连续的,那么未修复的错配将随着细胞分裂次数的增加而增加,这取决于绝对时间。因此,这些突变随着时间的推移和衰老而增加,与细胞更新速率相关,并以类似时钟的方式积累。
尽管频率较低,但在双链DNA断裂修复过程中发生的错误也可能导致通过DNA聚合酶介导的复制或聚腺苷二磷酸核糖聚合酶1(PARP1)依赖的微同源末端连接导致的小插入和/或缺失。在衰老的背景下,理论认为进化适应已经最大化了DNA修复过程,以改善生殖生命期间的适应性,而在生殖之后,修复过程的高能量成本会干扰DNA复制和转录的代谢过程。最近的报告进一步揭示了复杂性,这些报告表明,通常被认为在几分钟到几小时内修复的DNA损伤,实际上可以在多个细胞周期中持续存在而未被修复。从这些持续突变中推导出的特征估计占HSPCs中与衰老相关突变的高达10%。预计这些损伤会在每轮细胞分裂中产生不同的修复结果,作为局部、分散性高突变的来源。这些研究表明,在克隆扩增的背景下,突变的持续存在和修复的时机是另外两个需要理解的关键变量。
除了发育或衰老过程中自然发生的体细胞突变外,越来越多的证据表明肿瘤治疗也可以直接在HSPCs中诱导突变(图2)。在多发性骨髓瘤患者中,烷化剂马法兰可导致HSPCs中单碱基替换特征增加,系统发育分析表明,TET2和PPM1D突变是突变诱导的直接结果。大多数化疗药物,包括烷化剂、抗肿瘤抗生素和拓扑异构酶抑制剂,以及电离辐射,都会直接导致HSPCs中的DNA断裂,并干扰DNA修复。其他化疗药物,如抗代谢药物,会干扰DNA和RNA合成,在HSPCs中诱导DNA损伤反应。总的来说,内源性DNA损伤和外源性诱变因素都是HSPCs中CH突变的潜在来源。
环境因素对克隆选择的贡献
抗肿瘤治疗为具有抗凋亡基因突变的造血干细胞(HSCs)提供了竞争优势,某些CH突变在基因毒性应激下为造血干细胞和祖细胞(HSPCs)提供竞争优势。例如,HSCs中DNMT3A的体细胞突变可增强对蒽环类化疗的耐药性。除了基因毒性应激外,DNA损伤疗法还会引发炎症反应,增强HSC功能,包括产生促炎细胞因子和趋化因子。生物学衰老与骨髓内的低度炎症状态相关,这种状态被称为“炎症衰老”(inflammaging),对HSCs构成生存挑战。炎症-衰老轴以突变特异性的方式与CH扩增相交叉。Dnmt3a突变的HSCs在老年骨髓微环境中相对于非突变HSCs具有增强的竞争优势,至少部分通过增强肿瘤坏死因子(TNF)信号传导实现。TNF的炎症信号促进Tet2−/− HSCs在体外扩增,慢性分枝杆菌感染或干扰素-γ(IFNγ)注射有利于Dnmt3a−/− HSCs在体内扩增。从机制上讲,人类和小鼠研究均观察到,几种CH突变赋予HSCs对炎症的“耐受性”。这些研究以及其他研究表明,不同的炎症分子施加适应性挑战,从而决定了特定突变克隆在HSC池中的优势地位。
涉及HSC移植(HSCT)的肿瘤治疗是一个独特的情况。在淋巴瘤的自体HSCT中,移植时存在CHIP与较差的生存率和t-MNs风险增加有关。同样,t-MNs也可能是霍奇金淋巴瘤自体HSCT的一个复杂特征,因为自体移植物中存在TP53和/或PPM1D突变会增加这些患者患t-MNs和非复发死亡率的风险。这些可能是移植前治疗对移植物施加选择性压力的结果,有利于自体移植物中现有突变克隆的扩增和转化。在异基因HSCT的情况下,存在第二个来自供体细胞来源的造血克隆池。携带TP53、剪接因子或生殖系DDX41突变的克隆扩增供体细胞可能导致供体细胞白血病,与受者的原始肿瘤无关。然而,供体CH与HSCT结果之间的负相关并未广泛或均匀观察到。一项对372名异基因HSCT受者进行的13年随访研究并未发现与供体CHIP状态相关的继发性恶性肿瘤的差异,表明异基因供体中存在CHIP并不会对移植结局产生不利影响。另一项对16对匹配的供体-受体对进行的更长时间范围(HSCT后6.6至45.7年)的研究发现,供体和受体的平均突变率相似,只有少数变异(约5%)在受体中比供体中扩增得更多,表明在HSCT受体中移植细胞的克隆扩增是例外而非规则。关于HSCT后克隆动态的机制,人类数据的数学建模指向了在将HSCs从其原生环境移植到新微环境中时,由于选择性压力的改变而产生的多种过程。这些包括在移植前由于不同的动员、收集、体外存活或最初归巢至骨髓而发生的克隆扩增(修剪选择),以及在转移后和植入受者骨髓中后发生的生长选择。有趣的是,异基因HSCT受者中的CH可以有积极的结果。例如,观察到供体DNMT3A突变CH与改善生存率之间的关联,这似乎与增加的急性和慢性移植物抗宿主病有关。尽管关于是否应对HSCT供体进行CHIP筛查的争论仍在继续,但正在进行的(例如,NCT04689750)和未来的临床研究的额外数据将继续重要,以制定针对供体HSCs中CH相关基因突变的遗传筛查的细致临床指南。
当前的CH模型得益于对专门的患者队列进行画像、监测国家健康数据库以及使用同源小鼠模型进行受控的机制实验。同样地,我们也很可能可以通过一些特殊的急性事件来理解克隆扩增的特性。其中一个研究发现,在2001年世界贸易中心灾难的第一批响应者中CH的发生率增加。在一项因果科学研究中,将这场灾难中的颗粒物施用于小鼠,并证明其会导致HSCs发生突变,从而将急性暴露与诱变性DNA损伤联系起来。这是一个蓝图,通过它可以对致癌物、刺激物和炎症细胞因子进行功能性画像,以评估它们使HSCs发生突变和扩增的能力。在这场灾难发生近20年后,新冠疫情爆发了,在这场疫情中,大量研究得出了有时相互矛盾的结论,关于CH在预测新冠肺炎严重程度中的作用。纵向随访最终可能会揭示急性炎症、克隆稳定性与CH出现之间的关系。
大规模画像研究和特殊事件为剖析影响克隆扩增的突变特异性压力提供了基础(图3)。然而,目前仅确定了少数CH驱动因素。对冰岛人群的全基因组测序发现,不到15%的CH个体存在已知CH驱动基因的突变。同样地,对健康血液中同义乘客(passenger)突变的分析表明,大多数这些突变不能归因于携带已知CH突变的克隆。对于这些发现,有两种可能的解释。首先,突变检测仅仅触及参与CH的广泛基因的表面,还需要更复杂的统计方法来识别克隆扩增的致病驱动因素。第二种解释需要一个更系统的HSC克隆积累观点。在人类中的单克隆研究和小鼠中的实验模型已经证明,衰老与血液中克隆复杂性的降低相关。因此,CH可以被视为在这种崩溃过程中存活下来的克隆群体。追踪人类克隆的最常用方法依赖于体细胞突变,但这些突变是否代表这种存活中的致病因素,还是仅仅是一个条形码,仍有待确定。通过DNA甲基化或线粒体突变谱系追踪,可以在患者群体中实现追踪克隆的替代方法。像这样的工具将有助于确定CH是突变克隆加速生长的结果,还是周围克隆系统的崩溃。理解这种差异对于开发能够抑制克隆扩增或恢复克隆多样性的疗法至关重要。

针对克隆性造血以阻断血液恶性肿瘤
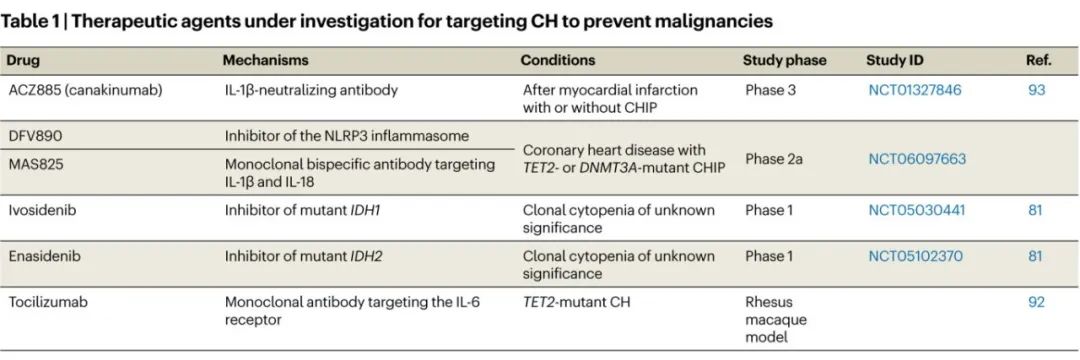
针对CH的治疗或可改善血液恶性肿瘤的临床管理。干预策略可以针对(1)减少CH克隆大小,或(2)减轻源自CH突变HSPCs的终末效应细胞的异常功能。最终,改变导致CH的选择性压力有可能降低CH的总体发生率以及血液恶性肿瘤的发展。在此讨论了新兴靶点、实验策略以及正在进行的临床试验,这些试验旨在阻断CH向血液肿瘤的进展(表1)。
再利用肿瘤治疗以阻断克隆演变
一项研究调查了AML的癌前突变图谱,发现所有携带IDH1和IDH2突变的患者最终都发展为AML,这凸显了对CH进行早期干预的潜在获益。随机临床试验表明,艾伏尼布(IDH1突变拮抗剂)和enasidenib(IDH2突变拮抗剂)在治疗新诊断、unfit或复发和/或难治性IDH1/IDH2突变AML患者中是安全且有效的。正在进行的1期试验(NCT05030441,NCT05102370)正在评估艾伏尼布和enasidenib治疗克隆性血细胞减少症(clonal cytopenia of unknown significance,一种表现为至少一种合格血细胞减少的CHIP变异)患者的血液学参数的影响。尚待确定的是,在IDH1/IDH2突变AML中实现的克隆抑制是否能够转化为癌前状态的有效性。即使没有克隆抑制,部分患者也可能从IDH2抑制剂enasidenib中获益,因为该药物已被证明即使在没有突变IDH2的情况下也能促进红系分化。
一种识别治疗机会(vulnerabilities)的方法是在治疗前后通过体外实验或使用小鼠模型追踪克隆图谱。在恶性肿瘤的背景下,Dnmt3a缺陷细胞对PARP抑制剂耐药,而Tet2缺陷细胞则敏感,这暗示了一种可能扩展到CH的敏感性谱系。这些方法也适用于具有PPM1D和TP53突变的t-MNs,这些突变预计会在血液恶性肿瘤中赋予化疗耐药性。靶向DNA损伤反应通路(例如TP53、PPM1D和EZH2)成分的抑制剂可能与传统抗癌疗法联合使用时具有协同效应,以防止突变造血细胞向t-MNs的克隆进展。高通量技术,如CRISPR–Cas9筛选,也已成功用于识别治疗机会。例如,对Idh2和Tet2突变HSPCs的体外筛选揭示了Kdm3b及其下游信号成分是突变HSPC适应性的关键调节因子。该筛选还发现了对JAK2抑制的敏感性。三项最近的研究表明,DNMT3A中反复出现的CH突变赋予小鼠和人类HSPCs增强的氧化磷酸化能力,从而推动它们的竞争优势,并代表了一种治疗机会。这种线粒体代谢表型可以成功地通过美国食品药品监督管理局批准的药物二甲双胍以及针对线粒体代谢的实验性化合物(如MitoQ和d-TPP(十二烷基-三苯基膦))进行靶向。对于CH和具有各种突变的髓系恶性肿瘤的药物敏感性进行更广泛的筛查,对于药物的重新利用和/或发现工作是必要的。
针对CH相关炎症通路
炎症信号传导对CH中突变HSCs施加选择性压力,使炎症通路成为潜在的治疗靶点。这些通路包括IFNγ信号传导、NLRP3炎症体介导的白细胞介素-1β(IL-1β)信号传导和TNF信号传导。目前正在进行研究,以评估针对促炎细胞因子的中和抗体和针对炎症通路的小分子抑制剂是否有可能防止CH进展为血液恶性肿瘤。例如,在CH的恒河猴模型中,通过托珠单抗阻断IL-6信号传导可抑制TET2突变HSCs的克隆扩增。这些有希望的结果可以扩展为一项长期研究,以评估托珠单抗防止CH进展为血液肿瘤的潜力,特别是在高危个体中。CANTOS(Canakinumab抗炎血栓形成结果研究)试验表明,canakinumab(IL-1β中和抗体)可降低有心肌梗死病史患者的动脉粥样硬化性心血管事件的发生率,特别是在同时存在TET2突变CHIP的患者中。其潜在机制可能涉及通过抑制NLRP3炎症体及其下游促炎细胞因子的分泌来改善CH中的炎症状态。一项正在进行的2a期临床试验(NCT06097663)正在评估针对NLRP3炎症体(DFV890)的抑制剂和针对IL-1β和IL-18的双特异性单克隆抗体(MAS825)如何影响携带TET2或DNMT3A突变CHIP的成年人血清中IL-6和IL-18的水平。
针对CH的有效手段及挑战
将针对CH的治疗与传统治疗相结合,可能作为一种辅助策略,用于减少高危个体中髓系增殖性疾病的复发。确定影响患者可能进展为疾病的临床参数,对于实施任何预防性治疗至关重要。一个高危患者群体可能是患有RUNX1突变家族性血小板减少症的患者,这是一种罕见的遗传性疾病,患者可能表现为血小板减少症,且超过45%的患者会发展为急性白血病。值得注意的是,到50岁时,30%到80%的患者会出现CH。正在进行的临床试验旨在纵向监测这一患者群体(NCT03854318),并评估他们在接受西罗莫司治疗时的造血功能(NCT06261060)。CH的高渗透率以及随后的恶性转化需要早期临床干预,这可以通过重新利用现有药物来实现。对新药物进行更广泛的测试需要能够模拟人类健康中CH动态变化的临床前模型。由于小鼠的寿命比人类短,导致突变积累较少,因此在没有实验性引入基因组损伤的情况下,研究CH自然进展为血液恶性肿瘤具有挑战。在大型人类人群中对CH进行观察性研究,以及对复发和/或耐药性血液肿瘤进行干预性研究,以及在非人灵长类动物中进行研究,可能会为通过靶向CH预防血液恶性肿瘤提供宝贵的见解。或许有些矛盾的是,我们还必须考虑在所有临床情境中,清除CH克隆可能并不总是有益的。在克隆复杂性降低的情况下,消除CH克隆可能会移除对炎症的保护机制,从而导致造血-炎症应激的总体增加。
CH在实体瘤中的意义
炎症既可以是CH的因,也可以是其果,这一事实产生了令人着迷且有时令人困惑的结果。CH与实体瘤发展之间也存在类似的双向关系,其中抗肿瘤治疗可以影响CH的启动和克隆扩增,而CH突变的效应细胞可以创造一个促肿瘤发生的环境。随着多种实体瘤治疗手段的进步,癌症患者的预期寿命显著增加。这一进步为肿瘤管理策略带来了挑战,这些策略现在必须解决长期治疗效应的累积风险,包括治疗后的CH和t-MNs。下文讨论了在实体瘤背景下CH的预后相关性、携带CH突变的肿瘤相关白细胞的含义,以及在实体瘤治疗过程中考虑CH的因素(图4)。
CH作为实体瘤疾病分层的参数
CH已被定义为某些癌症的独立风险因素,并与肿瘤治疗结局相关。例如,作为肺癌风险因素的CH与其他已知风险因素不同。一项对8810名实体瘤患者进行的回顾性研究表明,具有潜在白血病驱动突变的CH与不良临床结局相关。后续分析显示,不同亚型的肿瘤(例如,未分化甲状腺癌与分化型甲状腺癌)与CH突变特异性的髓系细胞浸润相关。另一项研究显示,具有潜在白血病驱动突变的CH可预测转移性食管胃癌患者更差的总生存率。在小鼠研究中,Asxl1突变CH促进乳腺肿瘤的进展,并加速自发性乳腺肿瘤的发展。然而,CH并不总是预测实体瘤的不良临床结局。在年轻女性乳腺癌研究和一项三阴性乳腺癌患者的研究中,无论克隆大小如何,治疗后的CH与癌症的预后较好或较差均无关联,在9年的中位随访期内没有发现差异。在小鼠研究中,Ppm1d突变的CH导致同种异体B16-F10黑色素瘤和LLC1 Lewis肺癌肿瘤生长减缓。在这些研究中得出结论的挑战在于,用于定义CH的标准(例如,测序平台、测序深度和数据解读)缺乏一致性。此外,CH中观察到的其他变异,如镶嵌染色体改变,通常未被包括在内,可能表明这些人群中CH的发生率被低估。需要进行具有明确CH定义标准的前瞻性临床试验,以确定使用CH作为生物标志物来分层各种实体瘤患者的潜在价值。
肿瘤微环境中的CH来源白细胞
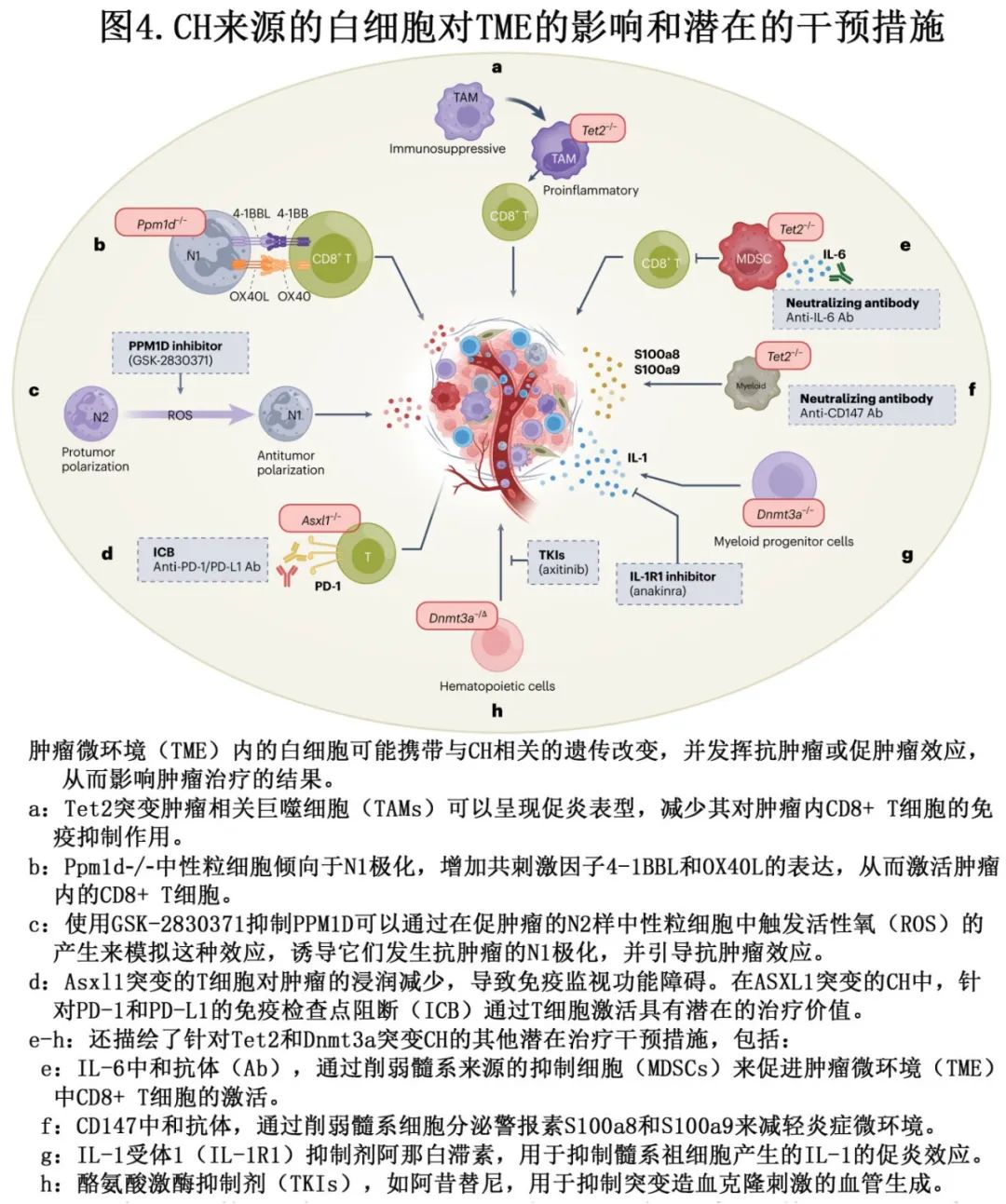
CH改变实体瘤发生和结果的风险机制可能与参与肿瘤细胞监视的CH突变免疫细胞的功能改变有关。实验表明,CH突变的白细胞会被招募到肿瘤中。2015年的一项开创性研究中,Kleppe等人对乳腺TME中的CD45+白细胞进行全外显子测序,发现与外周血相比,CH突变富集。该研究和其他研究挑战了TME基因组稳定的传统观点。动物模型研究提供了CH突变白细胞在TME中的功能角色的视角。仅在T细胞中表达的与CH相关的Asxl1突变被发现通过减少TME中的T细胞浸润和上调CD8+ T细胞上的程序性细胞死亡蛋白1(PD-1)表达来促进乳腺肿瘤进展。这种表型似乎源自T细胞产生的内在改变,因为Asxl1突变小鼠存在异常的胸腺内发育、CD4/CD8比值降低以及初始-记忆失衡。Tet2在小鼠中的全面敲除通过增加免疫抑制性粒细胞髓系来源的抑制细胞群体和系统性减少功能性CD8+ T细胞数量来加速同种异体肿瘤生长。相反,在髓系细胞中Tet2功能丧失被发现在黑色素瘤中将肿瘤相关巨噬细胞从免疫抑制转变为促炎,从而在体内抑制黑色素瘤生长。此外,在未分化甲状腺癌的TME中,Tet2突变巨噬细胞可以通过上调转化生长因子-β(TGFβ)家族配体来放大TGFβ信号,介导BrafV600E癌细胞对BRAF/MEK抑制的治疗抵抗。在中性粒细胞中敲除Ppm1d可增强细胞毒性T细胞反应,从而在体内抑制同种异体黑色素瘤和肺癌生长。这些研究表明,针对CH突变肿瘤浸润白细胞的治疗可能改善癌症预后。一项研究使用多激酶抑制剂阿昔替尼来减轻Dnmt3a突变CH在TME中的促血管生成功能,最终在实验小鼠模型中减少与结肠炎相关的结肠癌。其他方法旨在模仿PPMD1突变相关的抗肿瘤免疫细胞表型,显示抑制这种磷酸酶可改善人和小鼠中性粒细胞的抗肿瘤表型。最后,在Tet2缺失的背景下,使用EMMPRIN/CD147(已知的S100a8/S100a9受体)的中和抗体或免疫检查点阻断(例如,PD-1阻断)来恢复功能性抗肿瘤效应T细胞。鉴于CH来源的白细胞可能也是未来治疗相关髓系肿瘤(t-MNs)发展的哨兵,深入理解突变白细胞如何影响TME尤为重要。
在实体瘤治疗背景下考虑CH
除了CH在分层实体瘤临床结果中的潜在预测价值外,CH的存在可能是选择实体瘤治疗方案的一个考虑因素。例如,Tet2突变的巨噬细胞在未分化甲状腺癌微环境中积累,并能够削弱对MAPK/BRAF抑制的反应性。PPM1D突变可通过反复暴露于顺铂、蒽环类药物(例如,柔红霉素)和拓扑异构酶抑制剂(例如,依托泊苷)而被选择,但不会通过微管抑制剂(例如,长春碱)选择。对于t-MNs高风险患者,评估CH可以实现抗癌方案的明智选择和优化,并早期管理不良事件。
抗癌治疗中的另一个考虑因素是CH突变在工程细胞产品中的影响,例如现在用于实体瘤治疗的CAR-T细胞。例如,CAR-T细胞中DNMT3A耗竭在体内延长肿瘤暴露时保留它们的增殖和抗肿瘤反应,并与更好的临床结局相关。同样,在一名复发和难治性慢性淋巴细胞白血病患者中,TET2缺陷的CAR-T细胞显示出T细胞分化的改变分子特征,表现出中央记忆表型,发挥有效的抗癌效应,并使患者达到完全缓解。这些突变可能是在CAR-T细胞工程过程中通过插入突变引入的,并可能影响慢性淋巴细胞白血病的结果。在细胞工程之前或之后,对细胞免疫治疗产品进行白血病驱动CH突变的筛查的实用性,首先需要更多数据来判断这些突变是有益的、有害的还是中性的。
除了基于细胞的免疫疗法外,插入突变可能在CAR-T细胞工程过程中引入,并可能影响慢性淋巴细胞白血病的预后。在细胞工程之前或之后,对细胞免疫治疗产品进行白血病驱动CH突变的筛查的实用性,首先需要更多数据来判断这些突变是有益的、有害的还是中性的。除了基于细胞的免疫疗法外,实体瘤的免疫刺激治疗也可能受到共存CH的影响。GS-3583是一种FLT3激动剂Fc融合蛋白,用于实体瘤治疗,以增加TME中的传统树突状细胞并促进T细胞介导的肿瘤细胞毒性。GS-3583作为一种免疫刺激治疗已在晚期实体瘤患者中进行了1期试验。一名患者因治疗而发生了与治疗相关的第二原发性AML,导致研究终止。该患者之前接受过抗癌治疗,并存在一个DNMT3A突变克隆(3% VAF)。在接受GS-3583治疗后,该患者被发现存在NPM1(40% VAF)、TET2(34% VAF)和PCLO(51% VAF)的新突变。由于CH可以被视为一种白血病前期状态,因此在使用免疫刺激治疗时,对于存在共存CH的肿瘤患者应谨慎考虑。
CH作为治疗耐药性生物标志物
数十年来,基因检测一直影响着癌症治疗决策。这些检测范围从通过测序或核型分析识别癌基因病变以分配靶向治疗,到检测生殖系变异和启动子甲基化以评估药物敏感性和毒性。将基因检测扩展到包括CH是朝着全面疾病预后和治疗优化迈出的自然下一步。能够提供这些信息的CH的具体特性仍有待确定。我们设想了两条相关但不同的将CH作为生物标志物纳入的路径:(1)以机制驱动的科学为基础,提供特定可干预的靶向通路;(2)临床关联,近似反映CH的总体负担。
第一条路径遵循基因组学驱动的精准医疗时代的成功,其中可以对个体患者的肿瘤进行测序,并分配针对疾病潜在遗传易感性的治疗。例如,对于接受HSCT治疗的AML患者,敏感的可测量残留疾病检测对于FLT3和NPM1是减少巩固治疗的关键因素。将这些范式适应于CH突变白细胞在TME中的影响,将需要精确的、基于机制的研究,以提供合理的联合疗法。这些研究的结果本质上将为需要肿瘤细胞和TME遗传学交叉的肿瘤增加第二层基因检测。尽管在临床前研究中已经确定了这样的例子,但将这种成对策略大规模应用于CH的可能性很小。相反,这些策略应专注于CH和TME中最丰富的突变(例如,DNMT3A、TET2),以获得最广泛的应用和临床实施可能性。
如上所述,CH及其体细胞表现的全景尚未确定。确定每个突变如何影响TME,以及它是否可靶向,类似于将肿瘤中的个体体细胞突变分类为抗原性并能够引发免疫反应。从免疫治疗生物标志物开发领域汲取经验教训,先前的研究已经表明,总突变负荷是一个有争议但相关的免疫检查点抑制反应生物标志物。类似地,CH等位基因负荷或克隆复杂性可能在将CH整合到癌症预后和治疗决策中的临床实施中具有更大的潜力。这种系统级将CH归因于疾病进展或治疗的属性可能可以通过临床关联研究来评估,即使精确机制仍然知之甚少。在任何情况下,将CH纳入治疗计划都面临着挑战,包括需要标准化的CH相关突变测序协议以及准确解释CH数据。需要考虑的关键因素包括测序深度、基因覆盖范围、CH的VAF cutoff值,以及实施适当的对照以区分测序错误和胚系变异。
总体观点和未来方向
CH以年龄依赖的方式发生,特定的干扰可以增强携带体细胞突变的HSCs的适应性。这种现象可以通过进展为血液恶性肿瘤以及通过非细胞自主效应影响实体瘤生物学和肿瘤治疗的疗效来影响CH的后果和个体结局。最近开发了一种CH风险评分(CHRS),以预测CH进展为血液恶性肿瘤的风险。CHRS综合几个变量,包括患者的年龄、血液细胞中存在的突变类型和数量、携带突变的血液细胞的比例、血液计数以及与红细胞体积相关的参数。鉴于预测CH进展为髓系恶性肿瘤的临床价值,像CHRS这样的方法可以被改编用于监测接受实体瘤治疗后有治疗诱导髓系恶性肿瘤风险的患者。但还需要更多的临床研究来评估CHRS与实体瘤结局的相关性。越来越多的诊所已经在美国的主要健康中心建立,用于管理CH患者。这些诊所专注于在实体瘤和其他疾病患者中发现的CH,旨在更好地理解CH与癌症之间的关系,并将CH的肿瘤学意义转化为患者护理。随着对CH突变的了解不断增长,一个关键的挑战将在于确定CH对人类健康的影响是否继续依赖于单基因关联(例如,DNMT3A与TET2风险),或者是否考虑在克隆选择中发生的克隆多样性变化的总体情况。
在临床可操作性方面的主要挑战是CH中涉及的突变全景的部分特征以及对CH和癌症生物学之间复杂机制和相互依赖效应的不完全理解。因此,需要进一步的基础研究来解决这些问题。值得注意的是,最近的一份报告表明,与没有CH的个体相比,CH个体的非突变HSCs富含炎症和衰老特征,这突显了CH可能对野生型免疫细胞功能产生的非细胞自主效应。通过先进的遗传技术追踪人类和小鼠模型中的突变与非突变HSCs(例如,突变足迹分析或单细胞谱系追踪结合组学分析),可以区分影响肿瘤生物学的免疫效应细胞的起源和分子状态。本综述中突出了许多仍需解决的剩余问题。通过定义CH影响血液恶性肿瘤和实体瘤的细胞-细胞和细胞-组织相互作用,这些研究的总体目标是确定对CH的了解在改善癌症管理和治疗中的效用和机会。
随着分子工具箱不断丰富,相关性研究将超越CH的简单识别,朝着CH等位基因负荷、持久性以及细胞和遗传组成的精细关联方向发展。这些特征的长期适应性以及精确的术语,最终将决定CH作为人类健康中具有临床可操作性的生物标志物的设置和程度。
参考文献
Cai, X., Bowman, R.L. & Trowbridge, J.J. Clonal hematopoiesis in myeloid malignancies and solid tumors. Nat Cancer (2025). https://doi.org/10.1038/s43018-025-01014-0
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)