首页 > 医疗资讯/ 正文

当前,针对极罕见遗传性中枢神经系统(CNS)疾病的定制化RNA疗法因其高度针对性和潜在疗效,正成为临床和科学前沿热点。在Molecular Therapy: Nucleic Acids即将发表的Schüle等人研究中,基于1 Mutation-1 Medicine (1M1M)联盟的实践经验,团队建立了一个“1M1M最佳实践框架”,用于系统评估超罕见神经遗传病患者是否适合接受个性化ASO治疗。该框架强调透明的评价指标,从基因突变的病理机制、疾病进展特征到患者个体的临床和心理情况,构建综合的治疗获益风险衡量体系,为高复杂度、个体差异显著的“单例”核酸疗法提供指导依据。
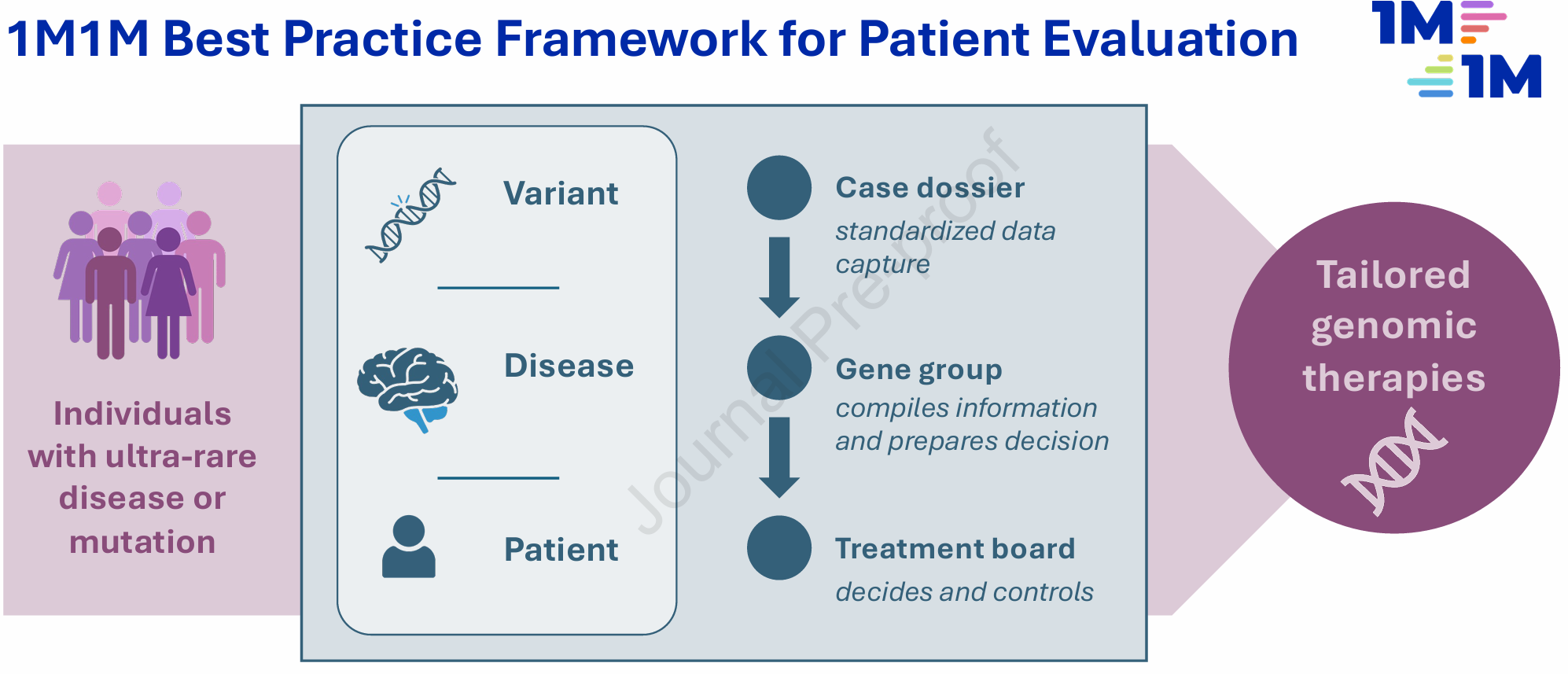
核酸基因治疗尤其是反义寡核苷酸(ASO)技术已取得多项突破,如脊髓性肌萎缩症(nusinersen)、SOD1相关肌萎缩侧索硬化(tofersen)和遗传性淀粉样变性(inotersen、patisiran)等。尽管针对更常见罕见病的药物开发已有轨迹,超罕见病因患者极少且临床异质性极大,传统药物开发路径往往无法满足加速开发和精准匹配的需求。此外,个体化疗法涉及伦理、临床、经济等多重挑战,亟需科学的病例评价和多学科决策机制支持,避免随意试验或资源浪费,并确保患者利益最大化。
本研究基于丰富的实际病例评估和多中心协作经验,构建了一个运用在个体化ASO疗法开发流程中的标准化框架。该框架通过“患者档案表”收集关键遗传、临床及心理信息,随后由“基因组专家组”审查变异的致病性及疗法可行性,再由“治疗评估委员会”进行多角度综合评估,确保决策的严谨性与公正性。
研究结果
1. 三轴评价体系
研究提出基于三个核心评价维度:
- 变异及ASO策略:明确致病变异的遗传学证据(ACMG分类≥4),确认变异的致病机制是否可被特定ASO策略纠正(如剪接调节、转录下调或蛋白翻译阻断)。设计需针对变异特性选择gapmer或剪接调节性ASO,排除不可纠正的临界剪接突变。对可能出现的功能缺失风险及替代剪接策略的可行性进行权衡。
- 疾病特征:需满足“严重致残或威胁生命”定义(即SDLT),并集中表现为中枢神经系统症状(确保经蛛网膜下腔给药ASO到达靶区),无或缺乏有效替代疗法,且病理过程仍有可逆空间。分析疾病进展速度、伴随系统受累及治疗生物标志物的可用性等。
- 患者个体特征:考虑患者病程阶段(越早接受越可能受益)、临床表现的系统性分布、能力接受复杂治疗程序的认知与心理准备,以及患者或监护人的风险接受度和期望。
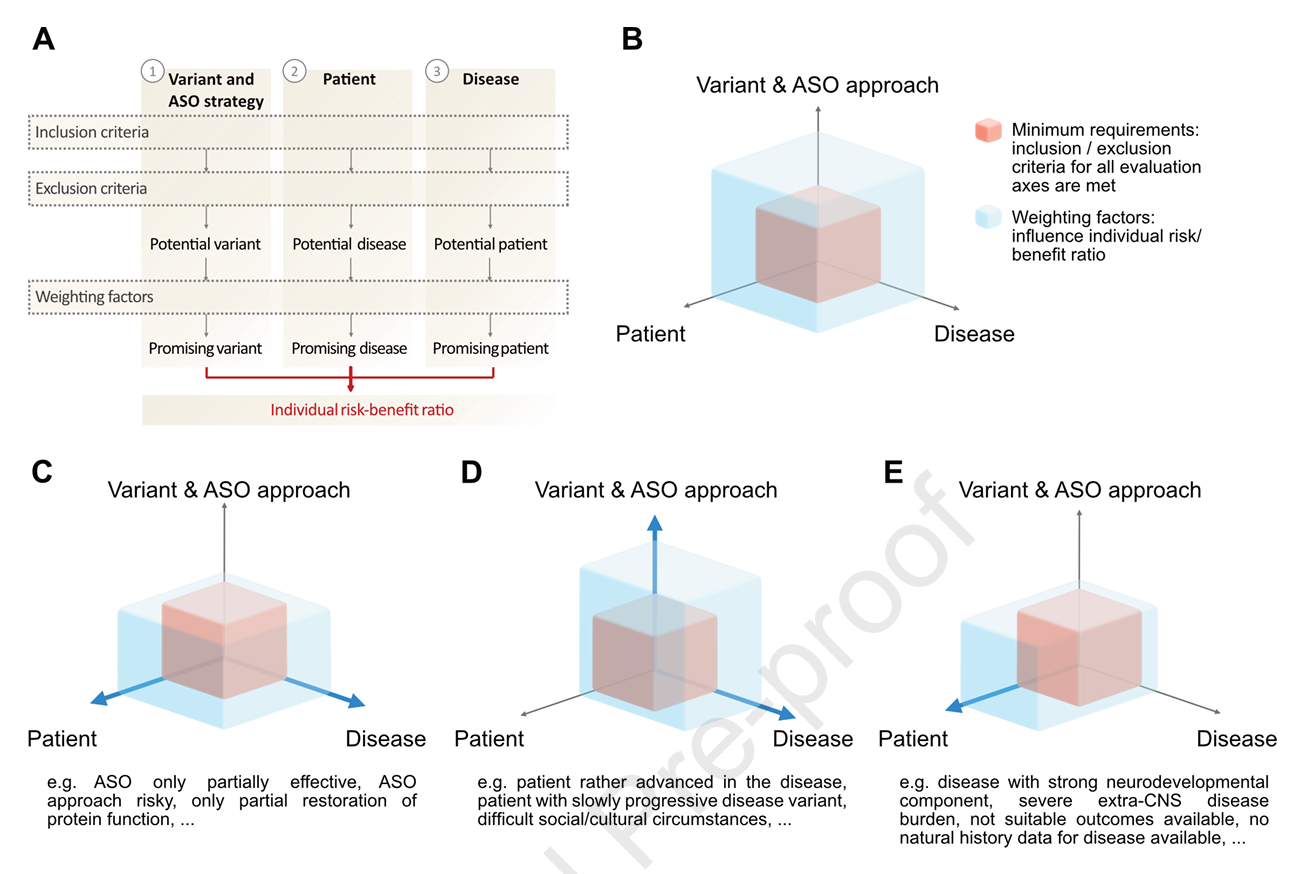
图1:1M1M方案评估流程及三轴评价示意
2. 评价标准及权重应用
每一轴设定明确的纳入/排除条件,辅以加权因素辅助判断。例如,位于变异轴上的“明确遗传致病性”是核心纳入条件;而疾病严重程度可作权重调节,影响最终决策。患者轴的临床状态如过重残障则为排除,边缘者视具体权重综合评判。
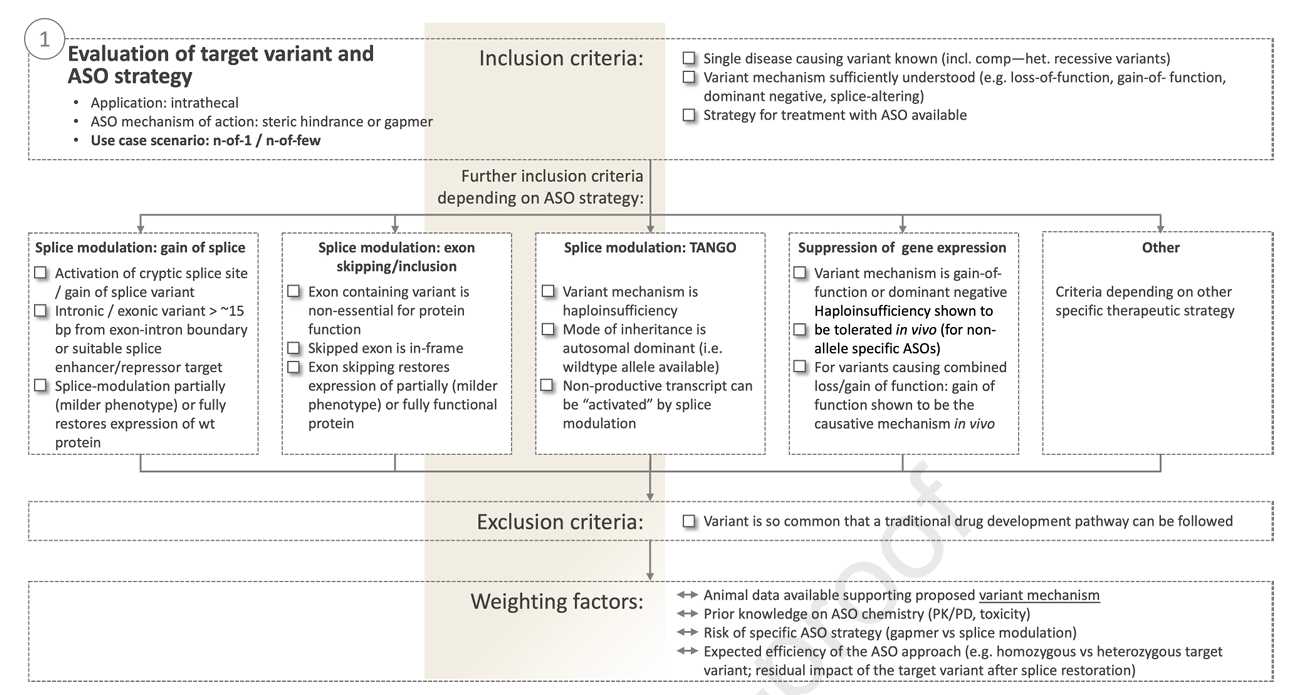
图2:变异及ASO策略评估框架示意
3. 案例解析
- Pelizaeus-Merzbacher病(PMD)中的PLP1变异,针对不同临床表现(重型PMD vs. 温和HEMS亚型)进行差异化评估,温和者不满足SDLT标准,可能不适合ASO治疗。
- POLR3A相关Wiedemann-Rautenstrauch综合征,突变满足变异轴,患者病死亡大多发生于围产期且脑损伤已成定局,故ASO干预获益低。
- 鲁登-拉乌滕塔赫综合征(Ataxia telangiectasia),满足变异和疾病轴纳入,因其主要神经症状进展显著且无有效治疗,对ASO有潜在适应性,但考虑到非中枢系统(免疫、恶性肿瘤)影响生存及生活质量,该因素需权衡。
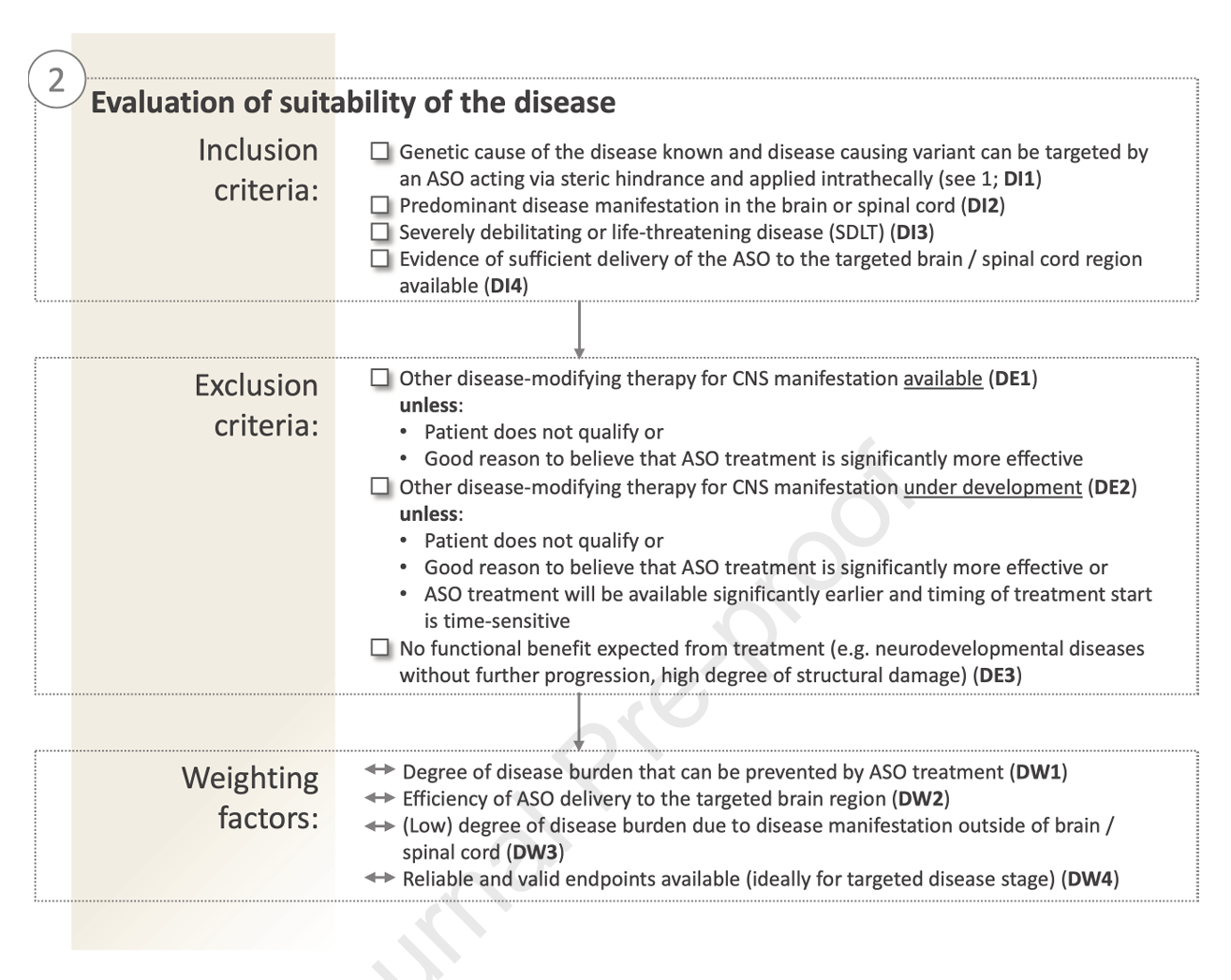
图3:疾病轴适应性评估要点
4. 多利益相关者治疗评估委员会作用
最后由多学科治疗评估委员会基于三轴综合数据,结合伦理专家与患者代表意见,进行受益风险综合分析,并就是否启动ASO定制研发及治疗给出建议。此过程确保评价的科学性、公正性与患者意愿的尊重。
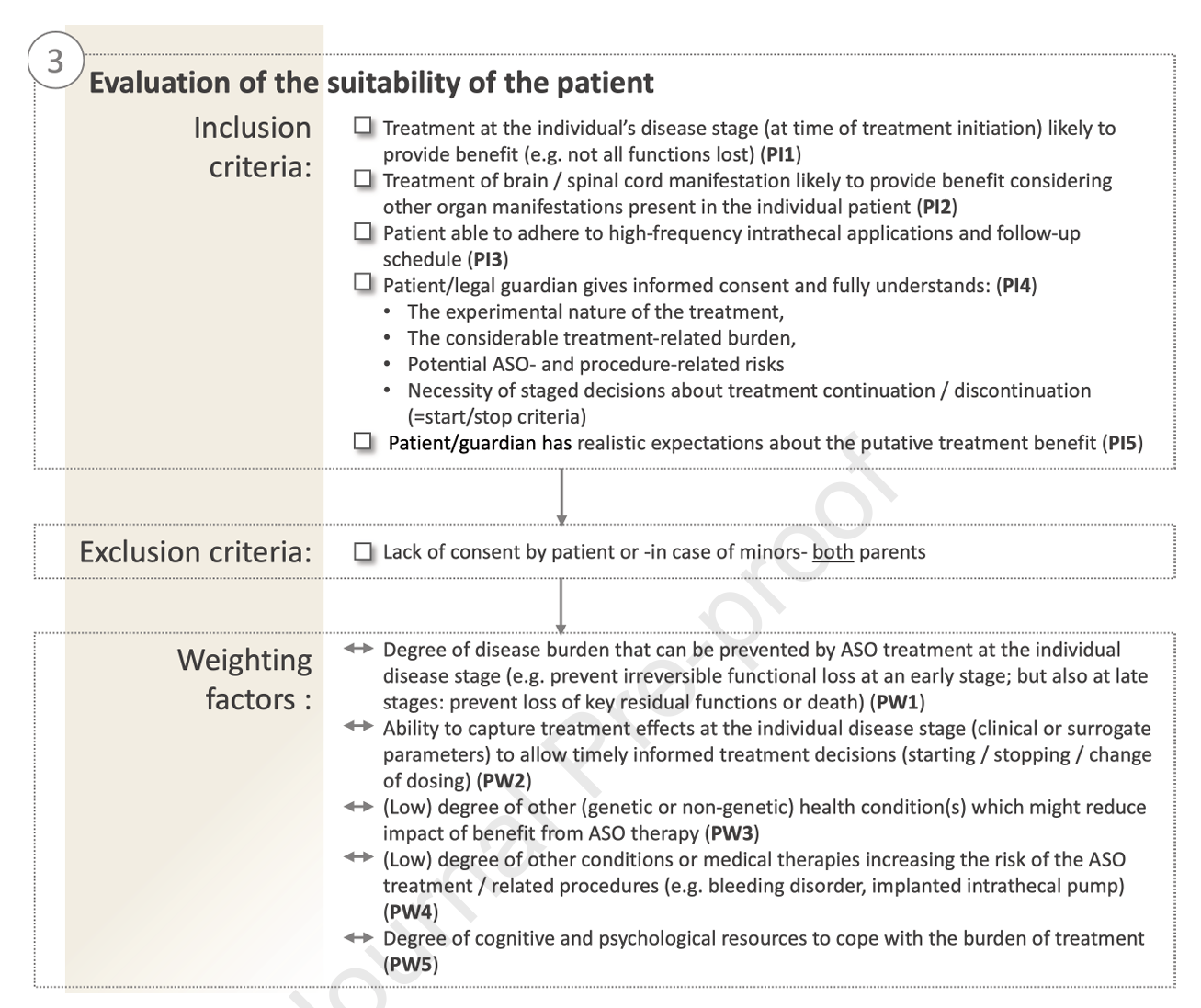
图4:患者轴评价要点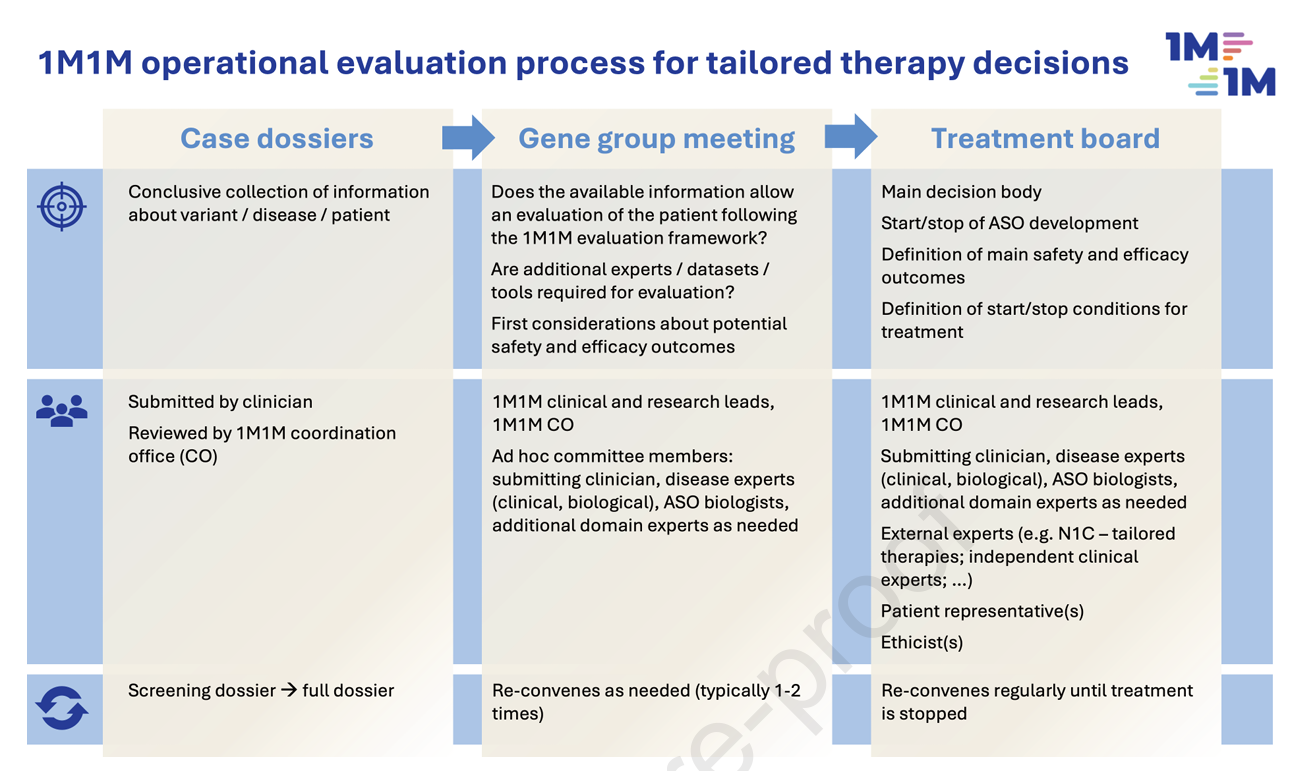
图5:1M1M联盟个性化ASO治疗评估与决策流程
价值与意义
该研究紧扣当前基因治疗快速发展的时代背景,针对个体化ASO治疗的复杂性与不确定性提出系统性评价框架,具有重要指导意义。该框架不仅规范了患者筛选与治疗决策流程,降低专家判断中的主观性偏差,也兼顾了伦理和患者意愿,提高决策透明度和公信力。其多轴评价体系涵盖从分子机制到临床表现,再到患者个人状况的全方位考量,有助于优化资源分配,提升疗效观察的科学性。随着个性化基因药物“n-of-1”疗法的兴起,该框架未来可推广至更多遗传病个案,推动精准治疗成为常规临床实践的一部分,同时为法规制定者提供科学依据。
原始出处
Schüle R, Graessner H, Aartsma-Rus A, van Roon-Mom WMC, N=1 Collaborative (N1C), 1 Mutation 1 Medicine Consortium (1M1M), Synofzik M. Tailored antisense oligonucleotide therapies for ultrarare CNS diseases and mutations: an experience-based best practice framework for individual patient evaluation. Mol Ther Nucleic Acids. 2025. doi:10.1016/j.omtn.2025.102615.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)