首页 > 医疗资讯/ 正文
糖尿病肾病 (DKD) 因缺乏有效治疗,在全球范围内造成了沉重的医疗负担。肾小管中高水平的线粒体氧化应激 (mtROS) 和线粒体损伤是 DKD 进展的始动因素和核心驱动因素。然而,目前抗氧化药物的疗效受到极大限制,主要原因是难以同时突破肾小球屏障并靶向作用于肾小管线粒体,以及其对慢性 DKD 的持续治疗能力有限。
2025年7月6日,中南大学湘雅医院药学部黄琼、中南大学湘雅药学院艾可龙共同通讯在Advanced Science 在线发表题为“Adaptive Antioxidant Nanomedicines Inhibit Ferroptosis in Renal Tubular Epithelial Cells to Alleviate Diabetic Kidney Disease”的研究论文。该研究报道了一种硒包埋的自适应抗氧化纳米药物 (AAN),该药物表面带负电荷,具有高度的线粒体靶向性,能够穿过肾小管并在 DKD 患者受损的肾小管线粒体中高度富集。
AAN 可以清除 mtROS 并释放可溶性硒,硒随后被转化为关键的生物活性酶——GPX4,通过发挥自适应抗氧化作用,有效抑制铁死亡并保护线粒体。在DKD小鼠模型中,AAN治疗可有效恢复肾功能,且每4天10 mg·kg−1剂量的治疗效果显著优于每日200 mg·kg−1剂量的二甲双胍。总而言之,本研究为增强抗氧化疗法的效果,突破DKD治疗中的病理障碍提供了一种有前景的策略。

全球糖尿病患者数量大幅增长,已超过8亿。糖尿病可引起一系列微血管并发症,其中糖尿病肾病(DKD)因其高发病率(占糖尿病患者的20%~40%)而备受关注。目前,DKD的治疗仅限于应用肾素-血管紧张素-醛固酮系统抑制剂控制血压,以及应用二甲双胍和钠-葡萄糖协同转运蛋白2抑制剂控制血糖。这些方法虽然具有一定的肾脏保护作用,但治疗效果并不理想,且难以抑制DKD进展至终末期肾病(ESRD)。由于缺乏有效的干预措施,DKD的10年死亡率高达31.1%。事实上,糖尿病合并慢性肾脏病的全因死亡风险甚至高于心肌梗死。糖尿病肾病 (DKD) 患者群体庞大且不断增长,造成了巨大的社会和医疗支出,而有效缓解 DKD 的治疗手段是亟待解决且远未得到满足的医疗需求。
新出现的证据表明,DKD 中的肾小球损伤既不是早期肾脏损害的主要事件,也不是 DKD 进展的决定因素。因此,肾小管损伤发生早于肾小球损伤,并且在 DKD 中更为关键。在 DKD 患者出现蛋白尿排泄和肾脏组织学缺陷之前,已观察到近端小管上皮细胞 (PTEC) 的线粒体动力学改变,这表明 PTEC 的线粒体功能障碍是 DKD 的一个始动因素。肾脏是一个富含线粒体的器官,其含量仅次于心脏。重吸收是近端小管的主要功能,这种主动的重吸收过程消耗大量能量,导致PTECs内的线粒体密度远远超过其他肾脏细胞。在DKD早期,高糖等多种因素导致mtROS大幅升高,诱导PTECs线粒体功能障碍和氧化应激,从而造成肾组织损伤和肾功能丧失。此外,在DKD中,由于慢性高糖和氧化应激,PTECs易发生铁沉积和脂质过氧化,进而引发铁死亡,诱发炎症细胞浸润,引起肾脏纤维化,最终导致ESRD。因此,PTECs内高水平的mtROS和随之而来的线粒体功能障碍是DKD肾小管病变的病理核心,尤其是在早期肾脏损伤中。尽管如此,目前尚无抗氧化剂被批准用于临床治疗糖尿病肾病(DKD)。其根本原因是常见的抗氧化剂在体内往往缺乏线粒体靶向性和肾小管靶向性。通过对抗氧化剂进行线粒体靶向基团修饰,可以使其具备一定的线粒体靶向能力。然而,目前常见的线粒体靶向基团如三苯基膦通常带高正电荷。经过线粒体靶向基团修饰的抗氧化剂在体内会优先在肝脏或肺部而非肾脏中蓄积,从而显著降低其生物利用度并增加毒副作用。此外,PTEC中的ROS水平是一个稳态过程。ROS也是重要的生物信号分子,过度清除ROS会导致细胞功能障碍。由于DKD是一种慢性疾病,需要长期或重复使用抗氧化剂,导致全身ROS波动,并因其毒性和非特异性分布而导致副作用和治疗效果降低。迫切需要一种能够靶向线粒体并自适应消除mtROS以恢复PTEC中线粒体功能的带负电荷的抗氧化纳米药物。
在此,我们开发了一种新颖的自适应抗氧化策略,通过一种高度靶向线粒体的自适应抗氧化纳米药物 (AAN) 来有效治疗糖尿病肾病 (DKD)。AAN 是一种硒掺杂碳复合纳米颗粒,由硒代半胱氨酸在碱性条件下温和热分解而成。AAN 因其丰富的硒和酚羟基,能够有效清除各种活性氧 (ROS)。此外,AAN 继承了硒代半胱氨酸的氨基乙酸基团,确保 AAN 不仅带负电荷,而且具有高度的线粒体靶向性。在先前的研究中,带正电荷的基团常被用于线粒体靶向,这主要是因为线粒体膜上含有丰富的带负电荷的磷脂。然而,除了磷脂之外,线粒体膜还含有极其丰富的线粒体膜蛋白,这为利用带负电荷基团进行靶向治疗提供了一种潜在的策略。在DKD小鼠中,静脉注射的AAN在肾脏中高度富集,并且由于其极小的粒径,可以穿过肾小球屏障到达PTEC。随后,AAN在PTEC的线粒体中高度富集,清除过量的线粒体ROS并释放可溶性硒,而PTEC可以高效地将可溶性硒转化为GPX4。 GPX4作为一种关键的抗氧化酶,能够自动适应氧化还原环境的变化,精准调控PTEC内的氧化还原平衡,抑制铁超载,降低脂质过氧化,从而保护PTEC免于铁死亡。正是基于这种高效的自适应抗氧化策略,AAN显著改善了DKD小鼠的肾功能,减轻了肾脏损伤,抑制了纤维化的进程,其效果显著优于2型糖尿病的一线药物二甲双胍。这一创新的治疗策略为DKD的治疗提供了有效的途径,也为靶向细胞死亡机制的研究及临床应用开辟了新的方向。
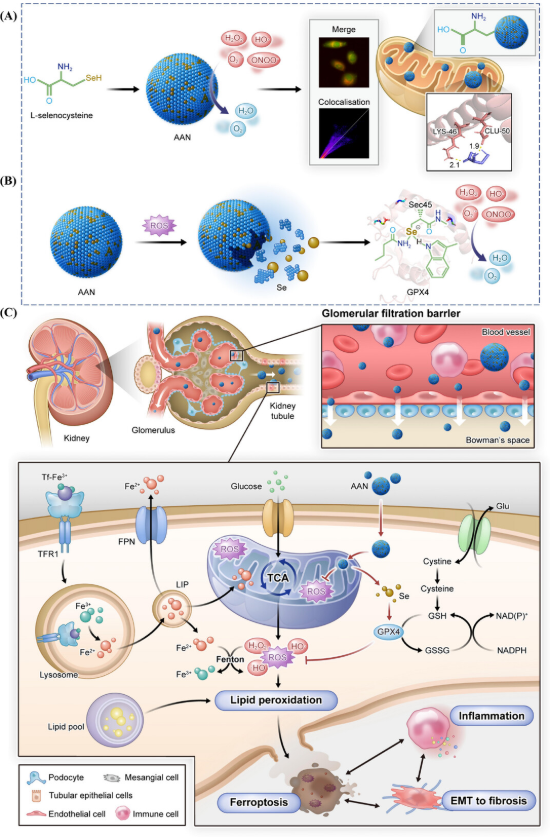
图1 AAN的合成、线粒体靶向和DKD的发生(图源自Advanced Science )
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202505168
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)