首页 > 医疗资讯/ 正文
近日,天津医科大学肿瘤医院妇科肿瘤科刘文欣教授作为通讯作者在国际权威杂志《Signal Transduction and Targeted Therapy》在线发表题为“Tislelizumab (anti-PD-1) plus chemotherapy as neoadjuvant therapy for patients with stage IB3/IIA2 cervical cancer (NATIC):a prospective, single-arm, phase II study”(替雷利珠单抗联合化疗新辅助治疗IB3/IIA2期宫颈癌(NATIC):一项前瞻性、单臂、II期研究)的原创研究论文,该研究展示了替雷利珠单抗联合化疗的新辅助治疗方案在IB3/IIA2期宫颈癌中显示出令人鼓舞的抗肿瘤活性、安全可控,这为局晚期宫颈癌(LACC)患者提供了一种新的治疗选择。

该论文的第一作者为天津医科大学肿瘤医院妇科肿瘤科盛今东医生、康圣真源医学科学部总监罗海涛博士、妇科肿瘤科刘翔宇医生。天津医科大学肿瘤医院胰腺癌防治中心郝继辉教授和妇科肿瘤科刘文欣教授为该论文共同通讯作者。
研究背景:局部晚期宫颈癌治疗仍存挑战
宫颈癌是女性第四大常见癌症,在发病率和死亡率方面均居前列。其中,局部晚期宫颈癌(LACC,IB3期和IIA2-IVA期)约占全球宫颈癌病例的37%。目前,以顺铂为基础的同步放化疗(CCRT)是LACC的标准治疗方式,但约10%的患者会出现局部复发,30%会发生远处转移。免疫检查点抑制剂(ICIs)与放化疗(CRT)的联合应用成为一种新的治疗选择。然而,不同研究结果存在差异,如CALLA研究中度伐利尤单抗联合CRT未获积极结果,而KEYNOTE-A18试验中帕博利珠单抗联合CRT显著改善了LACC患者的生存,该方案已被批准用于新诊断的FIGO 2014 III期和IVA期LACC患者。对于IB2-IIB期LACC,铂类新辅助化疗是一种替代治疗策略,但患者从中获得的生存益处和预后改善存在争议。将免疫治疗加入新辅助化疗,在多种实体瘤中已显示出显著的临床益处,而宫颈癌中存在高肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)、人乳头瘤病毒(HPV)感染以及高程序性死亡配体 1(PD-L1)表达等分子特征,为免疫治疗的应用提供了坚实的生物学基础。但LACC新辅助免疫化疗的证据仍有限。
研究设计:聚焦IB3/IIA2期患者
该研究是一项单中心、单臂、开放标签、研究者发起的II期试验。
入组标准:年龄18-65岁,经组织学证实为局部晚期宫颈鳞状细胞癌、腺癌或腺鳞癌,FIGO 2018分期为IB3、IIA2期(肿瘤直径≥4cm),ECOG PS评分0或1,器官功能充足,无既往抗肿瘤治疗史,至少有一个符合RECIST v1.1的可测量病灶。
治疗方案:入组患者在根治性手术前接受3 个周期的替雷利珠单抗(200mg,每3周一次)联合化疗。化疗方案为紫杉醇(175mg/m²,第1天)联合铂类(卡铂 AUC=5或顺铂60mg/m²,第1周期第2天,第2-3周期第1天)。根据RECIST v1.1,在新辅助治疗后影像学评估为完全缓解(CR)、部分缓解(PR)或稳定(SD)的患者,将进行根治性子宫切除术(C1 型)加盆腔淋巴结切除术和腹主动脉旁淋巴结切除术(至肠系膜下动脉水平)。对于<40岁的鳞状细胞癌患者,可考虑保留卵巢。术后患者可能接受辅助化疗、放疗或同步放化疗(CCRT)。
研究终点:主要终点是病理完全缓解(pCR),即原发灶和淋巴结中完全没有残留的存活肿瘤细胞。次要终点包括根据 RECIST v1.1评估的客观缓解率(ORR)、无病生存期、总生存期和安全性。探索性终点包括基于组织和血液的生物标志物,以确定临床结果背后的生物学驱动因素。
研究结果:疗效显著,安全性良好
1 患者基线特征
2022年11月至2024年3月期间,共筛查了31例患者,1例患者拒绝手术,最终30例患者入组并接受新辅助替雷利珠单抗联合化疗,所有患者均完成了3个周期的新辅助治疗并接受了根治性手术,纳入疗效和安全性分析。中位随访时间为14.7个月(数据截止日期为2024年12月31日),所有患者仍在进行随访。
患者中位年龄为51.5岁,80%的患者ECOG PS评分为0。大多数患者为鳞状细胞癌(28/30,93.3%),FIGO分期为IIA2期(19/30,63.3%),PD-L1阳性(联合阳性评分 [CPS]≥1;29/30,96.7%)。中位肿瘤大小为4.6cm,中位鳞状细胞癌抗原水平为5.2ng/mL。
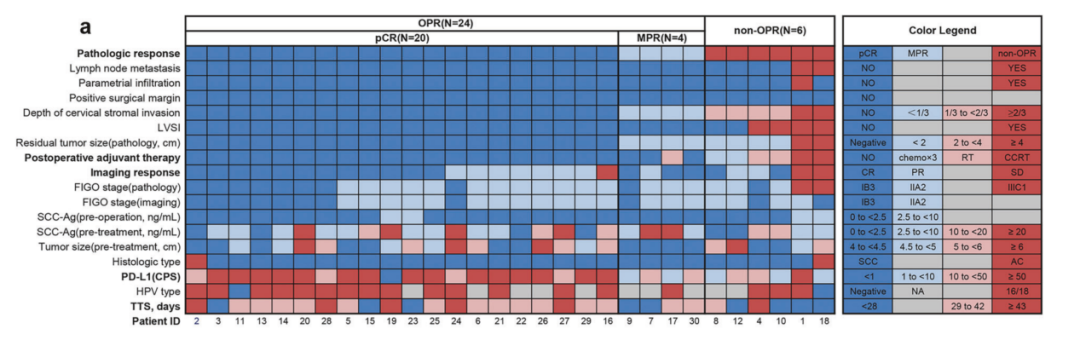
图:患者的基线特征、肿瘤应答及病理应答情况
2 临床疗效
病理缓解:30例患者中,20例达到pCR(66.7%;95% CI 48.8-80.8%),4例达到主要病理缓解(MPR;13.3%),最佳病理缓解率(OPR)为 80.0%(24/30)。
临床缓解:ORR为90.0%(95% CI 74.4-96.5%),其中17例(56.7%)达到 CR,10例(33.3%)达到PR,3例(10.0%)为SD,无进展病例。
生存情况:至截止日期,2例患者出现疾病复发:1例非OPR患者在术后11个月出现腹膜转移,接受了综合治疗;1例MPR患者在术后12个月出现阴道旁复发,接受了放疗。18个月无病生存率为90.0%(95% CI 77.7-100.0),未发生死亡事件。由于随访时间尚未达到方案规定的阈值,总生存期将在未来的出版物中报告。
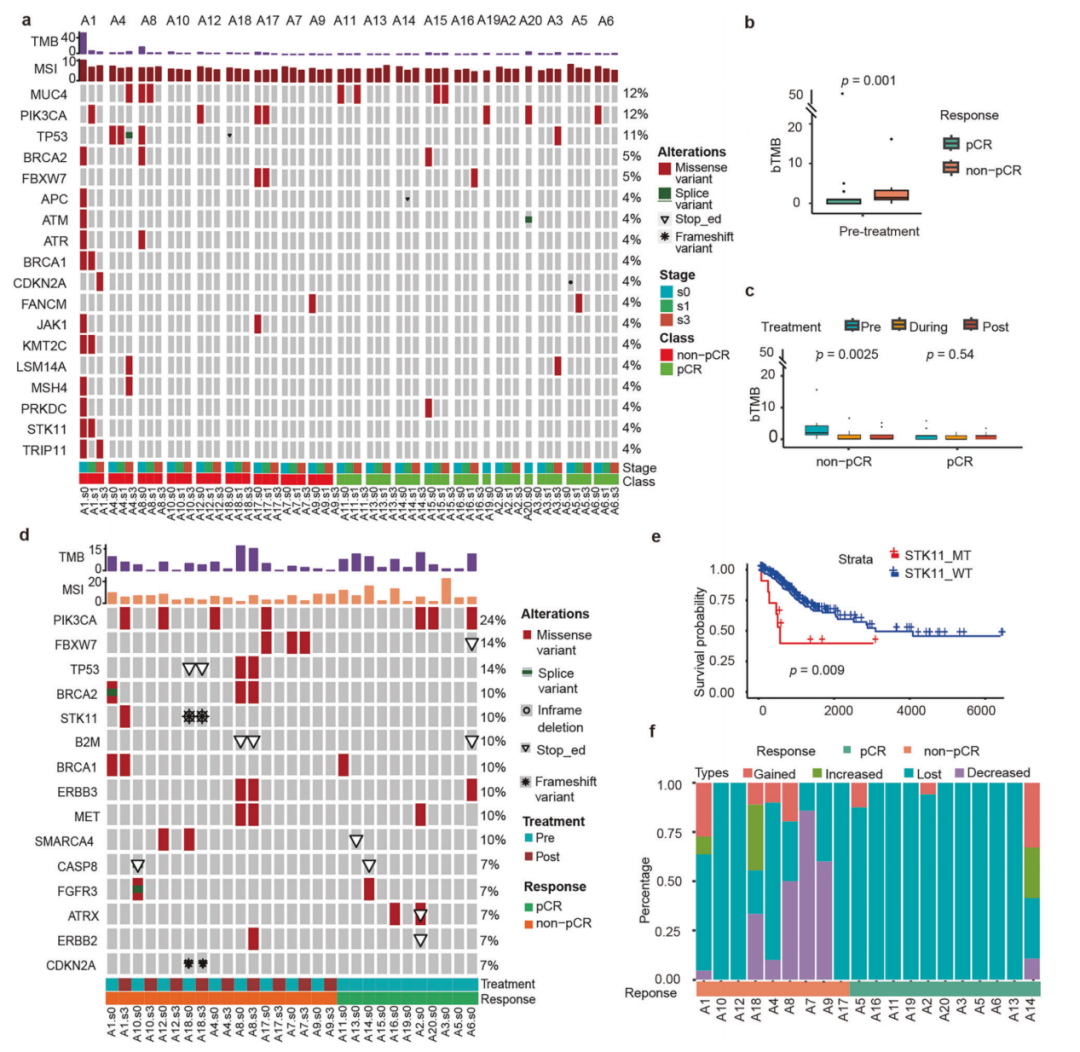
图:通过对血液(上)和肿瘤组织(下)样本的NGS测序分析,探究了基因组突变与新辅助治疗疗效之间的关系
3 生物标志物分析
PD-L1表达:pCR组患者的PD-L1 CPS显著更高(中位77.5 vs 8.5;p<0.001),提示PD-L1过表达可能预测对 ICIs的更好临床获益。值得注意的是,研究中1例PD-L1 CPS<1的患者在根治性手术后也达到了pCR。
手术时间:手术时间与病理反应存在显著差异(p=0.041),手术延迟(手术时间>6周)的患者pCR率最高,达到83.3%,表明在新辅助免疫化疗后4-6周甚至更晚进行手术可能会改善病理反应。
循环肿瘤DNA(ctDNA)突变:最常见的ctDNA遗传改变是MUC4(12%)、PIK3CA(12%)和TP53(11%)。治疗前,非 pCR组与更高的基于血液的TMB(bTMB)值显著相关。动态监测发现,治疗期间非pCR组的bTMB显著下降,而pCR组的bTMB保持相对稳定。
肿瘤组织突变:最常见的突变基因是PIK3CA、FBXW7和TP53。STK11基因突变仅在非pCR队列中观察到。基于TCGA-CESC队列验证发现,STK11突变患者的总生存期(OS)显著差于STK11野生型患者。
基因表达:治疗前,pCR组中BATF2、CXCL9和CD274等基因高表达,且pCR组中上调的基因与cytokine-cytokine受体相互作用、免疫反应和PD-L1/PD-1信号通路等通路相关;相比之下,非pCR组中上调的基因主要富集在细胞外空间、肽酶活性的负调控和脂质代谢过程。对非pCR组治疗前后的差异表达基因(DEGs)分析发现,非pCR组在治疗后肿瘤相关通路未被抑制,相反,包括T细胞增殖和先天免疫反应在内的免疫相关通路被抑制。
免疫特征:治疗前,pCR组在细胞溶解特征、CD8效应T细胞、T细胞耗竭和IFN-γ 特征方面水平更高,表明其肿瘤微环境(TME)更 “热”。免疫细胞丰度分析显示,pCR组的免疫细胞水平显著更高;相反,非pCR组在治疗期间Th1细胞丰度显著降低,M2巨噬细胞和调节性 T 细胞(Tregs)增加。
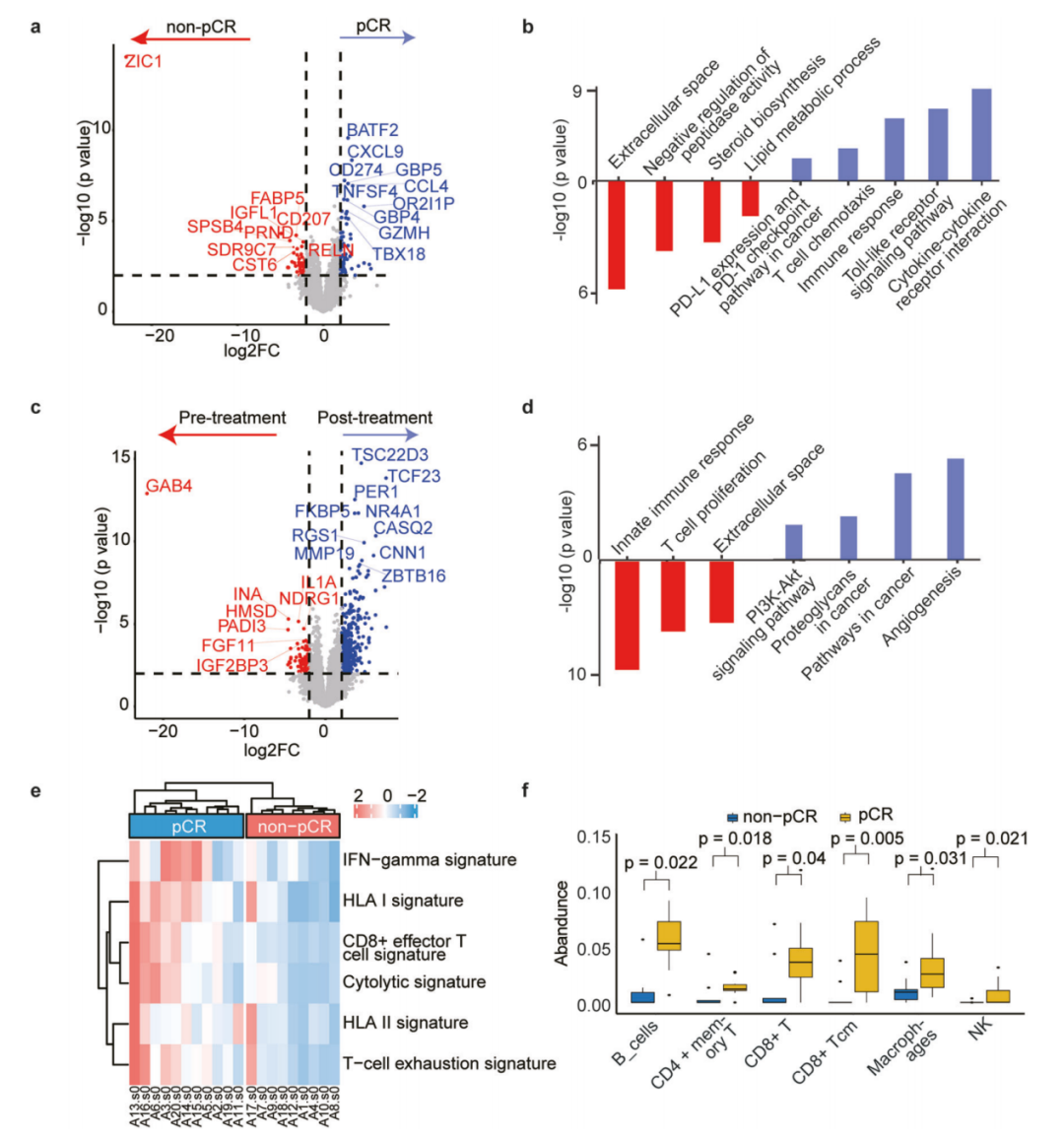
图:不同应答组之间差异基因、免疫信号及肿瘤微环境的比较
4 安全性
所有30例患者均出现治疗相关不良事件(TRAEs)。最常见的TRAEs是淋巴细胞减少(27/30,90.0%)、贫血(21/30,70.0%)和低白蛋白血症(21/30,70.0%)。8例患者(26.7%)出现3级TRAEs,无4级TRAEs报告。7例患者(23.3%)出现免疫相关不良事件(irAE),仅1例(3.3%)出现≥3级irAE,该患者(26号患者)在术后2周出现周围神经病变(包括肢体麻木和腿部无力),进展为吞咽和呼吸困难,最终诊断为格林-巴利综合征,经大剂量皮质类固醇治疗后症状明显改善。在新辅助治疗期间,未观察到需要停药、减量或导致死亡的不良事件。
6例患者的手术延迟超过6周。手术期间,中位术中失血量为140mL。4例患者(13.3%)至少经历了1种术后并发症,包括大于5cm的盆腔淋巴囊肿(6.7%)、术中血管损伤(3.3%)和术后深静脉血栓(3.3%)。术中无患者出现泌尿或胃肠道损伤。
研究结论
该研究达到了预设终点,显示替雷利珠单抗联合化疗作为局部晚期宫颈癌新辅助治疗具有良好的病理反应和可耐受的安全性。30例患者中,pCR率达到66.7%,OPR率为 80.0%,ORR为 90.0%,且安全性可控。与以往的铂类新辅助化疗相比,该研究中的pCR率显著更高。与其他评估LACC新辅助免疫治疗的研究相比,该研究中pCR率也更高,这可能与治疗周期更长(该研究为3个周期,NACI研究为2个周期)以及疾病分期更低(该研究所有患者均为IB3/IIA2期,而NACI研究中60%的患者为 IIB/IIIC1r期)有关。研究中观察到影像学和病理反应之间存在差异,仅有56.7%的患者影像学和病理结果一致。同时,一些术前影像学评估为PR(n=7)或SD(n=1)的患者在术后也能达到pCR;相反,5例术前达到CR的患者在手术检查中发现残留肿瘤组织。这可能是由于MRI在区分坏死组织、新辅助治疗引起的炎症变化和存活的肿瘤组织方面存在固有的局限性;此外,与传统方法相比,更彻底的手术(如C1型子宫切除术)可能会发现影像学遗漏的小病灶。该研究也存在一些局限性,如单臂试验设计、样本量相对较小可能引入潜在偏倚,随访时间短导致生存数据不成熟,主要终点pCR只是一个替代终点,术后随访计划和辅助治疗方案也需要进一步研究以确定最佳策略。未来需要通过更大规模的随机对照试验来进一步验证。
总之,替雷利珠单抗联合化疗有望成为局部晚期宫颈癌患者一种可行的新辅助治疗方案,患者术后可望减少辅助放化疗,其长期生存结果仍有待观察。
原文出处:Tislelizumab (anti-PD-1) plus chemotherapy as neoadjuvant therapy for patients with stage IB3/IIA2 cervical cancer (NATIC): a prospective, single-arm, phase II study. Signal Transduction and Targeted Therapy volume 10, Article number: 215 (2025)
原文链接:https://www.nature.com/articles/s41392-025-02294-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)