首页 > 医疗资讯/ 正文
研究亮点:
- 从芦荟中提取的纳米囊泡样颗粒(AV-EVLPs)通过激活ROS-GSDMD/E信号通路诱导胰腺癌细胞焦亡,显著抑制肿瘤进展。
- 超速离心法制备的AV-EVLPs(EV-U)相比聚合物沉淀法制备的颗粒(EV-P)具有更均一的结构和更强的抗肿瘤活性。
- EV-U在胰腺癌小鼠异种移植模型中有效缩小肿瘤体积和重量,且未表现出系统性毒性或免疫原性,展现优良的生物安全性。
胰腺癌因其早期症状不明显、进展隐匿,往往在晚期确诊,5年生存率不足10%。近年来免疫治疗兴起,诸如PD-1/PD-L1检查点抑制剂等虽在多种实体瘤表现出疗效,但对胰腺癌患者效果甚微,这主要归因于胰腺癌特殊而抑制性的肿瘤微环境(TME)。TME中免疫细胞稀少,尤以效应性T细胞为甚,导致该肿瘤被称为“最冷肿瘤”。此外,传统化疗药物多存在溶解度差、系统毒性等限制。因此,亟需新型靶向且具有良好生物相容性的治疗策略。
焦亡(Pyroptosis)作为一种炎症性程序性细胞死亡,能通过Gasdermin蛋白介导细胞裂解、释放炎症介质IL-1β、IL-18,激活免疫应答,被认为有望逆转胰腺癌的免疫逃逸并抑制肿瘤生长。此外,植物源性纳米囊泡样颗粒因其天然安全、高载药能力及优良的穿透肿瘤微环境能力被广泛关注,成为潜在的治疗载体。芦荟作为一种稳定、全年可采集的药用植物,富含多糖、蒽醌类成分,具有显著的抗肿瘤活性,但其源性纳米颗粒的抗胰腺癌作用尚未明确。

近日,发表于Chinese Medicine期刊的一项研究,系统探讨了芦荟中提取的纳米囊泡样颗粒(AV-EVLPs)在胰腺癌治疗中的潜在作用及机制。研究通过两种不同方法制备AV-EVLPs,比较其物理化学特性及生物活性,发现超速离心获得的EV-U粒径更均一、纯度更高,并能更有效地抑制Panc-1胰腺癌细胞迁移、侵袭,诱导细胞焦亡。进一步的体内实验确认了EV-U在胰腺癌异种移植小鼠中抑瘤活性和安全性,同时揭示了AV-EVLPs通过ROS激活caspase-1/3/7/9-GSDMD/E通路诱导细胞焦亡的详细分子机制。
本研究从新鲜芦荟中提取植物外泌体样颗粒,采用超速离心法(EV-U)和PEG-6000聚合物沉淀法(EV-P)两种技术进行制备。通过透射电子显微镜(TEM)、纳米颗粒追踪分析(NTA)、超高效液相色谱-质谱联用(UHPLC-QTOFMS)、SDS-PAGE等手段分别对两种制备的颗粒形态、大小、成分进行表征。随后,利用Panc-1胰腺癌细胞进行细胞存活率、细胞迁移/侵袭和纳米颗粒摄取测试。体内邀请胰腺癌异种移植小鼠进行抗肿瘤活性及毒性评价。炎症因子和焦亡相关蛋白(caspase-1/3/7/9,Gasdermin D/E)的表达通过ELISA、免疫组化、Western blot和qRT-PCR检测,揭示其机制。
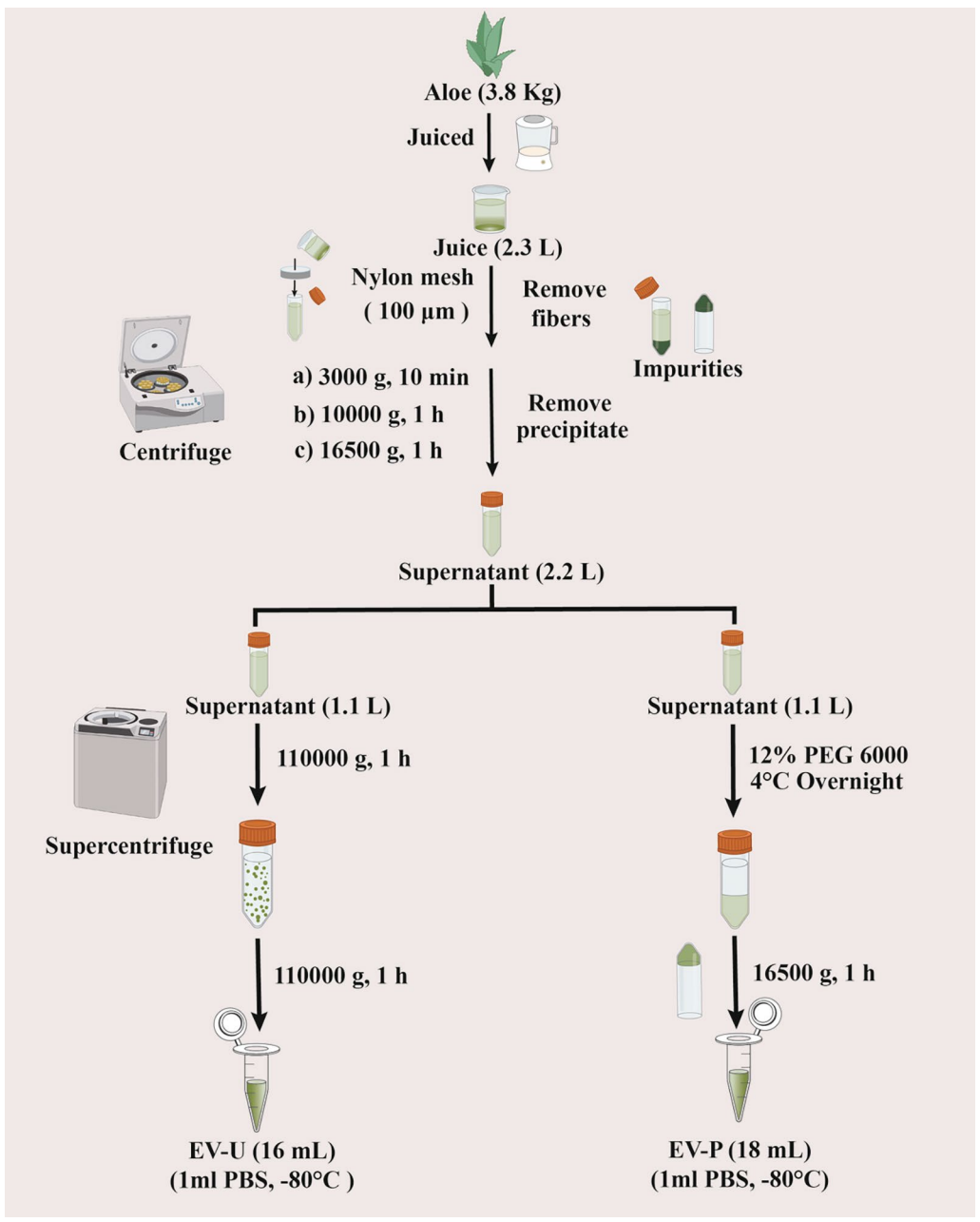
图:AV-EVLPs的分离及纯化流程示意图
研究结果
1. AV-EVLPs的物理化学特性对比
- 两种方法均获得了典型的“杯形”双层膜纳米颗粒,平均粒径分别为179.3 nm(EV-U)和227.1 nm(EV-P)。
- EV-U的颗粒大小更为均一,且杂质更少,蛋白含量高于EV-P。
- 脂质组学显示,EV-U富含磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、鞘磷脂(SM)等,EV-P则显示较多的胆固醇和磷脂酸,反映制备工艺的不同影响。
- 新鲜芦荟、EV-U和EV-P在化学成分谱上高度一致,证实纳米颗粒有效富集了芦荟活性成分。
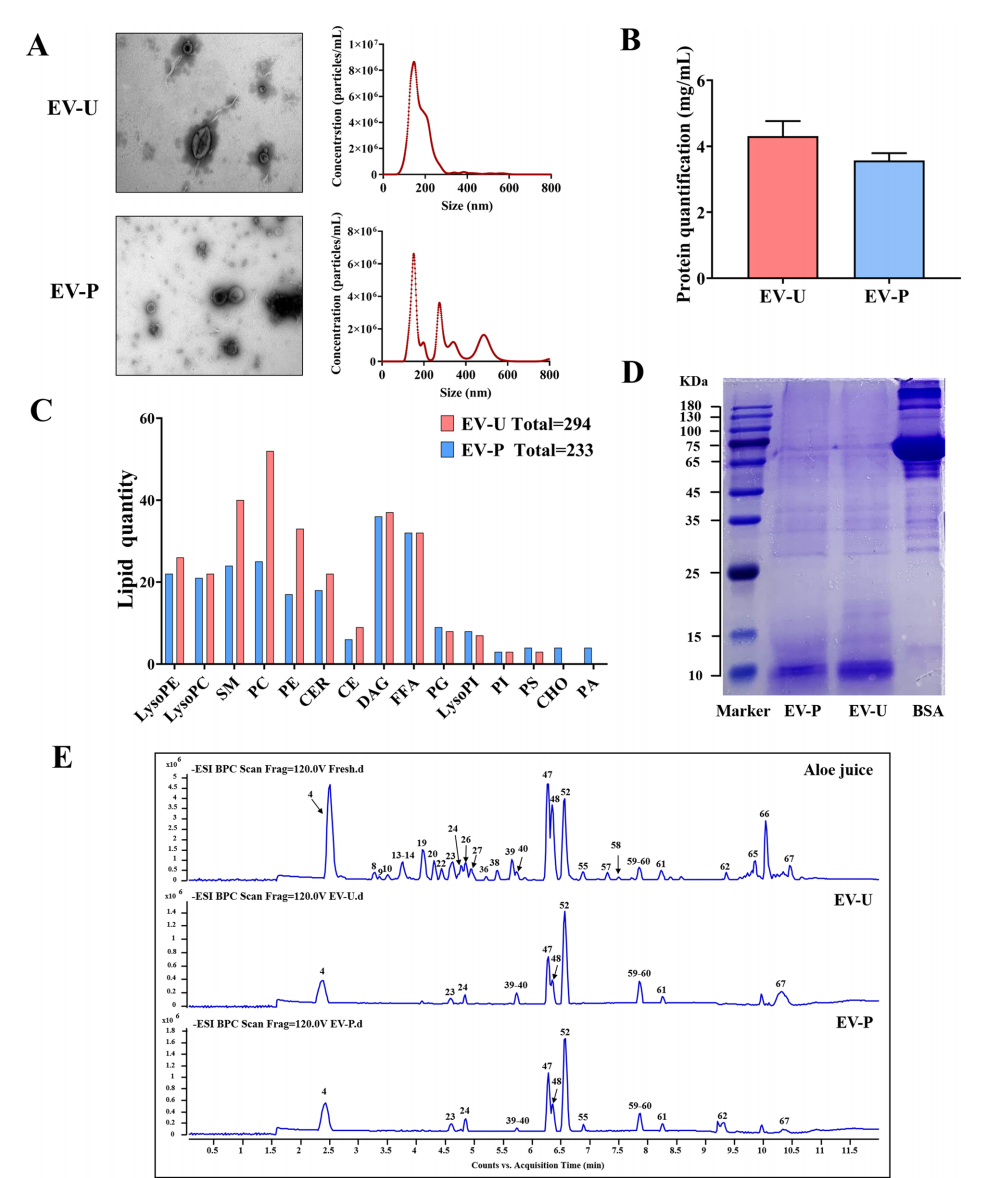
图:AV-EVLPs的形态学及成分分析
2. EV-U的更优细胞摄取和肿瘤抑制活性
- 细胞摄取实验显示,EV-U比EV-P在Panc-1细胞中的摄取效率更高,且呈时间依赖性增加。
- MTT实验证实,EV-U对Panc-1细胞的半数抑制浓度(IC50)约为296.4 μg/mL,优于EV-P的373.3 μg/mL,且对正常胰腺细胞无毒性。
- 伤口愈合和Transwell侵袭实验表明,两种颗粒均显著抑制癌细胞迁移与侵袭,EV-U抑制效果更显著。
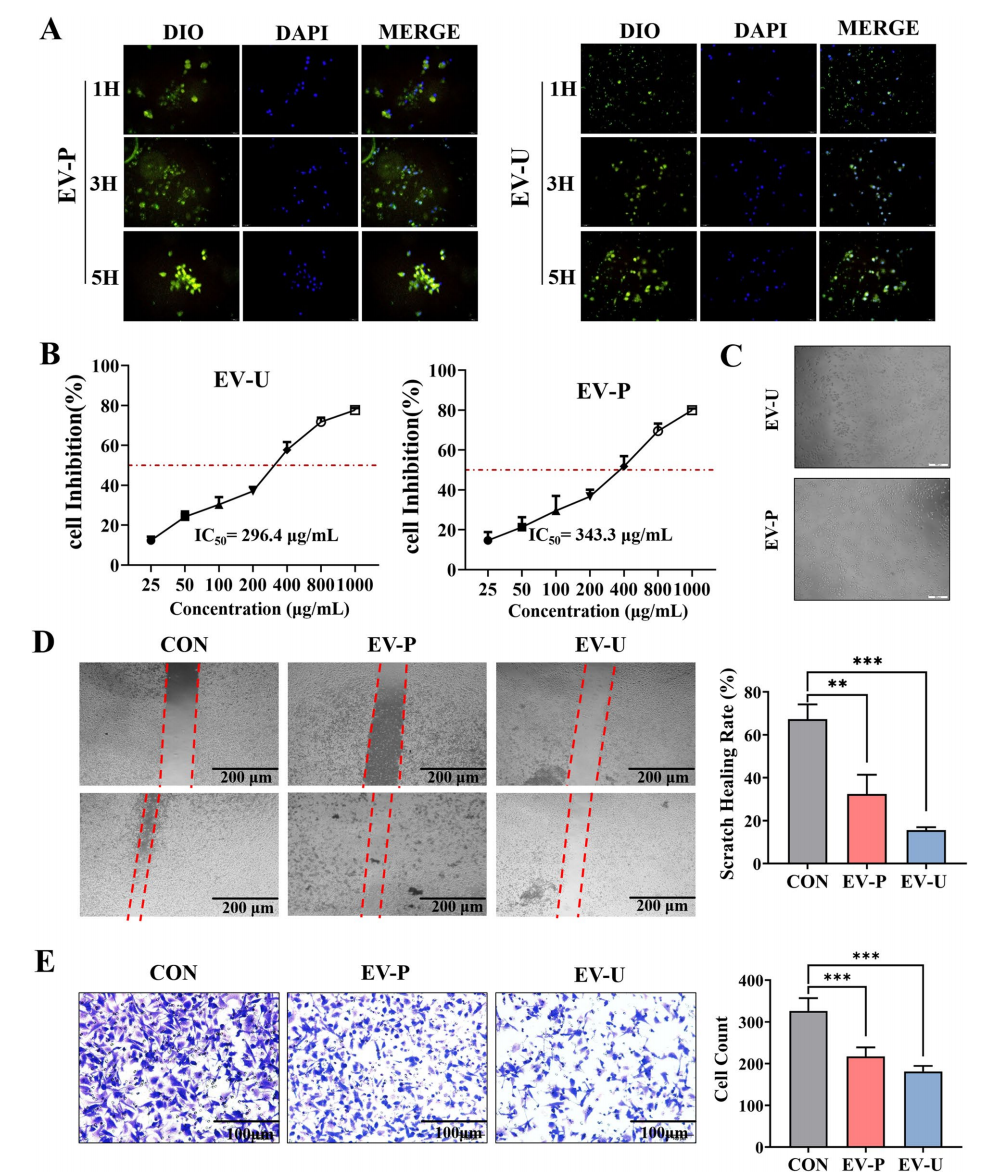
图:AV-EVLPs细胞摄取及对Panc-1细胞迁移和侵袭的抑制作用
3. EV-U诱导Panc-1细胞焦亡相关信号活化
- TUNEL染色显示EV-U处理组细胞DNA断裂显著增加,提示细胞焦亡。
- TEM下EV-U诱导的细胞出现细胞肿胀、膜破裂等典型焦亡形态。
- EV-U活化细胞内ROS水平增加,伴随细胞培养液中LDH、IL-18显著升高,而IL-1β水平下降,反映复杂的炎症调节。
- Western blot/qRT-PCR检测发现,EV-U显著上调焦亡通路关键蛋白包括caspase-1/3/7/9及Gasdermin D/E,表明通过经典和非经典焦亡途径共同发挥作用。
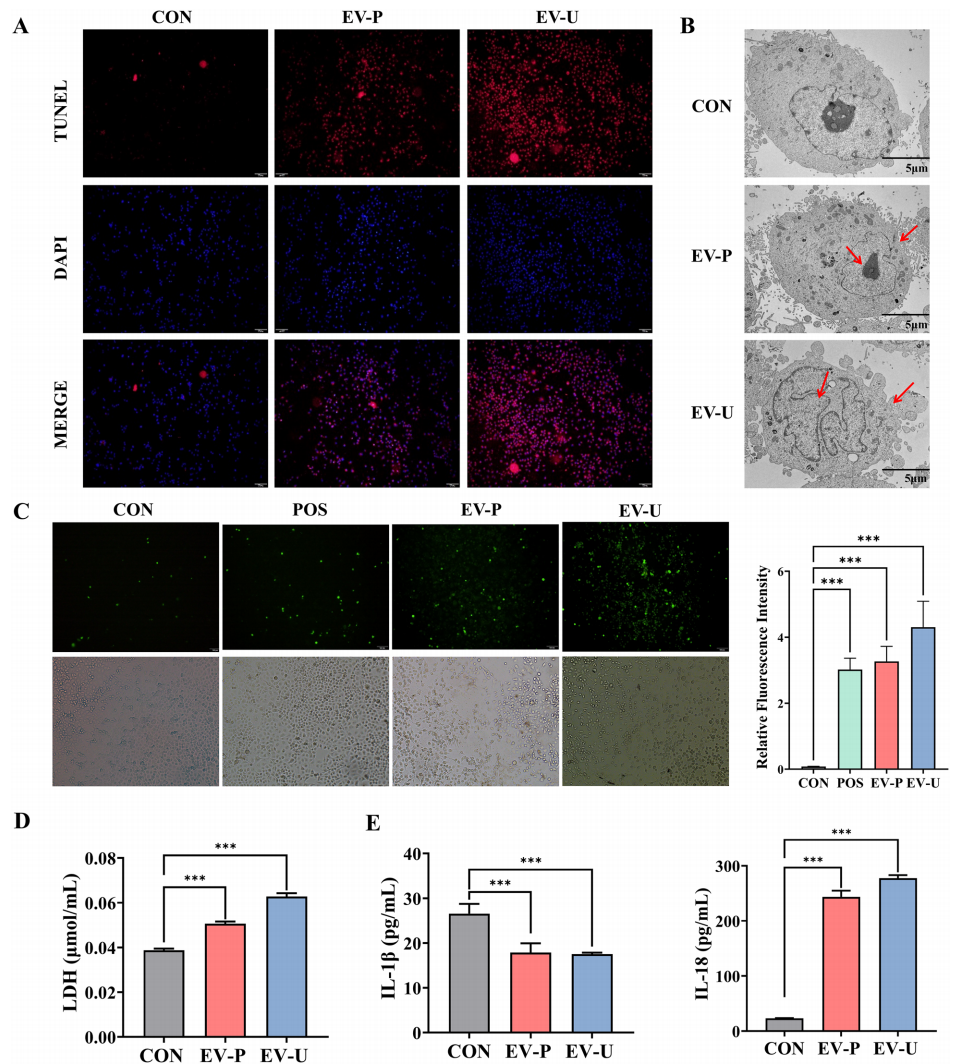
图:AV-EVLPs诱导Panc-1细胞焦亡的ROS及炎症因子变化
4. EV-U在体内抑制胰腺癌生长
- 在Panc-1异种移植小鼠模型中,EV-U以2 mg/kg和4 mg/kg剂量给药显著抑制肿瘤体积和重量,效果与化疗药顺铂相当,但体重保持稳定无毒性。
- 组织学分析显示EV-U组肿瘤组织结构破坏,核异型性减少,细胞凋亡增加(TUNEL染色增加、Ki-67阳性率下降)。
- 免疫组化显示肿瘤组织IL-18上调、IL-1β下调,符合细胞实验的规律,提示免疫微环境改善。
- 体内Western blot/qRT-PCR验证了caspase-1/3/7/9及Gasdermin D/E表达的增强,再次证实焦亡机制被激活。
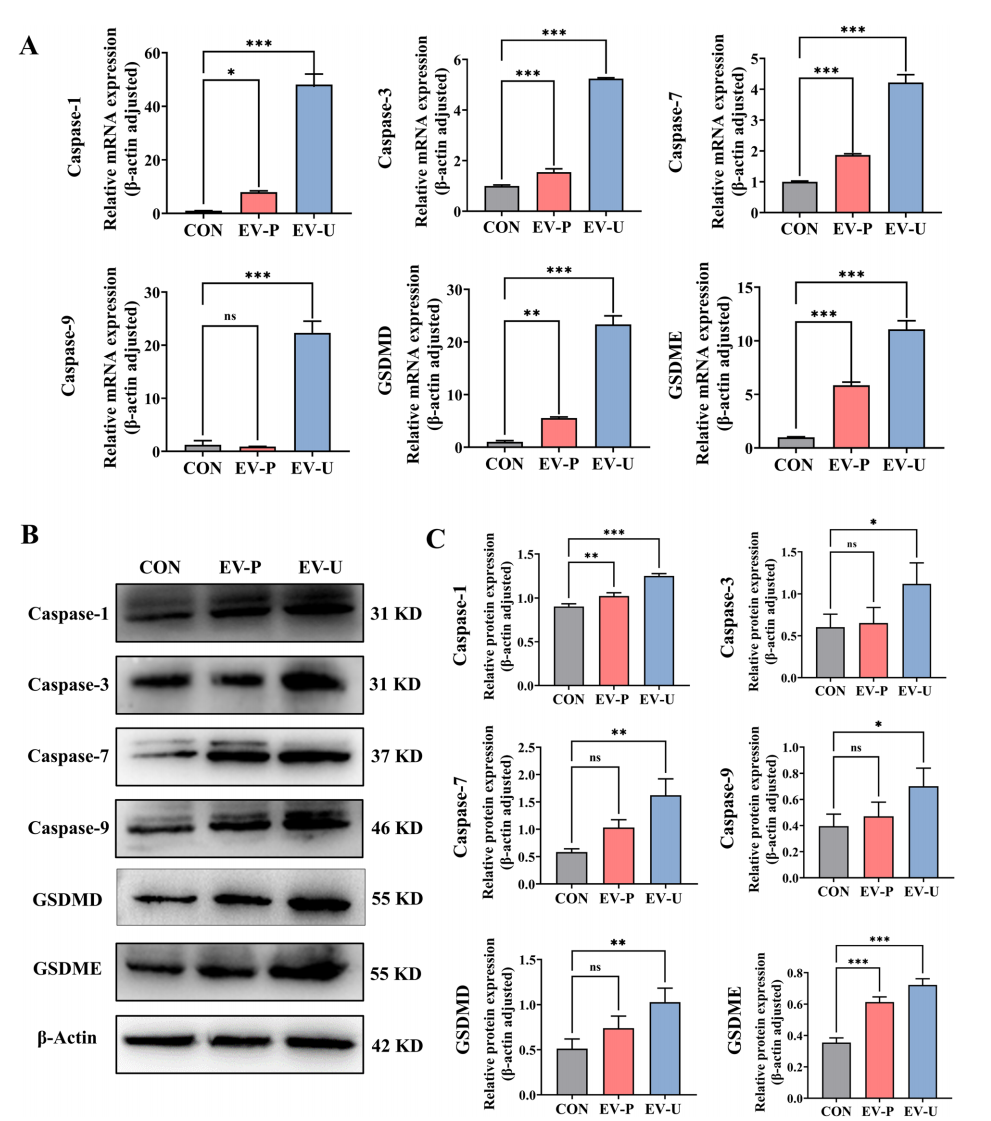
图:AV-EVLPs激活caspase-Gasdermin依赖性焦亡关键分子表达
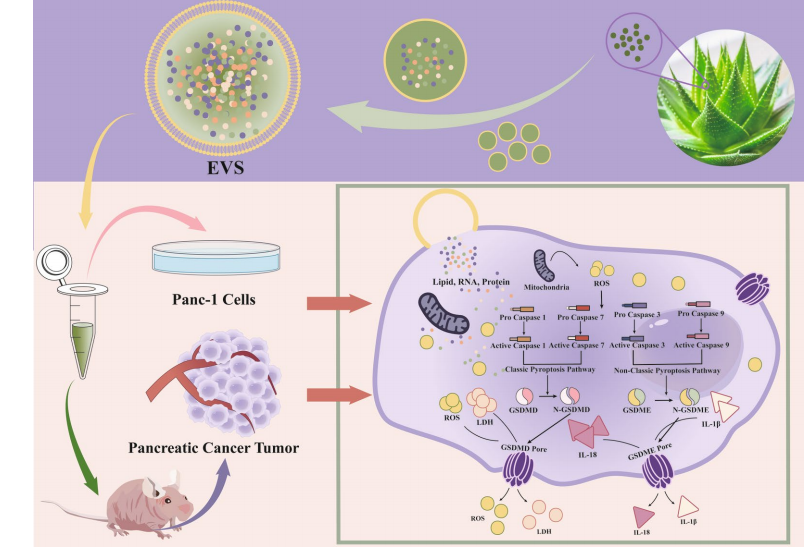
图:AV-EVLPs通过ROS介导的Gasdermin依赖性焦亡抑制胰腺癌进展
研究意义
本研究首次系统评估了芦荟源性植物外泌体样纳米颗粒(AV-EVLPs)在胰腺癌治疗中的抗肿瘤活性及其作用机制,揭示焦亡这一炎症性程序性细胞死亡方式在其中发挥关键作用。特别是结合超速离心法提高纳米颗粒的纯度和活性,有望推动芦荟相关植物纳米药物的标准化生产和临床转化。研究指出AV-EVLPs诱导巨噬细胞调控型细胞因子IL-18升高并抑制促炎因子IL-1β,有望通过重构胰腺癌免疫微环境,从“免疫冷”转变为“免疫热”,改善免疫治疗响应。此外,AV-EVLPs具有较好生物安全性和肿瘤靶向性,克服了传统化疗药物的溶解性差、系统毒性大等难题,展现了植物源纳米载体作为新型免疫调节及药物递送平台的广阔前景。该研究为胰腺癌精准治疗提供了创新思路,也为后续基于植物纳米颗粒的免疫治疗策略奠定了理论基础。
原始出处
Shen JY et al. Aloe vera-derived extracellular vesicle-like particles suppress pancreatic carcinoma progression through triggering pyroptosis via ROS-GSDMD/E signaling pathway. Chinese Medicine (2025) 20:101. https://doi.org/10.1186/s13020-025-01153-7)
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)