首页 > 医疗资讯/ 正文
特发性肺纤维化(IPF)是一种以进行性肺间质纤维化和呼吸功能衰竭为特征的疾病,平均诊断后生存期仅3-5年,临床异质性大且预后难以准确预测。遗传学研究已证明,少数罕见突变和众多常见遗传变异均参与IPF的易感与进展。端粒维护相关基因(如TERT、RTEL1等)的罕见致病变异与较差预后密切相关,而最著名的常见风险位点MUC5B启动子多态性(rs35705950)不仅增加IPF风险,且其风险等位基因延缓病程进展。尽管如此,罕见变异在IPF预后中的全面作用以及它们与多基因风险背景的交互尚未明确。此外,大多数现有研究重点关注端粒相关基因,缺乏对非端粒基因罕见变异及其临床意义的系统性评估。为此,本研究旨在整合端粒与非端粒相关肺纤维化单基因罕见变异,并联合PRS,探讨其与IPF患者临床结局的关联,为精准医疗提供遗传学基础。

2025年4月28日,《柳叶刀呼吸医学》(The Lancet Respiratory Medicine)在线发表了一篇多中心队列研究,系统分析了罕见致病变异及多基因风险评分(PRS)对特发性肺纤维化(IPF)患者存活的影响。本研究涵盖美国Pulmonary Fibrosis Foundation Patient Registry(PFFPR,888例)和英国PROFILE队列(472例),共1360名患者。研究首次全面考察了包括端粒相关及非端粒相关单基因肺纤维化基因中罕见变异对患者存活的影响,并结合PRS评价了常见风险位点对罕见变异携带者生存的修饰作用。结果揭示罕见变异携带者生存明显减弱,且伴随PRS降低,提示复杂的遗传交互机制。
研究方法
本研究在美国PFFPR和英国PROFILE两个独立队列中,利用全基因组测序技术筛查13个单基因肺纤维化相关基因中的罕见变异,分别归类为端粒相关和非端粒相关基因。通过严格的质量控制与遗传注释,识别出符合致病潜力的罕见变异(qualifying variants)。基于19个已知IPF关联的常见风控位点构建了多基因风险评分(PRS-IPF),并评估其在携带罕见变异患者中的修饰效应。利用多变量逻辑回归和Cox比例风险模型,调整性别、年龄、主成分等混杂因素,分析罕见变异与PRS对患者生存的独立及交互影响。结果在PROFILE队列中进行验证,最终通过meta分析整合数据。
研究结果详述
1. 研究人群概况及变异分布
- PFFPR队列共纳入888例IPF患者,其中16.2% (144例) 携带至少一个单基因肺纤维化相关基因的罕见致病变异。
- PROFILE队列纳入472例IPF患者,以验证发现。
- 13个研究基因包括8个端粒相关基因(TERT、TERC、RTEL1、PARN、TINF2等)及5个非端粒相关基因(SFTPC、SPDL1、KIF15等)。
- 变异分类涵盖病理性(P,LP)和不确定性(VUS)变异。
主要变异统计汇总
2. 罕见变异携带者与多基因风险评分(PRS)关联
- 罕见变异携带者的PRS-IPF显著低于非携带者,提示低PRS可能预示罕见致病变异的存在(p=0.01)。
- 研究将PRS分为三分位数,最低PRS分位携带者罕见变异的风险增加(OR 1.79,95%CI 1.15–2.81)。
- 排除MUC5B位点后,PRS差异及关联弱化,表明MUC5B对PRS整体贡献显著。
- 未观察到罕见变异与基于白细胞端粒长度相关位点的PRS-TL显著关联。
图:PFFPR队列中罕见变异携带者与非携带者的PRS-IPF分布比较
3. 罕见变异对患者生存的影响
- 罕见变异携带者生存显著低于非携带者(HR 1.53,95% CI 1.12-2.10,p=0.0073)。
- 病理性变异(P或LP)携带者生存风险更高(HR 1.71,p=0.016)。
- 端粒相关变异携带者表现出明显更差的生存(HR 1.49),其中PARN基因变异与生存关系最强(HR 2.28,p=0.025)。
- 非端粒基因变异对生存的影响趋势存在,但统计学意义未达标。
- 罕见的同义突变未对生存产生显著影响,控制了假阳性可能。
- 家族史及测序估算的端粒长度未能有效预测生存。
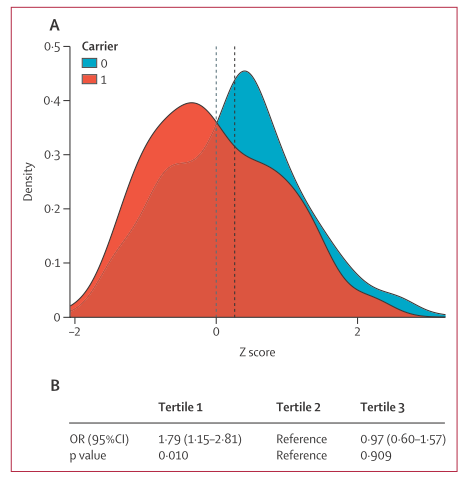
图:PFFPR队列中不同变异类型患者的Kaplan–Meier生存曲线
4. 多基因风险评分(PRS-IPF)与生存
- PRS最低分组患者生存显著差(HR 1.61,p=1.87×10^-4),支持低普通遗传风险但携带罕见致病变异的患者具有更差预后。
- PRS排除MUC5B位点后,生存相关性不显著,强调MUC5B变异对整体PRS的主导作用。
- 当按罕见变异携带状态分层,低PRS均对应较差生存,但罕见变异携带者该关联略微减弱。
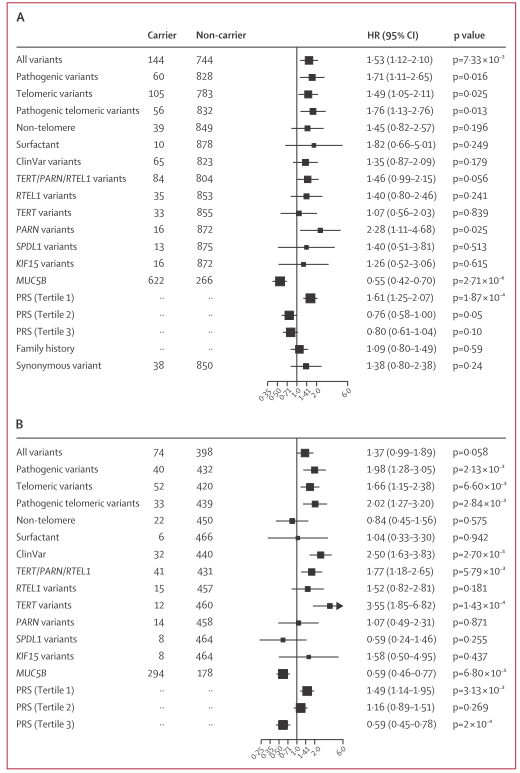
图:PFFPR队列患者按PRS三分位组的生存比较
5. 结果验证与综合分析
- PROFILE队列验证了罕见变异(主要为端粒相关)对生存的负面影响。
- 两队列的_Meta_分析结果一致,增强了发现的稳健性和普适性。
- 不同生存终点定义及治疗状态调整后,主要结论依然成立,表明结果具备较好泛化能力。
研究价值与意义
本研究首次从大样本多中心队列角度全方位整合分析了特发性肺纤维化患者单基因罕见致病变异,涵盖端粒及非端粒相关基因,并结合全局多基因风险评分探讨其对患者生存结局的影响。结果不仅明确了罕见变异携带者的生存预后显著更差,而且揭示罕见变异与常见变异在遗传风险层面呈非加性作用,提示IPF存在遗传异质性和潜在的临床亚型。换言之,部分患者的疾病驱动主要依赖罕见高穿透变异,而另一些则偏向普遍的多基因常见变异背景。此研究成果有助于推动IPF的精准分层管理,指导遗传检测策略的优化,未来有望在临床上利用PRS筛选优先进行基因测序,辅助治疗决策及预后评估。
此外,非端粒相关基因变异对生存的潜在贡献提示IPF病理机制的进一步复杂性,需在今后的遗传学与功能研究中持续关注。研究还指出,目前端粒长度的测序估计法在IPF预后中的局限,强调了临床监测和遗传信息综合利用的重要性。
综上,这项研究为理解IPF的遗传基础、改进遗传筛查和生存预测模型提供了重要科学依据,符合临床精准医学发展趋势,具有重要临床转化潜力和启示。
梅斯小编点评
本研究以大规模全基因组测序和严谨统计方法,首次系统揭示了IPF患者体内罕见单基因致病变异携带状态与多基因风险评分之间的复杂关系,填补了遗传学对IPF临床异质性理解的重大空白。尤其是通过两大多中心队列验证,体现了结果的可信度与推广价值。未来值得重点关注如下几个方向:
- 扩展对非端粒基因的系统筛查及其生物学功能解析,探索更多潜在的预后影响因子。
- 结合临床药物反应、生物标志物特征,构建多维度综合预测模型,提升IPF个体化管理水平。
- 开发非欧洲人群的多基因风险评分模型,解决遗传学研究的种族代表性不足问题。
- 探索如何将PRS应用于临床决策,明确其指导遗传检测和治疗的具体策略和效果。
这一研究路径不仅能够丰富IPF遗传学知识体系,更有助于精准干预、优化患者预后,值得临床与科研界广泛关注。
原始出处
Alonso-González A, Jáspez D, Lorenzo-Salazar JM, et al. Rare variants and survival of patients with idiopathic pulmonary fibrosis: analysis of a multicentre, observational cohort study with independent validation. Lancet Respir Med. 2025;13(6):495–504. https://doi.org/10.1016/S2213-2600(25)00045-1
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)