首页 > 医疗资讯/ 正文
摘 要
目的 基于一项针对重复氯胺酮注射治疗难治性抑郁障碍(treatment-resistant depression,TRD)的临床队列研究,检测患者脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)甲基化在不同疗效反应中的差异,以探索其在疗效预测中的潜在作用。
方法 回顾性分析83例TRD患者在接受为期2周、共6次氯胺酮注射治疗前后的外周血浆BDNF水平,用蒙哥马利-艾森贝格抑郁评定量表(Montgomery-Asberg depression rating scale,MADRS)评价疗效,比较治疗有效组与无效组之间的BDNF甲基化水平,通过双荧光素酶报告基因系统验证目标CpG位点的甲基化对转录活性的影响。
结果TRD患者在完成6次重复氯胺酮输注后,治疗有效组与治疗前的基线水平相比,MADRS评分[(25.20±7.54)分vs.(8.10±5.32)分]和血浆BDNF浓度[8.74(5.26,13.46)ng/mL vs. 16.59(7.41,24.46)ng/mL]均显著改善(P<0.01)。基线水平时,BDNF上有35个CpG位点甲基化程度在不同疗效组之间的差异有统计学意义(P<0.05)。全部患者中,有2个位于BDNF启动子区域的CpG位点(rs1240718851和cg06260077)呈现出高甲基化低表达的关系,其中一个CpG位点经双荧光素酶实验验证其可能影响BDNF的表达。
结论 TRD患者血浆BDNF浓度随着抑郁症状的缓解而上升,BDNF甲基化对基因表达的调控可预测重复静脉注射氯胺酮抗抑郁疗效。
关键词
重性抑郁障碍;难治性抑郁;氯胺酮;抗抑郁治疗;治疗效果;脑源性神经营养因子;DNA甲基化;表观遗传学
即使接受规范的药物治疗和心理治疗,仍有约1/3的重性抑郁障碍(major depressive disorder, MDD)患者未能达到预期疗效[1]。难治性抑郁障碍(treatment-resistant depression,TRD)目前在国际上没有统一的定义,一般是指患者经过足量足疗程的两类或两类以上不同机制抗抑郁药治疗后,其17项汉密尔顿抑郁量表(Hamilton depression scale,HAMD-17)减分率仍<20%[2-4]。氯胺酮作为一种具有快速、持久抗抑郁效果的新型药物,有着显著的临床应用潜力[5-7]。然而,其对部分类型的抑郁障碍患者疗效有限,并且患者注射氯胺酮后可能产生解离效应,以及记忆和认知功能障碍等不良反应[8-9]。寻找能够预测氯胺酮治疗反应的生物标志物,有助于指导临床精准用药,从而减轻患者疾病负担与经济负担[10]。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是中枢神经系统中调节神经突生长、功能性神经元连接、突触形成和突触可塑性的生长因子,全身或海马内给予BDNF都能发挥抗抑郁样作用[11]。基因甲基化则可以通过影响BDNF的表达,使大脑功能失衡,从而引发抑郁症状,这与MDD的发病机制相关[12]。本研究基于一项针对重复氯胺酮注射治疗TRD患者的临床队列研究,检测并分析BDNF基因甲基化水平和表达量,探讨患者治疗前的基线BDNF基因甲基化水平对重复静脉注射氯胺酮抗抑郁疗效的预测作用。
1 对象与方法
1.1 研究对象 本研究为回顾性研究,数据来自“针对不同抗抑郁药物的精准医疗靶点的发现及作用机制研究”项目。患者来自广州医科大学附属脑科医院,入组时间为2016年7月至2020年12月。入组标准:①男性或女性,年龄18~65岁;②符合《精神障碍诊断与统计手册第5版》(Diagnostic and Statistical Manual of Mental Disorders, 5th Edition, DSM-5)重性抑郁障碍的诊断标准;③HAMD-17总分≥17分;④符合TRD,即既往对两种及以上的抗抑郁药物足剂量、足疗程治疗后无效[足剂量是指最大推荐剂量的2/3以上(丙咪嗪剂量150~200 mg/d);足疗程是指充足量治疗4周以上,慢性抑郁障碍患者治疗8周以上;无效是指治疗后HAMD-17减分率<20%,或伴有自杀倾向,贝克自杀意念评估量表第一部分(scale for suicide ideation,SSI-5)的第4或第5项评估为“弱”或“中等到强烈”];⑤具有沟通和提供书面同意的能力。排除标准:①现有或者既往有药物滥用或药物依赖;②患有符合DSM-5诊断标准的其他重性精神障碍,包括器质性精神障碍、精神分裂症等,但允许患者合并焦虑障碍或强迫障碍;③毒理学筛查阳性;④存在临床不稳定的内科疾病,如充血性心力衰竭;⑤存在明确诊断的神经系统疾病,如阿尔茨海默病等;⑥无法配合临床研究程序。共有83例TRD患者纳入本研究。
本研究由医院伦理委员会批准,并在中国临床实验注册中心注册(注册编号:ChiCTR-OOC-17012239)。入组前由临床医师充分告知患者参与该项目的获益与风险,取得患者的完全同意且签署知情同意书。
1.2 研究方法
1.2.1 重复氯胺酮治疗与临床症状评估 所有患者接受每周3次的氯胺酮(0.5 mg/kg,持续40 min)治疗方案,为期2周,并进行2周的随访。输注前一晚禁食,从输注治疗前10 min开始,每10 min记录一次生命体征,包括血压、体温、心率和呼吸频率,持续1 h。所有患者要求在研究前4周和研究期间保持氟西汀抗抑郁治疗剂量一致。
临床精神科医生分别在治疗前(基线)、每次输注后24 h以及第6次输注后14 d(第26天)采集患者静脉血,并采用蒙哥马利-艾森贝格抑郁评定量表(Montgomery-Asberg depression rating scale,MADRS)评估抑郁障碍症状。当患者在第6次输注后24 h(第13天)MADRS评分较基线时降低50%或以上时,定义为治疗有效(respond)[13]。据此,将患者分为有效组与无效组。
1.2.2 BDNF甲基化和表达量的量化 如本课题组先前研究所述[14],使用酶联免疫吸附试验(ELISA)试剂盒(EMD Millipore Corporation, MA, USA)检测基线、第13天和第26天时血浆BDNF浓度[14]。收集基线时患者白细胞,提取DNA和RNA,分别进行全基因组DNA甲基化分析和RNA测序。所有实验至少重复3次。
采用基于Limma统计软件包(v3.41.17)经验贝叶斯方法的稳健回归模型,分析BDNF CpG位点的差异甲基化,以获取其甲基化变化。为控制多重检验误差,采用Benjamini-Hochberg方法对P值进行校正,将错误发现率(false discovery rate,FDR)q<0.05的位点判定为具有统计学意义[15]。
在RNA测序数据分析中,首先使用STAR软件(v2.5.2b)将测序数据比对至hg38人类参考基因组。然后,基于HTSeq软件interp_nonempty的表达量计数模式计算基因表达量,仅保留唯一比对读数用于后续分析。读数被注释至19965个蛋白质编码基因(GENCODE v32)。最后,应用DESeq2软件进行差异表达分析,以评估BDNF表达变化[16]。
1.2.3 双荧光素酶报告基因检测 在有效组和无效组间甲基化水平差异有统计学意义的CpG位点中,分析甲基化与表达量有相关关系的位点,结合有效组的BDNF表达量,进一步筛选出符合高甲基化低表达特点的位点,研究其甲基化是否参与调控BDNF表达。在UCSC Genome Browser网站上获取位点上下游约1000 bp的基因序列,设计引物,并通过聚合酶链反应扩增获取目的基因片段。目的基因片段位于BDNF启动子区,将目的基因插入双荧光素酶报告载体pGL4.18相应区域,构建野生型(wild type,WT)双荧光素酶报告载体,通过点突变(C碱基突变为T碱基)可分别获得2个CpG岛甲基化破坏后的不同突变体(mutant,Mut)。将WT和Mut分别转染到两种人源细胞系(HEK-293T和SK-N-SH),使用双荧光素酶报告基因检测系统试剂盒(Promega, USA)对目的基因载体的荧光量进行检测对比,验证CpG岛甲基化对基因表达的调控作用。所有实验至少重复3次。
1.3 统计学方法 使用GraphPad Prism(9.0,GraphPad Software公司)进行统计分析。基线人口统计学和临床特征、基因表达量、甲基化水平符合正态分布,有效组和无效组间比较采用独立样本t检验;血浆BDNF浓度不符合正态分布,组内比较采用配对样本 Wilcoxon检验;性别等分类变量组间比较使用χ2检验。使用简单线性回归分析所有患者CpG位点的甲基化水平与BDNF mRNA水平的相关性。检验水准α=0.05,双侧检验。
2 结果
2.1 临床特征 本研究纳入83例TRD患者,第6次氯胺酮治疗后,TRD治疗有效率为65.9%(43/83)。将患者分为有效组43例、无效组40例,治疗前,两组间基线人口学和临床变量之间的差异没有统计学意义(P>0.05)。见表1。
Tab.1 Demographic and clinical characteristic of study before treatment表1 患者治疗前的人口学与临床特征
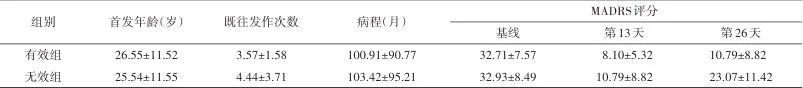
注:BMI,体质指数;MADRS,蒙哥马利-艾森贝格抑郁评定量表。
有效组MADRS评分在第13天时为(8.10±5.32)分,第26天时为(10.79±8.82)分,与基线相比发生较为明显改善(P<0.001)。见图1。
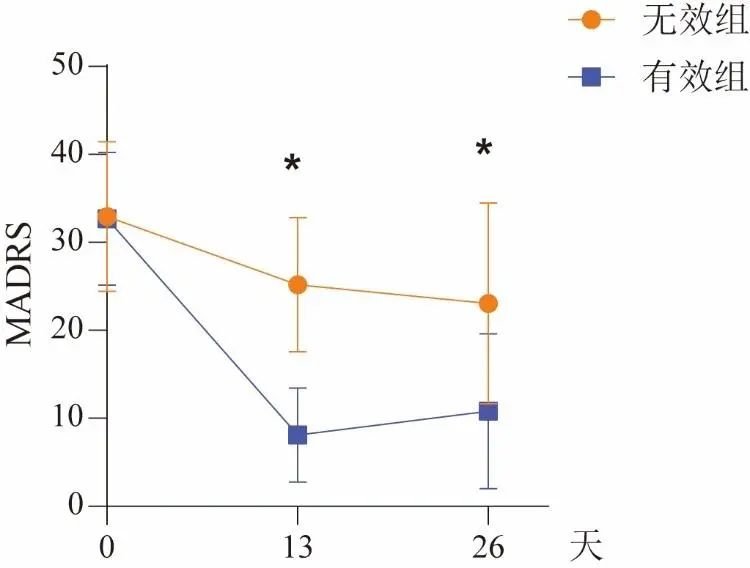
Fig.1 MADRS scores of TRD patients before and after ketamine treatment图1 TRD患者进行氯胺酮治疗前后MADRS评分
2.2 不同疗效患者BDNF水平比较 有效组治疗后血浆BDNF浓度较基线时有所升高(Z=-2.743,P=0.006)。有效组在基线时BDNF的RNA表达量较无效组低(t=1.998,P=0.049)。见表2。
Tab.2 Comparison of BDNF levels between different therapeutic efficacy groups表2 不同疗效组BDNF水平比较

1)与基线比较,经配对样本Wilcoxon检验,P<0.05;2)与无效组比较,经独立样本t检验,P<0.05。
2.3 DNA甲基化参与抗抑郁治疗和BDNF表达 共鉴定出35个CpG位点的基线甲基化程度在有效组和无效组间差异有统计学意义(P<0.05),见表3。简单线性回归分析显示,CpG3(B=-0.014,P=0.032)、CpG19(B=-0.018,P=0.031)、CpG35(B=-0.022,P=0.008)3个CpG位点的甲基化水平与BDNF mRNA水平呈负相关。其中,CpG19(cg06260077)和CpG35(rs1240718851)在有效组中相对于无效组甲基化程度更高(P<0.05),符合高甲基化与低表达量的特点。见图2。
Tab.3 Methylation of CpG sites between responders and non-responders at pretreatment baseline表3 有效组和无效组之间基线时CpG位点的甲基化比较
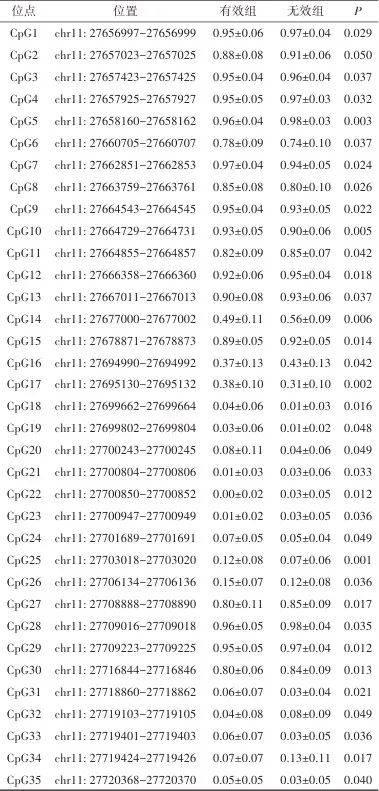
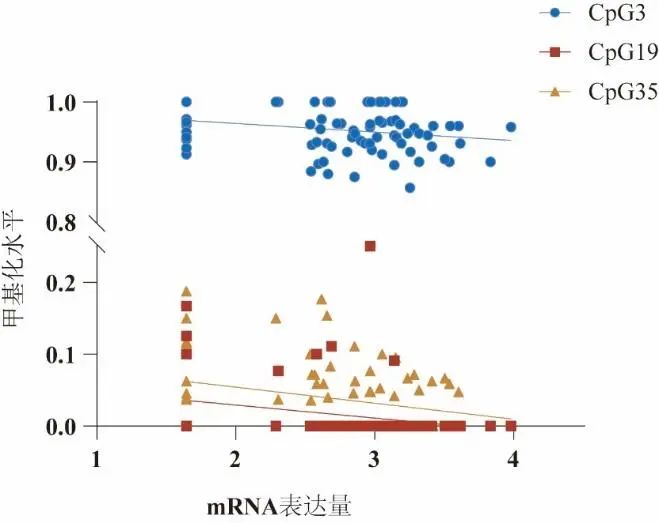
Fig.2 Association of DNA methylation and BDNF expression图2 DNA甲基化与BDNF表达量的关系
为验证位于BDNF启动子区域的CpG19(cg06260077)和CpG35(rs1240718851)2个CpG位点对BDNF表达的影响,分别生成1个由含有CpG19或CpG35的近端BDNF启动子驱动的荧光素酶报告基因。从人类基因组DNA中扩增出BDNF中CpG19(Chr11:27699802-27699804)上游95 bp至下游507 bp,或CpG35(Chr11:27720368-27720370)上游185 bp至下游297 bp的启动子区域,并将其克隆到pGL4.18荧光素酶报告载体中,见表4。与对照载体相比,含有CpG19的DNA片段表现出启动子抑制活性,在HEK-293T细胞中将CpG突变为TpG以破坏甲基化位点后,其仍表现出相似的抑制活性。而含有CpG35的DNA片段与对照载体相比,则表现出增强的启动子活性,在HEK-293T和SK-N-SH细胞中,将CpG突变为GpG后,均观察到启动子活性增强。见图3。
Tab.4 Primers used in this study表4 研究中使用的引物
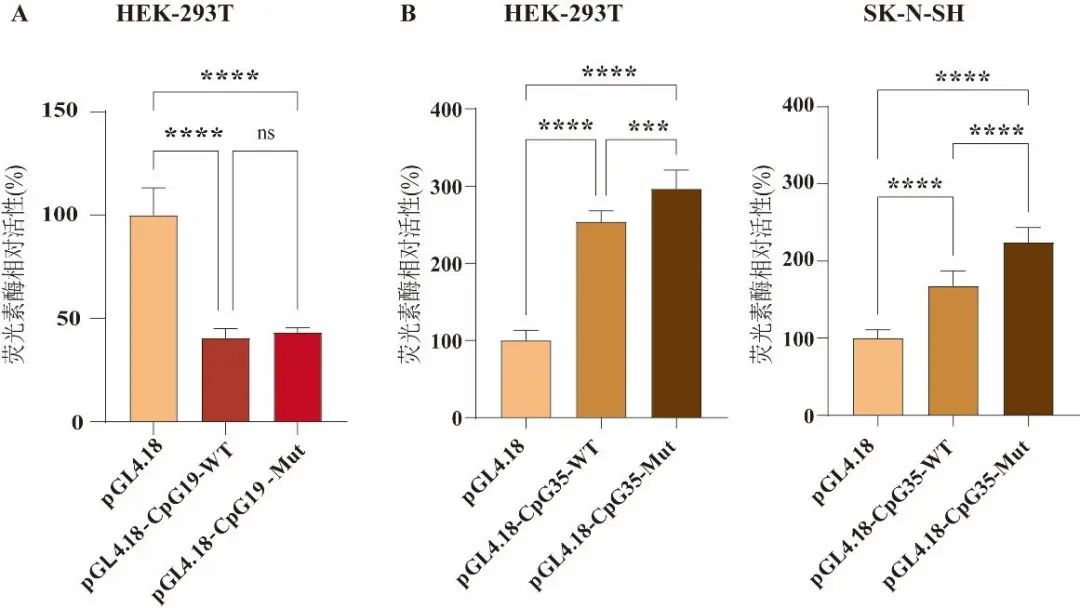
Fig.3 Regulatory effect of CpG19 and CpG35 on the BDNF promoter activity in luciferase reporter transfected HEK-293T and SK-N-SH cells图3 CpG19和CpG35位点对转染荧光素酶报告基因的HEK-293T和SK-N-SH细胞中BDNF启动子活性的调控作用 ns,组间比较差异无统计学意义(P>0.05);***,组间比较,经独立样本t检验,P<0.05;****,组间比较,经独立样本t检验,P<0.01。
3 讨论
与以往氯胺酮输注治疗的研究结果一致,本研究表明氯胺酮重复输注治疗后,治疗有效者血浆BDNF浓度显著增加。如HAILE等[17]发现,与无效者相比,在1次氯胺酮输注后,有效者血浆BDNF浓度显著增加。有研究表明,抗抑郁药,包括氟西汀等传统抗抑郁药和氯胺酮,可直接结合酪氨酸激酶B变构增强BDNF信号转导[18]。同时,BDNF参与突触可塑性的调节,包括α-氨基-3-羟基-5-甲基-4-异噁唑受体(α-amino-3-hydroxy-5-methyl-4-isox-azolepropionic acid receptor,AMPAR)的突触募集。因此,研究认为氯胺酮的抗抑郁作用可能是由于AMPAR与N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)等谷氨酸受体增加介导的神经元回路突触增强,导致抑郁症个体突触可塑性改变[19-22]。BDNF具有保护神经、增强突触可塑性、促进神经修复等功能,参与情绪调节,全身或海马内给予BDNF都能发挥抗抑郁样作用[11,23-24]。由此可见,BDNF在氯胺酮治疗抑郁症中可能具有不可或缺的作用。
抑郁障碍的特点是遗传和环境因素之间相互作用。DNA甲基化作为较早发现的基因表观修饰方式[25],常发生在基因启动子区的CpG岛(正常情况下一般处于非甲基化或低甲基化的活跃状态),在DNA甲基转移酶(DNA methyltransferase,DNMT)作用下与甲基结合形成5-甲基胞嘧啶,募集抑制因子,使某些转录因子不与高甲基化的CpG DNA序列结合,影响转录水平[26-27]。有研究对BDNF甲基化与疗效关系进行探索,例如KANG等[28]对108例MDD患者开展为期12周的抗抑郁药物治疗随访发现,治疗前BDNF启动子低甲基化的患者在治疗后自杀风险显著降低。以疗效为分组,本研究对TRD患者治疗前的BDNF甲基化位点进行差异分析,观察到有35个CpG位点在不同疗效反应中甲基化水平有差异。rs1240718851和cg06260077这2个CpG位点的甲基化水平与BDNF表达呈负相关,在有效组中表现为超甲基化。CpG位点rs1240718851的破坏增加了HEK-293T和SK-N-SH细胞中BDNF启动子的活性。这表明rs1240718851位点的甲基化水平可能作为TRD对抗抑郁药物疗效反应的潜在预测因子,未来需要通过大规模遗传研究进一步验证。
研究表明BDNF启动子区域的甲基化是抗抑郁治疗的潜在生物标志物[29-31],但并不是所有甲基化位点都能影响基因的转录翻译,因此本研究对rs1240718851和cg06260077这2个CpG位点进行功能研究,发现Chr11:27720368的甲基化水平(同时也为SNP位点rs1240718851)不仅与患者疗效预测相关,还参与影响BDNF的转录表达,是重复静脉注射氯胺酮后抗抑郁反应的潜在预测因子。可见,当患者使用氯胺酮治疗时,表观遗传因素可能影响BDNF的转录和翻译,干扰药物对下游通路的抑制或激活,影响治疗效果。既往研究通过分析39例MDD患者BDNF外显子Ⅳ中的12个CpG位点,发现CpG87去甲基化的患者在抗抑郁药物治疗的第1周内血浆BDNF水平显著下降[32],提示抗抑郁治疗后BDNF启动子甲基化增加与抑郁症状的缓解相关[32-34],而BDNF启动子低甲基化者对抗抑郁治疗不敏感。相反,抑郁障碍的神经营养假说认为,抑郁障碍的发生可能与BDNF高甲基化所导致的BDNF表达减少有关。如KIM等[34]研究发现,抑郁障碍患者在接受艾司西酞普兰的抗抑郁治疗后BDNF甲基化水平下降,该研究提出假说:抗抑郁药物可能需要BDNF甲基化来提供药物的作用结合位点,因而对BDNF高甲基化水平的患者更为有效。这一观点也为本研究所观察到氯胺酮治疗有效组患者治疗前的甲基化水平较高,且治疗后患者血浆BDNF水平显著增加的现象提供了合理的假说支持。
综上,血浆BDNF浓度和BDNF甲基化水平可能作为TRD患者重复静脉注射氯胺酮后抗抑郁疗效的潜在预测因素。本研究也存在局限性:目前的研究无法检测脑组织中DNA甲基化情况,只能通过外周血单核细胞DNA来测定甲基化;在研究期间,没有洗脱患者先前使用的药物,可能会影响血浆BDNF浓度[35-36]。后续研究需充分考虑多重混杂因素,并需要进行多中心、大样本量的纵向队列研究来支持本研究结论。
参考文献:
1. MCINTYRE R S, ALSUWAIDAN M, BAUNE B T, et al. Treatment-resistant depression: Definition, prevalence, detection, management, and investigational interventions[J]. World Psychiatry, 2023, 22(3): 394-412.
2. SMITH-APELDOORN S Y, VERAART J K, SPIJKER J , et al. Maintenance ketamine treatment for depression: A systematic review of efficacy, safety, and tolerability[J]. Lancet Psychiatry, 2022, 9(11): 907-921.
3. 吕鑫, 叶匡浩, 王宇涵, 等. 脑深部电刺激治疗难治性抑郁障碍临床疗效及机制研究进展[J]. 中国神经精神疾病杂志,2023, 49(11): 675-681.
4. WALASZEK M, CUBAŁA W J, KACHLIK Z, et al. Non-response to short-term ketamine use for treatment-resistant depression[J/OL]. Pharmacol Rep (2025-04-25) [2025-04-27]. doi: 10.1007/s43440-025-00730-9.
5. BERMAN R M, CAPPIELLO A, ANAND A, et al. Antidepressant effects of ketamine in depressed patients[J]. Biol Psychiatry, 2000, 47(4): 351-354.
6. JrZARATE C A, SINGH J B, CARLSON P J, et al. A randomized trial of an N-methyl-D-aspartate antagonist in treatment-resistant major depression[J]. Arch Gen Psychiatry, 2006, 63(8): 856-864.
7. LEPACK A E, FUCHIKAMI M, DWYER J M, et al. BDNF release is required for the behavioral actions of ketamine[J]. Int J Neuropsychopharmacol, 2014, 18(1): pyu033.
8. KRYSTAL J H, ABDALLAH C G, SANACORA G, et al. Ketamine: A paradigm shift for depression research and treatment[J]. Neuron, 2019, 101(5): 774-778.
9. 张敏玲, 麦思茗, 何红波, 等. 氯胺酮依赖患者抑郁症状的因子结构维度分析[J]. 中国药物滥用防治杂志, 2024, 30(10): 1785-1789.
10. CHEN M, JIN J, BI H, et al. Advances in the study of NMDA receptors in depression pathogenesis and the antidepressant efficacy of their antagonists[J]. Asian J Psychiatr, 2025, 108: 104502.
11. CASTRÉN E, KOJIMA M. Brain-derived neurotrophic factor in mood disorders and antidepressant treatments[J]. Neurobiol Dis, 2017, 97(Pt B): 119-126.
12. FUCHIKAMI M, MORINOBU S, SEGAWA M, et al. DNA methylation profiles of the brain-derived neurotrophic factor (BDNF) gene as a potent diagnostic biomarker in major depression[J]. PloS One, 2011, 6(8): e23881.
13. SOBSTYL M, PROKOPIENKO M, PIETRAS T. The ventral capsule and ventral striatum-stereotactic targets for the management of treatment-resistant depression. A systematic literature review[J]. Front Psychiatry, 2023, 14: 1100609.
14. ZHENG W, ZHOU Y L, WANG C Y, et al. Plasma BDNF concentrations and the antidepressant effects of six ketamine infusions in unipolar and bipolar depression[J]. PeerJ, 2021, 9: e10989.
15. DONG Z, ZHAO K, GU H, et al. Profiling of circulating cell-free DNA methylation patterns identifies aberrant methylated CTBP1 promotor sites for prediction of Alzheimer's disease[J]. J Integr Neurosci, 2025, 24(4): 36527.
16. BELAKHOUA S, VASUDEVARAJA V, SCHROFF C, et al. DNA methylation profiling of pituitary neuroendocrine tumors identifies distinct clinical and pathological subtypes based on epigenetic differentiation[J/OL]. Neuro Oncol, 2025: noaf109.
17. HAILE C N, MURROUGH J W, IOSIFESCU D V, et al. Plasma brain derived neurotrophic factor (BDNF) and response to ketamine in treatment-resistant depression[J]. Int J Neuropsychopharmacol, 2014, 17(2): 331-336.
18. CASAROTTO P C, GIRYCH M, FRED S M, et al. Antidepressant drugs act by directly binding to TRKB neurotrophin receptors[J]. Cell, 2021, 184(5): 1299-1313.
19. DU J, MACHADO-VIEIRA R, MAENG S, et al. Enhancing AMPA to NMDA throughput as a convergent mechanism for antidepressant action[J]. Drug Discov Today Ther Strateg, 2006, 3(4): 519-526.
20. JASO B A, NICIU M J, IADAROLA N D, et al. Therapeutic modulation of glutamate receptors in major depressive disorder[J]. Curr Neuropharmacol, 2017, 15(1): 57-70.
21. MAENG S, JrZARATE C A. The role of glutamate in mood disorders: Results from the ketamine in major depression study and the presumed cellular mechanism underlying its antidepressant effects[J]. Curr Psychiatry Rep, 2007, 9(6): 467-474.
22. JrZARATE C A, MACHADO-VIEIRA R. GSK-3: A key regulatory target for ketamine's rapid antidepressant effects mediated by enhanced AMPA to NMDA throughput[J]. Bipolar Disord, 2016, 18(8): 702-705.
23. AUTRY A E, MONTEGGIA L M. Brain-derived neurotrophic factor and neuropsychiatric disorders[J]. Pharmacol Rev, 2012, 64(2): 238-258.
24. SHIRAYAMA Y, CHEN A C, NAKAGAWA S, et al. Brain-derived neurotrophic factor produces antidepressant effects in behavioral models of depression[J]. J Neurosci, 2002, 22(8): 3251-3261.
25. 张瑶, 邹蔓姝, 韩远山, 等. 表观遗传学在抑郁症发病机制中的研究进展[J]. 中国临床药理学与治疗学, 2025, 30(4): 517-525.
26. ZAINA S. The functional significance of vascular DNA hypermethylation in atherosclerosis: A historical perspective[J]. Front Pharmacol, 2025, 16: 1562674.
27. BI H, JIN J, SUN M, et al. Epigenetic changes caused by early life stress in the pathogenesis of depression[J]. Eur J Pharmacol, 2025, 999: 177671
28. KANG H J, KIM J M, LEE J Y, et al. BDNF promoter methylation and suicidal behavior in depressive patients[J]. J Affect Disord, 2013, 151(2): 679-685.
29. HING B, SATHYAPUTRI L, POTASH J B. A comprehensive review of genetic and epigenetic mechanisms that regulate BDNF expression and function with relevance to major depressive disorder[J]. Am J Med Genet B Neuropsychiatr Genet, 2018, 177(2): 143-167.
30. IKEGAME T, BUNDO M, MURATA Y, et al. DNA methylation of the BDNF gene and its relevance to psychiatric disorders[J]. J Hum Genet, 2013, 58(7): 434-438.
31. JANUAR V, ANCELIN M L, RITCHIE K, et al. BDNF promoter methylation and genetic variation in late-life depression[J]. Transl Psychiatry, 2015, 5(8): e619.
32. WANG P, ZHANG C, LV Q, et al. Association of DNA methylation in BDNF with escitalopram treatment response in depressed Chinese Han patients[J]. Eur J Clin Pharmacol, 2018, 74(8): 1011-1020.
33. TADIĆ A, MÜLLER-ENGLING L, SCHLICHT K F, et al. Methylation of the promoter of brain-derived neurotrophic factor exon IV and antidepressant response in major depression[J]. Mol Psychiatry, 2014, 19(3): 281-283.
34. KIM J M, STEWART R, KANG H J, et al. BDNF methylation and depressive disorder in acute coronary syndrome: The K-DEPACS and EsDEPACS studies[J]. Psychoneuroendocrinology, 2015, 62: 159-165.
35. PRICE R B, KISSEL N, BAUMEISTER A, et al. International pooled patient-level meta-analysis of ketamine infusion for depression: In search of clinical moderators[J]. Mol Psychiatry, 2022, 27(12): 5096-5112.
36. SCOTT F, HAMPSEY E, GNANAPRAGASAM S, et al. Systematic review and meta-analysis of augmentation and combination treatments for early-stage treatment-resistant depression[J]. J Psychopharmacol, 2023, 37(3): 268-278.
【引用格式】蓝玉婷,周燕玲,刘冠希 ,等.脑源性神经营养因子甲基化水平与氯胺酮治疗难治性抑郁障碍疗效的关系[J]. 中国神经精神疾病杂志,2025,51(4):232-239.
【Cite this article】LAN Y T,ZHOU Y L,LIU G X,et al.The relationship between of methylation brain-derived neurotrophic factor and the efficacy of ketamine in the treatment of treatment-resistant depression[J]. Chin J Nervous Mental Dis,2025,51(4):232-239.
DOI:10.3969/j.issn.1002-0152.2025.04.005
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)