首页 > 医疗资讯/ 正文
摘 要
目的 总结颈动脉内膜剥脱术(carotid endarterectomy,CEA)治疗颈动脉狭窄的经验。
方法 回顾分析2022年1月至2024年12月收治的64例行外科手术治疗的颈动脉狭窄患者的临床资料,收集年龄、性别、基础疾病情况、颈动脉狭窄程度、冠脉狭窄程度、术前灌注情况、术前斑块性质、围手术期抗血小板药物使用情况、术中转流情况、术中颈动脉阻断时间、手术时间、术后并发症及随访结果等临床数据。
结果 64例患者均行CEA且顺利完成,14例患者接受术中转流;48例围手术期单抗治疗,16例双抗治疗。中位手术时间161.50(138.00,186.50)min,颈动脉阻断时间(28.42±10.72)min。 术后并发症:切口感染1例(1.56%)、切口血肿1例(1.56%)、颈内动脉闭塞1例(1.56%)、低灌注1例(1.56%);无术后脑梗死、过度灌注、心脏事件、脑神经损伤。术中转流的患者无术后并发症。所有患者随访3~38个月,其中2例发生脑梗死(3.13%),无死亡病例。转流组患者较非转流组患者术中颈动脉阻断时间缩短[(18.43±6.64) min vs. (31.22±9.98) min,P<0.05)],余各项数据差异无统计学意义(P>0.05)。双抗组患者较单抗组患者颈动脉狭窄严重[术侧(χ2=-2.377,P<0.05),对侧(χ2=-2.261,P<0.05)],余各项数据差异无统计学意义(P>0.05)。
结论 CEA是治疗颈动脉狭窄的有效措施,CEA术中使用转流管是安全的。精细的围手术期管理和手术操作有助于减少术后并发症。
关键词
颈动脉狭窄;颈动脉内膜剥脱术(CEA);转流;抗血小板;并发症
颈动脉狭窄是引起缺血性脑卒中的重要原因。目前颈动脉狭窄的治疗方法主要包括保守治疗、颈动脉内膜剥脱术(carotid endarterectomy,CEA)和颈动脉支架成形术(carotid artery stenting,CAS)。CEA在颈动脉狭窄治疗中占据主要地位,目前是治疗颈动脉狭窄的首选[1-2]。眼下国内越来越多医院甚至不少基层医院都已经开展此类手术,如何保证手术安全性,减少并发症,是值得关注的问题。本研究回顾性分析接受CEA手术的颈动脉狭窄患者的各项临床资料,将本中心的治疗体会报道如下。
1 资料与方法
1.1 研究对象 回顾性分析2022年1月至2024年12月绍兴市人民医院行CEA手术的64例颈动脉狭窄患者临床资料。纳入标准:①有症状性颈动脉狭窄,计算机断层血管造影(computed tomography angiography,CTA)、超声等检查提示狭窄率>50%;②无症状性颈动脉狭窄,CTA、超声等检查提示狭窄率>70%。排除标准:①慢性完全闭塞无明显脑缺血症状;②伴有颅内较大的动脉瘤,不能提前处理或同时处理;③有严重的出血倾向,或3个月内有颅内出血史;④凝血功能障碍,对肝素及抗血小板类药物有禁忌;⑤30 d内曾发生大面积脑梗死或心肌梗死;⑥3个月内有进展性脑梗死;⑦重要脏器如心、肺、肝和肾等严重功能不全,或不能耐受全麻;⑧严重痴呆;⑨预期寿命<5年。本研究经医院伦理委员会(批文号:2024-研立-第093-01)批准。
1.2 资料收集 收集患者资料,包括年龄、性别、基础疾病、颈动脉及冠脉狭窄程度、术前灌注及斑块性质、手术时间、阻断时间、围手术期抗血小板药物使用情况、术中转流情况、术后并发症(术后1个月)情况、远期卒中和死亡情况等。根据术中是否使用转流管分为转流组和非转流组,根据围手术期使用单一抗血小板药物或两联抗血小板药物分为单抗组和双抗组。参照相关文献,根据术前颈动脉CTA或超声、冠脉CTA结果,约定颈动脉狭窄70%以下属于重度狭窄以下,狭窄70%~99%属于重度狭窄(如狭窄95%~99%归类为近闭塞),狭窄100%属于闭塞;冠脉狭窄70%以下属于重度狭窄以下,狭窄70%~99%属于重度狭窄[3-5]。
1.3 治疗方法 患者围手术期常规选择单抗治疗(口服阿司匹林100 mg或氯吡格雷75 mg,1次/d)。但对于术侧颈动脉接近闭塞、对侧颈动脉近闭塞/闭塞,或近期行冠脉支架植入、颈动脉支架植入等介入手术的,围手术期双抗治疗(阿司匹林100mg和氯吡格雷75 mg,1次/d)。对于阿司匹林、氯吡格雷不能耐受的,根据患者情况选用西洛他唑等其他药物。64例气管插管全身麻醉,所有患者未使用颈动脉补片,原位缝合颈动脉。术中常规经颅多普勒(transcranial Doppler,TCD)监测。对于经颞骨窗TCD监测不满意的,采用颈动脉残端压力(stump pressure,SP)监测。夹闭颈总动脉后,TCD监测提示同侧大脑中动脉(middle cerebral artery,MCA)流速低于基础水平50%以上[6],或SP<35 mmHg时[7],使用转流管。手术采用胸锁乳突肌前缘纵行切口,切皮后逐层分离,暴露颈动脉鞘,游离出颈总动脉、颈内动脉、颈外动脉和甲状腺上动脉,4100 U静脉肝素化后升高血压至收缩压180 mmHg(有TCD监测的血压参考TCD监测结果适当调整),依次阻断甲状腺上动脉、颈外动脉、颈总动脉和颈内动脉并计时。然后沿颈总动脉向颈内动脉方向切开动脉壁,剥离斑块同时肝素盐水冲洗管腔,彻底剔除残余的斑块及内膜,肝素盐水冲洗同时用6-0普理灵线由远心端向近心端连续缝合颈动脉,至剩余两针时短暂释放颈内动脉临时阻断夹观察反流血并使残留斑块碎屑及气泡随血流冲走,然后再阻断颈内动脉继续缝合,缝合完毕,将收缩压降低至120 mmHg,止血纱布棉片轻压切口同时依次放开甲状腺上动脉、颈外动脉及颈总动脉,30 s后放开颈内动脉。皮下术腔放置非负压引流管,逐层缝合切口。术毕缓慢麻醉复苏,维持血压稳定(收缩压120 mmHg),拔除气管插管后回病房。
1.4 统计学方法 采用SPSS 16.0分析数据。符合正态分布的计量资料采用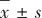 表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料采用M(QL,QU)表示,采用Mann-Whitney U检验。有序分类资料采用Wilcoxon符号秩检验,无序分类资料采用χ2检验或Fisher精确概率法。检验水准ɑ=0.05。
表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料采用M(QL,QU)表示,采用Mann-Whitney U检验。有序分类资料采用Wilcoxon符号秩检验,无序分类资料采用χ2检验或Fisher精确概率法。检验水准ɑ=0.05。
2 结果
2.1 一般资料 64例患者中,14例接受转流(12例MCA流速低于术前50%,2例SP<35 mmHg),50例未转流;48例围手术期单抗治疗(43例服用阿司匹林,4例服用氯吡格雷,1例服用西洛他唑),16例双抗治疗(所有患者至少术前5 d开始服用阿司匹林联合氯吡格雷)。转流组与非转流组患者的年龄、性别、基础疾病情况(高血压、糖尿病、高脂血症)、抗血小板药物使用情况、颈动脉及冠脉狭窄程度、术前灌注及斑块性质等均无统计学差异(P>0.05)。见表1。单抗组与双抗组颈动脉狭窄有统计学差异(P<0.05),患者的年龄、性别、基础疾病情况(高血压、糖尿病、高脂血症)、术前灌注及斑块性质、术中使用转流情况及冠脉狭窄情况等差异均无统计学意义(P>0.05),见表2。
Tab.1 Comparison of the general clinical data between shunting group and non-shunting group表1 转流组与非转流组患者的一般资料比较
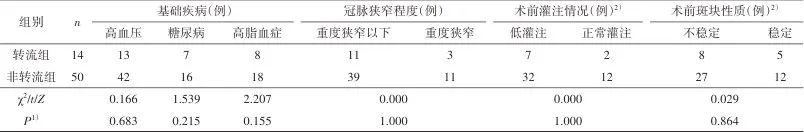
1)为双侧检验P值;2)部分数据缺失,成组删除后行χ2检验。
Tab.2 Comparison of the general clinical data between single antiplatelet group and dual antiplatelet group表2 单抗组与双抗组患者的一般资料比较
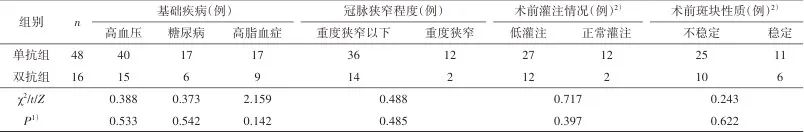
1)为双侧检验P值;2)部分数据缺失,成组删除后行χ2检验。
2.2 围手术期、术后并发症及随访情况 中位手术时间161.50(138.00,186.50) min,颈动脉阻断时间(28.42±10.72)min。所有患者术后无过度灌注症状,无脑神经损伤症状,无心脏事件发生,也无术后脑梗死事件发生,无病例死亡。术后切口感染、切口血肿、低灌注及术侧颈内动脉闭塞各有1例(1.56%)。随访时间3~38个月,随访过程中有2例发生脑梗死(3.13%)。
2.3 转流组和非转流组比较 转流组患者未发生转流管相关并发症。非转流组术后切口感染、切口血肿、低灌注及术侧颈内动脉闭塞各1例;以上并发症转流组未发生,但两组差异无统计学意义(P>0.05)。转流组和非转流组随访期间各有1例发生脑梗死,两组差异无统计学意义(P>0.05)。两组患者的手术时间差异无统计学意义(P>0.05)。非转流组术中颈动脉阻断时间为(31.22±9.98)min,转流组术中颈动脉阻断时间为(18.43±6.64)min,两组患者的术中颈动脉阻断时间差异有统计学意义(P<0.05)。见表3。
Tab.3 Comparison of perioperative data,postoperative complications and follow-up results between shunting group and non-shunting group表3 转流组与非转流组患者的围手术期、术后并发症及随访情况比较
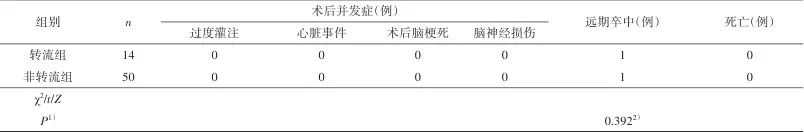
1)为双侧检验P值;2)Fisher精确概率检验。
2.4 单抗组和双抗组比较 单抗组术后切口感染、切口血肿、低灌注及术侧颈内动脉闭塞各有1例,无过度灌注、心脏事件、脑神经损伤症状,也无术后脑梗死事件发生;以上并发症双抗组未发生。但两组差异无统计学意义(P>0.05)。单抗组和双抗组随访期间各有1例发生脑梗死,两组差异无统计学意义(P>0.05)。两组的手术时间及术中颈动脉阻断时间差异无统计学意义(P>0.05)。见表4。
Tab.4 Comparison of perioperative data,postoperative complications and follow-up results between single antiplatelet group and dual antiplatelet group表4 单抗组与双抗组患者的围手术期、术后并发症及随访情况比较
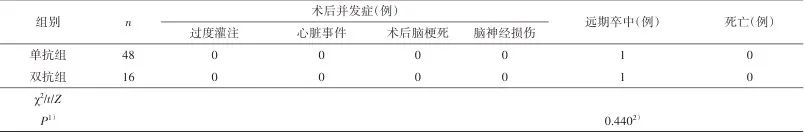
1)为双侧检验P值;2)Fisher精确概率检验。
3 讨论
在CEA术中,需要临时夹闭颈动脉而造成一定时间的脑缺血,故由此造成的术后缺血性脑卒中的风险不容忽视。术中转流管的使用可以缩短脑缺血的时间,从而降低患者术后缺血性脑卒中的风险,但是使用转流管存在术后颈动脉夹层、颈动脉血栓形成及颈动脉远端栓塞等风险[8]。对于术中是否需要使用转流管,业界曾存在较大分歧,近年来不建议使用转流管的声音越来越少,但转流与否仍未达成完全一致意见[9-11]。本研究中,转流组较非转流组患者阻断时间缩短,两组患者在一般资料、手术时间、术后并发症、远期卒中和死亡等方面差异无统计学意义。与VUURBERG等[10]结果一致。笔者认为,CEA术中使用转流是安全可行的;但是,转流毕竟增加了手术操作,潜在风险不能忽视,建议把握好转流指征,在严密监测下进行选择性转流。
本研究提示,双抗组较单抗组颈动脉狭窄严重,两组在术后并发症及远期卒中、死亡的发生率上差异并无统计学意义。本研究未发现双抗组较单抗组术后出血事件增加,与现有研究结果不一致[12-13],不排除与样本量偏少有关。参考现有指南及相关文献[12-14],结合本研究结果,笔者建议CEA围手术期常规使用单一抗血小板治疗,但对于那些术侧颈动脉接近闭塞、对侧颈动脉近闭塞/闭塞、近期行冠脉支架植入或颈动脉支架植入的患者,考虑到可能存在更高的卒中风险,可进行双抗治疗。
CEA术后缺血性脑卒中的发病率,目前报道在0~12.6%不等,平均1.8%[10]。本研究患者围手术期均无脑梗死并发症出现。但有1例入非转流组同时也入单抗组的无症状性重度颈动脉狭窄患者术后麻醉复苏完毕即出现对侧偏瘫,部分失语。术后即刻查头颅CT未见颅内出血;术后急查头颅MRI平扫+磁共振弥散加权成像(diffusion weighted imaging,DWI)未见脑梗死表现(4 d后复查头颅MRI平扫+DWI亦未见脑梗死表现);术后急查颈动脉CTA提示术侧颈动脉狭窄解除;术后次日灌注CT提示颅内灌注较术前无明显改变;术中持续TCD监测,至手术结束未见过度灌注及低灌注;入院来至术前基础血压维持在120 mmHg/65 mmHg(平均动脉压83.3 mmHg)~171 mmHg/78 mmHg(平均动脉压109 mmHg),麻醉复苏至回病房期间,血压维持在95 mmHg/52 mmHg(平均动脉压66.3 mmHg)~124 mmHg/73 mmHg(平均动脉压90 mmHg)。虽然该患者术后灌注CT及头颅MRI平扫+DWI均未见影像学的灌注减低及脑梗死改变,但结合王红芹等[15]对低灌注标准的定义:手术麻醉复苏后新出现言语、运动等神经功能缺损或原有脑缺血症状加重,或影像学检查发现新发脑梗死。笔者考虑存在低灌注,随后将该患者单抗改双抗,加用依达拉奉、丁苯酞、前列地尔,配合康复治疗,言语功能基本恢复,肌力恢复至4级。该病例提醒笔者,今后CEA患者术后的血压要在参考术前基础血压的前提下控制在更合理的范围。此外,随访过程中,有2例发生脑梗死,1例入转流组/双抗组,另1例入非转流组/单抗组。脑梗死患者随访期间长期服用阿司匹林,但存在房颤病史,房颤未在心血管科规范处理及随诊。脑梗死考虑和房颤有关,这提醒我们,更积极的处理房颤或许能使类似患者脑梗死发生概率进一步降低。
CEA围手术期死亡的发生率,有报道表明已低至0.5%[16]。但是远期死亡率,由于随访时间的不同,文献差异较大。有研究[17-18]表明,随访时间大于3年,死亡率达12%~34%。本研究围手术期及随访期间无病例死亡,不排除由于样本量不够多以及随访时间尚不够久的原因。
CEA术后切口血肿的发生率3%~7%[19-20]。本研究有1例入非转流组同时也入单抗组的患者发生切口血肿,发生率在文献报道范围内;但与转流组/双抗组相比发生率无统计学差异。发生切口血肿的患者术后当天有剧烈呕吐,切口敷料渗血,但未出现气管压迫症状及切口感染,经多次切口换药,切口愈合可。
CEA术后急性术侧颈内动脉闭塞,相对少见,同时可供查阅的文献不多,有报道[21-22]表明,CEA术后症状性术侧颈内动脉闭塞,其围手术期发生率0.5%~3.6%。本研究中,各组术后颈内动脉闭塞发生率差异无统计学意义。其中,有1例狭窄程度约90%入非转流组同时也入单抗组患者发生术后颈内动脉闭塞,发生率与文献报道相符,但属于无症状性颈内动脉闭塞。该患者术后次日常规复查颈动脉CTA时发现左侧颈内动脉闭塞,左侧前循环代偿良好。拟行急诊脑血管造影,因患方不接受而未进行。术中持续TCD监测,至手术结束未见过度灌注及低灌注。入院来至术前基础血压维持在92 mmHg/46 mmHg(平均动脉压61.3 mmHg)~131 mmHg/64 mmHg(平均动脉压86.3 mmHg),术后麻醉复苏至检查发现左侧颈内动脉闭塞,血压维持在95 mmHg/52 mmHg(平均动脉压66.3 mmHg)~124 mmHg/73 mmHg(平均动脉压90 mmHg)。该患者术后出现颈内动脉闭塞,推测可能原因是颈内动脉远心端斑块及内膜残留部分有脱垂,术后受到血流持续逆向冲击而形成局部夹层,最终造成急性闭塞。针对该现象,今后处理颈内动脉远端斑块及内膜时,需要更加小心谨慎,必要时钉缝处理以减少出现颈内动脉夹层的可能。
CEA术后切口感染发生率并不高,目前文献报道0.9%~2.5%[23-24]。本研究中,各组术后切口感染发生率差异无统计学意义。有1例入非转流组同时也入单抗组患者发生术后切口感染,发生率与文献报道符合。该患者有糖尿病,围手术期血糖控制在3.7~13.4 mmol/L,另外术后有剧烈呕吐,呕吐物污染切口敷料。经多次切口换药,切口愈合良好。
本研究术后并发症发生率都在文献报道范围内,有些则低于文献报道。这说明笔者的CEA手术效果总体是满意的。笔者的经验表明,术前的充分评估,围手术期将血压血糖严格控制在合理范围,扎实的手术解剖功底,术中颈内动脉远端斑块及内膜的妥当处理,术后呕吐及咳嗽等的合理防治等有助于将术后并发症控制在较低水平,是手术安全的重要保证。
综上所述,CEA是治疗颈动脉狭窄的有效措施,CEA术中使用转流管是安全的。精细的围手术期管理和手术操作有助于减少术后并发症。本研究为单中心回顾性研究,纳入的病例数有限,后续需要进一步扩大样本量,进行多中心前瞻性的研究,方能得出更可靠的结论。
参考文献:
1. ABURAHMA A F, AVGERINOS E D, CHANG R W, et al. Society for Vascular Surgery clinical practice guidelines for management of extracranial cerebrovascular disease[J]. J Vasc Surg, 2022, 75(1S): 4S-22S.
2. NAYLOR R, RANTNER B, ANCETTI S, et al. Editor’s Choice - European Society for Vascular Surgery (ESVS) 2023 Clinical Practice Guidelines on the Management of Atherosclerotic Carotid and Vertebral Artery Disease[J]. Eur J Vasc Endovasc Surg, 2023, 65(1): 7-111.
3. KELLY P J, CAMPS-RENOM P, GIANNOTTI N, et al. A Risk Score Including Carotid Plaque Inflammation and Stenosis Severity Improves Identification of Recurrent Stroke[J]. Stroke, 2020, 51(3): 838-845.
4. 黄亚波, 周鹏, 陆挺,等. 颈动脉内膜切除术治疗症状性颈动脉极重度狭窄[J]. 中华神经外科杂志, 2018, 34(5): 490-494.
5. 吕向洋, 孙可健, 帅杰. 颈动脉狭窄程度及血hs-CRP水平对缺血性脑血管事件的影响[J].中国神经精神疾病杂志, 2012, 38(8): 490-493.
6. 张明杰, 宋虓福, 马维宁, 等. 常规转流与选择性转流在颈动脉内膜切除术中的应用[J]. 中华神经外科杂志, 2016, 32(1): 60-63.
7. CHIA M C, WALLACE G A, CHENG B T, et al. Identifying a Safe Carotid Stump Pressure Threshold for Selective Shunting During Carotid Endarterectomy [J]. Ann Vasc Surg, 2020, 69: 158-162.
8. BOZZANI A, ARICI V, TICOZZELLI G, et al. Intraoperative Cerebral Monitoring During Carotid Surgery: A Narrative Review[J]. Ann Vasc Surg, 2022, 78: 36-44.
9. CHUATRAKOON B, NANTAKOOL S, RERKASEM A, et al. Routine or selective carotid artery shunting for carotid endarterectomy (and different methods of monitoring in selective shunting)[J]. Cochrane Database Syst Rev, 2022, 6(6): CD000190.
10. VUURBERG N E, POST I C J H, KELLER B P J A, et al. A Systematic Review and Meta-Analysis on Perioperative Cerebral and Hemodynamic Monitoring Methods during Carotid Endarterectomy[J]. Ann Vasc Surg, 2023, 88: 385-409.
11. KONDOV S, BOTHE D, BEYERSDORF F, et al. Routine versus selective near-infrared spectroscopy-guided shunting during carotid eversion endarterectomy[J]. Interdiscip Cardiovasc Thorac Surg, 2023, 36(2): ivad005.
12. KLEINDORFER D O, TOWFIGHI A, CHATURVEDI S, et al. 2021 Guideline for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack: A Guideline From the American Heart Association/American Stroke Association[J]. Stroke, 2021, 52(7): e364-e467.
13. KU J C, TASLIMI S, ZUCCATO J, et al. Editor’s Choice - Peri-Operative Outcomes of Carotid Endarterectomy are Not Improved on Dual Antiplatelet Therapy vs. Aspirin Monotherapy: A Systematic Review and Meta-Analysis[J]. Eur J Vasc Endovasc Surg, 2022, 63(4): 546-555.
14. 中华医学会外科学分会血管外科学组. 颈动脉狭窄诊治指南[J]. 中华血管外科杂志, 2017,2(2):78-84.
15. 王红芹, 洪川, 张莹,等. 术前血压变异性对颈动脉狭窄患者颈动脉内膜剥脱术后脑灌注改变的影响[J]. 中华神经医学杂志, 2023, 22(11): 1151-1156.
16. ROTHENBERG K A, TUCKER L Y, GOLOGORSKY R C, et al. Long-term stroke risk with carotid endarterectomy in patients with severe carotid stenosis[J]. J Vasc Surg, 2021, 73(3): 983-991.
17. LAWAETZ M, SANDHOLT B, EILERSEN E N, et al. Low Risk of Neurological Recurrence while Awaiting Carotid Endarterectomy: Results From a Danish Multicentre Study[J]. Eur J Vasc Endovasc Surg, 2021, 62(2): 160-166.
18. WADÉN K, HULTGREN R, KOTOPOULI M I, et al. Long Term Mortality Rate in Patients Treated with Carotid Endarterectomy[J]. Eur J Vasc Endovasc Surg, 2023, 65(6): 778-786.
19. LIESKER D J, GAREB B, LOOMAN R S, et al. Patch angioplasty during carotid endarterectomy using different materials has similar clinical outcomes[J]. J Vasc Surg, 2023, 77(2): 559-566.e1.
20. ABURAHMA A F, SANTINI A, ABURAHMA Z T, et al. Thirty-Day Perioperative Clinical Outcomes of Transcarotid Artery Revascularization vs Carotid Endarterectomy in a Single-Center Experience[J]. J Am Coll Surg, 2023, 236(4): 668-674.
21. RERKASEM K, ROTHWELL P M. Systematic review of randomized controlled trials of patch angioplasty versus primary closure and different types of patch materials during carotid endarterectomy[J]. Asian J Surg, 2011, 34(1): 32-40.
22. BOND R, RERKASEM K, NAYLOR A R, et al. Systematic review of randomized controlled trials of patch angioplasty versus primary closure and different types of patch materials during carotid endarterectomy[J]. J Vasc Surg, 2004, 40(6): 1126-1135.
23. KHAN M M, KHAN H M, CHOUDRY U K, et al. Carotid Endarterectomy: A Single Institutional Experience of 28 Years From Pakistan[J]. Ann Vasc Surg, 2021, 73: 566-570.
24. DROZ N M, LYDEN S P, SMOLOCK C J, et al. Carotid endarterectomy remains safe in high-risk patients[J] J Vasc Surg, 2021, 73(5): 1675-1682, e4.
【引用格式】包庆泉,王建莉,王芳 ,等.颈动脉内膜剥脱术治疗颈动脉狭窄(64例报告)[J]. 中国神经精神疾病杂志,2025,51(4):225-231.
【Cite this article】BAO Q Q,WANG J l,WANG F,et al.Carotid endarterectomy for carotid artery stenosis: A report of 64 cases[J]. Chin J Nervous Mental Dis,2025,51(4):225-231.
DOI:10.3969/j.issn.1002-0152.2025.04.004
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)