首页 > 医疗资讯/ 正文
神经母细胞瘤是幼儿期最常见的实体瘤,高危病例的5年总生存率为40-60%。因此,识别用于神经母细胞瘤诊断、预后和治疗的新型生物标志物,对于改善这些患者的临床结局至关重要。在本研究中,研究者对从生物样本库获取的48份新鲜冷冻肿瘤样本进行了全外显子组测序。使用生物信息学分析流程识别并筛选体细胞变异。采用Mutalisk在线工具确定突变特征。通过癌症基因组解释器(Cancer Genome Interpreter)预测癌症驱动基因和可药用突变。最常见的突变特征为单碱基替换5(single base substitution 5)。MUC4、MUC16和FLG被确定为突变频率最高的基因。通过癌症基因组解释器,研究者识别出5个涉及MUC16、MUC4、ALK和CTNND1的频发癌症驱动突变,其中CTNND1为新发现的突变,包含错义突变R439C。研究者还鉴定出11个潜在可干预突变,包括NF1 Q1798*、Q2616*和S636X,ALK F1174L和R1275Q,SETD2 P10L和Q1829E,BRCA1 R612S,NOTCH1 D1670V,ATR S1372L和FGFR1 N577K。本研究结果为神经母细胞瘤潜在分子发病机制和治疗靶点提供了相关新信息的全面概述。
研究背景
神经母细胞瘤(NB)是婴儿中最常见的实体瘤,中位发病年龄为18个月,但其可在儿童期的任何阶段发病。它是一种起源于神经嵴交感肾上腺谱系的常见恶性肿瘤,肿瘤可沿交感神经链任何部位发生,但最常见于肾上腺髓质和椎旁神经节。转移性疾病可见于远处淋巴结、骨骼、骨髓、肝脏和皮肤。过去二十年,美国和欧洲的全球儿童癌症流行病学研究显示,神经母细胞瘤患者的年患病率为6-7.5%。在泰国,1990至2011年间报道的神经母细胞瘤发病率为每年每百万人3-5例。基于泰国儿童癌症报告趋势的计算表明,神经母细胞瘤占所有儿童癌症的5%,或占实体瘤组的14.7%。尽管研究期间实体瘤的生存率相比第二个和第一个十年有显著改善,但中枢神经系统肿瘤、神经母细胞瘤和骨肿瘤的生存率并未改变。神经母细胞瘤患者的5年相关生存率为20%-70%。神经母细胞瘤生存率低的原因包括疾病就诊时已处于晚期、多因素预后不良,以及根治性治疗选择有限。据报道,高危患者的5年总生存率(OS)低于50%,这凸显了对新型免疫治疗方法的需求。治疗开始时或治疗期间的化疗耐药会影响高危患者的预后,已成为神经母细胞瘤治疗中的主要问题。因此,识别化疗耐药生物标志物和克服化疗耐药的替代治疗将大有益处。
根据国际神经母细胞瘤分期系统(INSS)的定义,该疾病因其广泛的临床行为谱而值得关注,可根据年龄、MYCN状态和组织学分为三个风险组(低、中、高风险)。国际神经母细胞瘤风险组(INRG)提供的更先进的肿瘤分期系统采用基于影像的分期系统,并根据患者的局限性或转移性疾病模式进行分类。最近,修订后的儿童肿瘤学组(COG)风险分类系统已开发完成,用于对符合条件的患者进行准确的风险分类和治疗分层,其中包括纳入INRG分期系统和作为新型预后生物标志物的节段性染色体变异。神经母细胞瘤的症状和体征差异很大,取决于年龄、原发肿瘤部位、是否存在转移,偶尔还取决于相关的副肿瘤综合征。与高危神经母细胞瘤的强化多模式治疗不同,风险分层治疗已使低风险和中风险疾病儿童的治疗强度降低。对于高危神经母细胞瘤患者,尽管采用了包括手术、化疗、放疗、自体造血干细胞支持下的大剂量化疗和免疫治疗在内的高强度多模式治疗,但仍存在预后不良和长期后遗症。虽然风险组分类系统可为统一界定风险提供平台,但最近针对基因通路和肿瘤微环境的研究方法有望为未来的根治性治疗提供新方向。
可靠的基因组和分子生物标志物的发现,为更精确的预后判断和优化治疗方法提供了框架,旨在实现更好的长期生活质量。肿瘤特异性基因标志物和组织病理学评估是治疗的关键决定因素。神经母细胞瘤的许多基因特征已被确定,例如MYCN原癌基因扩增(20-30%的患者)、染色体变异(包括1p缺失(~30%)、11q缺失(~40%)和17q获得(~50%))以及肿瘤细胞倍体,这些特征显示出其作为治疗反应和预后的有力预测因子的潜力。然而,这些基因因素无法用于阐明恶性肿瘤转化和进展的潜在机制。因此,研究重点已转向利用分子生物标志物来微调基因异常与新型治疗选择之间的关系。根据泛癌基因组分析,与成人癌症不同,儿童癌症中大多数常见突变基因在不同肿瘤类型中相互排斥。
主要缺陷通路包括MAPK、细胞周期和DNA修复通路的下游组件。ALK和PHOX2B的遗传突变已被确定为家族性神经母细胞瘤的致病突变。家族性和散发性神经母细胞瘤中均可发现基因变异,这为ALK提供了有前景的治疗靶点。已使用多种方法对神经母细胞瘤的基因组变异进行了几项综合分析。神经母细胞瘤中频繁检测到的体细胞突变包括ALK、PTPN11、ATRX、MYCN、NRAS、TERT和ARID1A/ARID1B,这些突变可能与年龄、进展和预后因素相关。TP53突变在所有人类癌症中超过50%的病例中高度复发,但在神经母细胞瘤肿瘤中很少发现。因此,未来十年的挑战是确定如何将这些信息转化为针对这些患者的更有效且毒性更低的治疗方法。
尽管下一代测序技术有了重大改进,但高危神经母细胞瘤肿瘤的基因学研究范式在临床结局方面仍几乎没有改善。本研究对48例神经母细胞瘤患者的肿瘤进行了全外显子组测序,分析了体细胞变异、肿瘤突变负荷、突变特征、蛋白质-蛋白质相互作用(PPI)网络、与体细胞突变对应的基因本体论(GO)富集术语和京都基因与基因组百科全书(KEGG)通路。此外,研究者尝试识别癌症驱动因子的变异作为对抗化疗耐药的靶点,并基于这些候选癌症驱动因子预测药物反应。神经母细胞瘤肿瘤的综合特征分析应阐明神经母细胞瘤的分子发病机制,并为预测靶向治疗中患者的药物反应提供潜在靶点。这些药物靶点为化疗耐药患者提供了一种新的治疗策略。本研究中化疗敏感性定义为完全或部分缓解,而疾病稳定或进展被归类为化疗耐药。
研究结果
患者与肿瘤特征:
本研究共纳入48例经诊断为NB患者的肿瘤样本。队列中参与者和样本的基线及临床病理特征详见表1。患者中,男性32例(66.7%),女性16例(33.3%),诊断时中位年龄为2.7岁(范围0.3–16.8岁)。大多数患者属于≥18月龄年龄组(36/48;75%)。根据《国家儿童癌症治疗方案》,共有43例患者(89.6%)被划分为INRG M期和INSS 4期,44例患者(占入组48例的91.7%)被归为高危组。正如预期,大多数NB肿瘤位于肾上腺(26/48,54.2%)。NB是最常见的恶性肿瘤类型(30/48,62.5%),其次是节神经母细胞瘤(9/48,18.8%)和节神经瘤(6/48,12.5%)。46例患者(95.8%)存在不同部位的转移,主要转移至骨骼(38/45,84.4%)和骨髓(26/45,57.8%)。仅4例(8.3%)观察到复发。在纳入研究的48例患者中,43例(89.6%)接受过NB化疗,26例(54.2%)显示完全缓解。部分患者接受了放射治疗,其肿瘤放疗总剂量如下:2例患者分14次照射21 Gy,1例患者分10次照射20 Gy,1例患者分17–20次照射25.5 Gy,1例患者分10次照射30 Gy。患者之间的放疗持续时间各不相同。末次随访时,40例患者(83.3%)存活,17例患者(35.4%)存活超过5年。
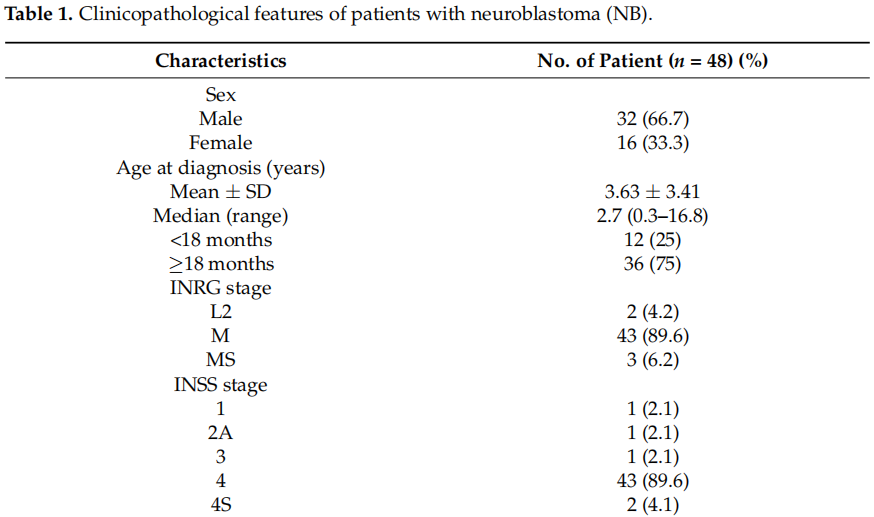

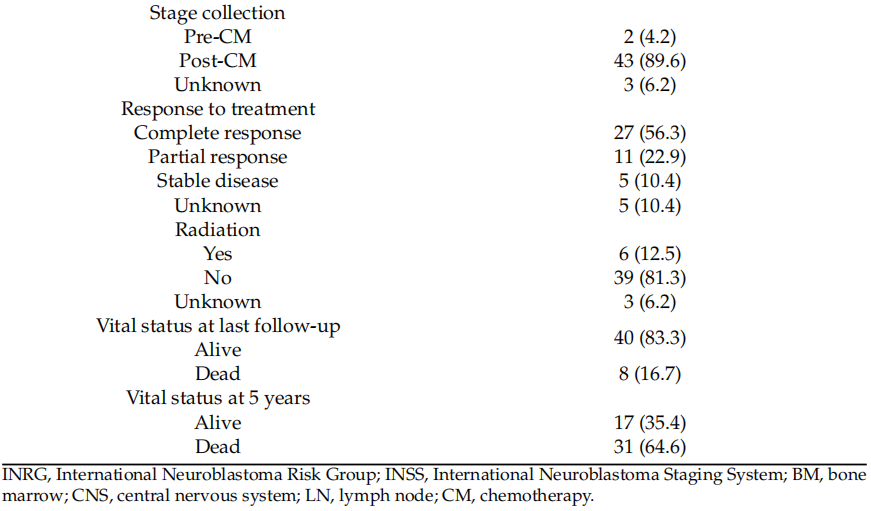
表1
全外显子组测序统计数据:
对从48份新鲜冷冻肿瘤样本中提取的DNA进行全外显子组测序。使用Qualimap软件(v.2.2.2)计算经indel重比对的bam文件的测序和映射指标。每个肿瘤样本平均包含5,676,815,827.75个高质量碱基,99.96–99.98%的序列读长映射到人类参考基因组的编码区。全外显子的覆盖深度范围为62.68×至105.09×,考虑所有肿瘤外显子序列时,平均覆盖深度为92.69×。
神经母细胞瘤患者的突变图谱:
为探索NB患者的体细胞突变谱,研究者使用R程序中的“maftools”软件包对体细胞突变数据进行分析和可视化。所有突变基因的外显子和剪接位点的体细胞突变详情总结于图1A。通过严格的变异过滤标准后,研究者在47个样本(97.9%)中鉴定出995个体细胞突变,涉及572个癌症相关基因。所得变异等位基因频率(VAF)显示,MUC4和KMT2C明显与其他基因分离,表明它们的非克隆状态。总体变异分类和单核苷酸变异(SNV)类型以不同颜色的条形图呈现。在变异分类方面,错义突变是主要类型,其次为无义突变和框内缺失。在每种变异分类中,有错义突变935个、无义突变18个、框内缺失17个、框内插入8个、移码缺失8个、剪接位点突变6个、移码插入1个、非终止突变1个和翻译起始位点突变1个。
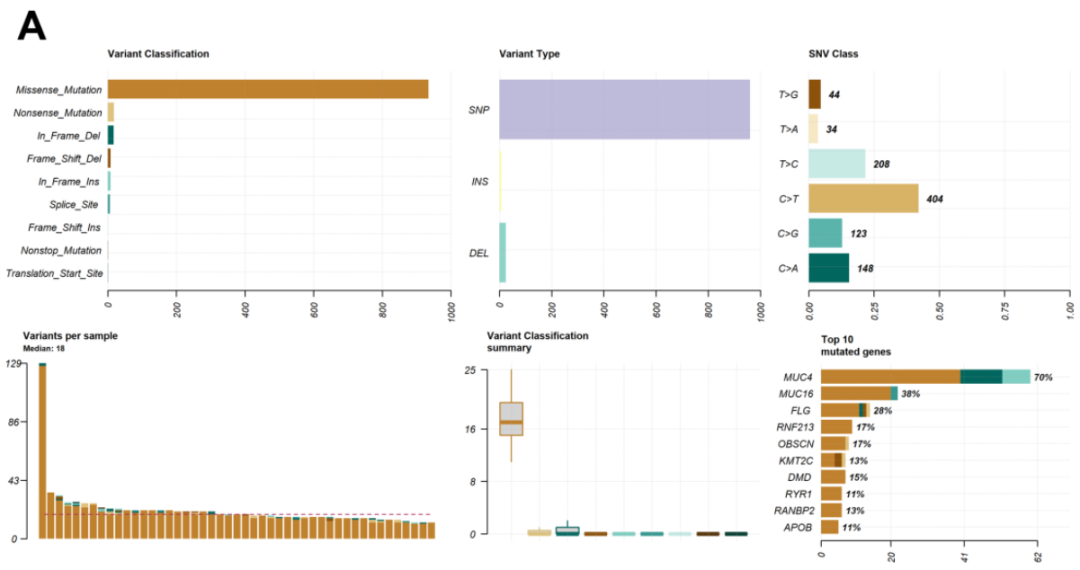
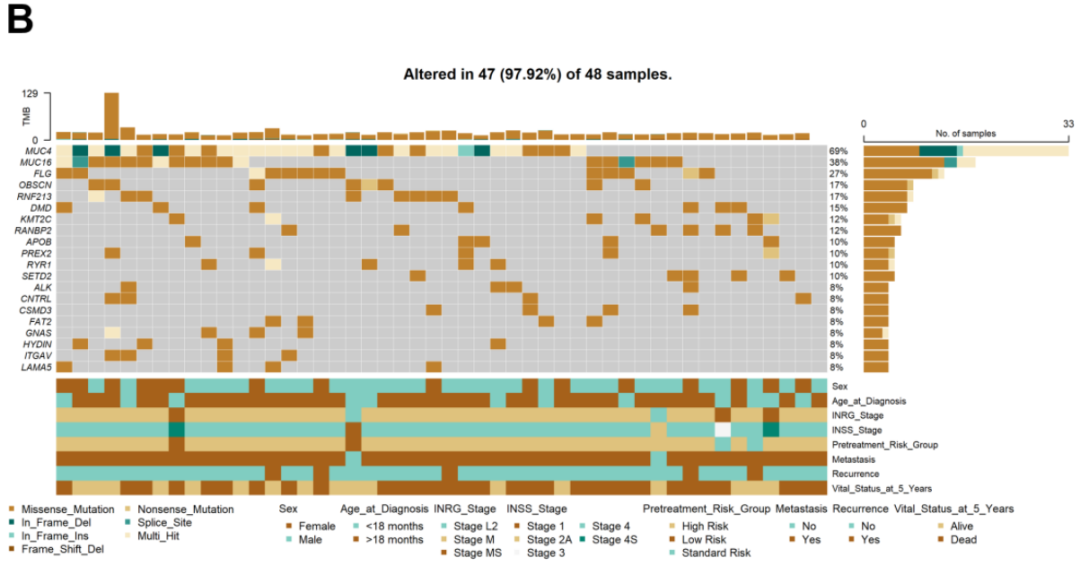
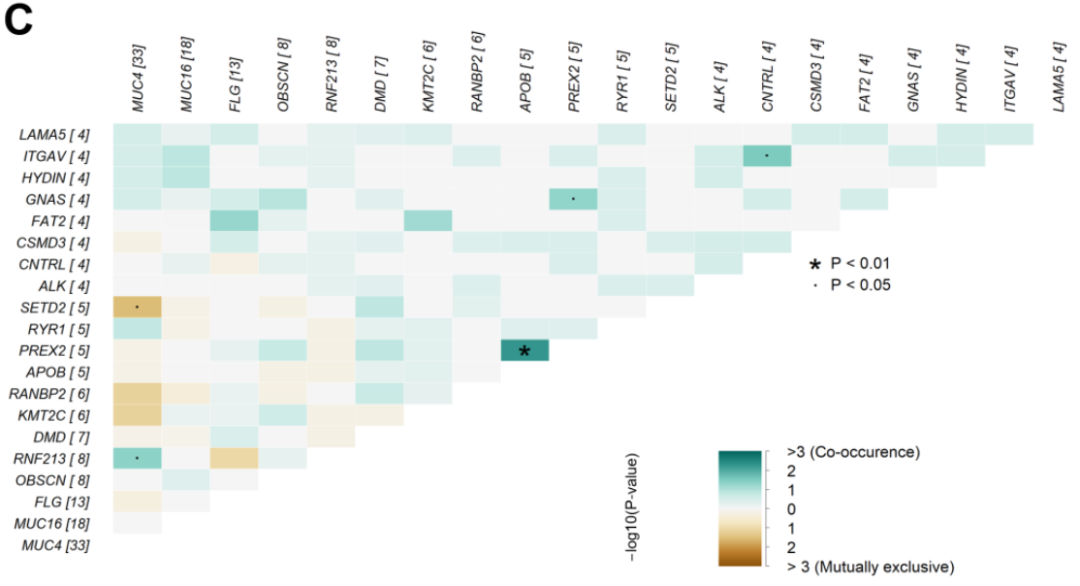

图1
SNVs占大多数变异类型(961个变异),而缺失(25个变异)和插入(9个变异)较少见。其中,在外显子区域鉴定出955个SNV和34个indel。SNV类型中以C > T和T > C为主,转换突变比颠换突变更常见。每个样本的体细胞变异数量在12至129之间,中位数为18。每个样本不同变异分类的数量以箱线图显示。生成肿瘤突变谱图(oncoplots)以展示本NB队列中所有样本的综合体细胞突变谱,列出突变率最高的20个基因及其百分比(图1B)。10个最常见突变基因依次为MUC4(70%)、MUC16(38%)、FLG(28%)、OBSCN(17%)、RNF213(17%)、DMD(15%)、KMT2C(13%)、Ran结合蛋白2(RANBP2)(13%)、载脂蛋白B(APOB)(11%)和PREX2(11%)。共鉴定出187个反复突变基因(>2个患者样本);然而,在任何NB肿瘤标本中均未检测到常见的体细胞变异。
共现突变基因的检测:
接下来,研究者研究了NB患者中鉴定出的突变基因是否存在共现或互斥情况。使用maftools分析体细胞相互作用,前20个突变基因的事件如图1C所示,其中绿色和棕色分别代表共现和互斥事件。MUC4突变与SETD2以互斥方式显著相关(p < 0.05)。在共现关系方面,研究者发现APOB和PREX2共存,具有统计学显著性(p < 0.01)。此外,MUC4、PREX2和CNTRL中的体细胞变异分别与RNF213、GNAS和ITGAV突变存在共现关系(p < 0.05)。
前6个突变基因的突变分布:
使用maftools生成棒棒糖图,以检查特定功能域的突变热点并鉴定6个最常见突变基因的频发突变(图2A–F)。总体而言,在MUC4中检测到60个体细胞突变(12个缺失、8个插入和40个SNP),MUC16中22个(22个SNP),FLG中14个(2个缺失和12个SNP),OBSCN中8个(8个SNP),RNF213中9个(9个SNP),DMD中7个(7个SNP)。仅在MUC4(33个样本)和MUC16(18个样本)中鉴定出至少2个样本的蛋白质改变,这两个基因位列前两大突变基因。除一个样本中外显子17中的p.E788K变异外,MUC4的所有突变均位于外显子2(图2A)。此外,在MUC4的功能域中未观察到突变。最常检测到的变异是p.T1679_P1680insSLPVTSTSSASTGHATPLPVTDNSSVSTGHAT插入(6个样本),其次是p.T1891A变异(5个样本)。研究者鉴定出8个反复突变:p.T1679_P1680insSLPVTSTSSASTGHATPLPVTDNSSVSTGHAT、p.T1891A、p.V2777del、p.L3381P、p.G3660A、p.V1006A、p.L2662_D2709del和p.A3294P。p.P6118S变异位于GRCh38的替代重叠群上,超出MUC4转录长度(NM_018406)。对于MUC16基因,研究者还观察到一个影响第2375位天冬酰胺残基的反复变异(p.N2375S),并在SEA结构域中鉴定出两个错义变异(图2B)。FLG的外显子3中发现多个突变(图2C)。在OBSCN中鉴定出的8个变异中,7个为错义变异,1个为无义变异(图2D)。这些突变发生在外显子4(p.L423H)、5(p.S528Y)、18(p.D1772Y)、27(p.T2432M)、29(p.G2646S)、55(p.Y4886H)、75(p.E6017D)和92(p.W6720X)的多个位置。在RNF213的zf-C3HC4_2结构域中观察到两个错义变异(p.G4002E和p.L4021F)(图2E)。DMD的所有错义突变均偏向于重复区域(图2F)。
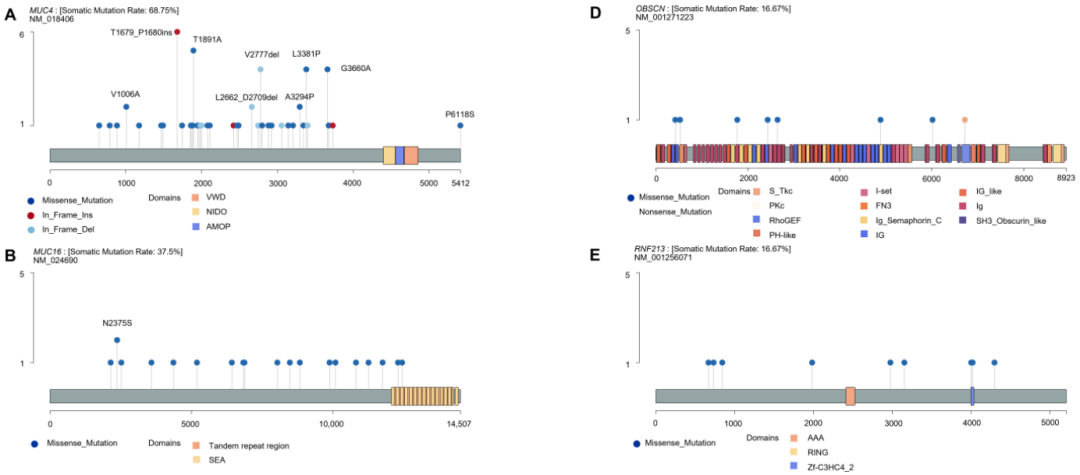
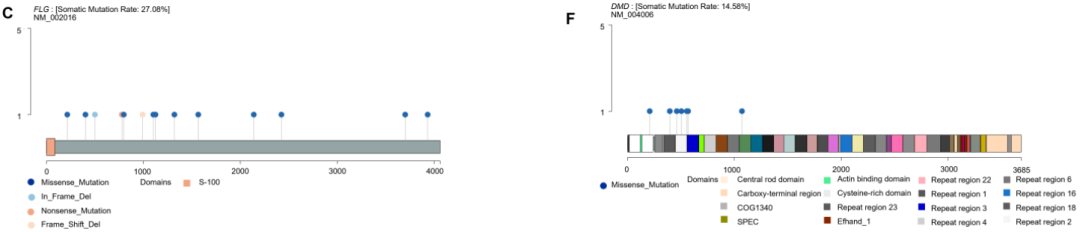
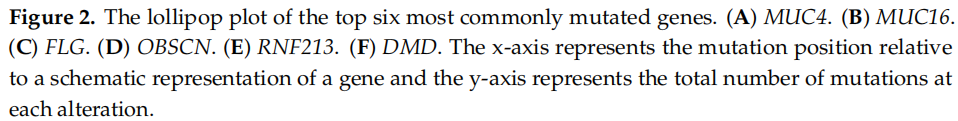
图2
高频突变基因的突变状态与临床病理参数的相关性及其预后影响:
研究者还研究了前10个最常见突变基因的突变与临床病理变量之间的关联。在MUC4、MUC16、FLG、OBSCN、RNF213、DMD、KMT2C、RANBP2、APOB或PREX2野生型与突变患者之间,诊断时年龄未观察到显著差异。此外,Fisher精确检验结果表明,两组在评估的临床病理参数方面无显著关联。然而,研究者发现DMD的突变状态与患者性别显著相关(p = 0.033)。RNF213野生型与骨转移显著相关(p = 0.047)。此外,RANBP2突变与治疗前风险组相关(p = 0.027),而APOB突变与治疗反应相关(p = 0.021)。
研究者通过Kaplan-Meier曲线生存分析评估了6个高频突变基因的预后价值(图3A-F)。这些基因的突变状态分为野生型或突变型。NB患者的随访时间为7.66至60个月,中位随访时间为30.28个月。结果表明,MUC4、MUC16、FLG、OBSCN、RNF213和DMD肿瘤突变患者与未突变患者的总生存期(OS)无显著差异(p值分别为0.265、0.646、0.801、0.174、0.158和0.752)。
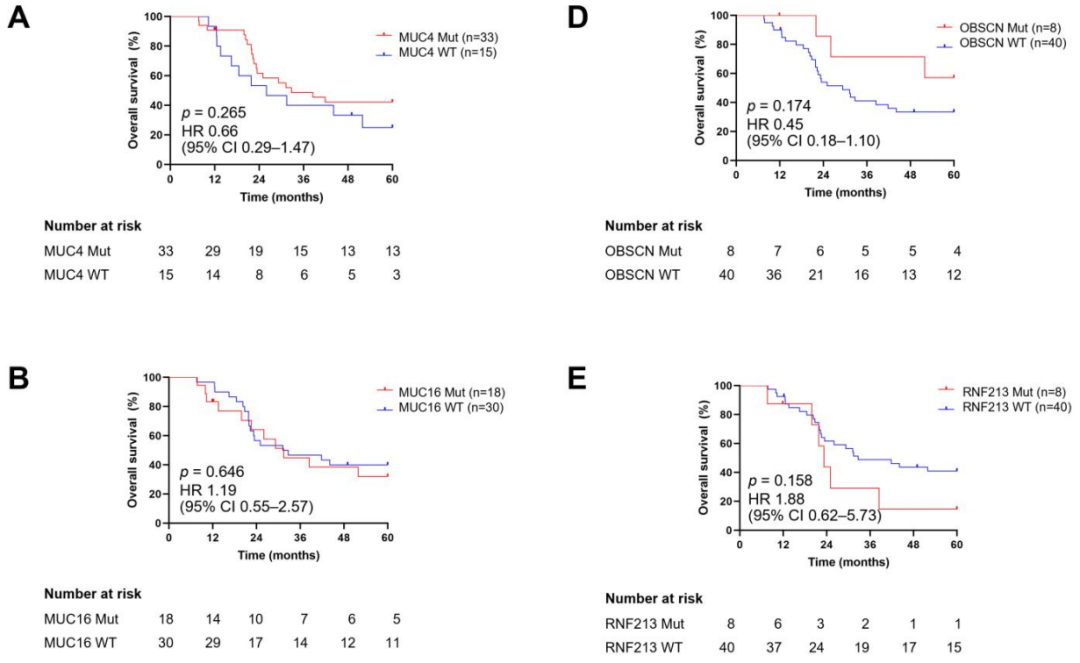
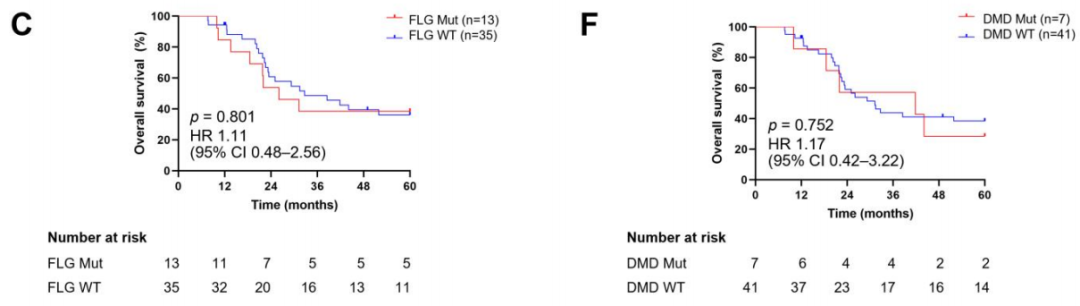

图3
研究者进一步评估了两个突变基因组合与OS的关联。MUC4和LRRN3同时突变与生存呈负相关(风险比[HR]:3.19,95% CI:0.58-17.61)(图4),而其他组合与野生型相比无显著关联。这些突变使中位生存时间显著缩短至16.62个月。
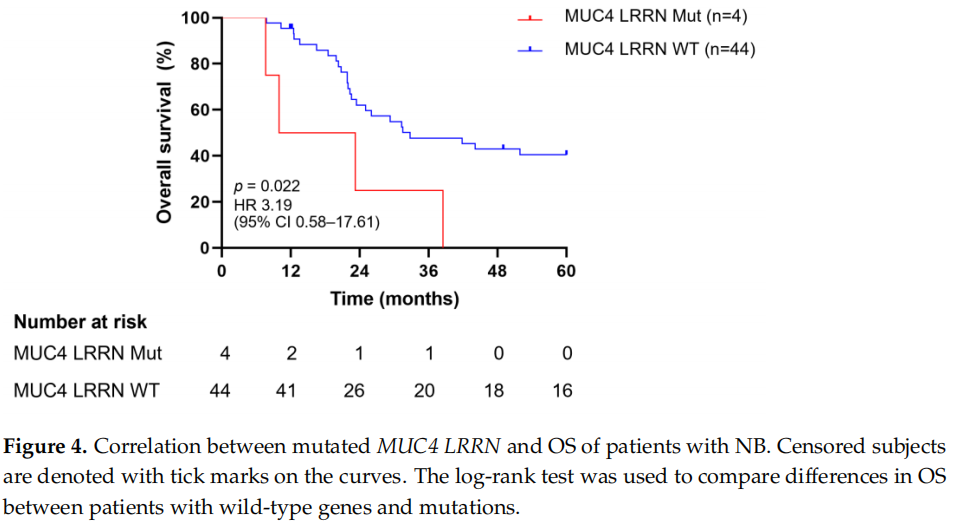
图4
TMB分布及其与年龄、性别、肿瘤原发部位和生存结局的关联:
本队列中的TMB值(以每百万碱基的突变总数表示)在3.37至6.54mut/Mb之间,中位TMB值为4.22mut/Mb(图5A)。根据TMB中位数,25例患者被划分为高TMB组(≥4.22mut/Mb),其余为低TMB组(<4.22mut/Mb)。研究者随后探讨了不同年龄组、性别和肿瘤原发部位的NB患者之间TMB水平的差异。这些临床病理参数与TMB值无显著关联(图5C-E)。同样,高TMB和低TMB患者的生存结局无显著差异(p = 0.493)。
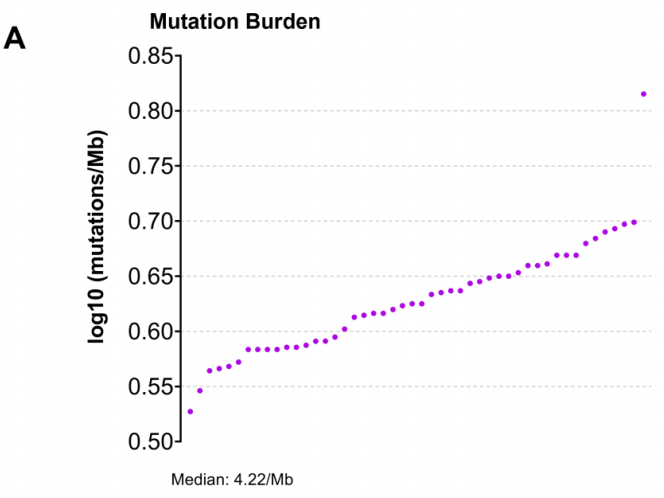
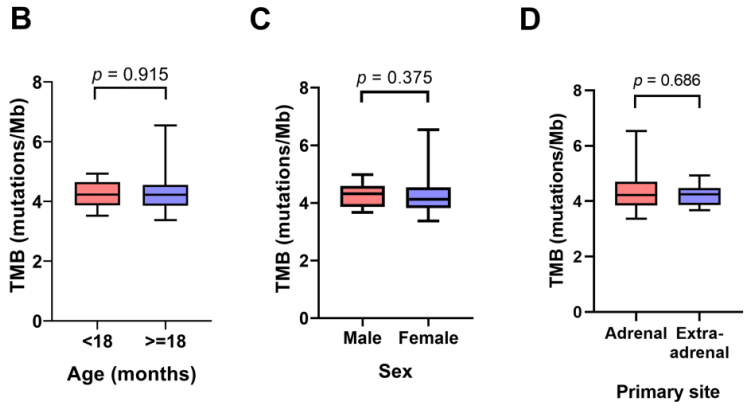
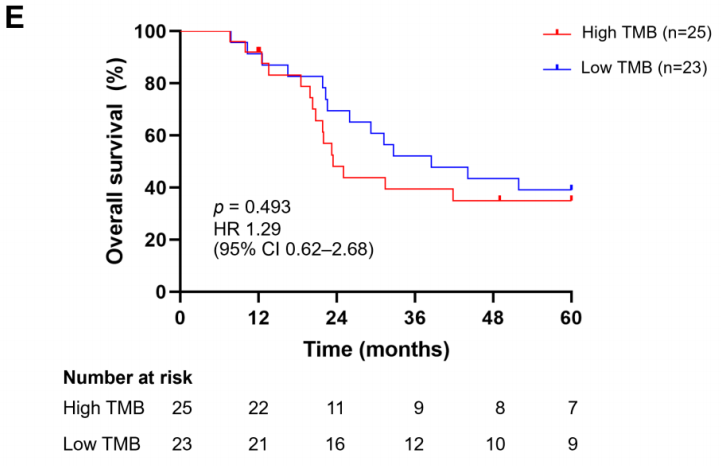

图5
神经母细胞瘤的突变特征:
为探究NB队列中导致体细胞变异的突变过程,基于30个COSMIC突变特征对数据集进行特征分解。计算每个特征的相对贡献百分比并绘制为热图(图6)。本研究NB队列显示出多种特征,包括SBS1、SBS3、SBS4、SBS5、SBS6、SBS7、SBS11、SBS12、SBS13、SBS19、SBS20、SBS23、SBS24、SBS26和SBS30。其中5个特征(3、6、20、26和30)与DNA修复缺陷相关的突变过程有关。C > T转换最为明显,相对贡献范围为39.3%至49.1%。此外,T > C在SBS中占比第二。所有样本均观察到COSMIC特征5,其中32个样本的贡献最高(≥26%),该特征遵循类似时钟的模式,表明突变数量与患者年龄相关。随后,97.9%的样本富集了特征SBS1,其病因源于5-甲基胞嘧啶自发或酶促脱氨为胸腺嘧啶(另一种时钟样特征)。特征3和6分别对应DNA修复机制缺陷(3为基于同源重组的DNA损伤修复,6为DNA错配修复),在48个样本中分别有35个(72.9%)和36个(75.0%)检测到。总之,NB队列中最常见的突变特征为SBS5(48/48,100%),其次是SBS1(47/48,97.9%)、SBS6(36/48,75.0%)和SBS3(35/48,72.9%)。
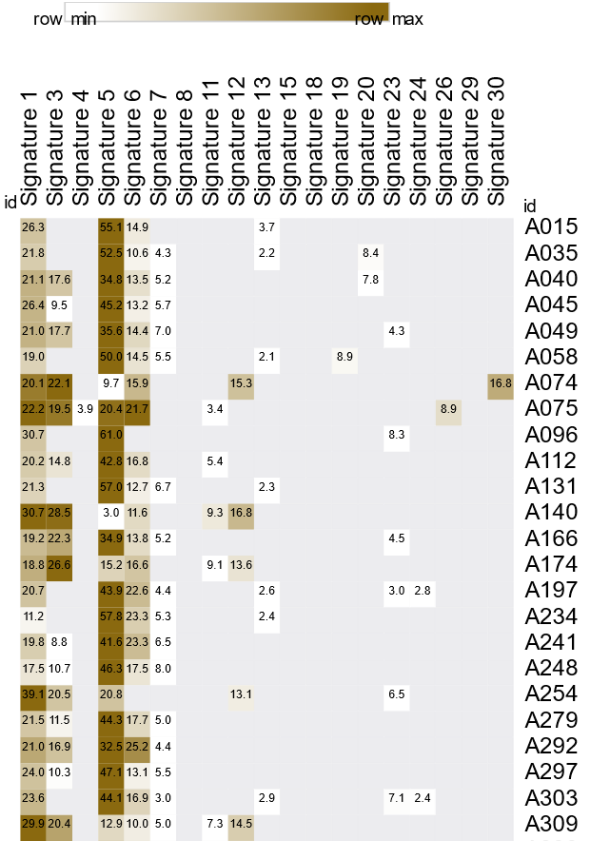

图6
突变基因在致癌信号通路中的富集:
为探索涉及所有突变基因的致癌信号通路,研究者使用R软件包maftools进行通路分析(图7A-D)。结果显示,突变基因在多个致癌通路中富集:TP53(4/6基因,66.7%)、RTK-RAS(21/85基因,24.7%)、MYC(3/13基因,23.1%)、Hippo(6/38基因,15.8%)、TGF-β(1/7基因,14.3%)、NOTCH(9/71基因,12.7%)、WNT(7/68基因,10.3%)、PI3K(3/29基因,10.3%)和细胞周期(1/15基因,6.7%)。从样本数量来看,最常受干扰的致癌通路为RTK-RAS(26/47样本,55.3%)、NOTCH(12/47样本,25.5%)、Hippo(12/47样本,25.5%)、WNT(10/47样本,21.3%)、MYC(6/47样本,12.8%)、PI3K(5/47样本,10.6%)、TP53(4/47样本,8.5%)、TGF-β(2/47样本,4.3%)和细胞周期(1/47样本,2.1%)(图7A)。与每个信号通路相关的突变基因列于图7B-D。最常见的突变基因包括RTK-RAS通路中的ALK和ROS1(4/26样本,15.4%)(图7B)、NOTCH通路中的NCOR2(3/12样本,25%)(图7C)、WNT通路中的APC(3/10样本,30%)、Hippo通路中的FAT2(4/12样本,33.3%)(图7D)、TP53通路中的ATM(2/4样本,50%)、MYC通路中的MGA(4/6样本,66.7%)以及PI3K通路中的TSC1(3/5样本,60%)。
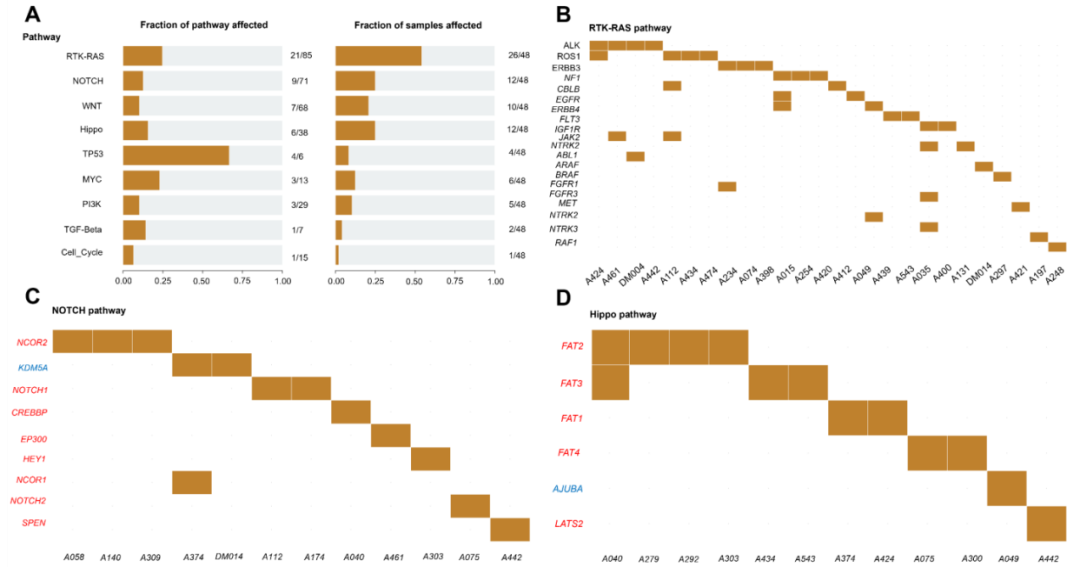

图7
NB突变基因的功能富集分析:
为深入了解NB中572个突变基因的生物学意义和相关通路,研究者进行了GO和KEGG通路富集分析(图8A-D)。在生物过程方面,GO分析显示转录调控、激酶活性、蛋白质(肽酰酪氨酸磷酸化)、多细胞生物发育、DNA修复和细胞衰老显著富集(图8A)。关于CC的GO术语,突变基因主要定位于核质、细胞核、染色质和细胞质(图8B)。分子功能GO术语表明,突变基因主要参与DNA、ATP、染色质和蛋白质结合,以及转录激活因子、转录因子和共激活因子的活性(图8C)。KEGG通路分析显示,所有突变基因与癌症、范可尼贫血以及PI3K-Akt和Rap1等信号通路显著相关(图8D)。此外,这些基因还与癌症中的转录失调、赖氨酸降解以及多种癌症(包括肝细胞癌、乳腺癌、结直肠癌、前列腺癌和子宫内膜癌)相关。
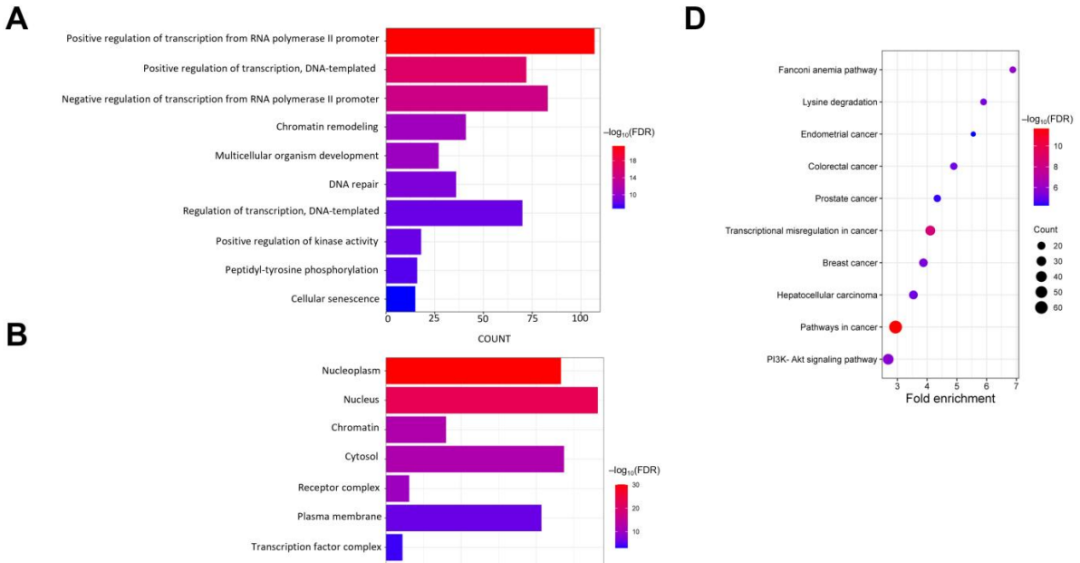
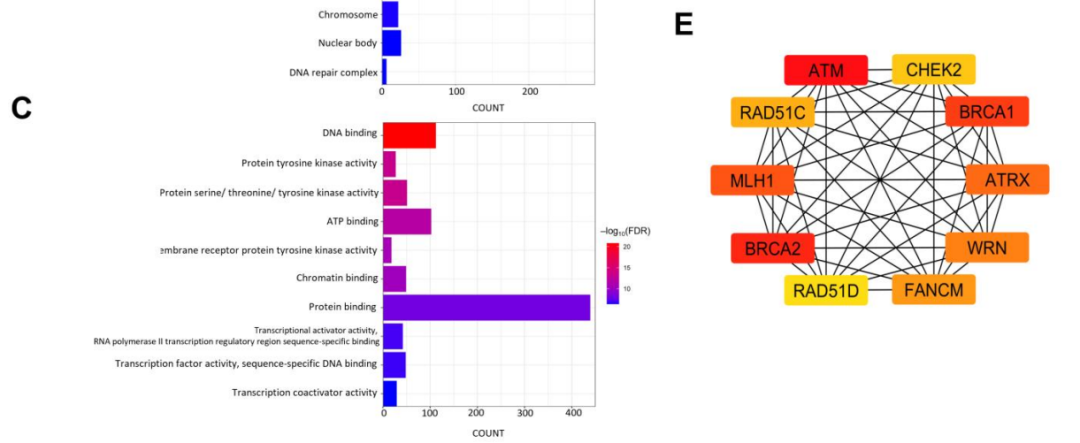

图8
PPI网络与枢纽基因鉴定:
使用STRING构建突变基因的PPI网络,得到570个节点和5349条边。随后将STRING网络导入Cytoscape软件(版本3.10.1)进行增强可视化。移除54个未连接到核心网络的节点,剩余516个节点和5347条边用于分析。使用Cytoscape中的CytoHubba插件和MCC算法鉴定枢纽基因。根据MCC排名,前10个候选枢纽基因依次为ATM、BRCA2、BRCA1、MLH1、ATRX、WRN、FANCM、RAD51C、CHEK2和RAD51D(图8E)。
癌症驱动基因及治疗靶点和药物反应生物标志物的鉴定:
接下来,研究者使用CGI的计算方法(oncodriveMUT和boostDM)研究所有样本中检测到的体细胞变异是否可注释或预测为驱动突变或乘客突变。在CGI服务器分类的964个体细胞变异中,122个突变被鉴定为候选“驱动”突变,存在于87.5%的样本中,而792个被分类为“乘客”突变。此外,有24个突变被分类为“非蛋白质影响”。在122个驱动突变中,共有15个在Oncokb(4个突变)、Oncokb和CGI(1个突变)或ClinVar(10个突变)中有充分注释,这些突变分布在MUC4、ALK、BRAF和FGFR1中。预测的驱动突变位于87个不同基因中。14个样本(29.2%)在包括若干已鉴定的驱动基因(如MUC16、MUC4、ALK和CTNND1)的5个变异中至少携带一个反复驱动突变(表2)。研究者还使用ANNOVAR的计算机预测工具预测了反复癌症驱动突变的有害功能效应。没有预测工具适用于分析MUC4中的两个反复变异。对于MUC16基因,MutationTaster和BayesDel(addAF和noAF)分别将一个反复剪接位点变异分类为致病和有害。ALK F1174L突变被SIFT、MutationTaster、PROVEAN、M-CAP和BayesDel(addAF和noAF)预测具有有害效应。同样,CTNND1基因中的体细胞驱动变异被SIFT、MutationTaster、PROVEAN和M-CAP预测对蛋白质功能有负面影响。关于反复驱动突变,MUC16中的剪接位点驱动变异存在于两个样本(4.2%)中。MUC4基因在第1679位苏氨酸和第1680位脯氨酸之间存在32个核苷酸的框内插入(p.T1679_P1680ins)。关于ALK基因,研究者在单个样本中观察到反复突变F1174L和ALK R1275Q。值得注意的是,研究者还发现了CTNND1基因中的反复错义突变R439C。这种新驱动突变在两个肿瘤样本中鉴定,并通过使用Applied Biosystems 3730/3730xl DNA分析仪的Sanger测序进一步验证。突变样本中反复癌症驱动基因的存在总结于表3。总之,每个样本的平均驱动突变数为2.5,中位数为2.5(突变范围,0-6)。根据前10个最常见突变基因列表,MUC4、MUC16、KMT2C和PREX2被注释为癌症驱动基因。在15个反复驱动基因中,MUC4在样本中最普遍(12/48,25.0%),其次是KMT2C(4/48,8.3%)和PREX2(4/48,8.3%)。其余肿瘤在两个肿瘤样本中检测到。
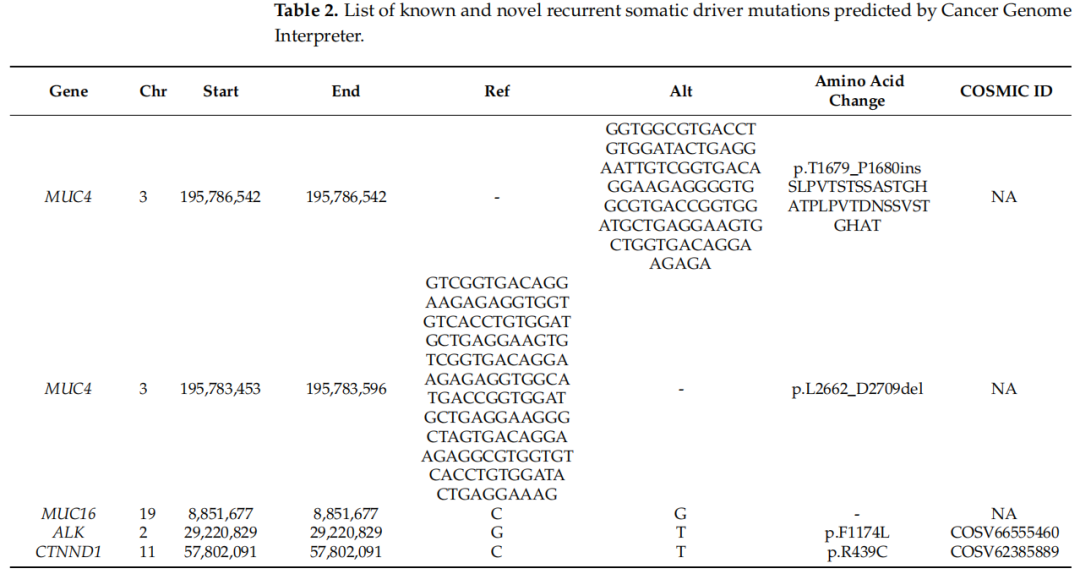
表2
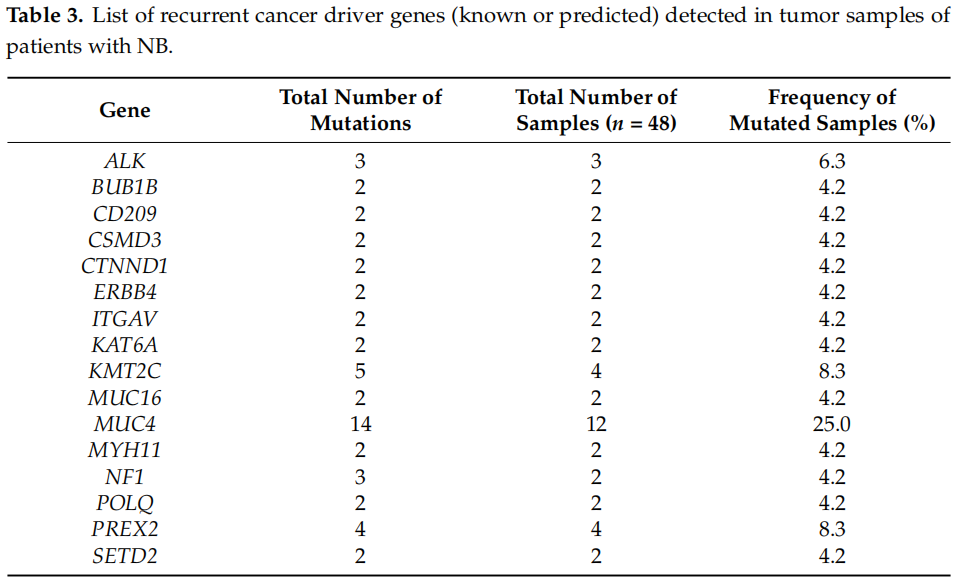
表3
对于个性化治疗中的CGI注释,研究者仅选择与相同基因和肿瘤类型(神经母细胞瘤或任何癌症类型)中鉴定的氨基酸变异完全匹配的可成药变异作为观察到的生物标志物。在11个样本(22.9%)中鉴定出跨越7个基因(NF1、ALK、SETD2、BRCA1、NOTCH1、ATR和FGFR1)的10个可干预突变(表4)。这些生物标志物得到早期试验(ALK、BRCA1和NOTCH1中的4个突变)和临床前数据(NF1、ALK、SETD2、ATR和FGFR1中的8个突变)的支持。其中,两个样本携带ALK F1174L突变作为潜在药物靶点,并对阿来替尼、克唑替尼、TAE684、AZD3463和劳拉替尼有反应。然而,这种突变可能导致克唑替尼耐药。在本研究的一个肿瘤样本中,ALK中的R1275Q突变也被鉴定为克唑替尼、劳拉替尼和TAE684的治疗靶点,尽管该突变可能对TAE684表现出耐药性。尽管如此,此类治疗的支持证据处于临床试验阶段。研究者鉴定出三个NF1致癌突变(Q1798*、Q2616*和S636X),可能导致对维甲酸的耐药性。预测对WEE1抑制剂有反应的驱动突变包括SETD2的P10L和Q1829E以及BRCA1的R612S。研究者还分析了其他肿瘤类型中这些可干预变异的药物再利用。在此背景下,研究者鉴定出24个用于治疗各种癌症的药物的预测生物标志物。指南或后期试验中有几种药物可用。
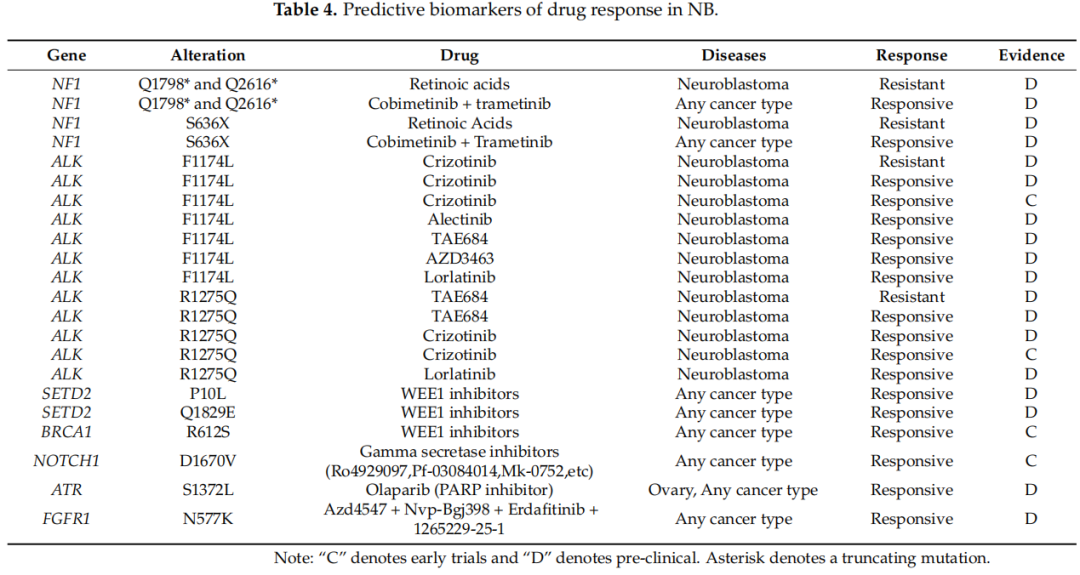
表4
化疗耐药相关生物标志物的鉴定:
为鉴定化疗耐药的预测标志物,研究者使用Fisher精确检验比较了化疗敏感组和化疗耐药组中体细胞突变的比例。结果显示,OR4N2、MC1R和NUP214中的变异与化疗耐药显著相关(p值<0.05)(图9)。CGI结果显示12个基因中的14个癌症驱动突变:EPHA2、NSD1、BUB1B、CTNND1、KAT6A、MUTYH、MAP3K13、MUC4、KMT2C、VAV1、BIRC6、NF1和MUC4。每个化疗耐药患者至少携带一个驱动突变,未鉴定出反复驱动因子。CGI提供了特定药物的列表及其在具有这些变异的患者中的反应,这些药物可能作为替代治疗选择。NF1基因S636残基的四名患者中有一名对考比替尼和曲美替尼有良好反应。这些药物在任何癌症类型中均有效,并且已在临床前研究中报道。EGFR单克隆抗体抑制剂,即西妥昔单抗和帕尼单抗,可能是对抗化疗耐药NB的相关选择,因为化疗耐药组中的所有患者均为野生型KRAS,表明有反应性。西妥昔单抗和帕尼单抗均已证明对结直肠腺癌有效,并在指南级研究中有证据支持。
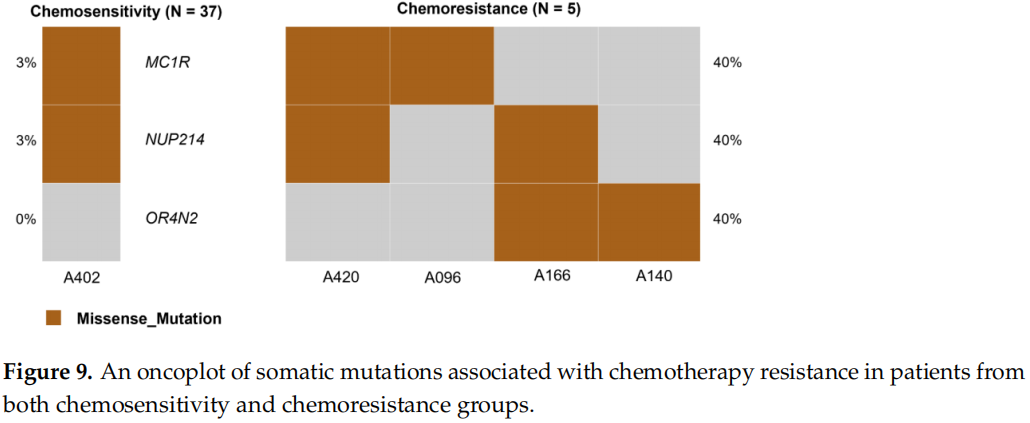
图9
讨 论
NB是幼儿中一种侵袭性颅外恶性肿瘤,表现出高度的临床和生物学异质性,对儿科治疗(尤其是化疗)构成重大挑战。根据修订的COG标准分类为高危组的患者,尽管采用了多模式强化治疗,其5年OS率仍低于50%。此外,高危NB患者可能在长期治疗后对化疗药物无反应,导致预后和临床结局较差。鉴于NB肿瘤的极端异质性以及为高危NB患者制定治疗策略的需求,采用个性化医疗作为应对该癌症的新方法备受期待。随着高通量测序技术的出现,目前已可从肿瘤中获取大量基因信息,以促进为每位患者量身定制治疗方案,从而实现更有利的疗效和最小毒性。然而,NB(尤其是高危病例)的综合基因变异仍知之甚少,阻碍了靶向治疗的发展。本研究试图揭示48例泰国NB患者(尤其是高危组)新鲜冷冻肿瘤样本的独特突变图谱。尽管样本数量有限,研究者还评估了TMB,并探讨了NB患者临床参数与高频突变基因以及TMB之间的相关性。研究者进一步寻求鉴定候选癌症驱动突变和基因及其作为推定可干预生物标志物的意义,以在基因组指导的癌症治疗前预测药物反应性。使用了多种生物信息学工具来深入了解突变和致癌特征、体细胞突变的功能和通路富集以及NB相关的关键蛋白质。
在本队列中,男性患者比例(66.7%)高于女性患者(33.3%),这与泰国先前一项研究一致,该研究报告称57.9%的男性和42.1%的女性患者为高危NB。东南欧儿童中也观察到男孩NB发病率较高。东南欧队列中患者的诊断中位年龄低于本研究(2岁 vs. 2.7岁)。本研究中患者诊断中位年龄较高可能部分归因于泰国缺乏成熟的NB筛查计划,这可能导致诊断延迟。另一种可能性是大多数病例来自其他医院转诊,导致该院医疗记录中记录的诊断日期较晚。INRG M期和INSS 4期且年龄大于18个月的患者占多数,这与既往接受自体干细胞移植的高危神经母细胞瘤队列一致。根据国家儿童癌症治疗方案,年龄超过18个月的转移性肿瘤(M期)患者可归为高危组。部分样本出现神经节瘤和节神经母细胞瘤组织学的发现很可能是化疗引入所致,因为众所周知化疗有助于神经母细胞瘤的成熟。这一解释得到以下观察的支持:所有患者化疗前均为神经母细胞瘤组织学,而化疗后患者可见更成熟的神经母细胞分化阶段。本研究中观察到的高转移频率可能归因于大多数重症患者转诊至该院(三级医院)。此外,与基于美国人群的监测、流行病学和最终结果数据相比,样本量较小和人群差异可能导致该结果存在偏差。与既往NB研究一致,最常见的转移部位是骨骼和骨髓。NB复发趋势的报道存在差异,与早期研究(30.3%)相比,本研究的复发率显著降低(8.3%)。低复发率可能源于记录患者复发状态的时间差异。研究者在样本采集时标记复发状态,而非末次随访时,这可能与其他研究不同。此外,大多数患者对化疗表现出良好反应,部分NB患者为其他医院转诊的新病例。本研究的复发率与末次随访时患者的生命状态一致,存活患者多于死亡患者。
接下来,研究者探讨了高频突变与临床病理特征之间的相关性。本研究结果显示,DMD突变状态与NB患者的性别显著相关。DMD是一种427 kDa的肌营养不良蛋白,通过与肌聚糖和肌营养不良蛋白等不同的蛋白质相互作用,支持肌纤维细胞骨架和肌膜细胞外基质之间的连接。DMD基因的基因组变异在临床上与杜氏肌营养不良症相关,这是一种X连锁神经肌肉疾病,属于遗传性肌营养不良症的一种,由抗肌萎缩蛋白的蛋白质翻译失败导致。此外,DMD的体细胞突变与非肌源性癌症患者的不良生存结局相关。RNF213(环指蛋白213)的突变状态与骨转移相关,该基因编码一种590 kDa的蛋白质,具有真正有趣的新基因(RING)指和AAA ATP酶结构域。在既往研究中,RNF213突变在转移性肿瘤中被鉴定,并与多种癌症(如肝癌、卵巢癌和胃癌)的肿瘤发生相关。
研究者还评估了最常见突变基因对NB患者OS的预后价值(图3)。尽管研究者未发现MUC4、MUC16、FLG、OBSCN、RNF213或DMD的任何突变与OS相关,但研究者确实发现MUC4和LRRN3的突变与OS呈显著负相关。作为一种膜结合粘蛋白,MUC4通常在气管、唾液腺、结肠、生殖道和细支气管中表达,其异常会导致肿瘤生长、转移和化疗耐药。此外,MUC4突变与结肠癌的不良预后相关。富含亮氨酸重复神经元蛋白3(LRRN3)属于LRRN家族,在脑、睾丸和肾上腺中高表达。NB患者的不良生存结局与LRRN3低表达相关。MUC4和LRRN3突变的组合可能作为NB的负性预后生物标志物,尽管需要在更大的队列中进一步验证其效用。MUC16编码最大的膜结合粘蛋白,与MUC4不同,其在眼表、生殖和内脏器官以及上呼吸道上皮中表达。与MUC4相反,突变的MUC16可能作为胃癌良好生存结局的预后标志物。由FLG基因编码的丝聚集蛋白或聚丝蛋白是在皮肤、颈部和口腔粘膜屏障中起功能作用的重要分子。膀胱尿路上皮癌患者中FLG突变的存在与更长的OS相关。OBSCN基因跨越超过150 kb,包含80多个外显子,编码 obscurin,这是一种肌节信号蛋白家族成员,其分别在乳腺癌和卵巢癌中作为肿瘤抑制因子和具有致癌特性。Obscurin参与许多信号通路,包括RAS、GPCR、Wnt和p75,并可能调节癌症的发生和进展,尤其是在乳腺癌中。Liu等人报道,结直肠癌患者OS的增加与OBSCN基因的变异显著相关。RNF213突变与OS之间的关系此前未见报道。既往研究表明,非肌源性肿瘤中的DMD突变与不良OS相关。总体而言,这些结果应谨慎解释,因为许多患者失访。
在这项回顾性研究中,WES仅对从48例患者获取的新鲜冷冻肿瘤组织进行,无匹配的正常样本。研究者按照既往研究对仅肿瘤样本的体细胞变异检测应用了严格的过滤标准。这种最佳过滤方法提高了在仅肿瘤模式下使用Mutect2检测体细胞突变的灵敏度和特异性。NB队列中突变频率最高的前10个基因是MUC4、MUC16、FLG、OBSCN、RNF213、DMD、KMT2C、RANBP2、APOB和PREX2(图1)。MUC4、MUC16和KMT2C的频率在既往研究中也显著较高,暗示它们在神经母细胞瘤发生中的作用。此外,本研究中MUC4和MUC16突变的频率显著高于既往关于MYCN非扩增神经母细胞瘤的研究(MUC4:70% vs. 26%;MUC16:38% vs. 14%)。据报道,MUC4参与神经节瘤的进展。这种跨膜粘蛋白阻止癌细胞粘附于原发肿瘤,导致肿瘤转移。因此,研究者推测MUC4在本队列患者的转移发展中起关键作用。
MUC4的反复变异此前未见报道,包括p.T1679_P1680ins(6个样本)、p.T1891A(5个样本)、p.V2777del(4个样本)、p.L3381P(4个样本)、p.G3660A(4个样本)、p.V1006A(2个样本)、p.L2662_D2709del(2个样本)和p.A3294P(2个样本)。所有突变均位于外显子2,该外显子编码最大的结构域和O-糖基化位点。本研究中观察到的MUC4外显子2变异的积累与既往肺癌患者的研究一致。儿科神经节瘤患者中已报道MUC4变异p.Ser2666Tyr和p.Ser2661Gly。然而,由于研究者发现的体细胞MUC4变异总数位于功能域之外,其对MUC4蛋白功能的影响可能受到质疑,因为很少进行实验研究来证实这些突变在MUC4中的功能意义。
MUC16(也称为CA125)是一种高分子量糖基化蛋白,通过与Janus激酶相互作用介导乳腺癌和肺癌的发展。在NB中,MUC16变异常见于MYCN非扩增患者,并与其复发状态相关。本研究结果显示,外显子1中存在单个反复突变N2375S,该外显子属于MUC16的糖基化细胞外序列。其他研究尚未证实MUC16反复体细胞突变参与NB或其他肿瘤类型的发展。
本队列中的FLG基因(编码丝聚蛋白,一种屏障相关分子)突变频率高于既往研究(28% vs. 4%);然而,FLG在NB中的功能仍未知。与既往报道一致,研究者未观察到任何与NB肿瘤进展相关的FLG反复变异。
OBSCN突变在高危NB中检测频率较高(23.3%),并在不同癌症类型中被发现。OBSCN基因参与细胞存活和凋亡,被认为是乳腺癌的潜在驱动因子。当发生突变时,它们会导致蛋白质丢失,从而增加DNA损伤的暴露。本研究结果与既往关于高危神经母细胞瘤的研究相反,因为未观察到OBSCN的反复突变。然而,反复变异的细节尚未披露。
RNF213是与烟雾病相关的已确认易感基因,其通过调节MAPK/JNK信号通路在肿瘤抑制中的重要作用已在胶质母细胞瘤中报道。Qin等人将RNF213鉴定为NB中OS的新预后生物标志物。本研究和既往研究中均未鉴定出影响NB发展的RNF213反复变异。
DMD是一种肿瘤抑制因子,与许多肿瘤类型的发病机制相关,如淋巴瘤、肉瘤和黑色素瘤。既往发现DMD基因的突变在NB的发展中起作用,尤其是体细胞缺失,其参与嗅神经母细胞瘤的发病机制。NB中尚未描述已确认的DMD反复突变。
KMT2C是一种组蛋白赖氨酸甲基转移酶,在DNA修复和基因组不稳定性中起作用。此外,KMT2C作为驱动基因促进乳腺癌的肿瘤进展,并且在各种癌症类型中(尤其是NB)已发现KMT2C的高突变率。
RanBP2是核孔复合体的一种350 kDa蛋白,具有Ran结合结构域和富含FG的重复序列,可高亲和力结合Ran GTP。RanBP2被鉴定为肺癌中的新肿瘤抑制因子,并已显示在细胞过程和蛋白质稳定(包括RAN蛋白)中起重要作用。尽管已描述RANBP2的异常参与肿瘤发生,但它们与NB风险无显著关联。
APOB是肝脏合成的极低密度脂蛋白(VLDL)的核心结构蛋白成分,在人体脂质运输中起关键作用。既往研究已证明APOB在神经嵴发育中的作用,表明其与NB的发生和进展相关。
PREX2是一种183 kDa的调节蛋白,称为鸟嘌呤核苷酸交换因子,可刺激小鸟苷三磷酸酶Rac并介导Akt和Rac信号通路。PREX在癌症中起重要作用,因为PREX2a的缺失会阻碍NB的增殖、迁移和侵袭。
总之,在本研究NB队列中观察到的显著共发生基因对包括APOB和PREX2、RNF213和LRRN3、CNTRL和ITGAV,以及LAMA5和LRRN3,而在体细胞互斥事件方面,观察到MUC4和SETD2之间存在互斥相互作用。此前,在胰腺导管腺癌中观察到突变基因对ARID1A-APOB的共现以及KRAS-APOB对的互斥,且差异显著。在转移性实体癌中,PREX2的基因变异通常伴随RUNX1T1表达。鉴于先前研究中描述的APOB和PREX2的作用,研究者推测APOB突变可能与PREX2突变协同促进神经嵴增殖并驱动NB发展。先前研究表明,在人类乳腺癌样本中,RNF213与NF1共突变。在隆突性皮肤纤维肉瘤中已鉴定出MUC4和MUC6的互斥突变。此外,在透明细胞肾细胞癌中,SETD2-BAP1突变存在互斥趋势。由于本研究中发现的共发生和互斥突变均未被先前报道,因此需要对神经母细胞瘤中这些共变异基因进行评估,以确定其未知的功能相互作用并探索潜在的治疗靶点。
TMB被认为是预测免疫检查点阻断治疗反应的新型生物标志物。确定TMB对于对可能从免疫治疗中获益的癌症患者进行分层至关重要。然而,尽管FoundationOne CDx检测确定的10mut/Mb的TMB已被FDA批准为使用程序性死亡蛋白1抑制剂治疗所有实体瘤的阈值,但WES尚未建立适用于所有癌症将患者分为高TMB和低TMB的普遍有效临界值。TMB通常定义为每Mb肿瘤外显子区域测序中的非同义突变总数;然而,一些研究使用所有类型的突变来估计TMB。由于早期研究表明,与肿瘤-正常配对测序相比,仅通过肿瘤测序获得的TMB被高估,研究者通过使用Sukhai等人提出的更严格过滤方法尽可能排除非体细胞变异来解决这一问题。
在本研究中,个体患者的TMB值范围为3.37至6.54mut/Mb,中位TMB为4.22mut/Mb(图4)。与之前两项关于MYCN非扩增(0.66mut/Mb)和嗅觉NB(0.45mut/Mb)的队列研究相比,本队列中的中位TMB显著更高,这可能表明使用严格过滤标准后仍无法完全排除的大量胚系变异(假阳性)、使用不同的TMB计算流程或生物信息学管道,或患者群体的差异。目前,在不同肿瘤类型中,尚无将患者分为高TMB和低TMB的共识TMB临界值。已提出几种确定特定TMB临界值的方法:任意方法;基于中位数、三分位数、四分位数或对数秩的方法;基于病理图像的方法;图形方法;以及基于临床研究的方法。然而,由于本研究的样本量小、缺乏肿瘤组织的苏木精和伊红染色切片,以及缺乏关于NB的相关研究和临床试验,如前所述,使用中位TMB值作为最终临界值。基于中位TMB作为临界值,25名患者被分层为高TMB组(≥4.22mut/Mb),该组可能对免疫检查点阻断反应良好。高TMB值被认为反映了肿瘤中的癌症新抗原,这些新抗原被称为T细胞的活化免疫细胞靶向并清除。
本研究结果表明,高TMB组与任何临床病理参数无关,在不同年龄、性别或原发部位的NB患者之间未观察到TMB值的显著差异。相比之下,Hwang等人报道了18个月龄患者与NB患者高TMB水平之间的关联。研究者还发现,高TMB组和低TMB组患者的OS无差异,尽管高TMB组存在OS较差的趋势。一致地,先前报道NB高TMB组患者的5年OS短于低TMB组(体细胞变异数为3个或更少)。需要进一步研究来阐明这种关系。
在癌细胞的整个生命周期中,暴露于不同来源的DNA损伤会产生数千个体细胞突变,留下特定于DNA损伤的独特指纹。在本研究中,研究者试图确定与NB相关的独特突变特征以及观察到的特征背后的突变过程(图6)。研究者观察到NB肿瘤样本中体细胞C>T转换突变占主导地位,这与多种癌症类型相关。更重要的是,C>T突变特征可能归因于肿瘤抑制基因的DNA甲基化。在本系列中,类似时钟的COSMIC特征SBS 5和1在包括NB在内的几种人类癌症中普遍存在,并与患者年龄相关,其次是SBS 6和3。由于本队列中的患者年龄较小,这些观察到的突变特征不一致,可能表明与年龄相关的突变模式比通常更快,以及DNA损伤和修复之间的不平衡。与先前报道类似,下一个最丰富的特征是SBS6和SBS3,它们分别与DNA错配修复失败和双链DNA同源重组修复失败相关。SBS3相关突变主要在无MYCN扩增的高危NB患者中观察到。本研究结果表明,DNA错配修复和DNA损伤修复的同源重组受损是NB突变发生的基础。出乎意料的是,在NB肿瘤样本中不存在NB中高度富集的ROS相关特征18。此外,先前研究显示MYCN非扩增NB中SBS18的发生率较低。这些结果与先前的观察结果一致,即该特征在已知高危和MYCN扩增的NB患者中频繁观察到。尽管如此,研究者在五名已知高危和MYCN扩增的NB患者中未观察到与特征18相关的突变。特征18的缺失表明在获取突变特征的方法或算法、患者的基因背景、已验证的体细胞突变数量、NB肿瘤具有SBS18的内在和稳定趋势,更重要的是,SBS18对NB的非特异性方面存在差异。
在本研究的NB肿瘤样本中,受影响最大的致癌信号通路是RTK-RAS、NOTCH和Hippo通路,它们分别与ALK、NCOR2和FAT2的原发突变相关。RTK/RAS通路与细胞分化、生长、进展和存活有关,其变异涉及致癌作用和高危NB。例如,RTK-RAS信号通路的成员ALK基因编码属于胰岛素受体超家族的酪氨酸激酶受体。作为神经母细胞瘤中最常突变的基因,ALK变异通过激活酪氨酸激酶受体促进肿瘤生长、增殖和迁移。许多研究表明,NOTCH信号通路在神经增殖、分化和存活中起作用,并根据癌症类型具有致癌或抑癌特性。该通路已被证明作为抑制肿瘤细胞分化的抑癌因子参与NB发病机制。NCOR2是NOTCH信号通路的核受体共抑制因子2,调节不同肿瘤的转录。已显示NCOR2发挥染色质重塑作用以调节NB致癌作用。Hippo信号通路调节组织和器官中的细胞增殖、分化、凋亡和稳态。先前研究证明了Hippo通路在NB调节和肿瘤发生中的重要作用,其成员的高表达与NB的侵袭和转移相关。与其他研究一致,NB中的体细胞变异主要影响RTK-RAS信号通路。
GO和KEGG通路富集分析揭示了本NB队列中检测到的体细胞突变基因的潜在功能分类和相关通路。因此,GO富集分析表明,所有突变基因均参与特定的生物学过程,包括转录调控、染色质重塑和激酶活性调节。一致地,与MF相关的基因在酪氨酸激酶活性以及因子、激活剂和共激活剂的转录活性中显著富集。与本研究GO结果类似,位于反复缺失染色体区域的基因参与转录调控,而低风险组的基因如前所述与酪氨酸激酶活性相关。各种转录调节因子和受体酪氨酸激酶的异常有助于神经母细胞瘤的病理发展。例如,MYCN基因的过表达导致凋亡信号抑制和细胞增殖诱导,ALK的激活突变促进肿瘤生长、增殖和迁移。先前研究证实染色质重塑的缺失与NB进展相关。具体而言,所有突变基因的富集GO术语均与基因表达调控相关。除了转录调控外,所得KEGG分析表明,突变基因与癌症和PI3K-Akt信号通路相关。后者促进神经母细胞瘤中的细胞存活并防止凋亡。枢纽基因定义为与大量其他基因相互作用的基因。通过构建PPI网络并使用CytoHubba,研究者确定ATM、BRCA2、BRCA1、MLH1、ATRX、WRN、FANCM、RAD51C、CHEK2和RAD51D是与NB相关的前10个候选枢纽基因。ATM是NB中潜在的肿瘤抑制因子,在调节凋亡、细胞周期停滞以及修复内源性基因组应激或外源性辐射引起的双链断裂中起关键作用。先前研究表明,miR-421对ATM的下调促进神经母细胞瘤进展。BRCA1和BRCA2是几种癌症中的肿瘤抑制因子,参与应对DNA断裂的DNA修复、转录调控和细胞生长控制。据报道,BRCA2与NB发展相关,尽管其潜在机制尚不清楚。在MYCN驱动的NB中,BRCA1对维持启动子序列的转录过程和DNA修复至关重要。需要进一步研究来了解这些枢纽基因在NB肿瘤发展中的确切作用。
驱动突变主要通过影响细胞增殖、凋亡、生长、能量代谢调节和免疫逃逸等关键细胞功能促进肿瘤发生。鉴定新的癌症驱动突变和基因可能为NB的发生机制提供重要见解,并为NB的早期诊断、预后判断和靶向治疗提供新的生物标志物。本研究发现每个NB肿瘤约携带3个驱动突变,这与先前报道的约5个驱动突变非常接近。在鉴定出的122个驱动基因突变中,有5个出现在至少两个样本中,包括MUC4、MUC16、ALK和CTNND1。这些驱动突变包括MUC16的剪接位点突变、MUC4中p.T1679_P1680ins的框内插入和p.L2662_D2709del的框内缺失、ALK的F1174L突变以及CTNND1的R439C突变。使用多种计算机预测工具预测了频发驱动突变的有害功能效应,许多工具将这些突变分类为可能对蛋白质功能具有有害影响。
尽管粘蛋白MUC4和MUC16的这些变异在NB肿瘤中尚未有过描述,但先前的研究已在粘蛋白基因中鉴定出点突变。由于WES在检测插入缺失(>20 bp)和剪接位点方面存在局限性,可能需要使用混合WES和Sanger测序进一步确认这些突变,以提供可靠的结果。ALK F1174L突变在家族性或散发性NB中频繁检测到,并在MYCN扩增的NB中具有强烈的致癌活性,可诱导组成型激活并调节MYCN基因。对细胞系的体外研究表明,该突变对TAE684和阿来替尼敏感,但对克唑替尼具有耐药性。肿瘤驱动因子CTNND1是参与细胞间粘附以及Rac1、Cdc42和Ras同源基因家族成员A(RhoA)激活的关键成分,据报道可抑制肿瘤细胞的迁移和侵袭。连环蛋白在人类胰腺癌中可能作为肿瘤抑制因子,而在肝细胞癌中作为癌基因,其过表达通过调节Wnt/β-连环蛋白信号传导促进HCC的侵袭和转移。CTNND1的可变剪接和定位改变促进细胞迁移和侵袭。此外,CTNND1变异与OS较差相关。本研究结果揭示了NB肿瘤中CTNND1的一种新的频发驱动突变R439C,其可能作为早期诊断和预后的新型生物标志物以及治疗靶点。
从临床角度来看,基因组指导的个体化精准治疗需要可靠的生物标志物来预测药物反应并促进患者的成功治疗。在此,研究者使用CGI鉴定出11种推定的可干预生物标志物,即NF1 Q1798*、Q2616*和S636X,ALK F1174L和R1275Q,SETD2 P10L和Q1829E,BRCA1 R612S,NOTCH1 D1670V,ATR S1372L和FGFR1 N577K,这些生物标志物先前在NB或任何癌症类型中已有报道,并且可能是现有或当前正在临床前或临床试验中研究的药物靶点。其中一些突变因其在耐药性中的作用已被广泛研究。例如,F1174L取代似乎是ALK中最常见的体细胞突变之一,并与MYCN扩增相关。这种变异通过促进ATP结合导致克唑替尼结合减少,从而导致克唑替尼耐药。对于ALK F1174L突变,除了阿来替尼以及克唑替尼和PI3K/AKT/mTOR通路的联合应用外,高剂量克唑替尼可能有效。这些先前的发现与本研究结果一致,表明该突变可能赋予对克唑替尼的敏感性或耐药性以及对阿来替尼的敏感性。由于其ATP结合亲和力低,R1275Q是家族性神经母细胞瘤中最常见的突变之一,并且对克唑替尼表现出最高的敏感性。此外,据报道其对TAE684敏感。由于缺乏经过验证的药物反应变异以及NB中广泛的肿瘤内异质性,仅有少数NB患者含有药物反应的候选生物标志物。由于几种用于治疗各种癌症类型的药物处于临床前阶段,它们可能有潜力被重新用于NB的替代治疗。本队列中NB患者通过其可用药变异对这些药物的潜在反应性的观察进一步支持了这一点。本研究结果证明了使用综合数据库预测具有推定癌症驱动突变的患者的药物反应性,并将其转化为个性化医疗。此外,它提供了NB患者中可用药变异的频率信息,这可能对药物开发有用。
尽管进行了强化多模式治疗,高危患者的长期生存仍然较差。NB成功治疗的主要障碍之一是化疗耐药性。据报道,71-85%的高危患者在诱导治疗后表现出部分或完全缓解,而约20%的患者对标准化疗表现出不利反应。本研究调查了NB患者中与化疗耐药相关的体细胞变异。所有5名患者均对化疗耐药。相关性分析确定了三个基因的变异,包括OR4N2、MC1R和NUP214,这些变异与化疗耐药相关。SET-NUP214(TAF1/CAN)融合基因已显示与成人T细胞急性淋巴细胞白血病的化疗耐药性密切相关。然而,需要注意的是,样本量太小,这可能导致统计效力较低。需要更大样本量的额外研究来确认它们与化疗耐药性的关联。
为了为化疗耐药的NB患者寻求其他治疗选择,研究者使用CGI平台鉴定预测对所列药物有良好反应的癌症驱动突变。研究者在所有化疗耐药患者(n=5)的12个基因中发现了14个驱动突变,所有这些突变都与可用药物相关。PALB2(p.A245V)和RAD51C(p.S16G)突变存在于两个化疗耐药病例中,并预测对奥拉帕利(一种PARP抑制剂)敏感。这种PARP抑制剂已被FDA批准用于治疗转移性去势抵抗性前列腺癌。然而,将这些FDA批准的药物重新用于NB治疗需要评估其在NB患者中的有效性和安全性。因此,需要进一步的研究来评估本研究中确定的药物对化疗耐药NB患者的治疗潜力。
当前研究需要解决几个局限性。首先,样本量小,从而限制了分析中的统计效力,包括临床病理参数与突变之间的相关性分析,并削弱了结果的准确性和可靠性。由于是回顾性设计,无法从患者的医疗记录中获得完整和详尽的信息。此外,在调用体细胞突变时,没有匹配的正常样本用于扣除所有胚系变异,也没有通过基因表达分析进一步验证体细胞变异。另一个局限性是难以排除化疗诱导的突变,并且由于几乎所有肿瘤都是在化疗后收集的,因此难以鉴定与NB发展和化疗耐药相关的体细胞突变。然而,研究者通过使用CGI服务器鉴定癌症驱动突变并比较两组患者(化疗敏感者和化疗耐药者)来解决这些问题,以寻找NB中化疗耐药的预测标志物。另一个潜在的局限性是NB肿瘤的高度异质性。由于仅对切除肿瘤的一个区域进行采样并送去进行全外显子测序,这种方法没有捕捉到这些肿瘤中体细胞突变的完整情况,因为从同一肿瘤的不同区域采样可能会产生不同的突变。由于缺乏所有肿瘤样本中免疫和非免疫细胞的完整和一致的组织学数据,无法进行肿瘤免疫微环境分析。此外,尚未进行体细胞驱动突变的功能研究来验证其在NB发展中的作用。最后,大多数患者未确定其MYCN扩增状态,因为仅在儿科肿瘤学家治疗前风险分类不明确的病例中进行评估。尽管存在这些局限性,本研究能够展示NB患者的体细胞突变图谱,鉴定药物反应的预测生物标志物,并为化疗耐药患者提供治疗选择。
本研究是首次在泰国患者中绘制体细胞突变的综合突变图谱,并鉴定出频繁突变的基因,如MUC4和MUC16,其具有显著的癌症驱动变异。CTNND1中的频发错义突变R439C已被鉴定为NB的新型推定癌症驱动变异。研究者证明了WES在预测肿瘤患者药物反应中的实用性,为临床医生提供了正确的治疗方法。已经提出了用于治疗化疗耐药NB患者的有前景的药物。先前已建立了NB的基因突变谱与临床病理参数之间的显著相关性。MUC4和LRRN3的突变与OS呈显著负相关。仅肿瘤样本的TMB被高估,并且高TMB组和低TMB组在患者OS方面没有差异。在NB样本中,RTK-RAS、NOTCH和Hippo信号通路受到显著影响,所有突变基因均显著富集于基因表达调控。突变特征5、1、6和3显著,与NB相关的核心基因为ATM、BRCA2和BRCA1。
参考文献:
okchan, N.; Suthapot, P.; Choochuen, P.; Khongcharoen, N.; Hongeng, S.; Anurathapan, U.; Surachat, K.; Sangkhathat, S.; Thai Pediatric Cancer Atlas (TPCA) Consortium. Whole-Exome Sequencing Reveals Novel Candidate Driver Mutations and Potential Druggable Mutations in Patients with High-Risk Neuroblastoma. J. Pers. Med. 2024, 14, 950. https://doi.org/10.3390/jpm14090950

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)