首页 > 医疗资讯/ 正文
由于缺乏有效的化疗药物,肝癌是全球范围内导致死亡的主要原因。Cuprotosis(铜死亡)是一种新型的受调控的细胞死亡机制,为消除肝癌提供了一种新的潜在机制。
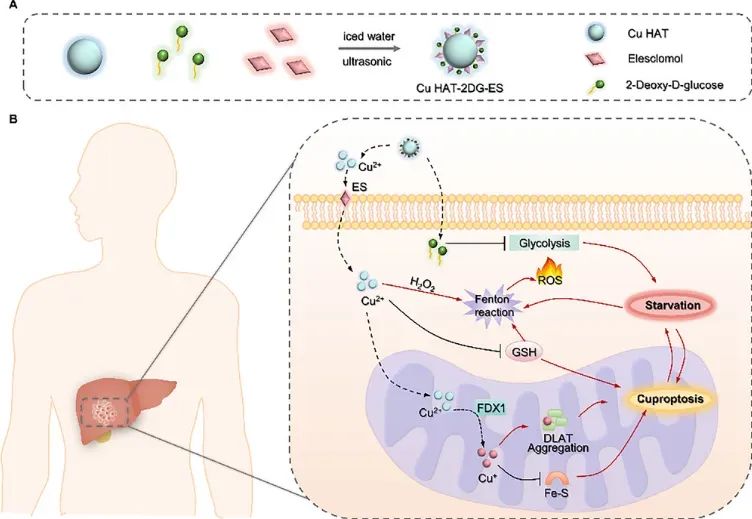
2025 年 6 月 5 日,西安交通大学第一附属医院刘晓菲和吕毅共同通讯在Advanced Science 在线发表题为“Copper-Based Nanotubes That Enhance Starvation Therapy Through Cuproptosis for Synergistic Cancer Treatment”的研究论文,该研究通过分析临床样本和数据库发现,肝细胞癌(HCC)对铜死亡敏感。因此,我们设计了一种铜基纳米管(NT),该纳米管带有铜离子载体,可增强铜死亡的诱导。
结合饥饿疗法,该NT显著抑制了HCC细胞的能量代谢。结果表明,Cu2+对GSH的消耗加剧了氧化应激和铜死亡,导致ROS生成和DLAT聚集,从而增强了铜死亡和Fenton反应。具有铜死亡、Fenton反应和饥饿疗法协同作用的NT,为HCC的治疗前景提供了宝贵的见解。

肝癌以肝细胞癌 (HCC) 为主,严重危害人类健康,2020 年导致 830180 人死亡。然而,大多数肝癌细胞对化疗不敏感,导致晚期肝癌患者面临治疗困境。铜凋亡 (Cuprotosis) 是一种近期发现的调节性细胞死亡形式,有望成为治疗肝癌的一种新策略,因为肝脏在铜代谢中起着核心作用,而铜代谢失衡会对肝脏产生不利影响。铜离子凋亡是由细胞内铜过量积累引起的,导致线粒体蛋白质聚集,进而导致铁硫簇蛋白丢失,最终导致三羧酸 (TCA) 循环中断和细胞死亡。但目前的研究主要集中在基因组学研究上,探索与铜离子凋亡相关的基因在肝癌治疗中的潜在应用。
肝癌与铜离子凋亡之间的基础研究尚处于起步阶段,尚待深入。同时,在过去的几十年中,已开发出多种用于肿瘤治疗的铜离子载体。例如,依乐斯克莫(Elesclomol,ES)在高乳酸水平的癌症患者中表现出显著疗效。然而,在糖酵解依赖性肿瘤细胞中,铜离子凋亡的作用有限,需要增强铜离子载体的疗效才能达到满意的疗效。纳米医学为基于铜离子凋亡的肿瘤治疗药物的开发提供了新的思路。
近年来,ROS(包括过氧化氢(H2O2)、单线态氧(1O2)和各种形式的氧自由基)在肿瘤发生发展中的作用机制已被广泛研究和探索,证实肿瘤细胞中ROS的过度积累是由于ROS生成-清除平衡失调造成的。随后,人们发现Cu离子可以通过Fenton反应催化肿瘤组织中过表达的H2O2生成有毒的·OH。此外,铜离子还能催化谷胱甘肽(GSH)的氧化,促使GSH转化为谷胱甘肽二硫化物(GSSG),从而增加细胞对铜凋亡的敏感性。
方案 1(图源自Advanced Science )
因此,提高铜离子浓度和活性氧水平可有效治疗肝细胞癌,因为它们具有协同作用。同时,肿瘤细胞用于糖酵解所需的葡萄糖比正常细胞多得多。因此,阻断肿瘤细胞的葡萄糖吸收成为一种干扰细胞代谢和诱导细胞死亡的有效策略,并促使人们对葡萄糖类似物或氧化酶进行了大量研究。2-脱氧葡萄糖 (2DG) 被用作饥饿疗法的葡萄糖类似物,它可以减少肿瘤细胞的能量供应,限制其增殖,并通过减少还原剂来加剧氧化还原平衡。然而,肿瘤细胞可以通过利用三羧酸循环 (TCA) 来减轻 2DG 的作用。因此,抑制糖酵解和三羧酸循环对于肿瘤饥饿疗法至关重要。
综上所述,铜基纳米材料能够提供充足的Cu离子诱导有效的细胞凋亡,从而抑制TCA循环,并作为Fenton反应和饥饿疗法的递送平台,有望成为治疗肝细胞癌(HCC)的潜在方法。因此,我们设计了一个铜基纳米平台,用于增强细胞凋亡、Fenton反应和饥饿疗法,从而治疗HCC。在该纳米管(NT)中,合成了CuHAT晶体,并负载了ES和2DG,它们催化Fenton反应,在细胞内产生过量的ROS。释放的Cu离子可以通过ES高效转运至细胞内,从而诱导细胞凋亡。同时,Cu离子可以氧化细胞内的GSH,增强细胞凋亡。2DG和细胞凋亡同步抑制肿瘤细胞内的糖酵解和TCA循环,协同扰乱肿瘤细胞的能量代谢,加剧氧化还原失衡,增强Fenton反应和细胞凋亡的作用。基于此背景开发的NT可以有效诱导肝细胞癌的杯状凋亡,并抑制小鼠肝细胞癌的生长。
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202504121
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)