首页 > 医疗资讯/ 正文
联合治疗是肺腺癌(LUAD)的一种有效策略,能够克服耐药性、副作用和肿瘤异质性。
2025年5月21日,广西医科大学阳洁、高明共同通讯在Biomaterials 上在线发表题为“CD44 and αV-integrins dual-targeting bimetallic nanozymes for lung adenocarcinoma therapy via NIR-enhanced ferroptosis/apoptosis”的研究论文。该研究报道了一种新型双靶向双金属纳米酶(MH-iRGD),由纳米级锰铁氧体(MF)组成,用多巴胺和甲基丙烯酸酐封装后修饰透明质酸,随后用整合素受体靶向肽(HS-PEG3400-iRGD)修饰用于LUAD靶向治疗。
研究证实,MH-iRGD结合近红外照射(NIR)具有显著的光热效应、活性氧(ROS)产生和GSH消耗能力。由于透明质酸涂层和iRGD修饰,MH-iRGD对过表达CD44和αV-整合素受体的LUAD细胞具有双重靶向能力。CD44和整合素的抑制剂可削弱LUAD细胞对MH-iRGD的摄取。此外,由于细胞内ROS的产生、谷胱甘肽(GSH)的消耗和线粒体功能障碍,MH-iRGD+NIR显示出优异的抗LUAD作用。从机制上讲,NIR通过下调SLC7A11、GPX4、Bcl-2水平同时上调Bax水平,增强MH-iRGD诱导的铁死亡和细胞凋亡。具体来说,在异种移植小鼠模型中,静脉注射MH-iRGD+NIR后,铁死亡和细胞凋亡增加,有效抑制LUAD生长。综上所述,该研究表明MH-iRGD+NIR是一种有效LUAD靶向疗法,它拓宽了高活性双靶向双金属纳米酶的应用。

尽管肺癌治疗已取得了可喜进展,但每年仍有约180万人死于肺癌。肺癌可分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),后者约占患者比例的80%-85%。目前,肺癌的治疗选择包括手术、放射疗法、化疗、靶向疗法和免疫疗法。靶向治疗和免疫治疗给NSCLC治疗带来变革性发展。然而,由于不可避免的耐药性、脱靶毒性、疗效有限和易复发,最常见的NSCLC肺腺癌(LUAD)仍是全球最致命的癌症。特别是,大多数LUAD患者在初始治疗后的选择有限,迫切需要探索LUAD的新疗法。
纳米酶是一类人工纳米材料,具有多种类酶催化活性,且存在物理化学稳定性、耐用性和成本低等优点。在以酸性pH值、缺氧、过表达GSH和H2O2为特征的肿瘤微环境(TME)中,纳米酶在模拟过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)的多种活性中起关键作用。由于催化氧化还原反应的活性位点的高效性以及独特的化学细胞毒性,许多以金属或金属氧化物(Pt、Fe、Pd、Mn、Cu等)为基础的纳米酶被应用于抗肿瘤治疗。为进一步提高其催化活性,设计了双金属和多金属纳米酶用于癌症治疗。两种或更多种金属元素的组合通常会最大限度地发挥每种成分的独特性质,从而提高催化效率和协同抗癌效果。如锰铁氧体(MF)纳米粒是一种经典的双金属纳米酶,主要表现出产生ROS和消耗GSH的酶活性,从而发挥抗肿瘤作用。此外,通过结合近红外(NIR)、超声(US)、磁场和紫外线(UV)刺激,显著增强了双金属和多金属纳米酶的催化功能和抗肿瘤作用。有学者设计了一种Pt纳米酶修饰的Ti3C2Tx MXene,利用NIR-II激光在TME中产生有效的光热治疗,并提高纳米酶的催化效率,从而实现协同光热/酶疗法。然而,仍不清楚双金属纳米酶与外部NIR刺激结合是否会产生LUAD耐药性。
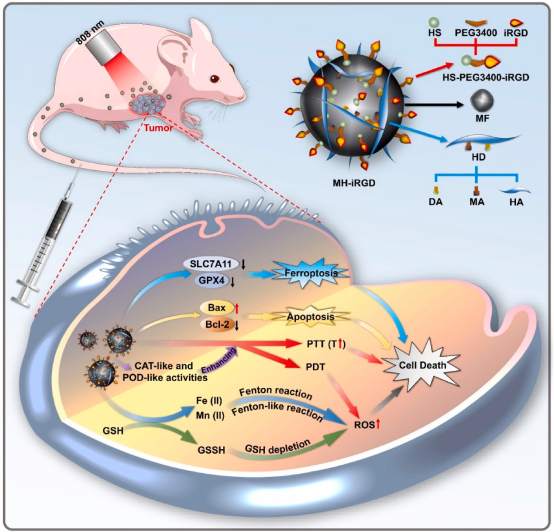
图1 MH-iRGD的组成及其作为双靶向双金属纳米酶联合NIR照射增强抗肿瘤治疗示意图(摘自Biomaterials)
抗肿瘤药物无法在肿瘤中有效积累是限制大多数抗癌药物疗效的关键原因之一。就金属基纳米酶而言,虽然其在抗肿瘤治疗方面潜力巨大,但由于靶向能力差,对正常细胞产生细胞毒性,往往无法达到预期治疗结果。为解决上述问题,已经探索了多种提高纳米酶靶向能力和生物相容性的新方法。透明质酸(HA)是一种天然聚合物,具有良好的生物相容性、生物降解性和CD44受体的特殊结合能力,作为肿瘤治疗的高效靶向递送载体而受到广泛关注。HA或其衍生物包埋可以有效增加纳米酶在肿瘤部位的富集,并提高其生物安全性。此外,iRGD肽修饰纳米酶以靶向肿瘤中常见的过表达αvβ3整合素受体可以极大地促进纳米酶在肿瘤细胞中的内化,从而减少对正常组织的损伤。然而,单靶点治疗在很大程度上受到TME复杂性的限制,容易出现脱靶和治疗失败。因此,双靶向治疗有望提高抗肿瘤治疗的特异性和高效率,尤其是对于LUAD治疗。
受上述启发,作者设计了一种型纳米酶(MH-iRGD),用多巴胺和甲基丙烯酸酐封装MF后修饰透明质酸,随后修饰HS-PEG3400-iRGD以实现双靶向LUAD治疗。有趣的是,MH-iRGD对过表达CD44和αV-整合素受体的LUAD细胞具有出色的双靶向能力,但不会靶向受体表达量低的正常肺上皮细胞。此外,NIR对MH-iRGD诱导的ROS生成和LUAD细胞中GSH消耗显示出良好的促进作用。从机制上讲,NIR通过下调SLC7A11、GPX4、Bcl-2水平,同时上调Bax水平,在体外和体内实验中显著增强MH-iRGD诱导的铁死亡和细胞凋亡。MH-iRGD+NIR是开发LUAD新型靶向治疗的有效策略,为设计用于其他疾病治疗的双靶向纳米酶提供了一种新途径。
参考消息:
https://www.sciencedirect.com/science/article/pii/S0142961225003266?via%3Dihub
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)