首页 > 医疗资讯/ 正文
阿霉素(DOX)是治疗乳腺癌最有效的化疗药物,但它通常与严重的心脏毒性有关。进一步研究以减轻其副作用是必不可少的。
2025 年 5 月 14 日,中国人民解放军总医院第二医学中心曹丰、Han Dong、王小宁共同通讯在Signal Transduction and Targeted Therapy上在线发表题为“Exosomal transfer of pro-pyroptotic miR-216a-5p exacerbates anthracycline cardiotoxicity through breast cancer-heart pathological crosstalk”的研究论文。本研究探讨了肿瘤与心脏跨器官通讯的机制和潜在的干预目标。
成年小鼠心肌细胞(AMVCs)和人诱导多能干细胞来源的心肌细胞(hiPSC-CMs)与乳腺癌细胞(BCCs)共培养后均可见形态上的气泡样突起,并伴有焦亡相关蛋白的表达升高。在原位乳腺癌小鼠模型中,来自DOX处理的BCC的外泌体(EXOs)加重了DOX诱导的心脏毒性(DOXIC)。通过敲低Rab27a来阻断miRNA或通过Dicer酶敲除来抑制EXO在肿瘤组织中的释放可减弱这种额外的损伤效应。外泌体miRNA测序显示,miR-216a-5p在DOX诱导的BCC的外泌体中表达上调。机制上,在BCC中,miR-216a-5p通过DOX诱导的AMP依赖性转录因子3(ATF3)介导的转录增强而上调,并通过剪接因子3b亚基4(SF3B4)包装到EXO中。E3泛素蛋白连接酶(ITCH)是miR-216a-5p的一个新的下游靶mRNA。ITCH负性介导硫氧还蛋白相互作用蛋白(TXNIP)泛素化激活NOD- LRR- pyrin结构域相关蛋白3(NLRP3)炎症小体通路,最终导致心肌细胞焦亡。研究结果揭示了乳腺癌和心脏之间新的跨器官致病沟通,通过外泌体mir -216a-5p介导的ITCH/TXNIP/NLRP3通路,从而驱动心肌细胞焦亡。这些发现提示靶向心肌miR-216a-5p或阻断来自乳腺癌的有害EXO是缓解DOXIC的潜在治疗策略。

心血管疾病(CVD)和乳腺癌是全球女性健康的两大最重大威胁。乳腺癌检测和治疗方式的显著进步导致越来越多的乳腺癌幸存者现在面临癌症化疗引起的长期心血管并发症风险增加。这一新出现的临床挑战引起了人们的极大担忧。化疗药物可诱发各种形式的心脏毒性,其中,阿霉素诱导的心脏毒性(DOXIC)最具代表性和临床意义。阿霉素(DOX)是一种在临床环境中广泛用作抗肿瘤剂的蒽环类抗生素,已显示出对包括乳腺癌、白血病和淋巴瘤在内的各种恶性肿瘤的显著疗效。然而,其治疗价值在很大程度上受到其可能导致危及生命的心脏毒性的限制。来自三项III期研究的临床证据表明,与安慰剂组相比,接受DOX治疗的患者充血性心力衰竭的发生率高出26%。DOXIC的临床表现包括心功能恶化、扩张型心肌病,严重时可出现充血性心力衰竭。因此,阐明DOXIC的潜在机制对于开发更有效的治疗策略以最大限度地减少心脏毒性和减少化疗相关并发症至关重要。
越来越多的证据表明,器官间通讯可能在肿瘤-心脏合并症的病理过程中建立肿瘤和心脏之间的关键联系。这种双向关系已在几个实验模型中得到证明,之前的研究揭示了肿瘤抑制RNA circITCH通过吸收miR-330-5p发挥作用,从而通过增加几个心脏保护因子的表达来保护心脏免受多西他嗪诱导的损伤。虽然DOX已被证明可通过多种机制直接损伤心肌细胞,但心脏和肿瘤之间的病理性沟通促发DOXIC进展的可能性仍未得到充分探索,需要进行全面研究。了解癌症和心血管系统之间复杂的相互作用对于开发同时解决恶性肿瘤和心脏保护的综合治疗方法至关重要,特别是在基于蒽环类药物的治疗方案中。
外泌体(EXO)代表真核细胞分泌的膜结构细胞外囊泡。这些纳米囊泡的直径通常为30-150nm,通过其转移生物活性分子的能力,越来越被认为是细胞间和器官间通讯的关键介质。在通过EXO传播的多种分子货物中,microRNA(miRNA)已成为研究最广泛的分子类别,部分原因是它们在跨组织和疾病状态的基因表达中无处不在的调节作用。外泌体可以被供体细胞调节,并与健康组织中的受体细胞交换或传递信息,但在病理条件下,外泌体可以影响疾病进展。肿瘤细胞经常将EXO释放到肿瘤微环境和患者体液中,促进癌细胞与其他细胞群之间的通讯。最近的研究表明,乳腺癌衍生的EXO可以积极促进癌症进展或诱导巨噬细胞产生促炎细胞因子,突出了它们在塑造肿瘤微环境中免疫反应中的作用。外泌体转移可能同样促进肿瘤和心脏之间的病理通讯。事实上,最近的研究表明,心肌梗死后心肌分泌的EXO可以刺激远处部位的肿瘤生长。然而,目前尚不清楚乳腺癌衍生的EXO是否以及通过何种机制参与DOXIC的发展和进展,尤其是在基于蒽环类药物的化疗的情况下。鉴定介导这种肿瘤-心脏通讯的特定外泌体货物可能会揭示减轻接受化疗的癌症患者心脏毒性的新治疗靶点。
在这项研究中,通过体外分子机制研究和体内概念验证动物模型,研究了阿霉素诱导的心脏毒性(DOXIC)中EXO介导的乳腺癌和心脏组织之间的病理交互作用。研究结果表明,EXO转移的miR-216a-5p通过ITCH/TXNIP/NLRP3炎性小体信号级联在心肌细胞中起焦亡增敏剂的作用。研究发现,促焦亡microRNA从阿霉素处理的乳腺癌细胞(BCC)的外泌体转移到心肌细胞是一种以前未被认识的分子机制,它加剧了蒽环类药物诱导的心脏毒性。这些转化发现为连接恶性肿瘤和心血管合并症的复杂病理生理机制提供了新的见解,可能为靶向治疗干预开辟有希望的途径,这些干预可以同时解决接受基于蒽环类药物的化疗患者的癌症治疗效果和心脏保护策略。这种细胞间通讯通路的鉴定可能导致开发用于早期检测癌症患者心脏毒性风险的新型生物标志物。
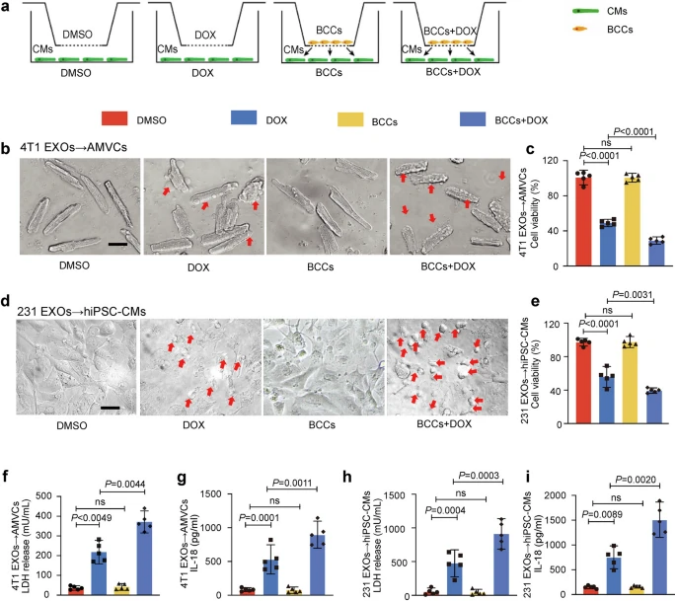
图1与乳腺癌细胞共孵育会加剧DOX诱导的心肌细胞焦亡(摘自Signal Transduction and Targeted Therapy)
参考消息:https://doi.org/10.1038/s41392-025-02245-4
猜你喜欢
- J Transl Med 江苏省人民医院贾恩志团队揭示冠心病中自噬图景及自噬相关LncRNA LUCAT1在冠心病中的作用机制
- 盐藻是否可以减肥呢?盐藻有减肥功效吗?
- 熘鸡块的做法-其它口味熘菜谱
- 小钙化,大问题!它会让心脏血管加速崩溃,如何做好“拆炸弹”工作?
- 半月板同种异体移植的长期软骨保护作用:一项 10 至 14 年的随访研究
- 【论著】| 探索阳性淋巴结比率在ypⅢ期结直肠癌患者中的预后价值及预测模型的建立
- ASCO 2023 重磅研究速递 | Sotorasib和多西他赛治疗KRAS 晚期G12C突变NSCLC的疗效对比!
- Cancer Cell评论文章 | 吴一龙团队:可切除NSCLC的免疫治疗探索
- 感冒咳嗽吃什么好化痰止咳的食疗方推荐
- 针灸扎哪个地方可以治疗失眠
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)