首页 > 医疗资讯/ 正文
大规模骨损伤修复一直是临床医学中的重大挑战,单纯依赖人体自愈或传统外科手段(如自体骨移植、金属内固定)常面临严峻问题,骨组织工程材料具有相当的应用前景,而骨组织工程中干细胞的成骨分化与无机骨基质的形成是影响骨缺损修复的关键问题。为解决该问题,上海市第六人民医院骨科蒋佳团队开发了一种可提供“力学信号”与“生物信号(矿化)”的3D打印与水凝胶复合支架。该支架可通过在水凝胶中嵌入PDA@Fe3O4磁性纳米颗粒来实现“磁-力”转化,当支架暴露于外部磁场时,PDA@Fe3O4纳米颗粒会经历重定向、旋转或振动,这些机械运动被转化为机械力,作用于支架内部的细胞。这些动态机械信号通过激活细胞内的Piezo1通道,引发细胞内钙离子的流入,进而激活YAP和β-catenin信号通路,促进干细胞的成骨分化。这种磁感应机制为骨组织工程提供了一种非侵入性的动态机械刺激方法,显著提高了骨缺损的修复效率;另外,通过可自主矿化的聚合物实现无机基质的积累,这种矿化过程不仅为干细胞提供了丰富的钙源,还模拟了天然骨组织的矿化过程,显著促进了干细胞的成骨分化和骨组织的再生。在二者共同作用下提高了骨再生修复的效率。该研究发表在Advanced Functional Materials上。

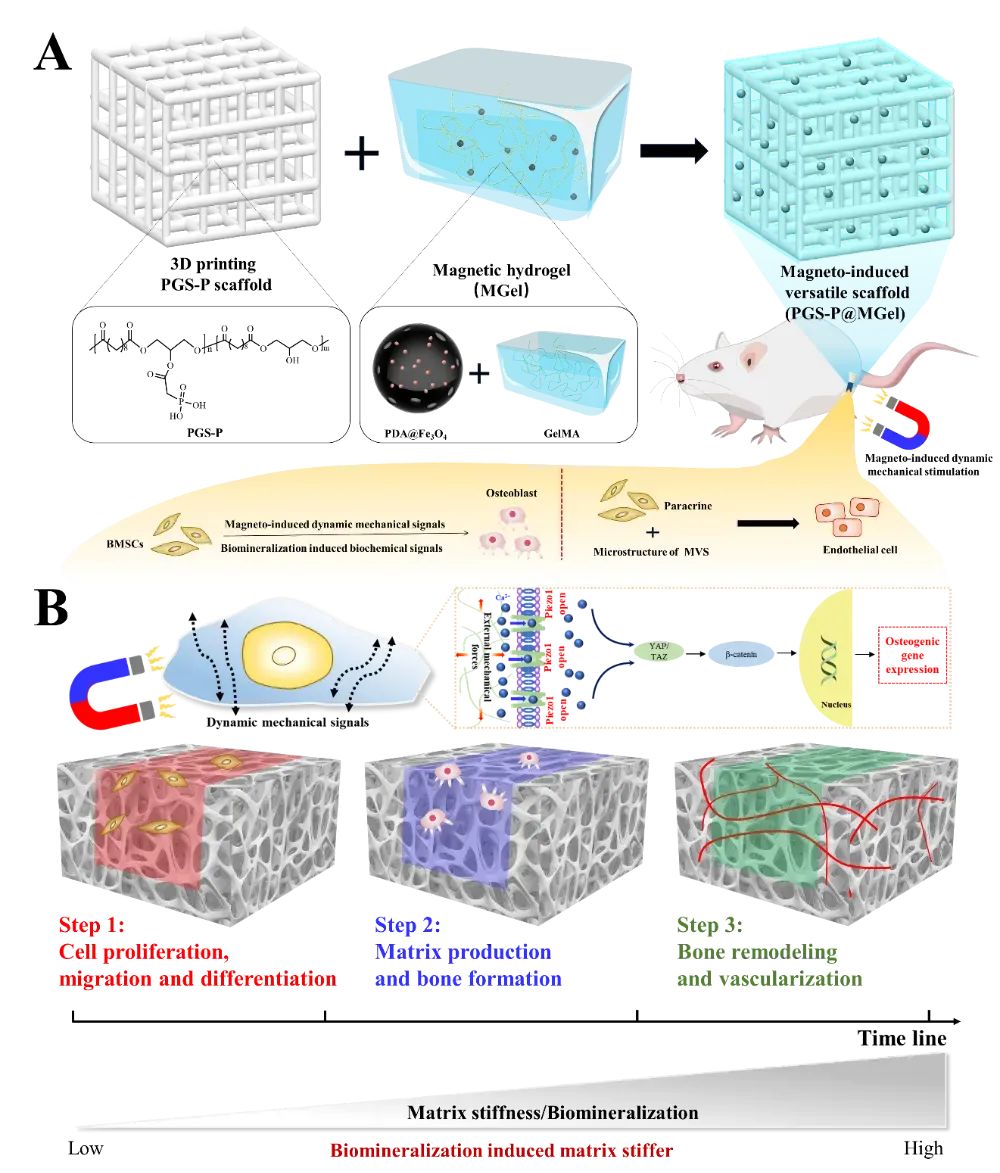
图1 复合支架(PGS-P@MGel)的设计和治疗机制示意图
支架的制备过程,包括化学合成和修饰、3D打印、磁性纳米颗粒的修饰、磁性水凝胶的合成以及复合支架的形成。治疗机制部分展示了PGS-P@MGel支架如何通过自发生物矿化和磁感应动态机械刺激促进骨缺损的修复。磁性水凝胶在外部磁场作用下产生动态机械信号,激活Piezo1通路,促进干细胞成骨分化和血管生成,从而加速骨缺损的修复。
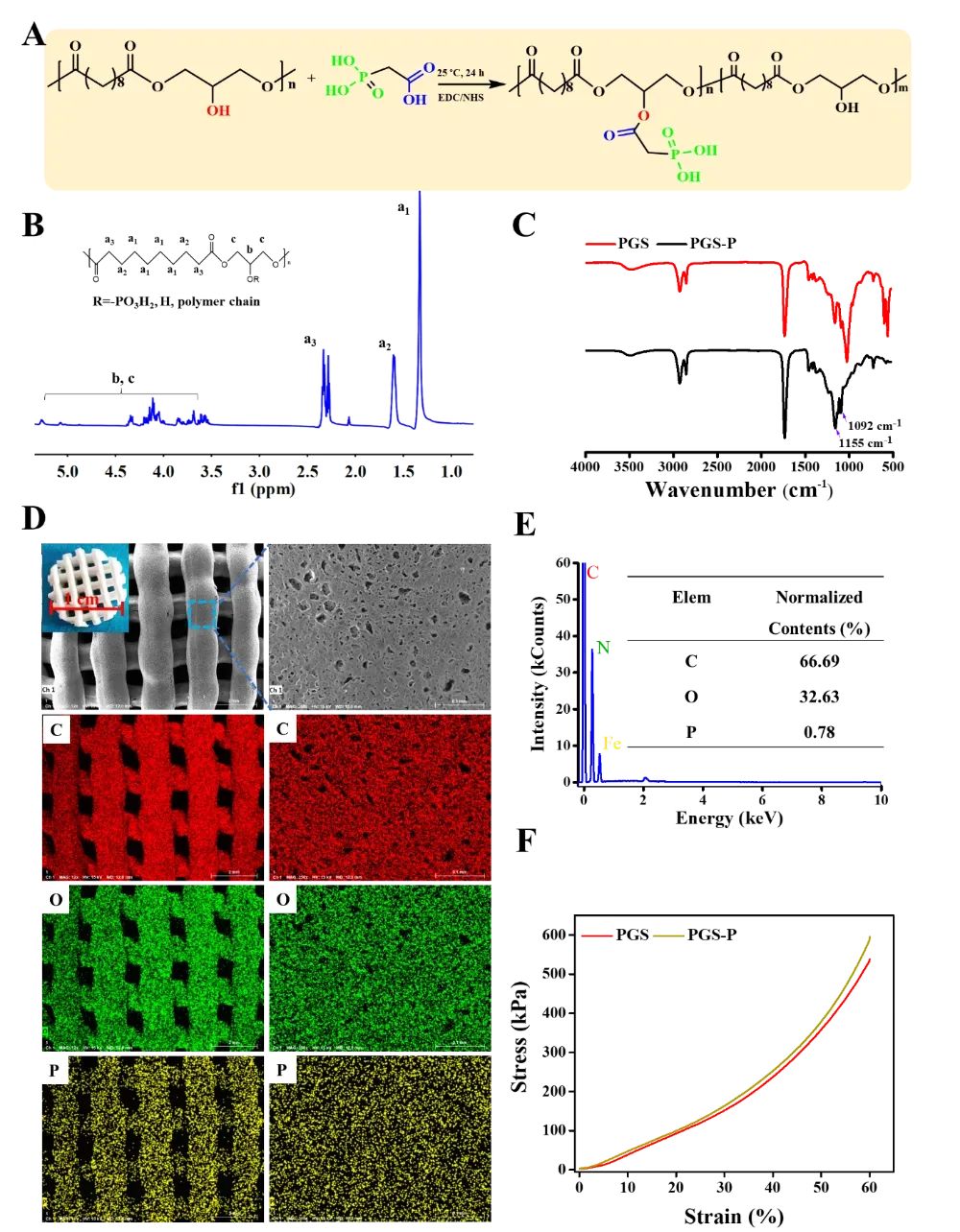
图2 PGS-P的合成与表征
通过核磁共振(NMR)、傅里叶变换红外光谱(FTIR)和凝胶渗透色谱(GPC)等技术,验证了PGS-P的成功合成。NMR谱图显示了PGS-P中磷酸基团的存在,FTIR谱图显示了磷酸基团的特征吸收峰。GPC结果表明,与前体PGS相比,PGS-P的分子量有所降低,这可能是由于磷酸化修饰导致的部分降解。此外,通过扫描电子显微镜(SEM)和能量色散X射线光谱(EDS)分析了3D打印的PGS-P支架的表面形貌和元素组成,确认了磷酸基团的存在和分布。
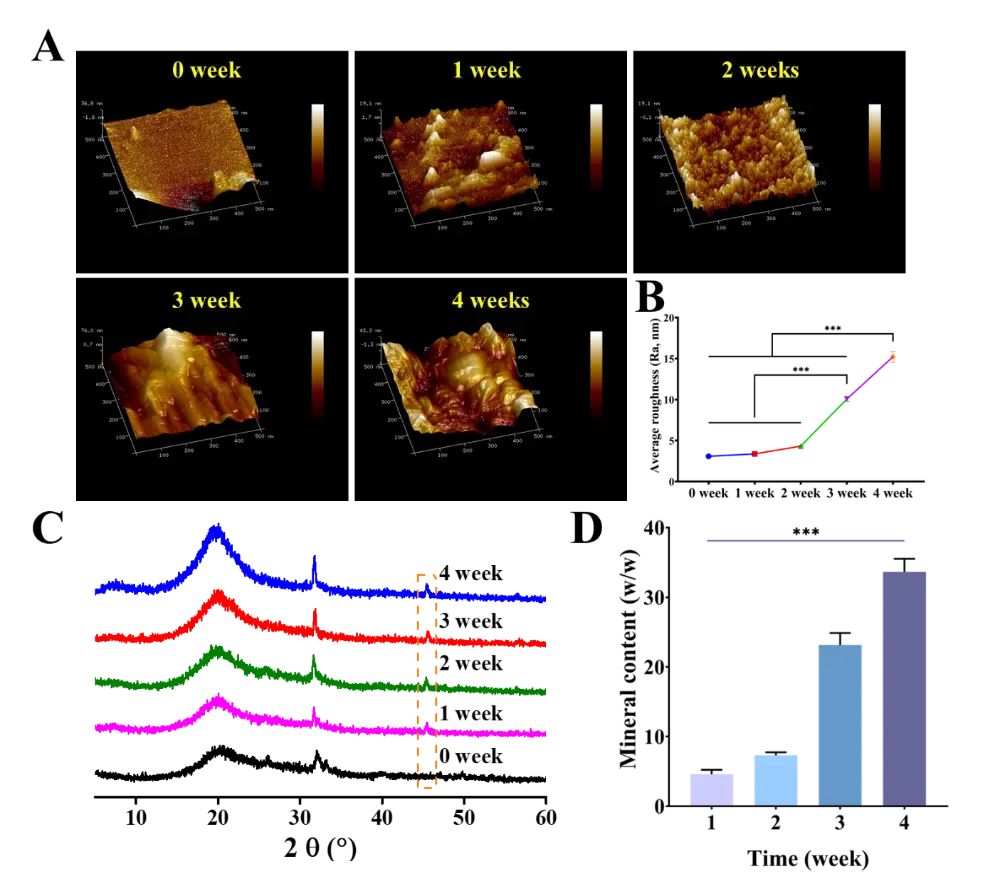
图3 PGS-P的自发生物矿化能力
通过原子力显微镜(AFM)和X射线衍射(XRD)分析了PGS-P在不同矿化时间点的表面形貌和结晶度。AFM结果显示,随着矿化时间的增加,PGS-P表面逐渐变得更加粗糙,形成了类似“钟乳石”和“山脊”的结构。XRD分析表明,矿化后的PGS-P结晶度增加,进一步证实了其自发生物矿化能力。这些结果表明,PGS-P能够在生理条件下自主结合钙离子,形成矿化基质,从而促进骨再生。
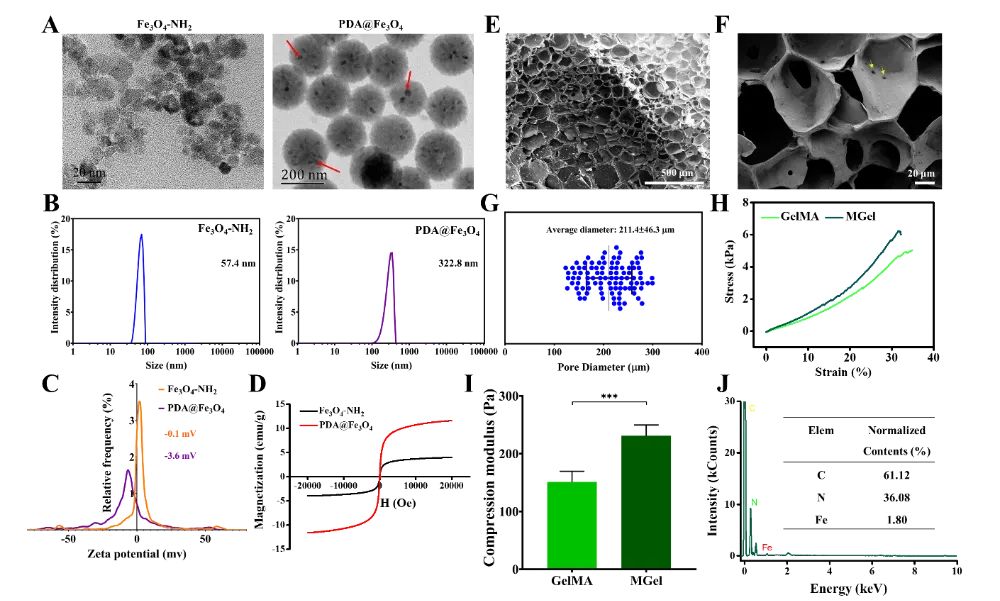
图4 磁性纳米颗粒和磁性水凝胶(MGel)的物理表征
通过扫描电子显微镜(SEM)、粒径分布、zeta电位和磁滞回线等技术,验证了PDA@Fe3O4纳米颗粒的成功制备和其超顺磁性。SEM图像显示了PDA@Fe3O4纳米颗粒的均匀分布和球形结构。此外,通过将PDA@Fe3O4纳米颗粒与GelMA水凝胶混合并交联,制备了磁性水凝胶(MGel)。MGel的孔隙结构和压缩力学性能也得到了表征,结果表明MGel具有良好的机械性能和磁响应性。
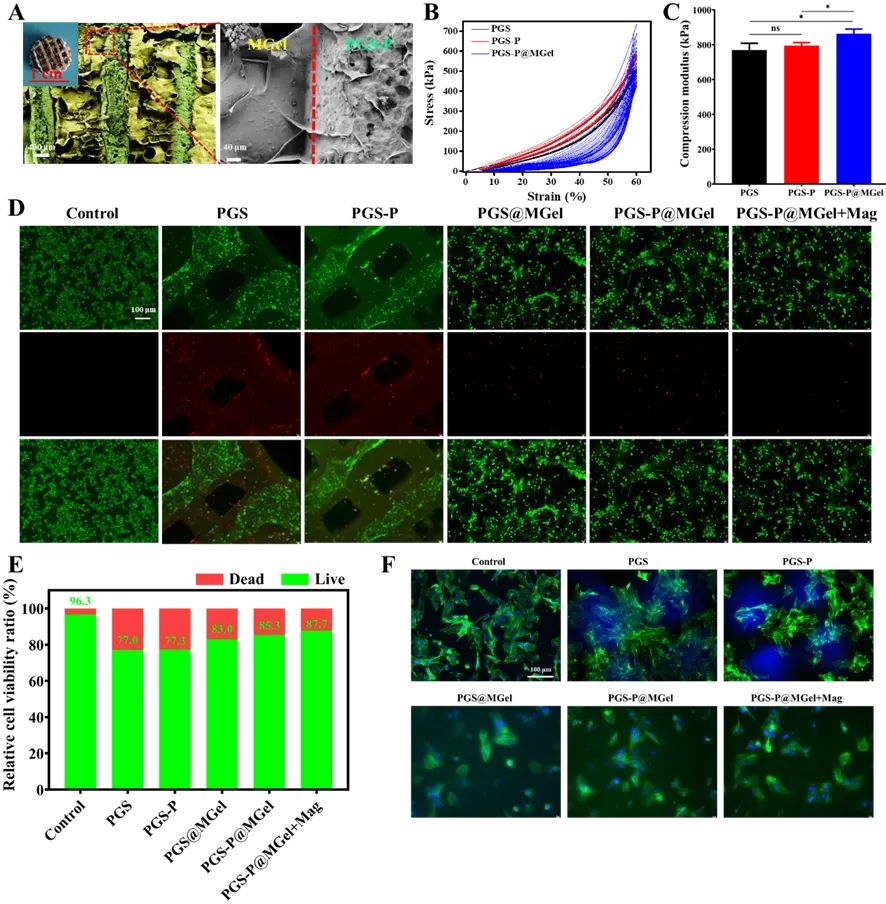
图5 复合支架(PGS-P@MGel)的物理表征和细胞相容性
通过扫描电子显微镜(SEM)分析了PGS-P@MGel支架的微观结构,确认了水凝胶与支架之间的良好结合。压缩力学测试表明,PGS-P@MGel支架具有较高的压缩模量,但缺乏弹性回复能力。细胞相容性实验通过活/死染色和细胞增殖实验,验证了PGS-P@MGel支架对骨髓间充质干细胞(BMSCs)和人脐静脉内皮细胞(HUVECs)的良好生物相容性。这些结果表明,PGS-P@MGel支架能够支持细胞的生长和分化。
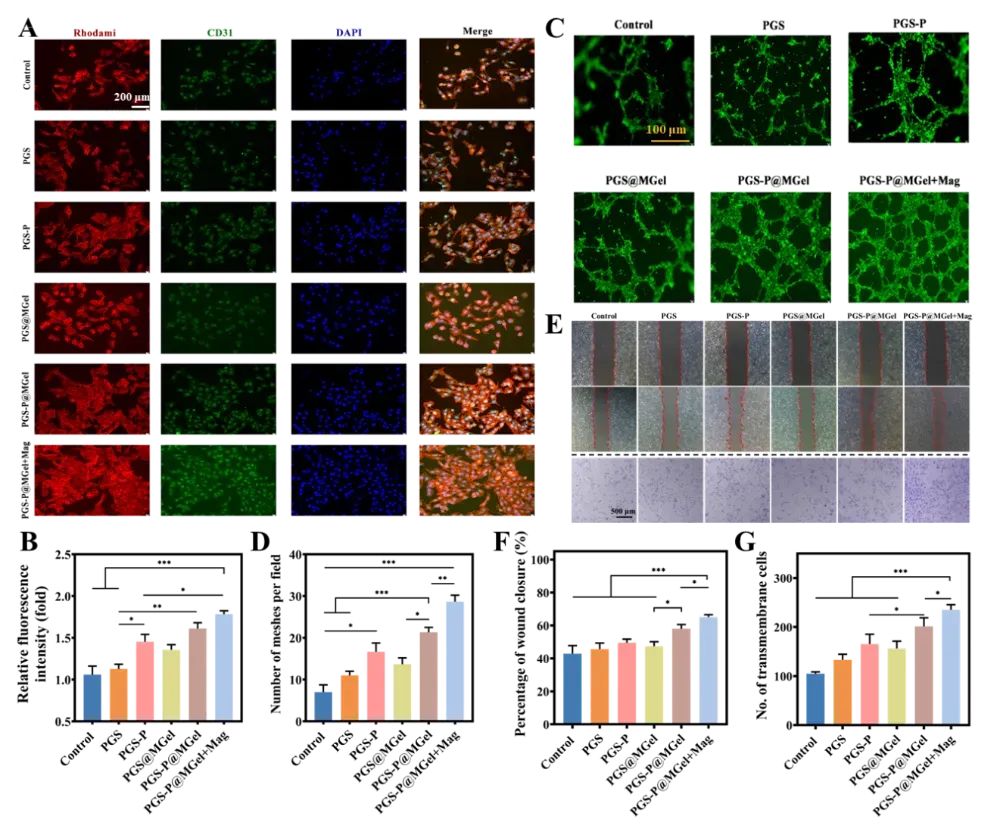
图6 支架对HUVECs成血管能力的影响
通过免疫荧光染色、Matrigel管形成实验、细胞迁移实验和Transwell细胞趋化实验,评估了支架的成血管能力。结果显示,PGS-P@MGel+Mag组在促进HUVECs的管形成和细胞迁移方面表现最佳,表明该组具有显著的成血管潜力。这些结果表明,动态机械信号能够促进BMSCs分泌成血管因子,从而调节HUVECs的生物学功能,包括引导细胞迁移和促进管形成。
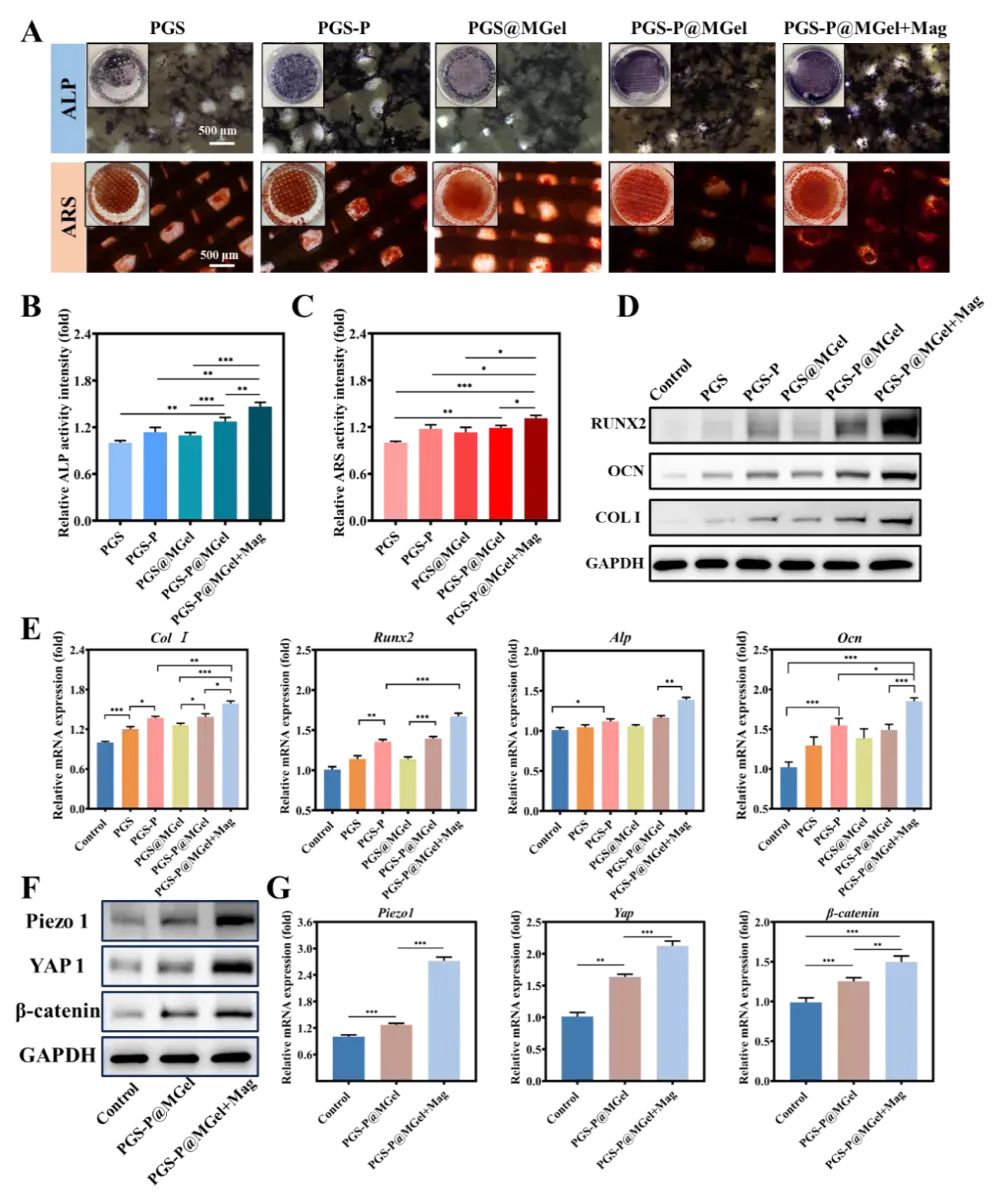
图7 支架的体外成骨效果
通过碱性磷酸酶(ALP)染色、茜素红S(ARS)染色、Western blot分析和定量实时聚合酶链反应(qRT-PCR)等方法,评估了支架对骨髓间充质干细胞(BMSCs)成骨分化的影响。结果显示,PGS-P@MGel+Mag组在促进BMSCs的成骨分化方面表现最佳,表现为最高的ALP活性和最多的钙沉积。Western blot和qRT-PCR结果进一步证实了该组在促进成骨相关蛋白和基因表达方面的优越性。这些结果表明,PGS-P@MGel+Mag组通过动态机械信号显著增强了BMSCs的成骨分化能力。
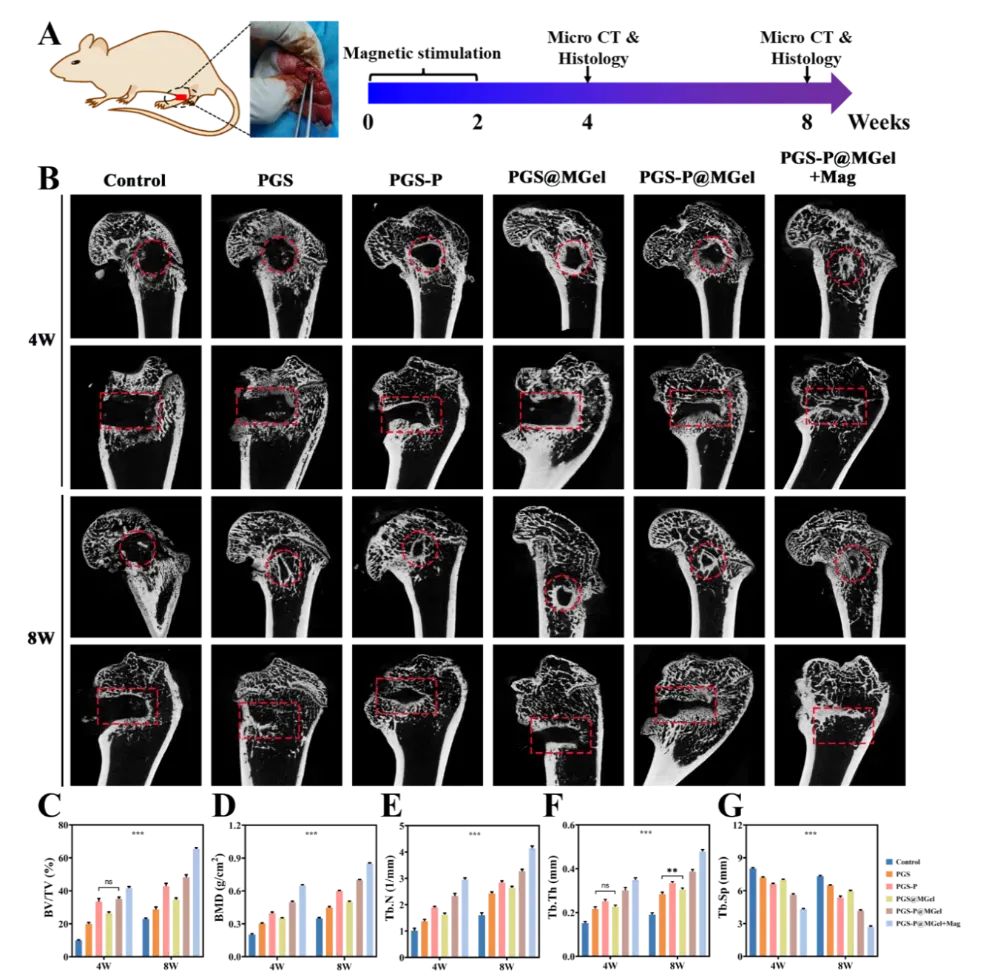
图8 体内骨再生评估
通过微计算机断层扫描(micro-CT)和组织学分析,评估了支架的骨再生能力。结果显示,PGS-P@MGel+Mag组在4周和8周时均显示出显著的骨再生效果,骨缺损区域几乎完全被新骨组织填充。micro-CT分析表明,该组的骨体积/总体积(BV/TV)、骨矿密度(BMD)、骨小梁数量(Tb.N)和骨小梁厚度(Tb.Th)显著高于其他组,而骨小梁间距(Tb.Sp)则显著降低。这些结果表明,PGS-P@MGel+Mag支架在体内具有优异的骨再生能力。
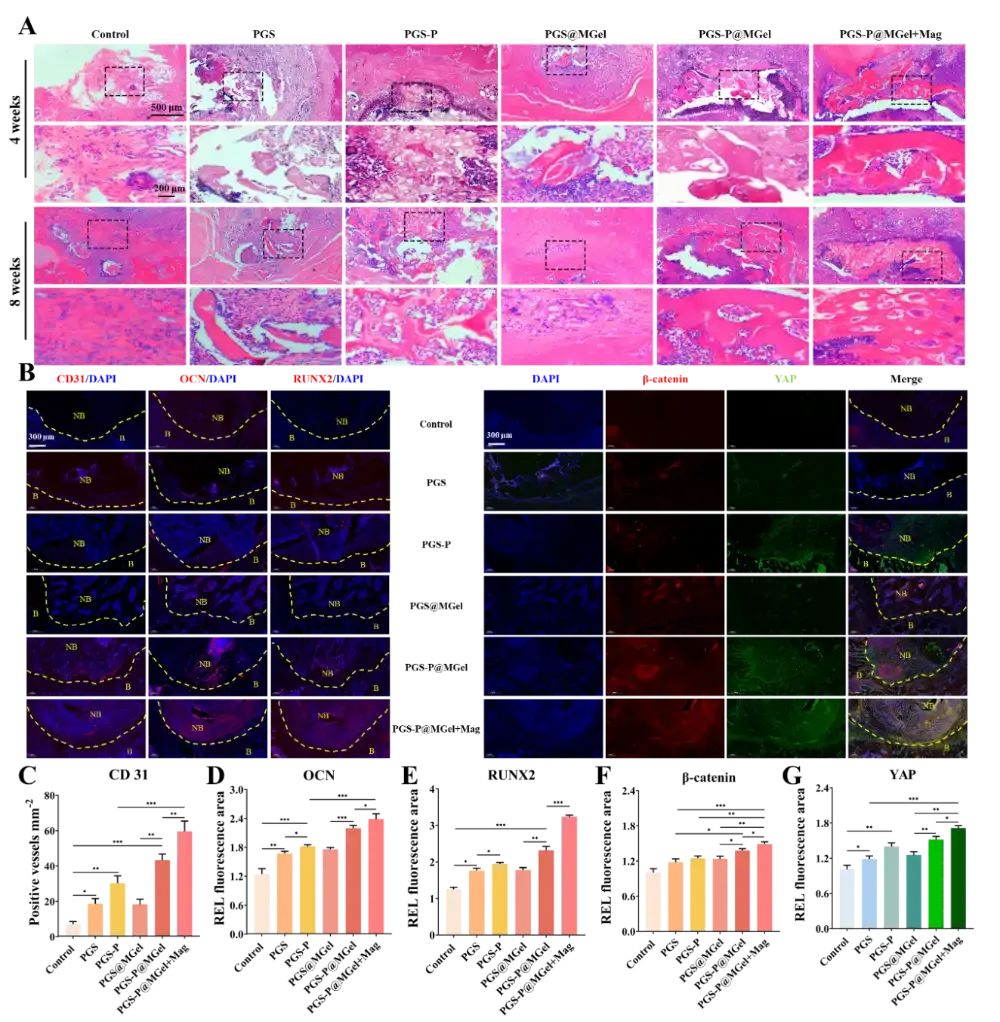
图9 组织学评估
通过苏木精-伊红(H&E)染色和免疫荧光染色评估的骨再生效果。H&E染色结果显示,PGS-P@MGel+Mag组在4周和8周时均显示出显著的骨再生效果,骨缺损区域几乎完全被新骨组织填充。免疫荧光染色结果显示,该组在促进血管生成(CD31)、成骨相关蛋白(OCN和RUNX2)表达以及激活Piezo1/β-catenin/YAP信号通路方面表现最佳。这些结果进一步证实了PGS-P@MGel+Mag支架在促进骨再生和血管生成方面的优越性。
总结:本研究介绍了一种多功能骨组织工程支架(PGS-P@MGel),它结合了自发生物矿化和磁感应动态机械刺激,以促进干细胞成骨分化和加速骨缺损修复。研究团队通过3D打印技术将磷酸化聚甘油癸二酸酯(PGS-P)与含有PDA@Fe3O4磁性纳米颗粒的水凝胶(MGel)结合,构建了这种复合支架。PGS-P能够自主结合钙离子,加速矿化基质的形成,而MGel在外部磁场作用下产生动态机械信号,激活Piezo1通路,促进干细胞成骨分化和血管生成。体外实验表明,PGS-P@MGel支架具有良好的生物相容性,能够显著促进细胞增殖、迁移和成血管能力。体内实验进一步证实了该支架在大鼠股骨骨缺损模型中具有优异的骨再生能力,显著加速了骨缺损的修复。这项研究为骨组织工程支架的设计和应用提供了新的思路,为大规模骨缺损修复提供了有价值的见解。
本研究工作以“Magnetically Guided Mechanoactive Mineralization Scaffolds for Enhanced Bone Regeneration”为题最近发表于Advanced Functional Materials期刊(DOI: 10.1002/adfm.202503903)。上海市第六人民医院骨科博士后郭煦然、博士研究生陶再进、上海市新华医院戴珍珍博士及东华大学高迎华博士为本文的共同第一作者,上海市第六人民医院骨科蒋佳主任、东华大学游正伟教授、上海市第六人民医院马昕主任以及上海市新华医院金芳纯副研究员为共同通讯作者。该研究得到国家自然科学基金面上项目的经费支持。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202503903
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)