首页 > 医疗资讯/ 正文
外周血MRD
急性髓系白血病 (AML) 是一种遗传异质性疾病,初始治疗后复发率较高。确定初始治疗后的可测量残留病 (MRD),对于评估反应、预测患者结局和确定需要额外干预的患者至关重要。目前的MRD分析依赖于侵入性连续骨髓 (BM) 活检,样本可用性和处理时间较为复杂,并对患者体验产生负面影响。此外,骨髓MRD阳性结果可能会产生比答案更多的问题,给患者带来焦虑。
外周血 (PB) 在检测 MRD 方面显示出前景,目前已被欧洲白血病网络推荐用于 AML 的某些遗传异常。基于 PB 的采样可以实现更频繁的检测间隔以及恶性扩增更好的时间分辨率,同时避免患者额外的侵入性操作。
《American Journal of Hematology》近日发表综述,讨论了用于PB检测MRD的现状,重点关注能够检测各 AML 亚型 MRD 的新一代测序方法。

1.引言
AML 是一种异质性血液癌症分类,起源于骨髓中髓系祖细胞的克隆扩增。部分复发性突变和细胞遗传学异常定义该疾病,也有部分在影响肿瘤发生和预后中具有明确作用,而另一些则不太确定生物学意义。WHO)将 AML 分为不同亚型,以指导治疗决策并告知总体预后。这些 AML 亚型定义为复发性基因异常(如PML::RARA、RUNX1::RUNX1T1、CBFB::MYH11、RBM15::MRTFA、BCR::ABL1、MECOM、NUP98、NPM1、CEBPA等)、分化状态(极少或无成熟细胞)和亚系特异性(粒单核细胞、单核细胞、红系、巨核细胞等)。
在所有亚型中,AML的进展通常是侵袭性。随着 AML 克隆以不受控制的方式扩增,它们可先后重塑 BM 微环境和损害造血功能,导致危及生命的血细胞减少症。尽管在诱导化疗后细胞形态学缓解率较高,但由于 BM 中持续存在残留白血病细胞,大多数患者会在1-2年内复发。这些残留细胞通常以不同的亚克隆形式存在,具有不断演变的突变、翻译和表观遗传特征,产生独特的生长特征和对化疗药物的反应差异。残留的白血病细胞通常太罕见,无法通过常规光学显微镜检测到,因此历来称为微小残留病(Minimal Residual Disease)。为了更好地代表检测的进展,这些细胞最近重新分类为可测量残留病 (Measurable Residual Disease,MRD)。
由于在检测复发和进展性耐药,AML 的5年生存率仍不理想(低于32%)。MRD的存在是 AML 复发的强预测因素,即使是极低水平的残留病灶也会显著增加随后复发的可能性,从而证实了 MRD 作为有效预后决定因素的作用。许多研究甚至根据 MRD 评估定制治疗方案。改善 MRD 监测不仅可以早期检测恶性扩增和干预,还可以为预防复发的靶向药物选择提供信息。
目前MRD检测需要连续 BM 采样和多次复杂的患者和亚型特异性检测,具有侵入性、昂贵、耗时且难以在不同机构进行比较的缺点。对于约32%存活至5年的 AML 患者,他们经常在此期间接受约15-20次 BM 活检,并接受侵袭性治疗方案。而使用外周血可以简化检测,实现更高的检测频率,重要的是减少BM 活检提高患者体验。此外,创建基于 PB 的 常见检测可通过提供急需的终点来比较临床试验间的治疗反应,从而改善 AML 的标准治疗。
本文将讨论基于 PB 的 MRD 检测的现状,重点关注有可能确定 AML 亚型疾病负荷并为治疗决策提供信息的方法和靶点(图1);也将强调检测 AML MRD 的新策略,这一点尤为重要,因为许多 AML 患者事实上缺乏复发性突变。
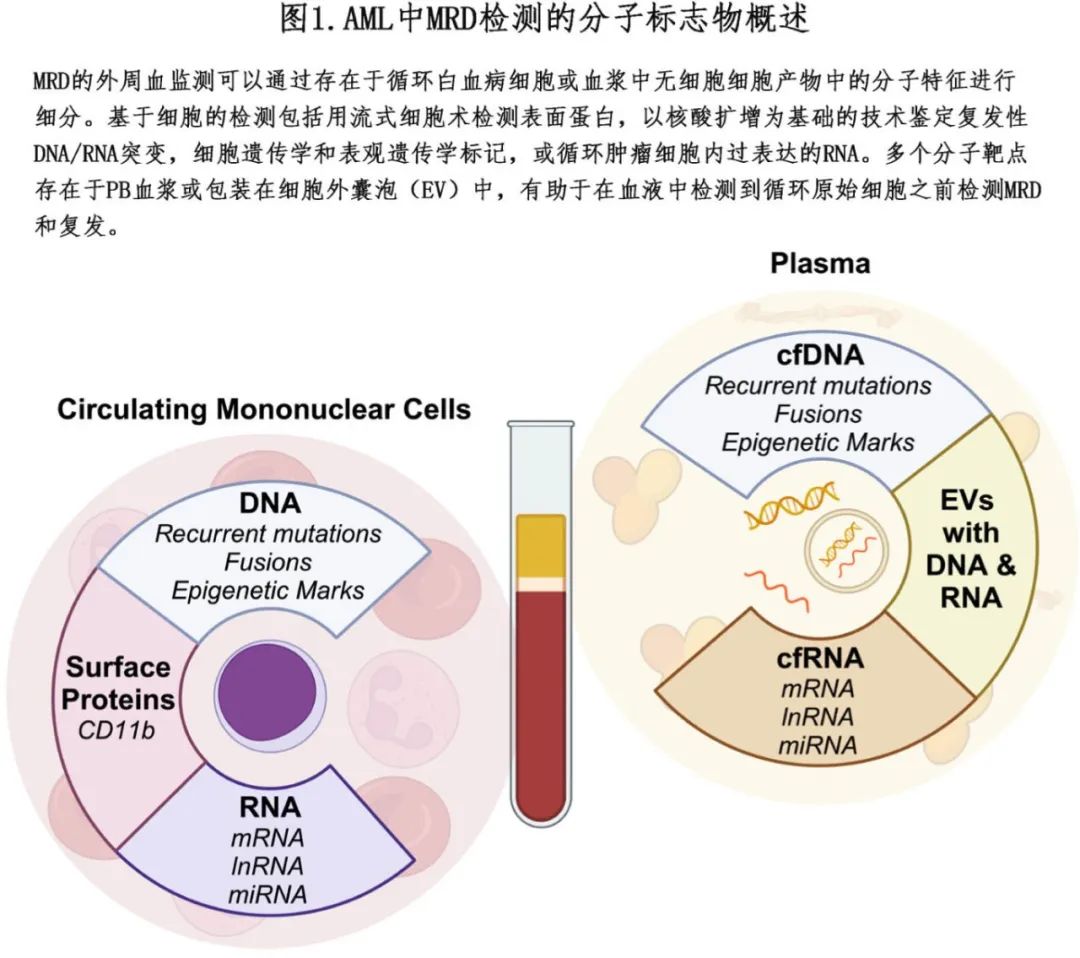
2.当前MRD检测的工作流程
检测 MRD 和确定复发风险仍存在挑战。目前,尚无关于检测间隔、样本来源和方法的标准化 MRD 检测方法,因此MRD检测是一个高度个体化的过程,不同机构之间存在差异。为了解决这一问题,欧洲白血病网络 (ELN) 成立了一个国际委员会,旨在根据2018年和2021年发布的建议制定 MRD 检测指南。虽然这些指南代表着标准化MRD检测最重要的第一步,但仍在很大程度上依赖于需要高度侵入性连续 BM 活检的劳动密集型手段。
根据最新指南,为了鉴定诱导化疗后骨髓中剩余的原始细胞,MRD检测从光学显微镜形态学分析开始,然而该方法的灵敏度有限,仅在频率大致> 1.0%时才能够区分异常原始细胞,这是由于在正常造血祖细胞的背景中很难识别原始细胞。根据形态学判定时,要求异常原始细胞最低阈值>5%才能判定为MRD 阳性。对于通过显微镜检查发现疾病缓解的患者,应通过多参数流式细胞术 (MFC) 评估MRD,这是一种更高通量的方法,允许同时对细胞群进行形态学和免疫表型表征,理论检测限范围为0.1%-0.0001%。然而在实践中,达到最低检测限仍具有挑战性,需要细胞群具有不同抗原表达以及与野生型细胞物理分离(在淋系白血病中更常见);然而在 AML 中,原始细胞群的大小、形态和免疫表型通常更模糊,导致检测限接近0.1%。与此限制一致的是,ELN AML MRD工作组提出>0.1%的异常原始细胞阈值作为 MRD 阳性。
尽管 MFC 是一种独立于基因改变的、检测MRD的有价值的工具,但它存在技术挑战和显著的设备间变异性。由于罕见、免疫表型变化中的克隆演变结果和/或与其他造血细胞群的门控重叠,MFC可能经常会遗漏恶性克隆。例如,很难区分前白血病亚克隆/年龄相关造血发育不良和真正的白血病原始细胞,特别是当没有可用于直接比较的诊断样本时。由于这些限制,通常需要额外的分子学检测和细胞遗传学检测。
3.可测量残留病的分子学检测现状
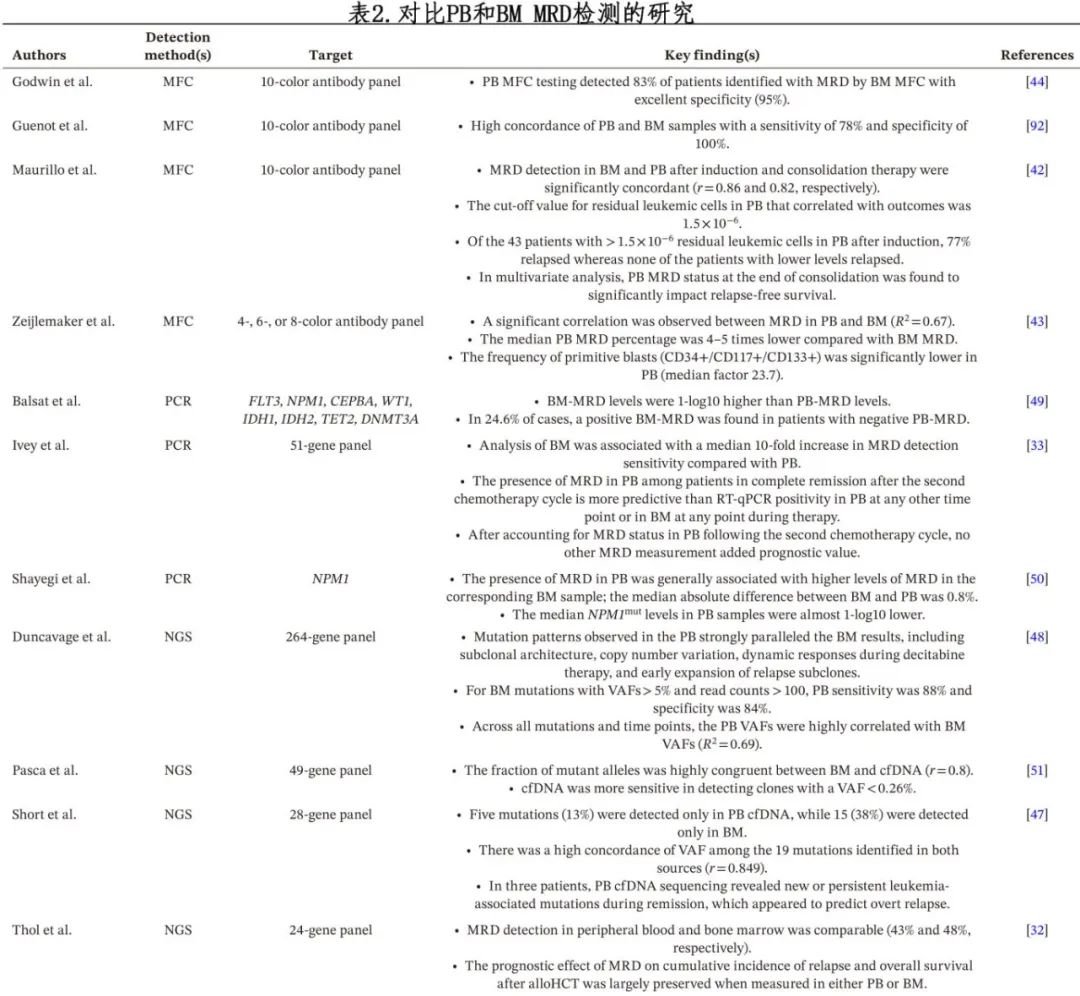
如 PCR 和二代测序 (NGS) 等分子学检测在大量野生型细胞背景中发现携带白血病特异性变体的残留细胞方面具有最高的分辨率,但也有其自身局限性。定量 PCR 检测(qRT-PCR和数字PCR)特别适用于具有良好复发性突变特征的 AML 亚型,然而这些仅占 AML 患者的~60%,需要突变特异性引物组进行检测。最常见的复发性突变之一——NPM,仅存在于大约30%的成人和8%的儿童中,但对于提示治疗反应是一种有价值的工具。RUNX1-RUNX1T1、CBFB-MYH11和 PML-RAR等其他突变也可代表残留肿瘤负荷,但与 AML 相关的许多其他复发性突变存在于通过衰老积累的非恶性造血亚克隆中 (DNMT3A、TET2、ASXL1) 或作为易感基因遗传 (GATA2、CEBPA、TP53、DDX41),因此这些突变无法提供残留恶性细胞群的信息,ELN 不推荐用于MRD检测。许多经典信号通路基因 (FLT3、KIT、RAS/MEK/MAP) 的突变也有局限性,因为这些通路的突变发生在恶变的晚期或呈现为亚克隆。突变阴性人群的复发很常见,可因靶向治疗的选择压力所致。多项研究表明,细胞信号传导基因靶点(如FLT3)可预测患者结局,但 ELN 建议用于 MRD 时使用 FLT3应与其他标记物配对。因此对于大多数患者来说,追踪多个靶点对于可靠地检测恶性克隆的存在和扩增较为必要,这通常需要使用针对每种变体的多个引物组进行定制分析。然而,白血病变体在整个治疗过程中都会发生变化,导致选择引物组检测突变等位基因变得复杂化。由于序列长度和断裂点区域的差异,使用 qPCR 通常难以检测某些遗传异常,如基因融合(易位和倒位导致)。因此,除了分子学检测外,MRD检测可能还需要通过核型分析和/或FISH进行劳动密集型的细胞遗传学分析。
4.可测量残留疾病新一代测序分析的现状
NGS 的出现引发了基因组学研究的重大转变,由于每个碱基对测序成本的显著降低,这种变革性技术的普及程度大幅上升。与传统的 Sanger 测序(与大量的财务和时间限制相关)不同,NGS可以比常规方法更快地对数百万 DNA 片段同时测序,同时保持高精度。大规模测序的经济障碍减少不仅使获得基因组信息的机会更高,还推动了包括 AML MRD 在内的多种生物学领域的进展。传统上,由于内在错误率,NGS在检测变异等位基因频率 (VAF) 小于1%方面受到限制,,后续在增加分辨率深度方面取得较大进展。新的错误纠正法(如Duplex测序)能够在108个野生型等位基因的背景下检测出 AML 特异性等位基因。这些较新的 NGS 技术仍然昂贵且并不广泛可用,但在许多大型机构越来越多地用于临床研究。
NGS 包括一系列方法论。其中一个突出的技术为全外显子测序 (WES),它只靶向蛋白编码区,可提供外显子组及其相关变异的重点信息。尽管存在局限性,WES仍能够检测可预测 AML 患者复发和总生存期的等位基因 NPM1 变体。WES还可以使用 DNA 或 RNA 样本输入检测常见的染色体畸变,如导致融合基因的易位和倒位(如RUNX1-RUNX1T),以及重复/拷贝数变化(如FLT3-ITD)。最近一项使用 WES 的研究可靠地检测到 RUNX1-RUNX1T1 融合转录本,且当基于3-log变化进行分层时,与2年总生存率(87%、74%和33%;p<0.08)和复发率(13%、42%和67%;p<0.05)相关。
尽管 WES 是一种强大的发现工具,但在患者间标准化以及在合理的周转时间解读数据方面存在缺陷。大规模 NGS 分析与 WES 一样,可创建需要复杂处理和解释的大量数据集,以识别变异体、确保质量控制和确定有临床意义的 VAF 阈值,这些大数据集的解读仍存在挑战性。然而随着计算生物学的飞速发展,该进程也变得更加精简。通过计算算法和 NGS 技术的进步,可以在临床可行的时间范围内预测疾病负担、预后和治疗反应。然而目前还没有集中的 AML 特异性文库可用于变体识别。正在进行的举措(如Beat AML)正在努力建立一个全面的数据集,以识别白血病变体并预测治疗反应,从而大大改善 MRD 检测和患者预后。
开发能够检测大多数AML亚型疾病负担的标准化 MRD 检测方法可能需要基于panel,并选择涵盖一系列已知复发性突变的靶点。通过这种方式,ThermoFisher最近发布了Oncomine Myeloid MRD Assay,这是一个基于 NGS 的平台,支持 DNA 和 RNA 输入,在单次基于panel的检测中检测超过90%的常见 AML 突变和融合。虽然尚未验证临床使用,但公司声称“可在33个基因中检测到低至0.05%等位基因频率的关键DNA突变,并评估43个RNA融合驱动基因的900多个同种异构体”, 包括集成信息学和报告,以显示不同频率随时间的变化。目前仅有有限的独立研究验证该测定法。然而一项初步研究表明,在 PB 和 BM 中均检测到特定变体,但不出所料,BM样本中的 VAF 更高。TwinStrand Biosciences的另一个商业 NGS 平台采用基于 ELN 建议的29基因panel的duplex测序,还声称可鉴定90%的常见 AML 突变。最近与 TwinStrand Biosciences 合作进行的一项研究表明,该panel可在诱导化疗后CR患者中鉴定出22/62例MRD(35%),而MFC仅鉴定出10例(16%);与MFC相比,NGS检测到MRD与更高的复发率和更低的5年生存率相关。尽管仍需要大量验证,但这些结果表明,市售 NGS 平台可能是标准化跨中心和临床试验 MRD 分析的有价值的工具。
2021 ELN 的建议表明,NGS与 MFC 联合使用时可用于判断预后,但也认为目前尚无足够的数据推荐 NGS 作为独立方法。随着改进样本分析的出现、AML特异性变体库和数据解释标准的创建以及 VAF 阈值的阐明(代表具有临床意义的MRD),这种建议在未来可能会发生变化。
5.检测PB MRD作为连续骨髓活检的替代方法
BM 活检是侵入性操作,通常需要麻醉,尤其是在儿科环境中。ELN目前建议在2个化疗周期后、治疗结束时和24个月随访监测(每3个月一次)进行 BM 检查(除诊断外),需进行多次活检。即使每3个月进行一次连续活检,由于 AML 的对数生长潜力,仍可能遗漏复发。增加 PB 用于 MRD 检测将简化样本采集、降低成本并改善患者体验,同时允许更频繁的检测间隔。因此临床医生可能有更大的机会早期发现复发,并保留侵入性 BM 分析用于确证性检测。
骨髓是白血病发生的主要部位,与 PB 相比,本质上含有更多数量的原始细胞。循环中原始细胞的较低比例仍是使用 PB 进行 MRD 检测的挑战,尤其是在低疾病负荷的情况下。然而许多研究表明,完整原始细胞及其到达 PB 的游离(cell-free)分子成分均可进行可靠检测,尽管灵敏度不同。然而对于髓外复发病例(约占复发的5%-10%),或者对于来自髂骨的骨髓无法代表身体其他部位隐匿性骨髓负荷的病例,基于PB的检测对于早期发现至关重要。
6.使用MFC检测PB样本中的MRD
多项研究表明,通过 MFC 检测PB中存在完整原始细胞预示着诱导和巩固化疗后复发,且匹配样本的 PB 和 BM 中原始细胞比例具有相关性(尽管 PB 中的比例预期较低,限制了其灵敏度)。一项在724例相匹配的 PB 和 BM 样本(在1周内采集,其中任何可检测到的疾病均视为 MRD 阳性)的大型队列中通过 MFC 直接评估 MRD 的研究显示,PB和 BM 之间存在0.92的显著相关性,灵敏度为92%,特异性为97%。为了明确 MFC 是否能够在低水平疾病负荷下进行MRD,从匹配的 BM 样本(均含有<5%的原始细胞)中分析了209份 PB 样本。在该队列中,PB检测 MRD 的灵敏度为83%,特异性为95%。然而当使用 ELN AML MRD 工作组推荐的原始细胞临界值>0.1%时,未能在部分 PB 样本中检测到阳性MRD,灵敏度降至62%。
7.PB中基于分子的检测
尽管完整循环原始细胞可提示复发,但其在 PB 中的丰度通常发现更晚。一项研究表明,在骨髓原始细胞<5%的情况下,如果单独使用 MFC,在疾病负荷较低的情况下,0.1%的cut-off值可能会遗漏残留疾病。因此,基于扩增的分子方法也可能是许多患者早期检测的关键。因此,目前正在设计 AML 特异性试验 (AMLM26 INTERCEPT,MyeloMATCH) 的多项临床前和临床试验 (Pathfinder1,Pathfinder 2) 中验证多循环肿瘤 DNA 和无细胞核酸靶标用于早期检测和监测各肿瘤类型的治疗反应。
ELN现在推荐对变异进行PB检测,作为对特定复发突变患者BM分析的替代方法(表1),因为多项研究已经证明了其价值。对于NPM1、RUNX1-RUNX1T1、CBFB-MYH11或 PML-RARA 变异患者,ELN建议基于 qPCR 的 MRD 评估,并于2021年更新的指南中纳入基于 PB 的检测作为每3个月连续 BM 活检的替代方法,但频率增加(每4-6周)。
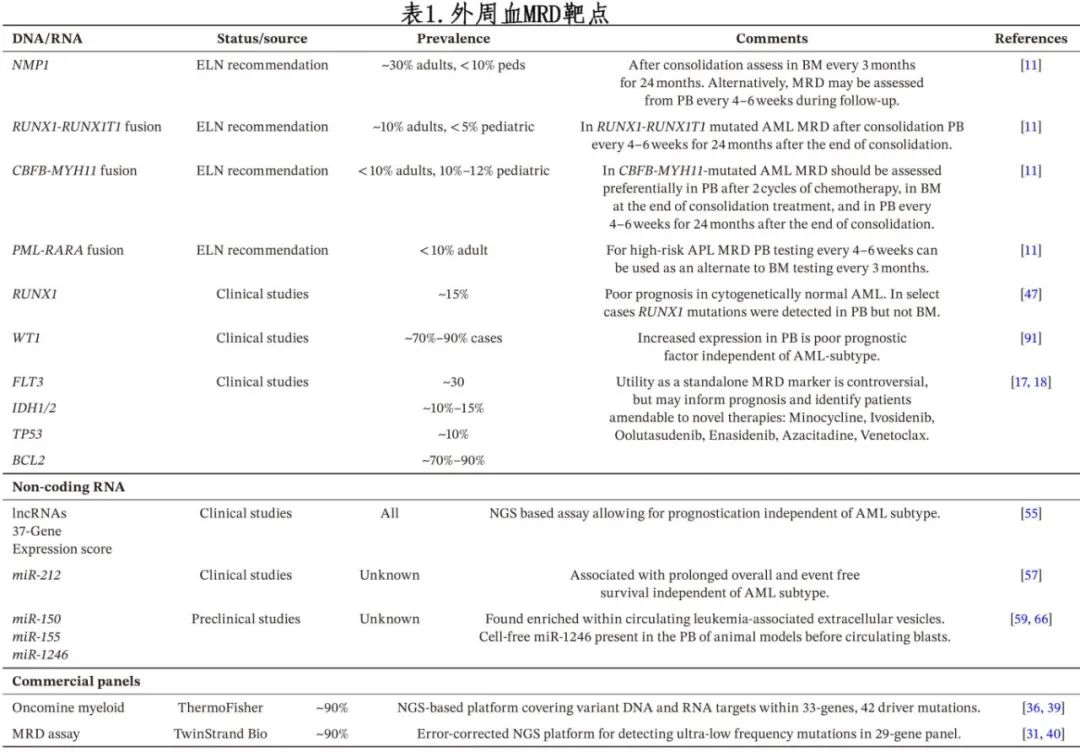
关于 BM 和 PB 样本之间灵敏度不一致仍存在问题(表2)。除了之前描述的 MFC 研究外,还有研究表明,与 BM 相比,PB样本中基于 PCR 和 NGS 的 MRD 检测具有可比性,可检测循环 PB 单核细胞中的 DNA 和游离DNA(cfDNA)。一项研究通过 NGS 比较了诊断和 CR 时 PB cfDNA 和 BM 中的28个靶基因,结果表明39个突变中19个突变的 VAF 高度一致 (r=0.849)。在化疗反应中也观察到突变模式的高度一致性,包括亚克隆结构、拷贝数变异和复发亚克隆的早期扩增。值得注意的是,使用 PCR 检测 MRD 的几项研究一致报告,与 PB 相比,BM中突变转录本增加达10倍。但也有研究发现,CR 患者第二个化疗周期后 PB MRD 是比其他时间点 PB 或治疗期间 BM的RT-qPCR 阳性更容易复发的预测因子。虽然 BM 和 PB 样本之间 MRD 检测的灵敏度存在差异,但这些研究表明,基于 PB 的检测仍是预测复发和总生存结局的有效方法。
PB 循环 cfDNA可有效提供多种肿瘤的诊断和预后意义。在髓系恶性肿瘤中,使用49基因panel分析异基因干细胞移植后患者的PB cfDNA,证明 PB cfDNA 中的 VAF 与 BM 相似。令人惊讶的是,PB cfDNA在检测小于0.26%的低 VAF 方面比 BM 更灵敏。移植后90天 PB cfDNA 样本中检测到的变异的清除与无复发生存期(未达到vs. 5.5个月,p<0.0001)和总生存期(未达到vs. 7.3个月,p<0.0001)的改善显著相关。此外,MRD持续存在大大降低了无复发生存率 (16.7% vs. 80.7%,p<0.0001) 和总生存率 (16.7% vs. 84.8%,p<0.0001)。
Short 等人的 NGS 研究证明39个不同突变中的19个在 PB 和 BM 中高度一致。然而有趣的是,对于其余突变,5个只在 PB 中检测到,而另外15个只在 BM 样本中检测到。该研究表明,两种样本来源都可能遗漏不同的亚克隆,尤其是当 VAF 较低 (<10%) 时。此外,在缓解患者中,持续突变和诊断时未出现的新突变均可在PB cfDNA中检测到,并在复发前检测到。
除了ELN目前推荐的基于PCR的基因靶标(NPM1、RUNX1-RUNX1T1、CBFB-MYH11和PML-RARA)外,其他基于PB的cfDNA靶标的结果都是初步的,需要额外的验证才能用于MRD检测。尽管如此,这些研究共同证明了 PB 作为样本来源的可行性,其与 BM 相比具有明显优势。不仅基于 PB 的检测的侵入性更小,而且允许更频繁的检测间隔,并可能提供显著的可及性获益,尤其是对于居住在远离大型治疗中心的患者。由于 PB 易于采集,因此可以在外部诊所使用现成的试剂盒提取并稳定核酸,并送去进行分析,取代患者需旅行进行专门的采样,以及与 BM 分析相关的快速样本处理的需求。
8.转录组作为MRD标志物
虽然基于 NGS 的 MRD 检测的大部分关注突变标志物,但大体积(bulk)和单细胞转录和表观遗传分析也成为基于 PBS 的 MRD 检测的补充方法。以下章节探讨转录组学分析的进展(包括编码和非编码 RNA 的RNA-seq、细胞外囊泡来源的 RNA 和游离核酸)如何改变我们对 AML 生物学和 MRD 检测的理解。同时,对表观遗传修饰(如 DNA 甲基化和组蛋白改变)的新见解也提供了额外的生物标志物,有可能改善 MRD 检测和预后。此外,单细胞测序技术提供了前所未有的 AML 异质性解决方案,使得能够发现和表征包括 AML MRD 在内的罕见人群。这些方法强调了 PB 采样用于 MRD 监测的通用性,并强调了其在检测早期复发和告知治疗决策方面的价值,尤其是对于缺乏复发性突变的 AML 患者(约40%)。
Beat AML 联盟进行了AML 全面转录表征的重大进展。通过从超过805个 BM 和 PB AML 样本中获得的基线 RNA-seq 数据,该联盟为理解 AML 的分子景观提供了实质性的资源。在他们对前两波 AML 患者数据的分析中,14组基因的表达与常见的 AML 突变共同发生。值得注意的是,一组345个基因经常与 FLT3-ITD 突变同时发生,从而强调了转录标志物识别 AML 细胞的潜力。该联盟随后的报告纳入最后两波患者数据的数据,并展示了 AML 细胞型基因表达标签的实用性。他们观察到基因突变和 AML 细胞类型基因表达特征之间存在许多显著相关性,包括在 HSC样AML 中富集TP53、BCORD和 SF3B1 突变、在原单核细胞样 AML 中富集NPM1、在单核细胞样 AML 中富集RAS。尽管这些研究未直接关注MRD,但也强调了使用 PB 技术检测 AML 时转录特征的前景。
除了检测变异或差异表达的mRNA外,非编码RNA的表达也有望在PB样品中检测MRD。研究表明,非编码 RNA 可以作为白血病的生物标志物,其诊断和预后意义与细胞来源无关,因为通常不清楚这些生物标志物是由白血病细胞直接释放还是由 BM 微环境失调中的旁观者细胞释放。MicroRNA(miRNA,长度为21-25 bp)和长链非编码RNA(ln-cRNA,长度 > 200 bp)是基因表达的强效调节因子,PB样本中的半衰期长于mRNA]。最近的一项研究对1298例儿童和96例成人 AML 患者的 lncRNA 特征进行测序,鉴定出37个上调的lncRNA,用于创建对照性lncScores,评分与初始和诱导后治疗反应相关。lncScores 阳性的患者5年 EFS 为26.7%,总生存率为42.7%,而 lncScores 阴性的患者分别为56.9%和76.3%(HR=2.48和3.16;p<0.001)。作者认为,lncScore的一致性与目前依赖于多种检测的分层方法相似,表明单独的转录分析可能对监测独立于AML亚型的MRD有价值。
大量研究也发现了 AML 中差异表达的miRNA。Lee等人的研究发现,与健康对照组相比,12个 microRNA在 AML BM 样本中高度上调。诊断时,mir-181、mir-221和 mir-3154 的表达高于缓解期,而mir-221、mir-146和 mir-155 水平与骨髓原始细胞计数升高相关。另一项研究在 BM 和 PB 样本中发现,miR-212高表达与OS、EFS和RFS延长相关,并在409例患者队列中得到验证 (HR=0.83,p=0.016)。有趣的是,miR-212高表达的发生率与 AML 的特定亚型不相关,从而使miR-212和其他非编码RNA成为MRD亚型无关的标志物的候选者。
非髓系细胞群转录谱的变化也可能预测复发;众所周知,失调的 BM 微环境中含有白血病细胞,并促进扩增和耐药。白血病微环境内非髓系细胞群释放的游离RNA也可能作为肿瘤负荷的有用替代,识别原始细胞出现于循环中之前的早期复发。
对于 PB 中的 RNA 分析,循环细胞外囊泡 (EV) 代表了 MRD 询问的一个有趣的避难所。EV是纳米级膜结合颗粒,主要由几乎所有细胞类型释放的微囊泡 (100-1000 nm) 和外泌体 (~100 nm) 组成,含有细胞特异性DNA、RNA和蛋白质。AAML 细胞脱落大量的EV,参与运输调节分子,重塑 BM 微环境并聚集在 PB 中。RNA通常在 PB 中不稳定,但包裹在 EV 脂质膜内的 RNA 本身对血清 RNAase 活性具有抗性,因此循环中的 AML 特异性 EV是亲本细胞转录状态的避难所,可用于 PB 中的疾病检测。这些囊泡可以被浓缩或选择性富集,以允许提取囊泡包裹的RNA。研究表明,在携带这些复发性突变的患者中,PB EV含有 NPM1 和FLT3-ITDmRNA,以及其他 AML 相关RNA(miR-150,CXCR4)。对从 AML 患者 PB 中采集的循环 EV 进行 NGS 检测,结果表明多个 AML 亚型中特征性miRNA(miRNA-150、miR-NA-155、miRNA-1246) 富集。最近的一项临床前研究表明,在 PB 检测到循环白血病细胞之前,在异种移植不同患者来源 AML 细胞的小鼠中,EV相关 miRNA-1246 可识别出恶性扩增。
总之,PB 中的转录生物标志物可能有助于识别 AML 和提示治疗决策。非编码 RNA 可能在通过依赖于突变驱动因子的转录失调来识别 MRD 方面具有特殊价值,这代表着约40%无复发性/决定性基因异常患者的重大进步。与之相反,由于非编码 RNA 的表达和释放不仅限于白血病细胞,其他生理或病理生理状态可能导致假阳性。例如,miRNA-155在 AML 中高表达,但在 B 细胞淋巴瘤以及正常巨噬细胞和 B 细胞对脂多糖的反应中也高表达,突出了具有特异性的问题。为了克服这一问题,在没有确定遗传畸变的情况下,MRD检测可能需要多个差异表达的非编码 RNA 靶标。尽管非编码 RNA 是无复发性/定义性基因突变患者的一个有趣的候选基因,但还需要更多的研究来确定可行的白血病特异性靶标和确定有临床意义的表达阈值。
9.表观基因组作为MRD的标志物
NGS 不仅能够深入了解 DNA 和 RNA 的全基因组分析,还能够研究 AML 的表观遗传调控。表观遗传修饰包括 DNA 甲基化和组蛋白修饰,在协调调节造血分化和维持的基因表达模式中很重要。AML的特征是广泛的表观遗传失调,导致异常基因沉默、癌基因激活和正常造血程序破坏。循环表观遗传生物标志物的鉴定具有改进诊断和预后分层的潜力,特别是在缺乏复发突变的患者中。了解AML的表观遗传学特征为AML MRD的分子基础提供了重要的见解,并可能作为其检测的PB标记物。
通过在 CpG 二核苷酸(也称为 CpG 岛)内的胞嘧啶残基上添加甲基,DNA甲基化可影响染色质结构和基因表达模式。在 AML 中,异常 DNA 甲基化模式与破坏正常造血分化、促进白血病发生和影响治疗反应有关。大型 AML 队列的表观遗传学分析显示,IDH1/2突变以及α-酮戊二酸依赖性 TET2 突变与不同的整体甲基化模式相关。同样,使用 qPCR 和重亚硫酸盐修饰的 DNA 对180例 AML 患者样本进行分析,发现ERα和/或 p15 的异常甲基化模式发生在 CR 期间>20%的白血病患者中。此外,研究人员甚至已经确定了4种 CpG 二核苷酸,它们通常揭示 AML 中异常的 DNA 甲基化模式,可以用来辨别健康和 AML 样本。尽管还需要更多的临床验证,但甲基化模式或可作为没有已知突变的患者的生物标志物。
组蛋白修饰是另一种重要的表观遗传调节机制,其失调可导致白血病转化和持续存在。这些组蛋白的化学变化构成染色质的基本单位,通过调节染色质结构和转录活性来协调遗传信息的可及性。值得注意的是,异常的组蛋白修饰是白血病转化的中心驱动因子。许多研究揭示了组蛋白修饰在 AML 中的意义,揭示了与不同细胞遗传学和分子亚型相关的组蛋白乙酰化和甲基化的特异性模式。此外,组蛋白修饰因子和读数因子的失调,如组蛋白去乙酰化酶 (HDAC) 和溴结构域蛋白,与 AML 发病机制有关。尽管如此,只有少数研究调评估了组蛋白修饰在治疗反应和 MRD 中的作用。最近的一项研究发现,PB和 BM 中对蒽环类药物阿霉素无反应的 AML 细胞缺乏阿霉素诱导的组蛋白3赖氨酸 27(H3K27me3) 或组蛋白3赖氨酸 4(H3K4me3) 三甲基化的上调。这些研究的信息有限可能是由于组蛋白修饰全基因组分析和染色质免疫沉淀测序(ChIP-seq)的标准技术。虽然像ENCODE这样的大型联盟已经部署了ChIP-seq来全面绘制全基因组组蛋白修饰,但这项技术需要大量的细胞进行每次试验。已经开发了新的酶促结合策略,包括Cleavage Under Targets and Tagmentation (CUT&Tag)和Cleavage Under Targets and Release Using Nuclease (CUT&RUN),以克服这些问题,或可更好地表征来自 PB 的 AML MRD 组蛋白修饰。
10.MRD的单细胞标志物
单细胞 NGS 技术通过分析单个细胞,提供了前所未有的循环 AML MRD 分辨率水平。与大体积测序方法相比,单细胞方法可揭示 AML 样本中以前被掩盖的细胞多样性。AML的单细胞转录组分析提高了对肿瘤层次结构的理解,并鉴定出新型细胞类型、白血病干细胞和耐药亚群。最近的一项研究甚至表明,与大体积测序相比,PB和 BM 样本中单细胞测序的 MRD 检测灵敏度更高,检测 MRD 的能力为0.12%(7840个细胞中的12个)。利用单细胞RNA-seq技术的研究已经促进了转录MRD标记物的鉴定。最近的一项研究对6份正常核型 AML 样本进行了增强全基因组测序和深度覆盖单细胞 RNA 测序,得到142642个高质量细胞用于分析。这些方法能够识别基因组和转录组的协调变化,并识别亚克隆特异性细胞状态。尽管研究的患者具有遗传、临床和转录多样性,但作者确定了携带静止、干性和细胞粘附转录标志物的复发富集白血病细胞群。单细胞测序甚至可以用免疫表型标记同时分析突变。这些研究表明,MAPK/ERK信号通路(包括NRAS、KRAS和PTPN11)突变的细胞与细胞表面 CD11b 表达升高相关。有多种商业平台可用于进行单细胞测序,包括10×Genomics和MissionBio;但这些方法存在重要的局限性,包括扩增偏倚、小基因panel、数据稀疏和多模式分析的有限使用。随着这些技术的不断发展,解决这些挑战对于充分发挥单细胞分析在解决复杂循环 AML MRD 方面的潜力至关重要。
11.NGS测序深度的挑战
测序深度仍是 NGS 技术的主要挑战,并且直接受到靶向基因数量的影响。WGS通常达到30-60×的深度,而聚焦基因panel达到更高的覆盖度,范围为100-500×。然而MRD检测需要更大的测序深度,一些研究建议深度超过20000×。与 BM 相比,PB中通常发现的较低变体频率进一步增强了该需求。为了满足这些需求而开发了基于“深度”NGS的 MRD 检测方法,使用基因特异性组合。这些panel通常根据患者的已知突变特征定制,可以实现测序深度超过20000×。与标准 MFC 或 PCR 检测相比,高灵敏度 NGS panel在检测血液肿瘤中的 MRD 方面表现出更高的灵敏度。虽然靶向方法固有地存在忽视新获得或de novo突变的风险,但它们强调了识别与MRD相关的新分子特征(无论是基于DNA、RNA还是基于表观遗传学)的重要性。测序技术的进步,如更长的读取长度和更低的错误率,有望降低目前全面基因组分析所需的测序深度。这些创新可以解决NGS的局限性,增强其在PB MRD检测中的适用性。
12.ctDNA全基因组测序
为了克服低循环肿瘤 DNA (ctDNA) 样本输入量和低拷贝变异的固有挑战,实体瘤领域的工作已纳入全基因组测序 (WGS),以规避测序深度的问题。他们没有增加测序的深度,而是利用突变的总广度,通过数学整合从1ml血浆中包含的ctDNA样本中采集的共同突变图景,来检测肺癌和结直肠癌的MRD。该方法在高突变负荷或非整倍体癌症中对 MRD 检测具有高度灵敏度,并且能够跟踪疾病负荷随时间的动态变化。但该方法检测特定驱动突变的信心有限,而突变可能有助于提示靶向治疗选择。此外,对于AML,该方法的灵敏度可能相对较低。与许多实体瘤相比,AML通常具有较低的突变负荷,中位每Mb DNA 有0.37个突变,而肺癌接近10个突变/Mb。然而基于 WGS 的方法量化突变的广度可能在区分真正的残留恶性肿瘤与癌前或年龄相关(携带特定复发突变的)克隆方面提供优势。尽管令人兴奋,但其对 AML 的疗效仍有待确定。在日本正在进行一项研究 (MONSTAR-SCREEN-3),目前正在检测基于 WGS 的肿瘤 PB MRD 检测分析,将包括白血病患者和健康对照。虽然 ctDNA 的 WGS 测序通过利用 AML 相关突变的广度显示出 MRD 检测的希望,但其对 AML MRD 检测的价值仍不确定,需要进一步验证。
13.总结
MRD 标准化的缺乏和 BM 分析的复杂性一直是患者治疗和临床试验的主要障碍。推进基于 PB 的监测策略是改善 AML 患者体验、预后和标准治疗的重要一步。设计一个包含许多 AML 亚型的单一panel是积极目标。然而随着NGS、计算算法和游离DNA/RNA 技术的进步,基于 PB 的更标准化方法的出现越来越成为现实。能够平行检测多种 AML 特异性靶标以预测疾病负荷、复发风险和确定治疗靶标的检测方法将大大改善对治疗反应的理解。基于 PB 的 MRD 有望改善疾病检测并对复发患者进行早期干预。随着转向更标准化的检验,MRD终点可能会被纳入 FDA 批准的注册研究中,然而关于如何标准化仍存在重大争议。
参考文献
Butler, J.T., Yashar, W.M. and Swords, R. (2025), Breaking the Bone Marrow Barrier: Peripheral Blood as a Gateway to Measurable Residual Disease Detection in Acute Myelogenous Leukemia. Am J Hematol. https://doi.org/10.1002/ajh.27586
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)