首页 > 医疗资讯/ 正文
近日,中国人民解放军总医院骨科研究所郭全义教授、刘舒云教授团队创新性地提出一种“无细胞再生策略”,从滑膜间充质干细胞(SMSCs)入手,利用生长分化因子5(GDF-5)预处理技术,开发出功能增强型外泌体(G-Exos),并将其载入3D打印甘草酸/透明质酸(GA/HA)支架,成功实现软骨缺损的高效修复。相关成果近日以“Three-Dimensional Bioprinting of Growth Differentiation Factor 5‑Preconditioned Mesenchymal Stem Cell-Derived Exosomes Facilitates Articular Cartilage Endogenous Regeneration”为题发表于顶级期刊《ACS Nano》,DOI:10.1021/acsnano.4c13492.研究所联合培养2022级硕士生郑亚哲、2022级博士生付力伟、2023级硕士生张智超和2024级博士生吴江为论文共同第一作者, 中国人民解放军总医院郭全义教授、刘舒云教授为论文的共同通讯作者。
【背景介绍】
关节软骨因缺乏血管和神经支配,自我修复能力极差,损伤后易发展为骨关节炎,传统疗法难以实现根本性修复。近年来,间充质干细胞(MSCs)因其多向分化潜能成为研究热点,但直接移植面临存活率低、免疫排斥等瓶颈。外泌体(Exos)作为MSCs分泌的纳米级囊泡,携带RNA、蛋白等活性成分,具有低免疫原性、高稳定性等优势,在软骨修复中展现出替代细胞治疗的潜力。研究表明,通过病理微环境模拟或生长因子预处理可增强Exos活性,如缺氧或TGF-β3预处理的Exos通过特定miRNA通路促进软骨再生。生长分化因子5(GDF-5)作为关键软骨发育调控因子,可显著提升MSCs的成软骨分化能力,但其衍生的Exos在关节腔内的长效递送仍是挑战。本研究结合3D生物打印技术,以甲基丙烯酰化透明质酸(HAMA)和甘草酸(GA)构建光固化GA/HA支架,作为Exos传递的理想载体和免疫调节的仿生平台。团队从GDF-5预处理的滑膜间充质干细胞中分离出强化外泌体(G-Exos),发现其通过富集miR-383-3p靶向抑制Kdm2a基因,激活SOX2信号轴,驱动软骨特异性标志物(SOX9、COL-2)表达。动物实验证实,载G-Exos支架可稳定释放活性外泌体20天,显著促进软骨-软骨下骨再生。该研究为无细胞软骨修复提供了新策略。
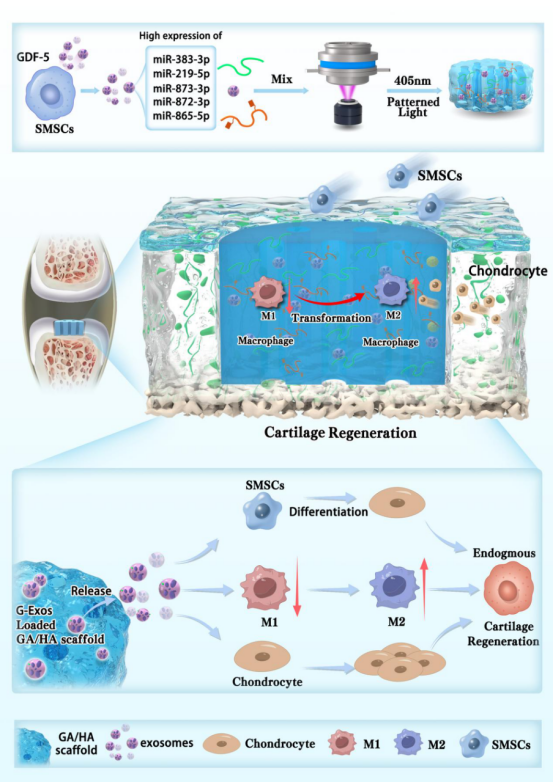
图1 负载GDF-5预处理SMSCs衍生的外泌体的DLP打印的GA/HA生物支架促进关节软骨内源性修复
研究团队通过GDF-5预处理滑膜间充质干细胞(SMSCs)48小时,利用差速离心技术成功提取出强化版外泌体G-Exos,并以普通外泌体N-Exos为对照。电镜观察显示,两类外泌体均呈现典型的双层杯状/球形结构。Western blot检测证实其高表达外泌体标志蛋白CD9、CD63、TSG101,且无细胞内膜蛋白Calnexin残留,纯度达标。纳米颗粒追踪分析(NTA)进一步表明,两者粒径分布无显著差异。为验证功能,团队用红色荧光染料PKH-26标记外泌体,与SMSCs、软骨细胞及巨噬细胞共培养24小时。结果显示,两类外泌体均被目标细胞高效内化,并富集于核周区域。
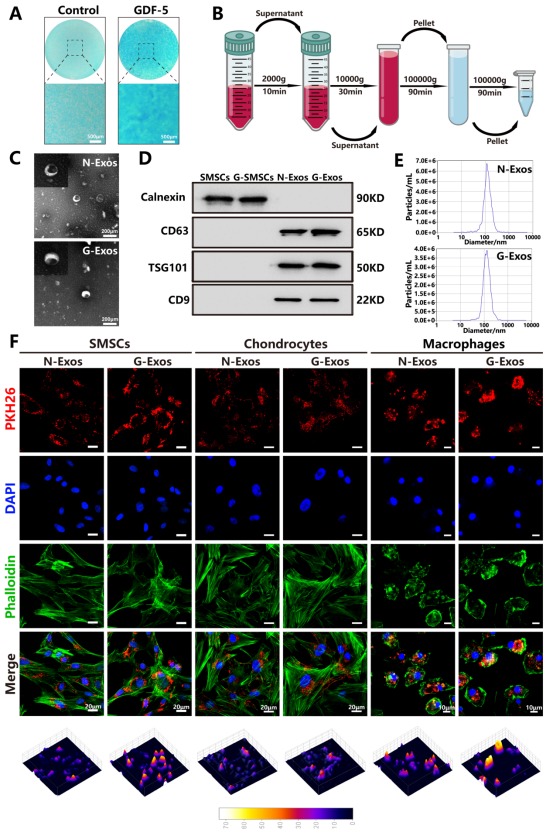
图2 G-Exos的表征和内化
通过mRNA测序和miRNA高通量分析,揭开了G-Exos促进软骨再生的分子密码。对比G-Exos处理的SMSCs与对照组,发现30个基因显著上调、20个下调,其中TGF-β、PI3K-Akt等通路被激活。高通量miRNA测序显示,miR-383-3p为G-Exos中上调最多的miRNA,成为软骨再生的“核心开关”。
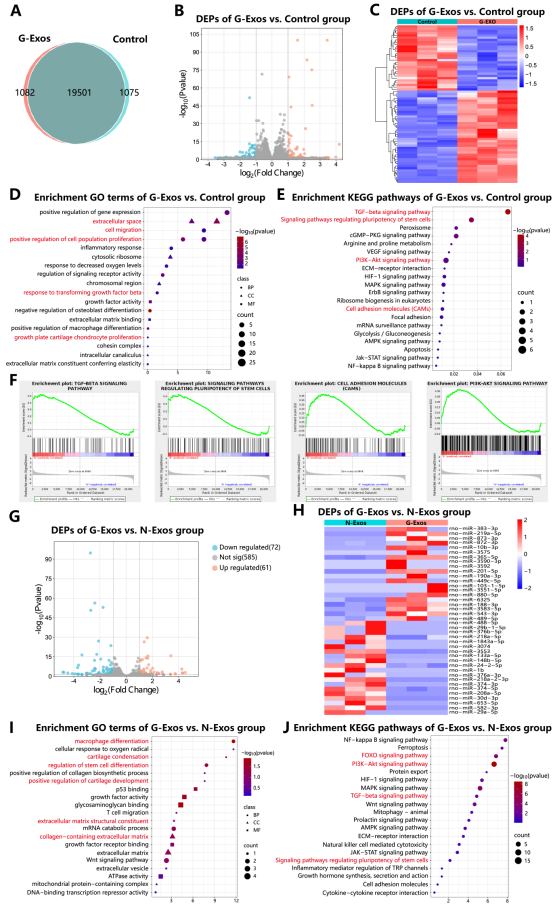
图3 G-Exos对软骨生成的内在机制
通过5个在线数据库mmiRTargetLink2.0、miRDB、RNAInter、DIANA-microT-CD及 miRWalk来预测miR-383-3p的潜在靶点。双荧光素酶报告基因检测证实miR-383-3p直接结合Kdm2a基因的3'非编码区,抑制其活性,免疫荧光染色和Western blot检测表明miR-383-3p的过表达抑制了Kdm2a,从而促进了SOX2和软骨特异性标志物(SOX9、ACAN和COL-2)的高表达。综上所述,G-Exos通过调节miR-383-3p/Kdm2a/SOX2信号轴来增加SMSCs的成软骨分化。
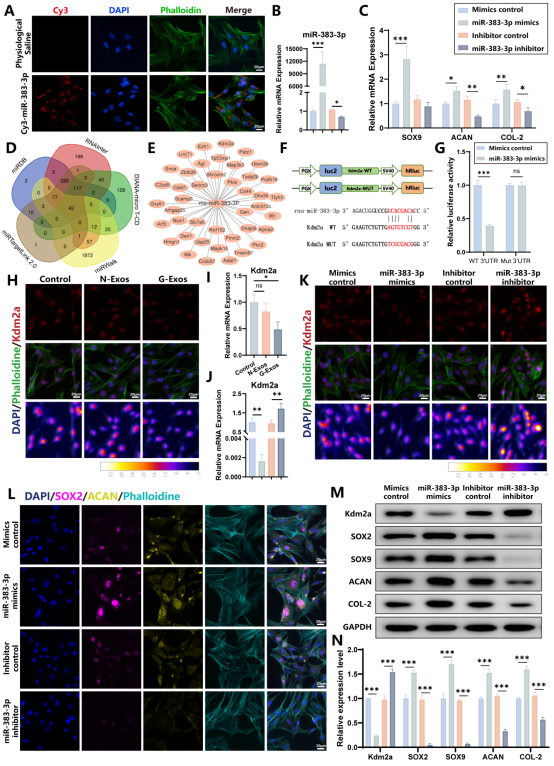
图4 G-Exos通过调节miR-383-3p/Kdm2a/SOX2通道轴促进软骨分化
关节腔内机械应力、酶降解和免疫清除如同“三重围剿”,常导致外泌体(Exos)快速失效。研究团队创新性开发DLP光固化3D打印GA/HA复合支架,成功破解这一难题。扫描电镜(SEM)显示,支架呈现多孔的海绵状结构,为细胞粘附与增殖起着至关重要的作用。释放实验显示,支架可持续释放外泌体长达20天,细胞骨架和活/死染色显示支架具有良好的生物相容性。在免疫微环境调控方面,甘草酸(GA)成分协同外泌体,促进巨噬细胞向抗炎M2型极化。综上所述,研究团队构建了一个具有良好物理和生物学特性的控制外泌体释放的3D打印支架,用于后续的体内研究。
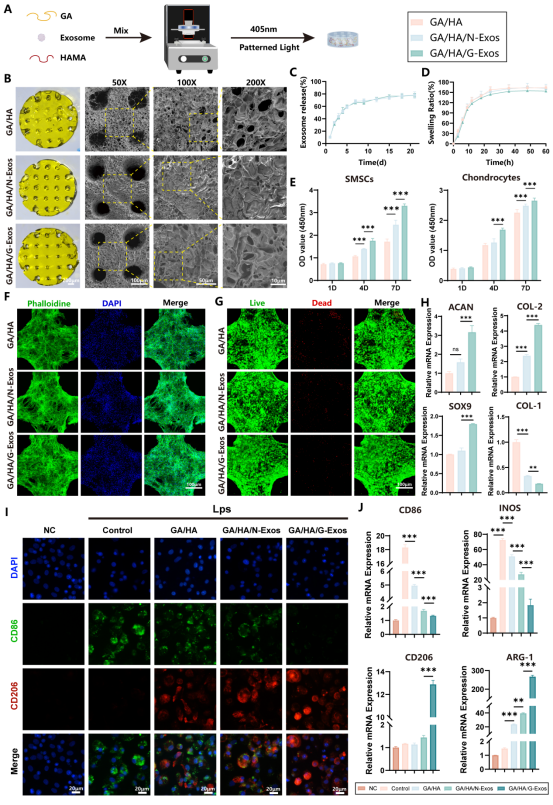
图5 负载G-Exos的DLP打印GA/HAMA支架制备与表征
研究团队通过大鼠股骨髁软骨缺损模型(直径2mm,深度1mm),系统性验证了GA/HA/G-Exos支架的修复效能。体内荧光追踪显示,支架负载的G-Exos在关节腔内稳定释放超过7天,滞留时间较直接注射组延长,保障了外泌体的持续作用。大体观察显示术后12周,GA/HA/G-Exos组新生软骨与周围组织无缝整合,表面光滑度接近假手术组,ICRS评分显示GA/HA/G-Exos组得分高于其他治疗组,但与假手术组相比仍有差异。Micro-CT分析显示,GA/HA/G-Exos组有大量新形成的软骨下骨。
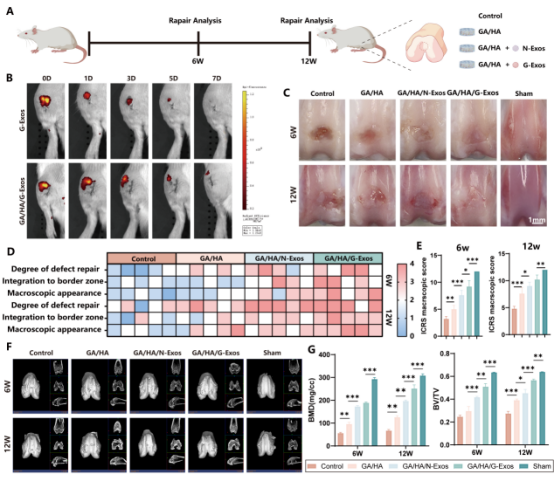
图6 G-Exos功能化的DLP打印支架促进关节软骨内源性再生
【总结】
本研究开发了一种基于GDF-5预处理SMSCs衍生的Exos和DLP生物打印的GA/HA支架修复关节软骨损伤的新治疗策略。G-Exos通过miR-383-3p/Kdm2a/SOX2轴显著增加SMSCs的成软骨潜能。并且通过将G-Exos加载到DLP生物打印的GA/HA控释支架上,实现了G-Exos在关节腔内的长期稳定作用。最后,在体内植入GA/HA/G-Exos多功能支架后,实现了高质量的关节软骨再生。因此,使用GA/HA/G-Exos作为生物支架代表了一种有前途的无细胞再生软骨缺损修复策略,为开发外泌体控制释放支架促进软骨再生的潜力提供了有价值的见解。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c13492
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)