首页 > 医疗资讯/ 正文
免疫检查点抑制剂疗法的出现是近年来癌症治疗领域最重要的进展之一。尽管这一疗法在某些癌症中已成为主要治疗手段,但在胰腺癌治疗中基本无效。胰腺导管腺癌和胰腺神经内分泌肿瘤对检查点抑制治疗很少产生应答。本文报告两例经传统治疗无效或复发的晚期胰腺癌病例。通过对每个肿瘤组织进行测序并分析PD-L1表达情况后,在评估了综合阳性评分(CPS)或肿瘤突变负荷(TMB)等预测性生物标志物后,开始对患者实施检查点阻断治疗。两例患者均获得了持久的影像学缓解。因此研究人员建议,在考虑启动免疫检查点抑制剂治疗时,对难治性或复发性胰腺癌进行综合阳性评分(CPS)和肿瘤突变负荷(TMB)评估是合理的。
背 景
胰腺恶性肿瘤(如胰腺导管腺癌[PDAC]与胰腺神经内分泌肿瘤[PNETs])在出现全身疾病进展时通常无法治愈,且除极少数患者外,这类肿瘤已被证实对免疫检查点阻断(ICB)治疗存在抵抗性。其原因涉及多方面,包括相对缺乏细胞毒性T细胞(CTL)浸润。尽管多种预测ICB应答的生物标志物正处于临床前和临床研究阶段,但目前尚无明确的确诊性检测方法。因此目前只能基于在更敏感恶性肿瘤中使用的现有生物标志物来识别ICB疗效的预测因子。
综合阳性评分(CPS)和肿瘤阳性比例评分(TPS)是基于组织的免疫组化评分系统,可定量评估PD-L1表达水平。这两种指标已被提出作为非胰腺恶性肿瘤对ICB治疗敏感性的预测因子。类似地,肿瘤突变负荷(TMB)升高可指导晚期实体瘤中ICB的临床应用。本文报告两例具有阳性TPS/CPS和高TMB(TMB-H)的胰腺恶性肿瘤病例,这些生物标志物与患者对ICB的显著临床应答相关。第一例患者以腹痛、尿液发黑和瘙痒就诊,被诊断为胰腺导管腺癌,最终出现远处转移且转移灶显示高TPS/CPS。另一例患者因腹痛就诊,被诊断为转移性PNET,其TMB-H促使临床采用免疫治疗。通过影像学评估和症状控制可见,两位患者均实现了显著且持续的临床缓解。本文研究表明,在通常对ICB无应答的胰腺恶性肿瘤类型中,TPS/CPS和TMB-H可能具有预测ICB治疗反应的潜力。
病例1
患者男,77 岁,最初因腹痛、尿液发黑及全身瘙痒就诊(图1)。影像学检查发现其存在胆道梗阻及胰腺肿块,经超声内镜引导下活检确诊为胰腺导管腺癌。初诊时为IIB期(cT3N1M0)。患者接受新辅助化疗(吉西他滨联合白蛋白结合型紫杉醇),期间并发白细胞减少、蜂窝织炎及贫血。随后接受放化疗,并行胰十二指肠切除术(术后分期为ypT1aN0M0),继而接受5-氟尿嘧啶辅助化疗。术后两年余,患者出现多发性肺部病灶,提示肿瘤复发转移。起初选择观察,但病灶持续增大,遂接受进一步治疗。肺部病灶活检证实为与胰腺原发灶一致的转移性腺癌,初始采用卡培他滨单药治疗。对活检样本进行下一代测序及免疫组化染色(PD-L1抗体克隆号DAKO 22C3)。转移病灶的PD-L1表达显示综合阳性评分(CPS)为40,肿瘤阳性比例评分(TPS)为 40%(图2),并存在CDH1功能缺失。对原发肿块的回顾性PD-L1检测显示CPS为 75、TPS为 70%,且错配修复功能完整。启动卡培他滨治疗后,患者不幸发生输入袢穿孔,需行剖腹探查及修补术,术后恢复顺利,未出现并发症。因这一急症事件,患者停用卡培他滨。后续发现胸腔内病灶负荷增加,鉴于肺部转移灶活检显示CPS/TPS阳性,开始使用帕博利珠单抗治疗,患者耐受良好,未出现皮疹、呼吸困难或腹泻。帕博利珠单抗治疗 7 个周期后随访影像显示肺部转移灶数量和大小显著减少,腹部及盆腔未见转移病灶(图2)。启动帕博利珠单抗治疗一年后出现疾病进展迹象。截至目前,患者仍持续接受帕博利珠单抗治疗,定期随访及监测。
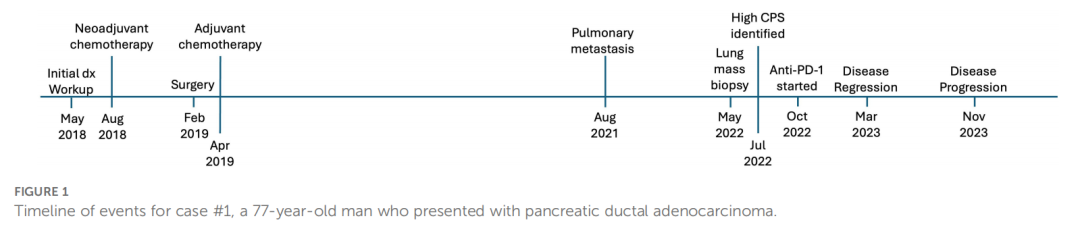
▲图1 病例1的治疗时间线
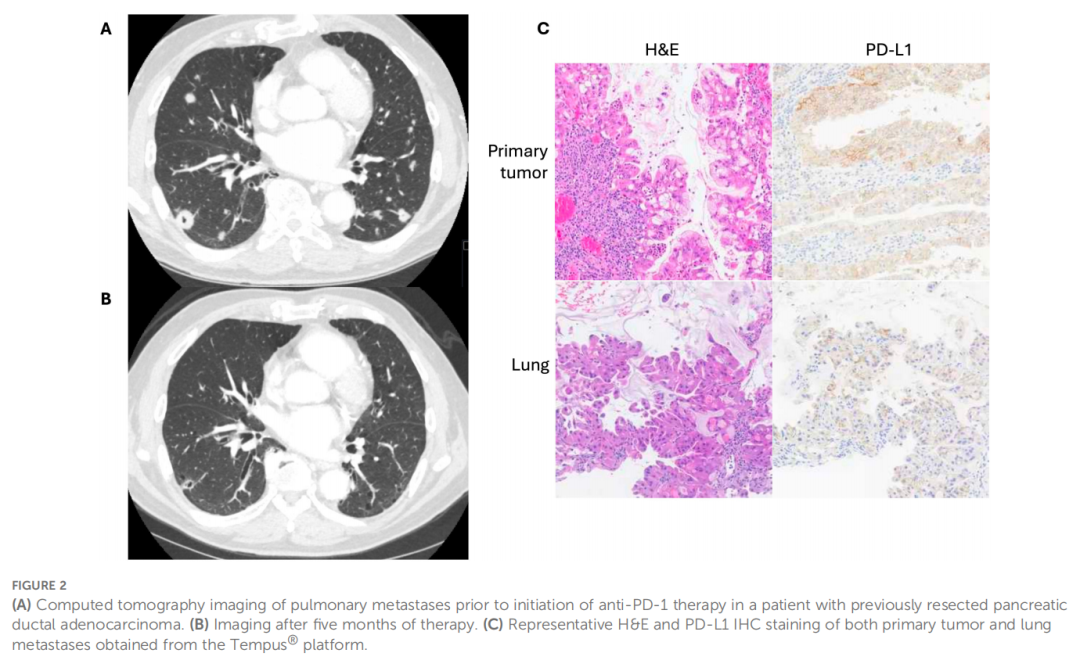
▲图2 影像学结果和病理结果
病例2
患者女,63 岁,有基底细胞皮肤癌病史,此次因腹痛 1 个月、食欲减退 2 周及黑便就诊(图3)。约一个月前结肠镜检查显示憩室病伴乙状结肠迂曲固定。CT扫描发现胰腺巨大占位(9×7 cm),周围淋巴结肿大及肝内病灶。随后的超声内镜显示一个圆形、轻度低回声、边界中等的肿块侵犯门静脉主干并伴有门静脉血栓形成,同时累及肝动脉和胆总管。遂行胆总管支架置入术。细针穿刺活检证实为2级神经内分泌肿瘤(Ki-67指数 15%)。PET扫描显示中腹部存在生长抑素受体高亲和性肿块,对应胰腺原发灶及门静脉周围淋巴结,但肝内病灶未见明显摄取。患者初始接受奥曲肽治疗,但诊断后 6 个月内出现体重下降、血清嗜铬粒蛋白A水平升高及影像学疾病进展。复查内镜显示肿瘤侵犯胆管支架周围十二指肠。因疾病进展,加用依维莫司治疗,并继续奥曲肽。间隔期CT复查显示胰头部肿块缩小至 8.8×8.2 cm,门静脉侵犯范围减少。
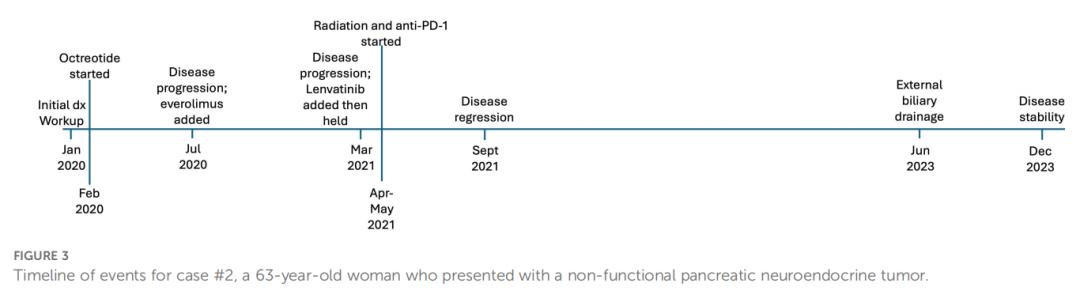
▲图3 病例2的治疗时间线
通过下一代测序进行分子检测,结果显示存在TP53和TSC2基因致病性突变,且肿瘤突变负荷(TMB)为 10.5 muts/Mb(排位为 89%)。值得注意的是,此时患者的肿瘤PD-L1表达为阴性。因疼痛问题,患者转诊至放射肿瘤科,并对原发肿瘤完成立体定向体部放疗(SBRT)。在继续奥曲肽与依维莫司治疗的基础上,基于TMB-H状态加用帕博利珠单抗。启动帕博利珠单抗治疗 6 个月后的再分期扫描显示,胰腺原发肿瘤及门静脉周围淋巴结肿大均较前缩小(图4)。治疗 9 个月时复查磁共振成像(MRI)显示肿瘤体积进一步减小。患者病程中曾并发中性粒细胞减少症、直肠结肠炎、产志贺毒素大肠杆菌感染及艰难梭菌感染。自启动帕博利珠单抗治疗至今已超过两年,患者仍维持疾病控制,唯一新增并发症为胆道梗阻需行外引流治疗。
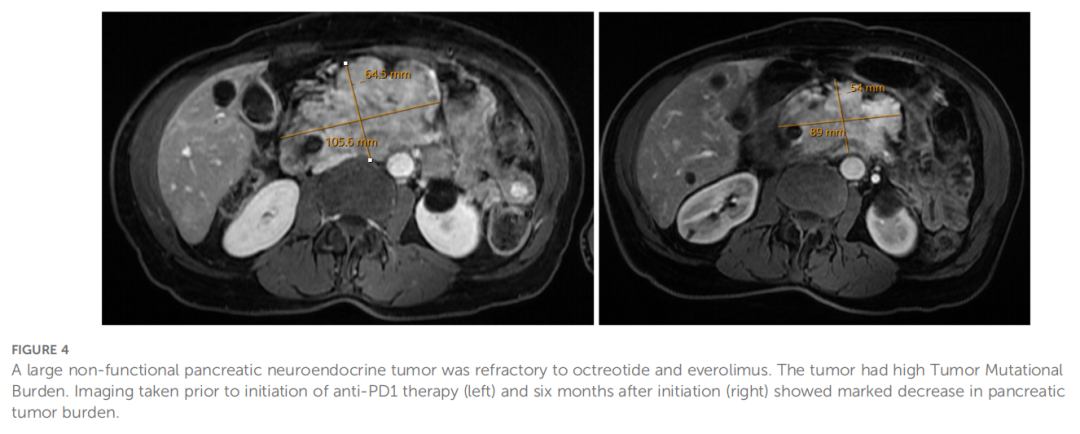
▲图4 胰腺神经内分泌肿瘤对奥曲肽和依维莫司具有耐药性
讨 论
胰腺导管腺癌(PDAC)与胰腺神经内分泌肿瘤(PNET)通常对免疫检查点阻断疗法(ICB)无应答,仅有不足 5% 的PDAC患者能从检查点治疗中获益。一项纳入 207 例晚期癌症患者接受抗PD-L1治疗的I期临床试验中,14 例胰腺癌患者无一出现治疗反应。另一项针对晚期PDAC患者评估抗CTLA4治疗的II期试验同样显示无应答者。然而,可能有一小部分胰腺癌患者能从ICB中获益。因此,在PDAC和PNET患者中寻找更多预测检查点阻断疗效的指标至关重要。本文报告的两例胰腺恶性肿瘤病例中,尽管患者错配修复蛋白功能完整,但仍从ICB治疗中获得显著且持久的临床获益。
第一例为PDAC患者,在接受化疗和手术等常规治疗后出现肺转移复发。转移灶活检及新一代测序显示其综合阳性评分(CPS)升高,回顾性分析原发灶也显示类似结果。因此,该患者接受帕博利珠单抗作为挽救治疗,疾病控制持续超过一年。第二例为局部晚期PNET患者,在奥曲肽和依维莫司治疗期间疾病进展,但因其肿瘤突变负荷高(TMB-H)接受ICB后实现持续缓解。综合来看,这些病例提示CPS/TPS定量分析与TMB检测可能对指导胰腺恶性肿瘤患者的ICB治疗决策具有价值。
TMB作为反映肿瘤基因组突变频率的指标,与肿瘤免疫原性相关,可能预测PD-L1阻断疗效。PDAC和PNET患者中TMB-H的比例极低。部分研究提示,TMB-H的PDAC患者可能表现出更强的抗肿瘤免疫活性,且存在微卫星稳定(MSS)但TMB-H的亚群。在一项评估特瑞普利单抗(抗PD-1单抗)治疗晚期神经内分泌肿瘤的IB期试验中,TMB前 10% 患者的客观缓解率显著高于后 10% 患者。此外,Keynote-158研究前瞻性分析了TMB-H与帕博利珠单抗疗效的关系,纳入 92 例神经内分泌肿瘤患者。结果显示,无论是什么癌种,TMB-H患者接受帕博利珠单抗治疗后的无进展生存期均优于低TMB患者。
肿瘤免疫微环境也是影响ICB疗效的关键因素。在胰腺癌中,PDAC的肿瘤免疫微环境研究最为深入,肿瘤特异性细胞毒性T细胞(CTL)的存在可能是ICB起效的前提条件。PDAC通常被归类为免疫学“冷肿瘤”,即缺乏活跃的CTL浸润。导致这种免疫抑制状态的因素复杂,可能涉及髓系细胞浸润、调节性T细胞(Treg)富集、肿瘤基质特性、细胞间信号传导以及特定基因突变。其中,髓系细胞在肿瘤发生、免疫逃逸和转移中发挥重要作用。为改善胰腺癌的免疫活性,已有多种策略尝试将PDAC从“冷肿瘤”转化为具有丰富CTL浸润的“热肿瘤”,例如通过抑制自噬上调MHC-I表达、阻断STAT3和MEK信号通路、以及CD40激动剂激活抗肿瘤巨噬细胞和树突状细胞。尽管这些研究超出本文讨论范围,但未来探索CTL数量或肿瘤相关巨噬细胞活性作为胰腺癌ICB疗效预测指标的可能性值得关注。
疾病复发和转移的部位也可能是预测胰腺癌ICB疗效的重要因素。第一例患者仅出现孤立性肺转移,这可能与其良好预后相关。肺转移在PDAC术后复发中相对少见(发生率约 14%),而肝转移更为常见。回顾性研究显示,孤立性肺转移患者的生存期显著优于其他转移模式(中位总生存期 40.3 个月 vs. 20.9 个月)。日本多中心研究及系统综述也证实,肺转移患者接受寡转移灶切除后中位生存期可达 31.3 个月。相反,孤立性肝转移患者预后较差。SEER数据库分析显示,无论原发肿瘤类型,肝转移患者的死亡风险最高。另一项研究指出,胰腺癌术后肺转移患者总生存最佳,而肝转移患者预后最差。孤立性肺转移与生存优势的关联机制尚未明确,其与PD-1/PD-L1阻断疗效的关系仍需进一步探索。尽管本例患者的高CPS状态可能预测了ICB疗效,但需注意孤立性肝转移患者的结局可能不同。
本报告的主要局限性在于其回顾性研究性质及样本量较小。仅有两例病例的报道,无法外推至所有难治性胰腺癌患者。由于样本量有限,研究人员无法对多例患者的治疗效果进行统计分析。此外,无法确定伴随的基因突变是否会影响检查点抑制的疗效。对于PDAC患者而言,其孤立性肺转移模式可能是决定其对免疫检查点阻断产生良好应答的关键因素,而类似肝转移患者是否具有相同结局尚不明确。截至本文撰写时,本机构尚未发现伴有肝转移并对免疫检查点阻断产生应答的胰腺癌病例。最后,本文还缺乏其他潜在生物标志物(如CTLs或肿瘤髓系细胞)的定量数据。
据研究人员所知,迄今为止尚未有前瞻性研究探讨CPS或TPS能否预测胰腺恶性肿瘤对ICB的应答。目前尚无大规模研究报道胰腺导管腺癌患者的CPS评分分布,回顾性分析亦表明TMB-H发生率较低。然而,本文报道的病例提示可能存在CPS、TPS或TMB升高的胰腺癌患者亚群能够从检查点抑制治疗中获益。因此,这些生物标志物可能适用于所有对常规治疗无效的复发性胰腺癌病例。
参考文献:
Li KY, Lowy AM and Fanta P (2024) Quantification of PD-L1 expression and tumor mutational burden in biologically distinct advanced pancreatic cancers responding to pembrolizumab: case reports. Front. Immunol. 15:1452543. doi: 10.3389/fimmu.2024.1452543

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)