首页 > 医疗资讯/ 正文
[摘要] 胃癌是全球范围内高发恶性肿瘤,具有高度侵袭性,总体预后不佳等特点。东西方胃癌人群在流行病学、临床病理学特征、治疗模式及药物选择等方面存在差异。近年来,随着靶向治疗和免疫治疗的快速推进,精准治疗理念的成熟和多学科治疗的推广等,临床研究成果不断更新,胃癌指南每年持续更新,以适应不断变化的诊疗需求。本文就全球范围内三大权威胃癌指南最新版[包括美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)胃癌临床实践指南2024年V5版(2024年12月发布)、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)胃癌在线指南2024版(2024年9月发布)和中国临床肿瘤协会(Chinese Society of Clinical Oncology, CSCO)胃癌诊疗指南(2024年4月发布)]更新内容的异同点进行对比与梳理,聚焦不可手术切除的局部晚期或转移性食管胃结合部和胃腺癌的临床治疗策略,关注基于靶点如人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、程序性死亡受体配体1(programmed death-ligand 1,PD-L1)表达、错配修复蛋白(mismatch repair,MMR)状态和新靶点如Claudin 18.2(CLDN18.2)等为导向的抗肿瘤药物的精准实施和全程管理。其中, HER2阳性晚期胃癌进入全线抗HER2治疗时代,抗HER2的抗体药物偶联物(antibody-drug conjugate,ADC)成为一线曲妥珠单抗治疗耐药之后的新选择。除此之外,免疫治疗联合化疗成为晚期胃癌一线治疗新标准,基于MMR状态和PD-L1表达指导的诊疗模式将免疫治疗推向精准化,然而目前PD-L1表达检测在临床推广和执行的过程中仍存在一定困难。2024年发表的三大指南融合了最新的临床研究结果、药物适应证的获批情况和医疗保健系统的实情等内容,尤其是CSCO胃癌指南基于中国自主研发药物的快速发展和针对中国人群研究适应证的成功获批进行了更新。三大指南在靶向治疗、免疫疗法等新疗法的推荐和采用等方面存在差异,本文基于不同指南内容展现出不同的视角与侧重,以丰富临床决策的维度,增强循证医学指南的临床适应性,进而指导临床实践。
[关键词] 胃癌;诊疗指南;中国临床肿瘤协会;美国国家综合癌症网络;欧洲肿瘤内科学会
[Abstract] Gastric cancer is a highly prevalent and aggressive malignancy worldwide, with generally poor prognosis. There are differences in epidemiology, clinicopathological characteristics, treatment modalities, and drug selection for gastric cancer between Eastern and Western populations. Recent advancements in targeted therapy and immunotherapy, the maturation of precision treatment concepts, and the promotion of multidisciplinary therapy have led to continuous updates in clinical research outcomes. Gastric cancer guidelines are annually updated to meet evolving diagnostic and therapeutic needs. This article compared the latest versions of three authoritative global gastric cancer guidelines [National Comprehensive Cancer Network (NCCN) clinical practice guidelines for gastric cancer 2024 version 5, European Society for Medical Oncology (ESMO) online guidelines for gastric cancer 2024, and Chinese Society of Clinical Oncology (CSCO) guidelines for gastric cancer diagnosis and treatment 2024], focusing on clinical treatment strategies for unresectable locally advanced or metastatic esophagogastric junction/gastric adenocarcinoma, and on the whole-process management and precise implementation guided by targets such as human epidermal growth factor receptor 2 (HER2) expression, programmed cell death ligand 1 (PD-L1) expression, mismatch repair (MMR) status,, and novel targets such as Claudin 18.2. Meanwhile, HER2-positive advanced gastric cancer has entered the era of full-line anti-HER2 treatment. Anti-HER2 antibody-drug conjugates (ADCs) has become a new option after first-line trastuzumab resistance. Immunotherapy combined with chemotherapy is regarded as a new standard for the first-line treatment of advanced gastric cancer. The diagnosis and treatment mode based on MMR status and PD-L1 expression promote the precision of immunotherapy. However, the detection of PD-L1 expression has difficulties in clinical promotion and implementation. The three guidelines in 2024 integrate the latest clinical study results, the new indication approval and the updated health care system. In particular, the CSCO gastric cancer guidelines are rewritten based on the rapid development of independently developed drugs in China and the approval of new indications. The three guidelines differ in the recommendation and adoption of targeted therapy and immunotherapy. This article showed different perspectives and focuses based on different guidelines, enriched the dimensions of clinical decision-making, helped the clinical adaptability of evidence-based guidelines to better enlightens clinical practice.
[Key words] Gastric cancer; Diagnosis and treatment guidelines; CSCO; NCCN; EMSO
据2024年全球癌症数据统计[1]显示,胃癌新发病例数和死亡病例数均居恶性肿瘤的第5位,其中新发病例数为96.84万例,且年轻人患胃癌的概率越来越高,死亡病例数为65.99万例。中国胃癌高发,约占全球的40%,国家癌症中心2024发布的数据[2]显示,全国胃癌的年发患者数超过35万,位列所有恶性肿瘤的第5位;死亡人数超过26万人,位列恶性肿瘤的第3位。胃癌具有高度侵袭性,多数胃癌初诊时已处于中晚期,预后不佳,手术、放疗和化疗等传统手段的疗效有限,胃癌诊治体系面临着诸多亟待解决的问题。近年来,随着靶向治疗和免疫治疗的快速推进,许多新型药物的获批和新治疗模式如精准治疗和多学科治疗理念的成熟,使得胃癌的临床治疗手段日益丰富,为患者带来了新的希望。
癌症诊疗指南作为循证医学的产物,为临床提供标准化的诊治决策,随着临床实践经验的积累和研究成果的不断更新,胃癌指南每年持续更新,以适应不断变化的诊疗需求。众所周知,胃癌时空异质性强,肿瘤微环境复杂,东西方胃癌人群在流行病学发病特征、临床病理学特征、生物学行为、治疗模式及药物选择等方面存在差异。不同地区或国家的胃癌临床管理方式存在差异,这些差异也反映在不同地区的不同临床情况、研究重点和医疗保健系统运行状况上。本文就在全球范围内三大权威胃癌指南的最新版本[包括美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)胃癌临床实践指南2024年第5版(2024年12月发布)、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)胃癌在线指南2024版(2024年9月发布)和中国临床肿瘤协会(Chinese Society of Clinical Oncology,CSCO)胃癌诊疗指南(2024年4月发布)]更新内容的异同点进行对比与梳理,聚焦不可手术切除的局部晚期或转移性胃食管结合部肿瘤/胃腺癌的临床治疗策略,探讨抗肿瘤药物布局和精准治疗,致力于解决循证医学指南的临床适应性问题,以更好地启迪临床研究思路和指导临床实践。
1 晚期不可切除或转移性胃癌的一线治疗
对于无手术根治机会或转移性胃癌患者,三大指南均推荐应采取以全身药物治疗为主的综合治疗。药物选择依据患者年龄、体能状况、伴随疾病、既往治疗情况、患者意愿、经济状况、临床实践偏向、药物可及性等综合诊断评估,主要差异体现在靶向治疗、免疫疗法等新疗法的推荐和采用等方面。
三大指南一致推荐根据人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达和错配修复蛋白(mismatch repair,MMR)状态对患者群体进行分类管理,包括HER2高表达阳性人群、HER2阴性表达人群和错配修复蛋白缺失/微卫星高度不稳定(deficient mismatch repair/microsatellite instability-high, dMMR/MSI-H)人群。Claudin18.2阳性表达人群管理受到三大指南关注。另外CSCO指南增加产甲胎蛋白(alpha fetal protein,AFP)胃癌人群的管理。
1.1 HER2阳性患者的一线治疗
三大胃癌指南在局部晚期不可切除或转移性HER2阳性胃癌患者[免疫组织化学(immunohistochemistry,IHC)检测结果为3+或IHC为2+/荧光原位杂交技术(fluorescence in situ hybridization,FISH)+]的一线治疗推荐方案上意见一致,即基于HER2状态的免疫治疗优势人群再分层:对于程序性死亡受体配体1(programmed death-ligand 1,PD-L1)综合阳性评分(combined positive score,CPS)≥1的患者,优先推荐在标准治疗(化疗联合曲妥珠单抗)的基础上联合帕博利珠单抗治疗。对于CPS评分<1的患者,优先推荐化疗联合曲妥珠单抗治疗。决策改变的依据主要基于全球多中心KEYNOTE-811[3]Ⅲ期临床研究结果的更新公布。该研究入组了698例初治的HER2阳性的晚期胃癌患者,首次中期分析结果显示,在曲妥珠单抗+化疗的基础上加入帕博利珠单抗,患者的客观缓解率(objective response rate,ORR)提高了22.7%(74.4% vs 51.9%,95% CI:11.2~33.7;P=0.000)。因此,2021年5月美国食品药品监督管理局(Food and Drug Administration,FDA)加速批准帕博利珠单抗联合曲妥珠单抗和化疗用于HER2阳性晚期不可切除或转移性胃癌患者的一线治疗。2023年ESMO会议上公布的生存结果[4]显示,在意向性治疗(intension-to-treat,ITT)人群中,曲妥珠单抗+化疗+帕博丽珠单抗一线治疗可延长患者的中位无进展生存期(median progression-free survival,mPFS),根据PD-L1表达水平进行分层,PD-L1 CPS≥1的患者mPFS显著延长(10.9个月 vs 7.3个月,HR=0.71);而对于CPS<1的患者两组之间mPFS差异无统计学意义(9.5个月 vs 9.5个月,HR=1.03),观察到的不良事件(adverse event,AE)符合预期,未发现新的安全性问题。
曲妥珠单抗联合化疗+帕博利珠单抗先后在美国、欧盟和中国获批用于治疗HER2阳性和PD-L1 CPS≥1双重表达的局部晚期不可切除或转移性胃食管结合部肿瘤或胃腺癌患者。在KEYNOTE-811研究[3]中,87%的患者接受了XELOX(奥沙利铂+卡培他滨)方案化疗,真实世界临床实践应用现状显示,相对于顺铂,患者对奥沙利铂有更好的耐受性。因此,在化疗方案的选择上,三大指南均推荐铂类药物联合氟尿嘧啶,铂类药物优先推荐奥沙利铂。
1.2 HER2阴性患者的一线治疗
三大指南在HER2阴性局部晚期不可切除或转移性胃癌的一线治疗方案推荐上一致,即基于肿瘤组织PD-L1表达水平推荐化疗是否进一步联合免疫治疗药物或不同的免疫检查点抑制剂。在化疗方案选择上,三大指南均推荐氟尿嘧啶联合铂类药物的两药联合方案,其中NCCN指南和CSCO指南提出优先推荐含奥沙利铂的方案。ESMO指南不建议FLOT(氟尿嘧啶+奥沙利铂+ 多西他赛)联合免疫治疗,基于多西他赛加入后的潜在益处与潜在危害的评估,相较于FOLFOX (氟尿嘧啶+奥沙利铂)方案,FLOT方案的血液学和胃肠道毒性及神经系统等不良事件增加。
NCCN指南基于Checkmate 649研究[5]结果,推荐PD-L1 CPS≥5的患者优先接受一线化疗联合纳武利尤单抗治疗(1类推荐),对于PD-L1 CPS<5的患者在某些情形下考虑化疗联合纳武利尤单抗治疗(2B类推荐)。基于KEYNOTE-859研究[6]结果,推荐PD-L1 CPS≥1的患者接受一线化疗联合帕博利珠单抗治疗,其中PD-L1 CPS≥10的人群为1类推荐,PD-L1 CPS为1~10的患者为2B类推荐。ESMO指南基于Checkmate 649研究[5]结果,推荐PD-L1 CPS为1~4的患者可考虑纳武单抗联合化疗,PD-L1 CPS≥5的患者则推荐给与纳武单抗联合化疗,分层推荐的理由为PD-L1的表达水平与程序性死亡受体-1(programmed death-1,PD-1)单抗的疗效线性相关,PD-L1 CPS为1~4与临界疗效相关(HR=0.95),而且目前关于纳武利尤单抗的适应证的范围,FDA的批准无PD-L1 CPS表达水平的限制,欧洲药品管理局(European Medicines Agency,EMA)的批准限于PD-L1 CPS≥5的患者。基于KEYNOTE-859研究[6]的结果,帕博丽珠单抗联合化疗可考虑适用于PD-L1 CPS为1~9的患者,对于PD-L1 CPS≥10的患者应予以帕博丽珠单抗联合化疗。分层推荐理由鉴于该研究报道的PD-L1的表达水平越高则疗效越高的结果。CPS 1~9与临界疗效相关(HR=0.83),而且目前FDA对于帕博丽珠单抗的使用无PD-L1 CPS表达水平的限制,EMA的批准则限于PD-L1 CPS≥1的胃腺癌和CPS≥10的食管腺癌)。
与NCCN和ESMO指南相比,CSCO指南推荐化疗联合免疫治疗,且免疫检查点抑制剂的选择更加丰富和多样:包括多个PD-1单抗(如纳武利尤单抗、帕博丽珠单抗、信迪利单抗和替雷利珠单抗)、PD-L1单抗(如舒格利单抗)和PD-1/细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)双抗(如卡度尼利单抗)等,基于不同的Ⅲ期临床研究结果,根据PD-L1表达评估方法和表达水平的不同,免疫治疗联合化疗的推荐方案更加多元化和细化,且覆盖人群更广,包括PD-L1低表达甚或CPS<1或检测不可及的患者,也纳入单药免疫治疗适应人群的考量。基于CheckMate 649[5]和ATTRACTION-4[7]Ⅲ期临床研究的结果,对于PD-L1 CPS≥5分的患者,推荐FOLFOX/XELOX联合纳武利尤单抗(1A类);基于ORIENT-16[8]Ⅲ期临床研究结果,对于PD-L1 CPS≥5分的患者,推荐XELOX联合信迪利单抗(1A类);基于RATIONALE-305[9]Ⅲ期临床研究结果,对于PD-L1 TAP≥5%的患者,推荐XELOX或FP(氟尿嘧啶+顺铂)联合替雷利珠单抗(1A类);基于KEYNOTE-859研究[6]结果,对于PD-L1 CPS≥10的患者,推荐XELOX或FP联合帕博利珠单抗(1A类);基于GEMSTONE-303[10]Ⅲ期临床研究结果,对于PD-LI CPS≥5分的患者,推荐XELOX联合舒格利单抗(1A类);根据COMPASSION-15[11]Ⅲ 期临床研究取得的阳性结果,无论PD-L1表达情况如何,化疗联合卡度尼利单抗(PD-1/CTLA-4双特异性抗体)一线治疗较单纯化疗显著延长了患者的OS,并显著提高了患者的ORR;其中,在PD-L1低表达人群(CPS<5),该方案扔使患者显著获益(HR=0.68)。CSCO指南更新时卡度尼利的胃癌适应证尚未被国家药品监督管理局(National Medical Products Administration,NMPA)批准,CSCO指南以注释增加。对于 PD-L1 CPS<1的患者,NCCN与ESMO指南并未将免疫治疗作为常规推荐。在CSCO指南中,对于PD-L1低表达(包括CPS<1或PD-L1检测不可及)的患者,如果不存在免疫检查点抑制剂禁忌证时,结合中国适应证范围内多个免疫检查点抑制剂的可及性,在临床实践中考虑到患者需要尽快降低肿瘤负荷以缓解症状,可考虑将一线化疗联合免疫治疗作为Ⅱ级推荐(1B类)。基于KEYNOTE-062研究[12]亚组分析结果,对比单纯化疗,帕博利珠单抗单药显著地改善了PD-L1 CPS≥10的患者的总生存(overall survival,OS)情况,安全性良好,针对存在的化疗禁忌、拒绝化疗或者不能耐受化疗的患者,可考虑将帕博利珠单抗单药治疗作为Ⅲ级推荐(2B类)。
1.3 dMMR/MSI-H人群的一线治疗
dMMR/MSI-H胃癌的发病率较低,占晚期胃癌患者数的5%左右,其生物学行为、化疗敏感性、肿瘤微环境、预后等与pMMR/MSS患者存在显著差异。三大指南针对该类患者均推荐免疫治疗,循证推荐级别及不同方案选择主要根据一线Ⅲ期随机对照研究如KEYNOTE-062[12]、 CheckMate 649[5]和KEYNOTE-859[6]等关于dMMR/MSI-H人群的亚组分析结果,结果一致表明,免疫单药或免疫联合化疗的疗效和生存数据均优于单纯化疗。NO LIMIT是一项小样本的前瞻性Ⅱ期临床研究,旨在评估纳武利尤单抗(240 mg,Q2W)+低剂量伊匹单抗(1 mg/kg, Q6W)一线治疗晚期MSI-H胃食管结合部肿瘤或胃癌患者的疗效和安全性,该研究纳入了29例患者,结果显示,ORR为62.1%,患者的1年PFS率和1年OS率分别为73%和80%,显示双免疫治疗药物方案较好的疗效和安全性。不同免疫治疗研究的汇总数据分析也证明免疫治疗相较于化疗的获益优势。
NCCN指南推荐:dMMR/MSI-H的晚期患者,无论PD-L1状态,依次推荐帕博丽珠单抗或多塔利单抗、纳武利尤单抗联合伊匹木单抗、纳武利尤单抗联合化疗(氟尿嘧啶或卡培他滨联合奥沙利铂)、帕博丽珠单抗联合化疗(氟尿嘧啶或卡培他滨联合奥沙利铂)。
ESMO指南推荐:dMMR/MSI-H的晚期患者,推荐免疫治疗,但指出PD-1单抗单独使用还是与化疗联合是一个悬而未决的问题。如果患者症状较重、转移涉及重要器官等,需要治疗快速起效,可考虑与PD-1单抗联合治疗。
CSCO指南推荐:dMMR/MSI-H的晚期患者,无论HER2状态,依次推荐纳武利尤单抗联合伊匹木单抗(Ⅱ级推荐,2B类)、帕博利珠单抗(Ⅱ级推荐,2B类)、纳武利尤单抗联合FOLFOX/XELOXs(Ⅲ级推荐,2B类)和帕博利珠单抗联合顺铂+氟尿嘧啶(Ⅲ级推荐,2B类)。此外,推荐意见基于中国的临床实践,并考虑患者的经济依从性,国内已上市的其他免疫检查点抑制剂亦可作为Ⅲ级推荐(3类)。仅在免疫检查点抑制剂应用存在禁忌或不可及时考虑单纯化疗。
1.4 产AFP胃癌人群的一线治疗
与NCCN和ESMO指南不同,CSCO指南增加产AFP胃癌患者的管理。产AFP胃癌约占所有胃癌的3%,为罕见亚型,患者预后差。中国的一项前瞻性Ⅱ期临床研究[13]纳入了36例伴AFP>2×ULN或AFP阳性的胃癌患者,予以SOX(S1+ 奥沙利铂)联合卡瑞利珠单抗/阿帕替尼方案一线治疗,结果提示,ORR为55.6%(20/36), 12个月的PFS率和OS率分别为42.1%和63.7%。CSCO指南首次关注产AFP胃癌亚型的治疗并新增SOX联合卡瑞利珠单抗/阿帕替尼一线治疗方案(Ⅱ级推荐)。
1.5 Claudin18.2(CLDN18.2)阳性患者的一线治疗
NCCN胃癌指南和ESMO指南(1类推荐)新增CLDN18.2作为HER2阴性患者的一线治疗分层,对于pMMR和HER2阴性且CLDN18.2阳性(≥75%的肿瘤细胞CLDN18.2膜染色,IHC检测结果为≥2+)的患者,推荐化疗联合佐妥昔单抗。国际多中心Ⅲ期临床研究SPOTLIGH[14]和GLOW(中国注册研究)[15]的结果显示,对于CLDN18.2阳性且HER2阴性的初始治疗晚期食管胃结合部肿瘤/胃腺癌患者,与单纯化疗(mFOLFOX6/CAPOX)组相比,CLDN18.2单抗佐妥昔单抗联合化疗作为一线治疗药物显著改善了患者的mPFS。因该适应证在中国未获批,CSCO指南以注释形式呈现佐妥昔单抗联合化疗一线治疗晚期胃癌的数据。CLDN18.2目前被认为是继HER2之后,胃癌的第二重要的靶点,高表达人群甚至超过了HER2,其他靶向CLDN18.2的新型药物如抗体药物偶联物(antibody-drug conjugate,ADC)、双抗、嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)等研发在国内疾步向前,针对胃癌后线治疗的Ⅰ~Ⅱ期临床研究结果显示出较好的缩瘤率,确证性研究目前正在进行中。
2 晚期不可切除或转移性胃癌的二线及后线治疗
对于不可手术切除的局部晚期或转移性胃癌的二线及后线治疗,强调生物标志物指导下人群分类的精准管理。HER2及MMR状态仍然是重要的分层因素。
2.1 HER2阳性人群的二线及后线治疗
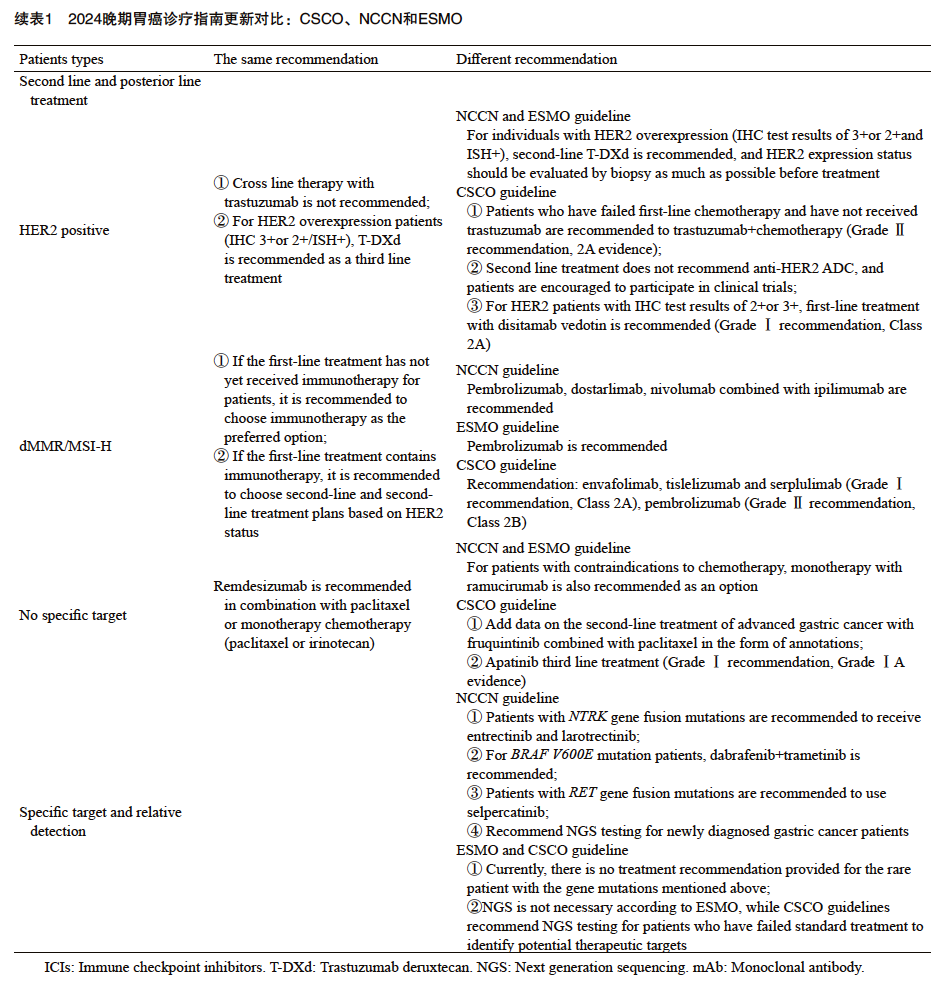
NCCN/ESMO指南均不推荐曲妥珠单抗的跨线治疗,推荐德曲妥珠单抗二线及后线治疗,且治疗前尽可能再活检评估HER2的表达状态。三线及后线治疗推荐基于DESTINY-Gastric01[16]Ⅱ 期临床研究结果,主队列研究纳入HER2阳性且经二线及以上治疗后进展且既往治疗中包括曲妥珠单抗的胃癌患者,随机分配入组予以德曲妥珠单抗或医师选择的化疗(伊立替康或紫杉醇),结果显示,与化疗组相比,德曲妥珠单抗组的ORR(51% vs 14%,P<0.001)和中位OS更长(12.0、5.0和8.4个月,HR=0.59)。二线治疗推荐基于DESTINY-Gastric02[17]Ⅱ期临床研究结果,79例HER2阳性且经一线含曲妥珠单抗方案治疗失败的胃癌患者接受德曲妥珠单抗治疗,结果显示,ORR为38%,mOS为12.1个月,mPFS为5.6个月,安全性可控。
CSCO指南仅对于既往接受铂类药物治疗失败且未接受过曲妥珠单抗治疗的HER2阳性患者推荐曲妥珠单抗联合紫杉醇单药治疗(Ⅱ级推荐,2A类证据)。对于一线化疗进展后的HER2阳性晚期胃癌患者的Ⅱ期临床研究[18]结果显示了紫杉醇联合曲妥珠单抗的疗效和安全性,但不推荐曲妥珠单抗的跨线治疗。目前的Ⅱ期临床研究和回顾性研究结果显示,一线化疗联合曲妥珠单抗治疗失败后的患者接受曲妥珠单抗跨线治疗的价值尚存在争议,缺乏高级别的循证医学依据。抗HER2的ADC二线治疗目前未获得指南推荐,鼓励患者加入临床研究。三线治疗优先推荐抗HER2的ADC药物,包括维迪西妥单抗和德曲妥珠单抗,对患者的推荐不同主要基于研究设计纳入的人群不同和获批适应证的考量。中国多中心Ⅱ期临床研究C008[19]的结果显示,维迪西妥单抗用于既往已接受过≥2线治疗的HER2阳性(IHC检测结果为2+或3+)的晚期胃癌患者, ORR达24.4%,中位OS达7.6个月,亚组分析结果显示,HER2的IHC检测结果为2+和3+的患者均可获益。DESTINY-Gastric06研究[20]为中国注册的桥接试验,评估德曲妥珠单抗在既往接受 ≥2种抗肿瘤治疗方案失败的HER2阳性胃癌患者中的效果和安全性。结果显示,ORR为28.8%, mPFS为5.7个月和mOS为10.2个月,安全性结果与既往研究报道一致。
2.2 dMMR/MSI-H的患者的二线及后线治疗
对于dMMR/MSI-H的患者,若一线治疗尚未接受过PD-1或PD-L1单抗治疗,三大指南一致推荐免疫治疗。ESMO推荐帕博利珠单抗。NCCN指南推荐帕博利珠单抗、多塔利单抗、纳武利尤单抗联合伊匹木单抗。CSCO指南推荐涵盖恩沃利单抗(Ⅰ级推荐,2A类)、替雷利珠单抗(Ⅰ级推荐,2A类)、斯鲁利单抗(Ⅰ级推荐,2A类)、帕博利珠单抗(Ⅱ级推荐,2B类),恩沃利单抗[21]、替雷利珠单抗[22]和斯鲁利单抗[23]的推荐均基于针对标准治疗失败的dMMR/MSI-H晚期实体瘤患者包括胃癌人群的前瞻性多中心Ⅱ 期临床研究的结果。对于一线治疗已接受免疫治疗的患者,根据HER2状态选择相应的二线及后线治疗方案(Ⅰ级推荐,2A类)。
2.3 无特定靶点人群的二线及后线治疗
针对无特殊靶点患者的二线治疗,三大指南均推荐雷莫西尤单抗联合紫杉类药物或单药化疗(紫杉类药物或伊立替康)。对于存在化疗禁忌证的患者,基于REGARD[24]研究,NCCN和ESMO指南将雷莫西尤单抗单药治疗也作为可选择的推荐。与NCCN和ESMO指南不同, CSCO指南以注释形式增加呋喹替尼联合紫杉醇二线治疗晚期胃癌的数据——Ⅲ期临床研究 FRUTIGA[25]的结果。该研究纳入了703例患者,结果显示,与安慰剂联合紫杉醇相比,呋喹替尼联合紫杉醇显著改善了mPFS(5.55个月 vs 2.73个月;P<0.001],提高了患者的ORR(42.5% vs 22.4%,P<0.00 1),且mOS有延长趋势(9.56个月 vs 7.85个月;P=0.023),且未发现新的安全性信号。针对无特殊靶点患者的三线治疗,CSCO指南还推荐了阿帕替尼(Ⅰ级推荐,1A类证据)。该推荐主要基于Ⅲ期临床研究[26]结果:纳入二线及以上化疗失败的中国晚期食管胃结合部或胃腺癌患者273例,甲磺酸阿帕替尼治疗组较安慰剂组延长了患者的中位PFS(2.6个月 vs 1.8个月,P=0.016)和提高了患者的疾病控制率(42.05% vs 8.79%)。NPMA批准了甲磺酸阿帕替尼在晚期胃癌的三线及三线以上治疗的适应证。
2.4 特定靶点人群的后线治疗及分子检测
对于携带NTRK基因融合突变的患者,NCCN指南提出了恩曲替尼与拉罗替尼的治疗选择,对于BRAF V600E突变患者推荐达拉非尼与曲美替尼的组合方案。对于RET基因融合突变患者推荐使用塞普替尼。然而,CSCO与ESMO指南目前尚未针对这些特定基因变异的少见患者群体给出治疗建议。就分子分型诊断而言,三大指南均推荐进行HER2、PD-L1、MSI-H/dMMR检测。对于二代测序技术(next generation sequencing,NGS),ESMO指南未作推荐,CSCO指南则推荐对标准治疗失败的晚期胃癌患者进行NGS检测以寻找潜在的治疗靶点。NCCN指南更加肯定了NGS检测的重要性,首次推荐所有新确诊的胃癌患者接受NGS检测。
3 总结与展望
就指南诊治推荐而言,晚期胃癌已开启生物标志物指导的精准靶向治疗格局,新的检测手段的应用和免疫治疗或靶向治疗相关生物标志物的检测对治疗方案的选择至关重要,尤其是对HER2的表达状态、PD-L1的水平的检测以及对MMR状态的评估。HER2阳性晚期胃癌进入全线抗HER2治疗的时代,抗HER2的ADC正成为曲妥珠单抗一线治疗耐药后的后线选择。生物标志物检测技术的进步,综合多种手段的提高和克服异质性的表达,力求更加精准地筛选出HER2阳性的患者群体。HER2阴性胃癌的一线免疫治疗强调精准化分层治疗,除MMR状态外,临床工作者应关注基于不同PD-L1表达的分层治疗和思考。随着临床药物的发展,一些特殊人群有了新的治疗选择,如CLND18.2的阳性表达情况、NTRK基因融合突变、BRAF V600E突变等,期待未来有更多的靶向治疗药物获批。中国比国外具有更多的国产PD-1药物选择,免疫治疗联合化疗成为新的治疗趋势,基于PD-L1 CPS的表达状态指导的诊疗模式将免疫治疗推向精准化,然而PD-L1表达的检测在临床实践中尚存在一定困难,基于PD-L1表达的不同在新型免疫治疗联合策略和布局的优选方案的临床价值值得关注。
指南之间的不同反映出不同地区临床实践中侧重点的不同,同时也反映了患者需求的多样化。CSCO指南的制定较NCCN以及ESMO指南更契合于中国的特点,同时考虑了中国的具体情况,也考虑了药物和诊疗手段的可及性以及肿瘤治疗的社会价值等方面。针对晚期胃癌,以靶点为导向的全程管理成为趋势,三大指南的治疗原则基本一致(表1、2)。此外,三大指南更新并整合了最新的临床研究结果,优先考虑综合诊断及个体化评估,对患者群体进行个性化分层管理并为患者临床治疗方案的制定提供依据。
作者简介:
蓝 煜,中山大学肿瘤防治中心硕士研究生。
通信作者:
王风华,博士,主任医师。
作者贡献声明:
蓝 煜:资料收集、文献检索及文章撰写;王风华:写作指导与审阅。


[参考文献]
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2] HAN B F, ZHENG R S, ZENG H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[3] J A N J I G I A N Y Y , K A W A Z O E A , B A I Y X , e t a l . Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial[J]. Lancet, 2023, 402(10418): 2197-2208.
[4] RHA S Y, KAWAZOE A, BAI Y, et al. Final overall survival for the phase Ⅲ, KEYNOTE-811 study of pembrolizumab plus trastuzumab and chemotherapy for HER2+ advanced, unresectable or metastatic G/GEJ adenocarcinoma[J]. Ann Oncol, 2024, 35: S1453-S1454.
[5] JANJIGIAN Y Y, SHITARA K, MOEHLER M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40.
[6] RHA S Y, OH D Y, YAÑEZ P, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2- negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2023, 24(11): 1181-1195.
[7] KANG Y K, CHEN L T, RYU M H, et al. Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2022, 23(2): 234-247.
[8] XU J M, JIANG H P, PAN Y Y, et al. Sintilimab plus chemotherapy for unresectable gastric or gastroesophageal junction cancer: the ORIENT-16 randomized clinical trial[J]. JAMA, 2023, 330(21): 2064-2074.
[9] QIU M Z, OH D Y, KATO K, et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first line treatment for advanced gastric or gastro-oesophageal junction adenocarcinoma: RATIONALE-305 randomised, double blind, phase 3 trial[J]. BMJ, 2024, 385: e078876.
[10] ZHANG X, WANG J, WANG G, et al. Prespecified progressionfree survival (PFS) and overall survival (OS) final analyses of a phase Ⅲ study of sugemalimab plus chemotherapy vs placebo plus chemotherapy in treatment-naïve advanced gastric or gastroesophageal junction (G/GEJ) adenocarcinoma[J]. Ann Oncol, 2023, 34: S1319.
[11] JI J F, ZIYU LI, ZHANG X T, GAO X Y, et al. Cadonilimab plus chemotherapy versus chemotherapy as first-line treatment for unresectable locally advanced or metastatic gastric or gastroesophageal junction (G/GEJ) adenocarcinoma (COMPASSION-15): a randomized, double-blind, phase 3 trial[C]. AACR, 2024.
[12] SHITARA K, VAN CUTSEM E, BANG Y J, et al. Efficacy and safety of pembrolizumab or pembrolizumab plus chemotherapy vs chemotherapy alone for patients with first-line, advanced gastric cancer: the KEYNOTE-062 phase 3 randomized clinical trial[J]. JAMA Oncol, 2020, 6(10): 1571-1580.
[13] WANG Y K, WANG C, CHEN X F, et al. Camrelizumab plus apatinib and SOX as first-line treatment in patients with alphafetoprotein-producing gastric or gastroesophageal junction adenocarcinoma: a single-arm, multi-center, phase 2 trial[J]. J Clin Oncol, 2024, 42(3_suppl): 351.
[14] SHITARA K, LORDICK F, BANG Y J, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet, 2023, 401(10389): 1655-1668.
[15] SHAH M A, SHITARA K, AJANI J A, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial[J]. Nat Med, 2023, 29(8): 2133-2141.
[16] SHITARA K, BANG Y J, IWASA S, et al. Trastuzumab deruxtecan in HER2-positive advanced gastric cancer: exploratory biomarker analysis of the randomized, phase 2 DESTINY-Gastric01 trial[J]. Nat Med, 2024, 30(7): 1933-1942.
[17] VAN CUTSEM E, DI BARTOLOMEO M, SMYTH E, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumabcontaining regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study[J]. Lancet Oncol, 2023, 24(7): 744-756.
[18] THUSS-PATIENCE P C, SHAH M A, OHTSU A, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study[J]. Lancet Oncol, 2017, 18(5): 640-653.
[19] PENG Z, LIU T S, WEI J, et al. Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase Ⅱ study[J]. Cancer Commun (Lond), 2021, 41(11): 1173-1182.
[20] SHEN L, CHEN P, LU J, et al. Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2-positive locally advanced/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): primary efficacy and safety from the phase Ⅱ single-arm DESTINY-Gastric06 (DG06) trial[J]. Ann Oncol, 2023, 34: S1542-S1543.
[21] SHEN L, LI J, DENG Y H, et al. Envafolimab (KN035) in advanced tumors with mismatch-repair deficiency[J]. J Clin Oncol, 2020, 38(15_suppl): 3021.
[22] LI J, XU Y, ZANG A M, et al. A phase 2 study of tislelizumab monotherapy in patients with previously treated, locally advanced unresectable ormetastatic microsatellite instabilityhigh/ mismatch repair deficient solid tumors[J]. J Clin Oncol, 2021, 39(15_suppl): 2569.
[23] QIN S, LI J, ZHONG H, et al. Efficacy and safety of HLX10, a novel anti-PD-1 antibody, in patients with previously treated unresectable or metastatic microsatellite instabilityhigh or mismatch repair-deficient solid tumors: a single-arm, multicenter, phase 2 study[J] . J Clin Oncol, 2022.
[24] FUCHS C S, TOMASEK J, YONG C J, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial[J]. Lancet, 2014, 383(9911): 31-39.
[25] XU R H, WANG F, SHEN L, et al. Fruquintinib plus paclitaxel versus paclitaxel as second-line therapy for patients with advanced gastric or gastroesophageal junction adenocarcinoma (FRUTIGA): a randomized, multicenter, double-blind, placebocontrolled, phase 3 study[J]. J Clin Oncol, 2024, 42(36_suppl): 438780.
[26] LI J, QIN S K, XU J M, et al. Randomized, double-blind, placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016, 34(13): 1448-1454.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)