首页 > 医疗资讯/ 正文
摘要
目的 探究帕金森病(PD)抑郁与自主神经功能相关性,为PD抑郁的临床治疗提供依据。方法 分析2022年7月—2023年7月就诊于海南医学院第二附属医院神经内科的168例PD患者临床及神经循环数据,通过贝克抑郁量表将患者分为PD伴抑郁(dPD)组(57例)和PD非抑郁(nPD)组(111例),收集患者的一般临床信息,并进行TCD监测下的卧立位实验,分别于1min,3min,5min记录患者卧位及立位收缩压(SBP)、舒张压(DBP)、心率(HR),及大脑中动脉的平均脑血流速度(Vm)、搏动指数(PI)、阻力指数(RI),构建PD抑郁症状网络。结果 抑郁在PD非运动症状网络中心性最高,可预测性最强,与睡眠/疲劳、情绪/认知强相关(强度中心性相关稳定系数,CS strength=0.440)。相较于nPD组,dPD组卧位HR、∆HR、立位Vm、∆Vm%更小,∆DBP更大,更易发生头晕伴直立性低血压和直立性脑低灌注(P<0.05)。抑郁与∆SBP、∆DBP、卧位Vm、立位RI正相关,与∆HR、卧位DBP、卧位HR、∆PI呈负相关(CS strength=0.375,CS strength=0.222)。结论 心血管和脑自主神经功能受损可能参与PD发生抑郁的机制,抑郁的干预有助于改善PD的整体非运动症状,睡眠、疲劳、认知是改善PD抑郁的有效靶点。
帕金森病(Parkinson disease,PD)是一类以运动迟缓,静止性震颤,肌强直及姿势异常为主要临床表现的神经系统变性疾病。对于PD的临床治疗多聚焦于运动症状,近年来PD的非运动症状受到广泛关注,抑郁作为常见的非运动症状,其发病率高,既往研究发现抑郁可发生在PD运动症状发生之前,且加速患者疾病进展,可能是PD预后不良的独立危险因素,由于抑郁症状与其他非运动症状存在错综复杂的重叠关系,临床实践中PD患者的抑郁症状早期识别困难,治疗不充分。
Epskamp等于2018年提出了症状网络,此分析由社会网络分析分化而来,网络分析可直接估算复杂的互联网络中所有变量之间的关联,与以往关注个体症状并必须控制其他变量的研究模式不同,这种网络理论已应用于社会学、神经科学,个体症状与行为研究及心理复杂系统的分析等多个领域,我们可以从这种类型的分析中推断出在疾病中起着核心作用的症状,哪些症状的干预可能是改善网络中的其他症状最有效的治疗,从而提高疾病的早期预防效率并提供精准治疗靶点依据。本研究拟通过症状网络分析探讨与PD抑郁症相关的核心症状,提高临床医生对PD伴发抑郁的早期识别与治疗能力。
1 资料与方法
1.1 研究对象
回顾收集2022年7月1日—2023年7月31日就诊于海南医学院第二附属医院(以下简称“我院”)神经内科PD患者,依据纳排标准,最终入组168例。本研究所有受试者的TCD操作均由相关专业人员完成。纳入标准:(1)诊断符合《中国帕金森病的诊断指南(2016版)》中临床确定和很可能的标准,并由我院神经内科主任医师根据患者的临床症状及体征做出诊断;(2)能配合完成量表评估;(3)患者或家属签署知情同意书。排除标准:(1)治疗过程中确诊为多系统萎缩、进行性核上性麻痹、皮质基底节综合征等帕金森叠加综合征及各种原因所致的继发性帕金森综合征;(2)既往患有PD共病精神疾病、明确诊断为原发性抑郁症患者;(3)患有严重的认知障碍、语言障碍、严重心脑血管疾病及其他精神疾病的患者;(4)不能完成主动卧立位检查者。
1.2 研究方法
1.2.1 临床资料的收集
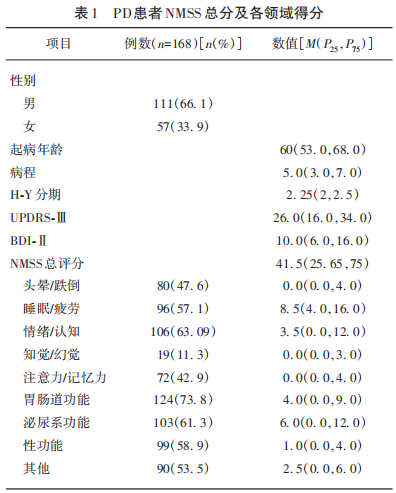
在基线时收集患者人口统计学及基本临床信息:包括性别、年龄、起病年龄、病程。所有患者均于开期时完成神经功能评估,采用贝克抑郁量表(Beck Depression Scale,BDI-Ⅱ)评估抑郁症状,0~13分诊断为非抑郁状态,得分>13分诊断为抑郁状态。以统一帕金森病评定量表中第三部分(Unified Parkinson’s Disease Rating Scale-Ⅲ,UPDRS-Ⅲ)评估患者运动症状、Hoehn-Yahr分期(Hoehn and Yahr Staging,H-Y分期)反映疾病严重程度;非运动症状评估量表(Non-Motor symptom Evaluation Scale,NMSS)根据患者近1个月以来对自身的非运动症状的严重程度评估,通过将严重程度(0=无,1=轻度,2=中度,3=重度)和频率(1=很少,2=经常,3=频繁,4=非常频繁)相乘计算每个项目的评分,范围为0~12分,包括9个不同的领域:头晕/跌倒,睡眠/疲劳、情绪/认知、知觉/幻觉、注意力/记忆、胃肠道系统、泌尿系统、性功能、其他。
1.2.2 卧立位TCD试验
采用2 MHz探头探查任意一侧大脑中动脉(MCA),深度为50~60 mm,探测及至清晰的血流信号后使用头套固定,并使患者在仰卧位时安静平躺2~3 min,记录此时形成的平均脑血流速度(mean velocity,Vm)曲线,嘱受试者在8 s内迅速站起, 并保持站立位5 min,最后再次平躺2~3 min, 检查全过程在15 min内完成。期间TCD持续监测MCA的血流速度、搏动指数(pulsatility index,PI)、阻力指数(resistance index,RI),并计算卧/立位Vm差值、卧/立位Vm差百分率(立位脑血流/卧位脑血流×100%),卧/立位PI差绝对值、卧/立位RI差绝对值,分别记录患者在平卧位及站立时1 min、3 min、5 min时的血压、心率,选择直立位时的最低值进行统计分析。
1.2.3 卧立位试验结果判定
(1)直立性低血压(orthostatic hypotension,OH)(伴或不伴直立性脑低灌注)组:卧立位试验中收缩压下降≥20 mmHg,和(或)舒张压下降≥10 mmHg;(2)直立性脑低灌注(orthostatic hypoperfusion,OHP)组:由卧位转为立位时心血管自主神经反射测试分级测定(Quantitative Scale for Grading of Cardiovascular Autonomic Reflex Tests, QASAT)脑血流速度评分>1分,不伴OH及心率异常;(3)直立性高血压(orthostatic hypertension,OHT)组:体位由卧位转为直立位后收缩压升高至少20 mmHg;(4)正常反应组:由卧位转为立位时全程监测收缩压、舒张压、脑血流动力学均无异常变化。
1.3 统计学方法
采用SPSS 26.0软件处理数据。服从正态分布的计量资料采用(x±s)表示,组间比较采用独立样本t检验;非正态分布计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用非参数检验(Mann-Whitney U检验);计量资料采用例数或例数(百分率)[n(%)]表示,组间比较采用χ2检验或Fisher确切概率法;采用R Studio(Version 4.3.1)中qgraph软件包进行二次分析计算相关网络,利用EBICglasso模型选择的图形LASSO计算正则化偏相关网络,分别探讨PD抑郁与其他非运动症状9个领域、PD抑郁与卧立位血压、脑血流变化之间的关系,由于本研究样本量较小,为了减少变量之间的虚假相关,EBIC调优参数γ被设置为0.5,从而产生较为稀疏的网络。在可视化症状网络中,每个症状均视为一个节点,症状之间的连线视为相互关系,蓝边代表呈正相关,红边代表负相关,边连线的粗细用边强度(edge weight)衡量,反映节点之间关系的强弱。另外,节点的中心性测量反映变量在整个网络图中处于中心地位的程度,以此可确定核心症状节点,作为临床症状管理干预的重点。强度中心性(strength)是描述节点中心性的最重要指标,以网络中某节点连接其他节点的个数来衡量,程度越强说明该节点影响网络中其他节点的能力越强。节点的可预测性(node predictability)代表某节点被与其连接的所有其他节点预测的程度,可预测值以方差值R2表示,范围为0~1,≥0.13的值被视为中等,≥0.26的值被视为较高。使用bootnet对网络的稳定性进行检验,网络相关稳定系数(Cs)>0.25以上视为一般稳定,Cs>0.5表示网络较为稳定。
2 结 果
本研究共纳入168例PD患者,其中男性111例(66.1%),女性57例(33.9%),年龄42~84岁,病程中位数为5.0(3.0,7.0)年,起病年龄中位数60.0(53.0,68.0)岁,H-Y分期中位数为2.25(2,2.5)期,UPDRS-Ⅲ评分中位数为26(16,34)分,BDI-Ⅱ得分中位数为10(6,16)分,NMSS总评分中位数为41.5(25.65,75)分,NMSS各分项(见表1)。合并抑郁状态的PD患者57例(33.9%),dPD组的病程、UPDRS-Ⅲ评分、H-Y分期、NMSS总分均显著高于nPD组,差异有统计学意义(P<0.05),两组性别、年龄、病程比较,差异无统计学意义(P>0.05)(见表2)。

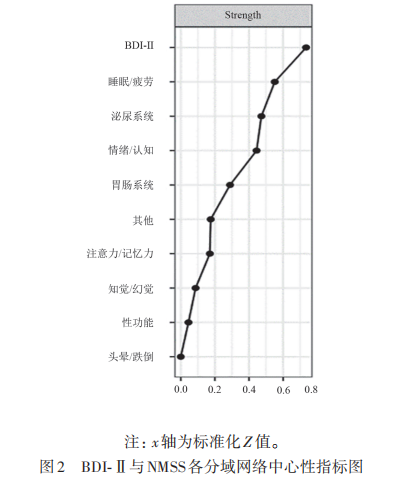
2.1 PD患者抑郁与非运动症状网络结构图
将PD患者抑郁评分与各领域非运动症状之间进行网络分析(见图1),其中,BDI-Ⅱ评分与情绪/认知呈强正相关(edge weight=0.400),与睡眠/疲劳(edge weight=0.180)、泌尿系统症状(edge weight=0.110)呈微弱正相关。在网络分析图中,中心性最高的症状为抑郁评分(strength=0.735,见图2),网络模型节点可预测结果显示,抑郁评分也是可预测性最强的节点(R2=0.562,见表3),表示抑郁症状较易受相连的非运动症状影响。网络稳定性分析结果表明,强度中心性相关稳定系数(CS strength=0.440),故此网络模型相对稳定。


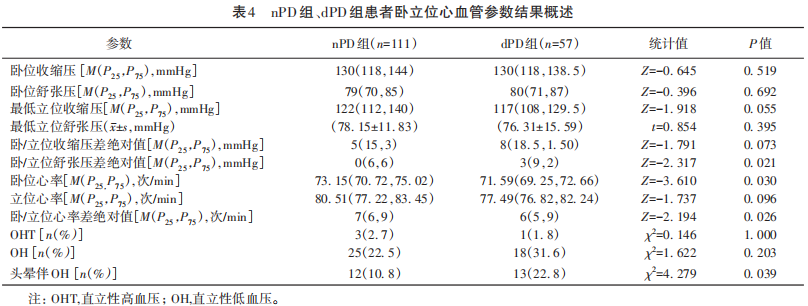
2.2 PD伴或不伴抑郁患者卧立位试验血压参数比较
根据BDI-Ⅱ量表得分将入组患者分为PD伴抑郁(depression in PD,dPD)组57例,PD不伴抑郁(non-depression in PD,nPD)组111例。试验中82例患者由于颞窗探测不良未取得经颅多普勒脑血流结果。进一步做PD抑郁患者的BDI-Ⅱ得分与卧立位试验结果的探索性网络分析(见图3、图4)。
两两比较非参数秩和检验显示dPD组患者较nPD组卧位心率更慢,卧/立位心率差绝对值更小(P=0.030,P=0.026),dPD组卧/立位舒张压差绝对值明显大于nPD组患者(P=0.021),两组间立位心率、卧位血压、立位血压、卧/立位收缩压差绝对值差异无统计学意义。dPD组患者发生头晕伴OH占22.8%,较nPD组患者发生率更高,差异有统计学意义(P=0.039)。两组间患者OHT、OH发生率比较,差异无统计学意义(见表4)。另外,本研究中观察到的OH均为神经源性OH,nPD组与dPD组患者组内卧位心率与立位心率差异无统计学意义[73(71,75) vs 77(66,82),P=0.113,72(70.5,74.5) vs 77(68.5,79),P=0.084],组内卧/立位心率差极值在(0~15) 次/min。
dPD组BDI-Ⅱ得分与卧立位试验心血管参数进行网络分析,BDI-Ⅱ得分与卧/立位舒张压差绝对值、收缩压差绝对值呈正相关(edge weight=0.200,edge weight=0.210),与卧/立位心率差绝对值、卧位舒张压、卧位心率呈负相关(edge weight=-0.340,edge weight=-0.230,edge weight=-0.160)(该网络模型相对稳定,强度中心性CS strength=0.375)(见图3)。


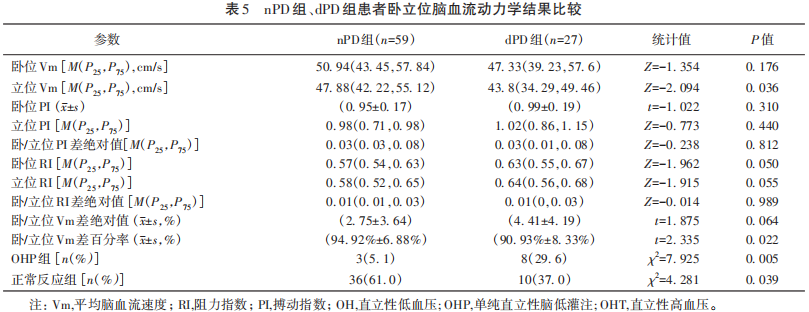
2.3 PD伴或不伴抑郁患者卧立位试验脑血流动力学结果分析
相较于nPD组,dPD组患者立位Vm更低,卧-立位Vm差百分率更小(P=0.036,P=0.022)。dPD组OHP患者8例(29.6%),比例显著高于nPD组(5.1%),两组差异有统计学意义(P=0.005),dPD组中正常反应患者10例(29.6%),nPD组36例(61.0%),差异有统计学意义(P=0.039),两组间卧位Vm、卧位PI、立位PI、卧位RI、立位PI、卧/立位PI差绝对值、卧/立位RI差绝对值差异均无统计学意义(见表5)。dPD组患者BDI-Ⅱ得分与脑血流动力学网络分析显示(见图4),BDI-Ⅱ得分与卧/立位PI差绝对值负相关,与卧位Vm、立位RI正相关(edge weight=-0.160,edge weight=0.080,edge weight=0.100),相关系数较低(该网络模型接近稳定,强度中心性CS strength=0.222)。
3 讨 论
既往研究发现PD抑郁症状与认知下降、疲劳、日间嗜睡等非运动症状密切相关,本研究得到类似结果,但在相关性分析中未考虑到非运动症状之间存在的相互影响,我们首次采用网络分析方法,发现抑郁在PD中与其他非运动症状之间存在多组相关关系,是中心性最强的指标,提示抗抑郁治疗对PD患者整体非运动症状都有正性影响;抑郁作为网络中可预测性最强的指标,睡眠、疲劳和认知的改善是PD抑郁临床治疗的有效干预靶点,这可能与中脑黑质多巴胺能的缺失、肾上腺素能、去甲肾上腺素能神经元功能障碍、腹侧纹状体多巴胺转运蛋白结合减少等多种机制有关。最近研究发现,人际关系改善和心理治疗在改善PD患者的抑郁症状的同时,患者的生活质量和认知功能也有明显提高。
本研究发现合并抑郁状态的PD患者更容易出现症状性OH、心血管自主调节功能异常和尿控异常,这与Park等研究结果一致,提示合并抑郁的PD患者较不伴抑郁PD患者有更广泛的自主神经功能受损,且随着抑郁症状的加重而恶化。
卧立位TCD脑血流监测研究结果显示,dPD患者较nPD患者更易发生直立性脑低灌注,提示脑自主调节功能受损脑自主调节参与维持正常脑血流灌注,随着脑灌注压变化,脑血管系统通过自主收缩舒张以维持人体不同活动下的恒定脑血流,PI、RI值常用以评估脑小血管舒缩功能,本研究发现,抑郁状态更常伴随PI、RI值的异常,这可能与患者的血管内皮细胞受损、小胶质细胞过度活化、下丘脑-垂体-肾上腺轴过度激活、单胺类神经递质紊乱等多因素相关。本团队既往研究发现,伴有脑灌注不足的PD患者更易出现认知及情绪障碍,既往多项研究通过SPECT观察到PD伴抑郁患者合并有前额叶、颞叶、海马、扣带回、丘脑、壳核等多个脑区rCBF灌注异常,且抑郁症状越重,rCBF下降越明显。本研究同样发现合并抑郁的PD患者卧位脑血流速度更低,与以上研究结果一致。
本研究存在的局限性:(1)本研究纳入的样本量数量较小,并可能是影响PD患者抑郁得分与卧立位脑血流参数网络分析稳定性的原因,影响研究结果的外推;(2)本研究为横断面研究,仅能进行多因素间的相关性分析。未来需要进一步加大样本量并建立随访队列,更深入探讨抑郁症状的加重因素及控制抑郁后对其他非运动症状的影响。
综上所述,PD患者抑郁障碍的发生率高,是PD患者非运动症状的核心症状,心血管和脑自主神经功能受损可能是PD患者发生抑郁障碍的原因之一,早期识别和干预抑郁症状及其原因可能改善PD患者其他非运动症状,这值得未来进行大样本RCT研究证实。
参考文献
[1]Bloem BR,Okun MS,Klein C. Parkinson’s disease[J]. Lancet,2021,397(10291):2284-2303.
[2]Chuquilín-Arista F,Álvarez-Avellón T,Menéndez-González M. Prevalence of depression and anxiety in Parkinson disease and impact on quality of life:a community-based study in Spain[J]. J Geriatr Psychiatry Neurol,2020,33(4):207-213.
[3]Ng A,Chander RJ,Tan LCS,et al. Influence of depression in mild Parkinson’s disease on longitudinal motor and cognitive function[J]. Parkinsonism Relat Disord,2015,21(9):1056-1060.
[4]Tandberg E,Larsen JP,Aarsland D,et al. The occurrence of depression in Parkinson’s disease. A community-based study[J]. Arch Neurol,1996,53(2):175-179.
[5]Celesia GG,Wanamaker WM. Psychiatric disturbances in Parkinson’s disease[J]. Dis Nerv Syst,1972,33(9):577-583.
[6]Stohlman SL,Barrett MJ,Sperling SA. Factor structure of the BDI-Ⅱ in Parkinson’s disease[J]. Neuropsychology,2021,35(5):540-546.
[7]Goodarzi Z,Mrklas KJ,Roberts DJ,et al. Detecting depression in parkinson disease:a systematic review and meta-analysis[J]. Neurology,2016,87(4):426-437.
[8]Schrag A. Quality of life and depression in Parkinson’s disease[J]. J Neurol Sci,2006,248(1/2):151-157.
[9]Epskamp S,Borsboom D,Fried EI. Estimating psychological networks and their accuracy:a tutorial paper[J]. Behav Res Methods,2018,50(1):195-212.
[10]Wolfe A. Social network analysis:methods and applications[J]. Am Ethnol,1997,24:219-220.
[11]中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会帕金森病及运动障碍专业. 中国帕金森病的诊断标准(2016版)[J]. 中华神经科杂志,2016,49(4):268-271.
[12]García-Batista ZE,Guerra-Peña K,Cano-Vindel A,et al. Validity and reliability of the Beck Depression Inventory (BDI-Ⅱ) in general and hospital population of Dominican Republic[J]. PLoS One,2018,13(6):e0199750.
[13]Wang G,Hong Z,Cheng Q,et al. Validation of the Chinese non-motor symptoms scale for Parkinson’s disease:results from a Chinese pilot study[J]. Clin Neurol Neurosurg,2009,111(6):523-526.
[14]Xu WH,Wang H,Wang B,et al. Disparate cardio-cerebral vascular modulation during standing in multiple system atrophy and Parkinson disease[J]. J Neurol Sci,2009,276(1-2):84-87.
[15]Wieling W,Kaufmann H,Claydon VE,et al. Diagnosis and treatment of orthostatic hypotension[J]. Lancet Neurol,2022,21(8):735-746.
[16]Novak P. Cerebral blood flow,heart rate,and blood pressure patterns during the tilt test in common orthostatic syndromes[J]. Neurosci J,2016,2016:6127340.
[17]Jordan J,Biaggioni I,Grassi G,et al. When blood pressure increases with standing:consensus definition for diagnosing orthostatic hypertension[J]. Blood Press,2023,32(1):2161871.
[18]Haslbeck JMB,Waldorp LJ. How well do network models predict observations?On the importance of predictability in network models[J]. Behav Res Methods,2018,50(2):853-861.
[19]Der-Avakian A,Markou A. The neurobiology of anhedonia and other reward-related deficits[J]. Trends Neurosci,2012,35(1):68-77.
[20]Jones JD,Kurniadi NE,Kuhn TP,et al. Depressive symptoms precede cognitive impairment in de novo Parkinson’s disease patients:analysis of the PPMI cohort[J]. Neuropsychology,2019,33(8):1111-1120.
[21]Yamamoto M. Depression in Parkinson’s disease:its prevalence,diagnosis,and neurochemical background[J]. J Neurol,2001,248(Suppl 3):Ⅲ5-Ⅲ11.
[22]Koszycki D,Taljaard M,Kogan C,et al. Interpersonal psychotherapy for depression in Parkinson’s disease:a feasibility study[J]. J Geriatr Psychiatry Neurol,2023,36(1):52-62.
[23]Park HE,Kim JS,Oh YS,et al. Autonomic nervous system dysfunction in patients with parkinson disease having depression[J]. J Geriatr Psychiatry Neurol,2016,29(1):11-17.
[24]Jain S,Goldstein DS. Cardiovascular dysautonomia in parkinson disease:from pathophysiology to pathogenesis[J]. Neurobiol Dis,2012,46(3):572-580.
[25]Mayberg HS. Limbic-cortical dysregulation:a proposed model of depression[J]. J Neuropsychiatry Clin Neurosci,1997,9(3):471-481.
[26]White H,Venkatesh B. Applications of transcranial Doppler in the ICU:a review[J]. Intensive Care Med,2006,32(7):981-994.
[27]Liu M,He E,Fu X,et al. Cerebral blood flow self-regulation in depression[J]. J Affect Disord,2022,302:324-331.
[28]唐玮婷,余雅纯,顾慧,等. TCD联合卧立位试验观察帕金森病患者神经循环异常的临床特点[J]. 中国神经免疫学和神经病学杂志,2021,28(2):134-139.
[29]Imamura K,Okayasu N,Nagatsu T. The relationship between depression and regional cerebral blood flow in Parkinson’s disease and the effect of selegiline treatment[J]. Acta Neurol Scand,2011,124(1):28-39.
[30]Ring HA,Bench CJ,Trimble MR,et al.Depression in Parkinson’s disease.A positron emission study[J].Br J Psychiatry,1994,165(3):333-339.
[31]Kim YD,Jeong HS,Song IU,et al. Brain perfusion alterations in depressed patients with Parkinson’s disease[J]. Ann Nucl Med,2016,30(10):731-737.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)