首页 > 医疗资讯/ 正文
急性髓系白血病
急性髓系白血病 (AML) 是一种由克隆性造血细胞不受控增殖引起的疾病,占美国所有新发癌症病例的1%。AML确诊时的年龄一般较高(中位年龄为68岁),5年 OS 为32%(年轻患者高达50%,60岁以上患者低于10%)。自2017年以来,已有12种新药或联合方案获得批准,然而将新药纳入治疗方案的最佳策略仍存在争议,总体治疗仍需整合治疗目标、合并症和疾病特征。此外,有关 AML 生物学的新见解也提高了 AML 患者的诊断、预后和监测能力。
Dana-Farber Cancer Institute三位教授近日于《American Journal of Hematology》发表综述,阐述了AML的诊断、危险度分层和治疗的最新进展,现整理全文供参考。共2万余字,若有错误敬请谅解。

2 诊断的更新
2022年发表了WHO第五版和国际共识标准 (ICC)两套AML 分类系统,两者均整合了新的分子学结果,并突出了生物学定义的和临床相关的AML 亚型。本文讨论了两个系统之间的异同,以及自引入这些分类以来所面临的挑战和吸取的教训。
值得注意的是,急性早幼粒细胞白血病 (APL) 通常与PML::RARA易位相关,是一种独特的临床病理学 AML 疾病,占 AML 的5%-10%。APL的初始治疗通常为全反式维甲酸 (ATRA) +三氧化二砷 (ATO),WBC>10K/μL的患者接受额外化疗。该疾病预后极好,尤其是与其他非 APL AML 亚型相比。因此本综述中的AML单指非APL AML,不讨论 APL(中国指南也是分开讨论)。
ICC 和 WHO 第五版都定义了分子学异常,即使在骨髓原始细胞计数相对较低的情况下也可诊断为AML。除RUNX1::RUNX1T1和CBFB::MYH11外,由于 NPM1 突变在骨髓增生异常综合征 (MDS) 中的罕见性以及在既往定义为 MDS 伴 NPM1 突变的大多数患者中观察到的快速进展,因此两种分类均将 NPM1 视为 AML 定义性(defining)突变。WHO将 CEBPA 突变 AML 描述为一种实体,包括双等位基因 CEPBA 突变(不考虑突变类型)或单等位基因内部碱性亮氨酸拉链区 (bZIP) 突变基因;而ICC对 CEBPA 突变 AML 的定义仅要求存在 bZIP 改变。这一增加是由于发现 C 末端 bZIP C 末端区域的框内突变具有独特的临床和分子学特征:年龄较小、白细胞计数较高以及 GATA2 和 NPM1 的共突变富集。bZIP框内突变与反应良好和生存期改善相关。BCR::ABL1也作为正式的AML定义性病变,要求原细胞≥20%(而非≥10%),以与加速期CML区分。
WHO 和 ICC 分类在某些情况下采用不同的原始细胞阈值来定义AML:WHO标准中没有定义遗传学异常AML 的最低阈值(AML伴BCR::ABL1和 AML 伴 CEBPAbZIP 突变除外,为20%);ICC要求骨髓或外周血原始细胞≥10%来定义AML伴复发性遗传学异常 (BCR::ABL1 AML或既往MDS/MPN的AML[如CMML]除外,为≥20%)。对于所有其他 AML 亚组,WHO保留了20%原始细胞阈值。然而ICC引入了一个新的 MDS/AML 类别,包括骨髓或外周血中原始细胞为10%-19%的患者,原因在于认识到此类患者与原始细胞≥20%的患者在生物学和预后方面的相似性。AML定义性基因病变伴原始细胞计数相对较低的患者的治疗反应是否与具有相同病变但原始细胞计数较高的患者相似,仍有待前瞻性证实。
两个分类系统中均未纳入 AML 伴骨髓增生异常相关改变 (myelodysplasia related changes,MRC) 的定义,但都引入了分子学和细胞遗传学异常的分类(定义功能性继发性个体发育),在接受强化疗时与预后不良相关。然而不同分类之间“继发性”的定义并不同。WHO定义的骨髓增生异常相关 MR(AML-MR) 包括以下其中一项:(1)MDS或 MDS/MPN 的临床病史,(2)MDS的典型细胞遗传学, (3) 基于8种继发性个体发育定义突变之一的分子学定义。而ICC包括两个独立的继发性 AML 实体:分子学定义(称为 AML 伴骨髓增生异常相关基因突变)和细胞遗传学定义(称为 AML 伴骨髓增生异常相关细胞遗传学异常)。此外在 ICC 中,既往 MDS 或 MDS/MPN 的临床病史用于注释 AML 的诊断,而非视为单独实体。此外,两种分类中MDS 定义性分子学和细胞遗传学异常也略有不同,例如,ICC将 RUNX1 突变纳入 ICC 定义性骨髓发育异常,但其未纳入 WHO 2022 标准(图1和表2)。
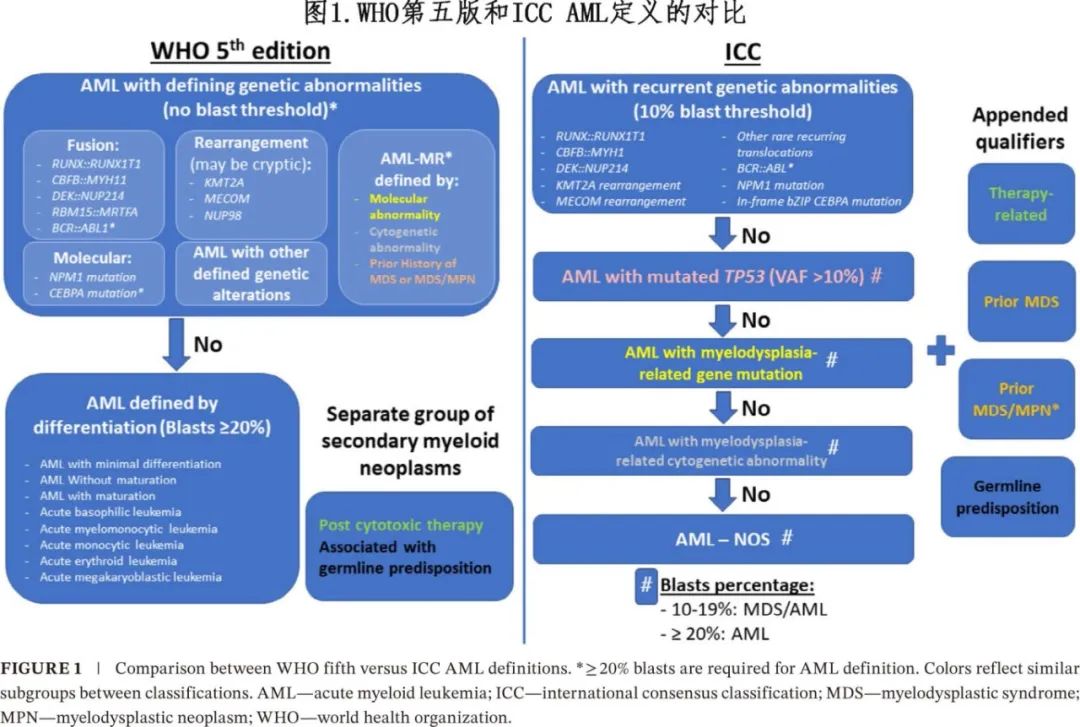
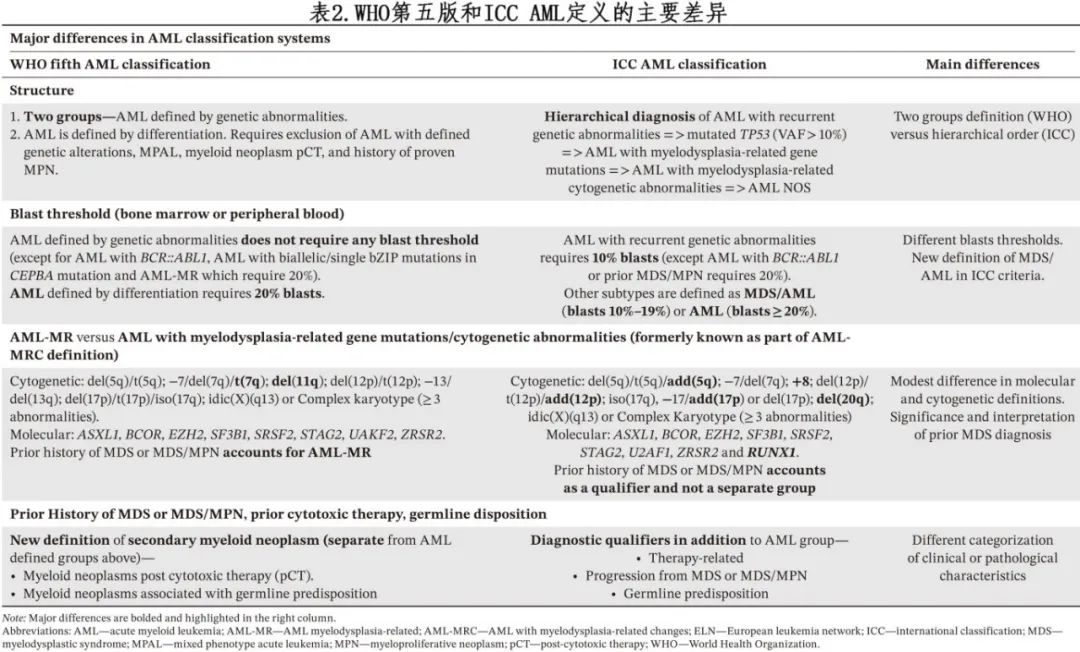
两种分类系统均特别考虑了既往细胞毒性暴露和基因易感性(predisposition)。在 WHO 分类中,它们重新归类为新的诊断类别,称为继发性髓系肿瘤,包括细胞毒性治疗后发生的髓系肿瘤或具有明确生殖系易感性的髓系肿瘤。在 ICC 分类中,它们认为是 AML 诊断的限定符或注释,而非单独的诊断类别(图1)。
治疗相关 AML 传统上与较差预后相关,尽管并未作为不良风险正式纳入 ELN 预后标准。最近的发现表明,TP53和相关基因(如PPM1D)的突变可驱动化疗耐药和不良预后。事实上,白血病的生物学特征通常比临床病史更重要,例如,在暴露于另一种癌症的化疗后发生 APL 的患者通常预后良好。
随着分子诊断和分析的最新进展,更多的髓系恶性肿瘤患者(即使是在高龄时就诊的患者)现在被认为具有遗传性胚系易感性。因此有人认为,具有某些分子学/细胞遗传学病变、髓系恶性肿瘤综合征表现或提示家族史的 MDS 和/或 AML 患者应对未受影响的组织进行基因分析,以评估胚系易感性。
举例说明,DDX41突变是成人 MDS 和 AML 中最常见的易感基因,在欧洲成人中约1:430携带导致 MDS 或 AML 风险增加的胚系致病性变体。在DDX41胚系突变患者中,AML的发生通常被认为涉及通过另一个等位基因突变的“二次打击”。携带 DDX41 胚系突变的 AML 具有独特的临床特征:以男性为主,在70岁前发病,外周血白细胞和骨髓原始细胞计数低,强化疗或基于维奈克拉的治疗方案反应良好,预后优于匹配的野生型 DDX41 患者。未来发现的更多胚系易感综合征可能会越来越多地影响治疗策略,如异基因干细胞移植的供体选择、最佳移植预处理方案的选择或家庭成员评估和监测的方式。
虽然 AML 诊断的进展有助于优化个体化治疗,但两种新的分类系统也挑战了医疗保健专业人员(尤其是病理学家)、治疗临床医生和患者之间的互相交流。在过去几年中,对两种分类进行了大量比较,并呼吁采用统一的诊断方法。两种分类系统之间的相似性超过其差异,但临床医生仍应综合生物学、临床和个人数据,同时考虑现有文献以做出治疗决策。显然,单独的诊断,无论是使用 ICC 还是 WHO ,都不能成为该决策的唯一因素。此外,ICC建议在3-5天内进行分子检测,这一目标对世界各地的许多中心都有压力。虽然整合新型分子结果可能会提高诊断准确性并促进基于生物学的治疗,但也应考虑对整个医疗保健界建议的适用性和普遍性,因为主要目标是优化全球患者的治疗。
3 危险度分层的更新
欧洲白血病网络 (ELN) 2022 指南整合了新的分子学发现和近期的试验结果。与 ELN 2017 相比的主要变化包括(表3):

•危险度分层中不再考虑 FLT3 内部串联重复 (ITD) 等位基因比率 (AR)。将 FLT3-ITD 突变 AML 患者分配至中危组,不考虑 AR 或是否存在 NPM1 突变。该变更的原因包括 FLT3 抑制剂对 FLT3-ITD 突变 AML 患者预后的影响以及将 MRD 纳入决策。
•AML 伴骨髓增生异常相关基因突变(根据 ICC 定义)现定义为高危实体,通过以下一种或多种疾病中存在病理性变体来描述:ASXL1、BCOR、EZH2、RUNX1、SF3B1、SRSF2、STAG2、U2AF1、或 ZRSR2 基因。这些突变不会对具有低危畸变的患者产生不良风险。
•将伴有不良细胞遗传学异常的 NPM1 突变 AML 归类为高危。该变更是基于一项荟萃分析,该分析评价了 NPM1 突变 AML 患者中的附加细胞遗传学异常,附加分子学异常(FLT3-ITD除外)在 NPM1 突变 AML 患者中的确切作用尚不明确;目前仍认为,同时存在 NPM1 和骨髓增生异常基因突变甚至 TP53 突变的患者为低危(尽管存在矛盾的数据);然而自 ELN 2022 危险度标准发表以来,已有多项研究质疑存在其他高危突变时NPM1的良好预后影响。
•CEPBA 突变 AML 的良好预后仅取决于影响 bZIP 区域的框内突变,无论是否存在单或双等位基因突变。
•目前视为高危的其他疾病定义性细胞遗传学异常与KAT6A::CREBBP相关,包括涉及 MECOM 基因的t(3q26.2;v) 和t(8;16)(p11;p13),因为它们也与长期总生存期不佳相关。
•具有超二倍体核型伴多个三体(或多体)的 AML 不再被认为等同于复杂核型,并被排除在高危组之外,因为与具有≥3个细胞遗传学变化伴结构异常的患者相比,仅具有细胞遗传学数量变化而无结构异常的此类患者生存结局良好。
然而应注意,该指南主要是基于接受强化治疗的≤60岁患者。最近的一项研究基于 NCRI-AML 18 和 HOVON-SAKK 队列生成了≥60岁老年患者的预后评分,基于临床(男性,WBC≥20x109/L细胞,年龄>65岁)和遗传学(单体核型、TP53、RUNX1、FLT3-ITD、ASXL1 和 DNMT3A 突变)特征分为四组。与ELN 2022相比,该分类改进了校准能力。此外,异基因干细胞移植(alloSCT)与极高危组和中危组的生存率改善有关,在高危组也有改善生存率的趋势,而低危组没有改善;在后两组中,alloSCT降低非复发死亡率的获益被移植相关高死亡率所抵消。该结果应在外部队列中验证其普遍性。
然而,两个标准均来自接受强化疗的患者,多项研究表明,ELN 2022标准在接受非强化治疗(主要是基于维奈克拉的方案)的患者中的预后作用有限。例如,在接受去甲基化药物 (HMA) +维奈克拉的患者中开展的一项研究表明,AML-MR突变不会导致预后较差,因此必须在接受特定治疗的背景下考虑 ELN-2022 模式。基于对前瞻性随机化 VIALE-A 研究和既往 Ib 期研究(涉及 HMA+维奈克拉)的分析,4基因标记风险评分将患者分为3个预后组:(1)TP53突变患者纳入低获益组;(2) 无 TP53 但携带FLT3-ITD、NRAS或 KRAS 突变的患者居中;(3) 无4种突变中任何一种的患者为低危(中位 OS 分别为5.5、12.1和26.5个月)。基于该分类的回顾性研究显示了相似结果,从而能够为接受低强度治疗的 AML 患者制定新的 ELN 风险标准(表4)。
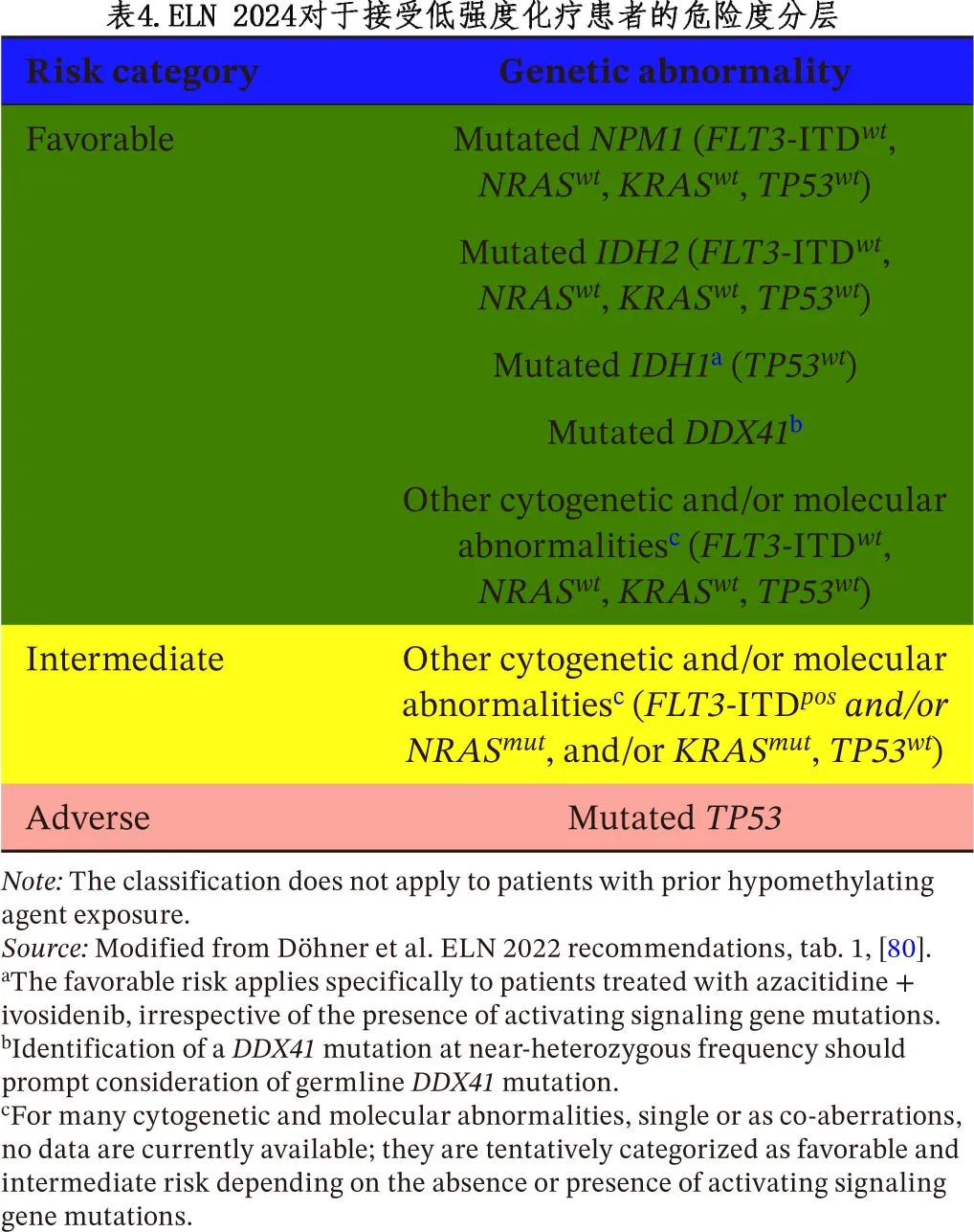
然而,应注意的是,与VIALE-A研究相比,HMA+维奈克拉已在更广泛、更异质的人群中使用。近期在英国接受维奈克拉+阿扎胞苷 (n=587) 或低剂量阿糖胞苷 (LDAC;n=67) 治疗的患者中进行的一项真实世界研究表明,新 ELN 2024 的表现优于ELN 2022(C指数为0.568 vs. 0.542),然而其预后价值也存在不足。在3个学术中心进行的一项大型回顾性研究 (n=279) 提示应进行重新分类:低危(NPM1、IDH1、IDH2、DDX41突变,N/KRAS、PTPN11、FLT3-ITD、TP53野生型)、中危(FLT3-ITD、NRAS突变或其他未分类的突变, KRAS、PTPN11和TP53野生型)和高危(KRAS、PTPN11或TP53突变)。在英国外部队列中验证了该分类 (n=430)。因此,ELN 2024危险度标准的普遍性仍不清楚。此外,尽管 DDX41 突变 AML 归类为低危(不考虑共突变),但关于 TP53 共突变及其临床意义的数据有限。
4 MRD检测和监测的更新
MRD(微小或可测量残留病)是用于 AML 预后、预测、监测和缓解评估的生物标志物。评价 MRD 的两种最常用技术为多参数流式细胞术 (MFC) 和实时定量PCR(RT-qPCR),每种技术均可在104个细胞中检测出一个恶性肿瘤细胞。前者可能适用于大多数AML患者,而后者需要了解特定的诊断细胞遗传学异常或突变,常用于追踪CBF或NPM1突变患者。其他使用越来越常用的技术为二代测序 (NGS) 和数字PCR(ddPCR;后者的灵敏度可达约1/10 6)。2021年的 ELN 建议重点关注 MFC-MRD 和 RT-qPCR MRD 阈值的标准化、MRD缓解定义和 MRD 在临床决策中的应用。目前,ELN推荐的检测水平为1/103或更低。然而随着时间的推移,检测也变得更加敏感,并且生成了临床试验的数据,因此预计 MRD 评估的使用和解释会不断发展。
在接受强化和低强度化疗的患者中,MRD的预后价值(无论检测手段如何)均已得到确认。在一项纳入346例 NPM1 突变患者的研究中,发现2个周期强化疗后通过 RT-qPCR 测量的该基因的MRD(阈值为0.1%)是独立预后因素(MRD 阳性死亡的HR=4.38;95%CI:2.57-7.47;p<0.001)。另一项关键研究在430例强化治疗患者中评估了两个化疗周期后 MRD CR(NGS,阳性临界值≥0.02%)的效用,持续 MRD 阳性(不包括 DNMT3A、TET2 和ASXL1突变,它们通常存在于克隆性造血患者中)患者的4年复发率高于 MRD 检测阴性患者(55.4% vs. 31.9%;HR=2.14;p<0.001),4年总生存率也更差(41.9% vs. 66.1%;死亡HR=2.06;p<0.001)。此外与单独使用 MFC-MRD 相比,NGS也可增加预后价值,因为两者均为阴性的患者的复发率最低(两者均为阳性时为73%,MFC-MRD或 NGS-MRD 为阴性时约为50%,两者均为阴性时为27%,p<0.001)。一项系统评价和荟萃分析纳入11151例接受强化治疗的 AML 患者,评估MRD作为预后工具,达到 MRD 阴性的平均 OS HR 为0.36,达到 MRD 阴性的患者与未达到 MRD 阴性的患者的5年 OS 分别为68%和34%。
MRD 在非强化治疗患者中也有预后价值。在 VIALE-A 研究中接受阿扎胞苷和维奈克拉治疗的患者中,达到复合完全缓解 (cCR)(定义为完全缓解 [CR] 或完全缓解伴不完全计数恢复 [CRi])的患者中,MFC-MRD阴性 (<0.1%)患者的预后更优;MRD阴性患者未达到中位DOR、EFS和OS,12个月DOR、EFS和 OS 分别为81.2%、83.2%和94.0%,MRD 阳性cCR 患者中位DOR、EFS和 OS 分别为9.7、10.6和18.7个月,12个月DOR、EFS和 OS 分别为46.6%、45.4%和67.9%。在校正年龄、细胞遗传学和 AML 类型(de novo或继发性)的 COX 回归多因素分析中,MFC MRD阴性是 OS 改善的独立预测因素(死亡率HR=0.285,p<0.001)。在接受HMA+VEN治疗的 NPM1 突变患者中进行的一项研究表明,MRD阴性(定义为第4周期结束时每 100个ABL1 有0个NPM1 拷贝)与 预后更优相关,包括2年OS(84% vs. MRD阳性患者46%)、EFS(84% vs. 20%)和累积复发率(10% vs. 72%)。
围移植期是 MRD 评估的关键时期,此时通常需要决定巩固化疗和移植后维持的相对效用,然而移植前 MRD 检测的预后价值受到诊断特征的影响。例如,在一项≥60岁患者接受强化疗序贯减低强度预处理 (RIC) alloSCT的研究中,NGS检测的 MRD 阴性定义为无任何非 DNMT3A 或 TET2 突变,在单因素模型中,与 MRD 阳性相比,MRD阴性的无白血病生存期 (LFS) 更好。然而在多因素模型中,MRD不再是预后因素,主要是由于其与诊断性遗传学特征相关,包括 MDS 相关基因突变、TP53突变和高危核型。当通过 MFC 测量 MRD 时也观察到类似结果,从而强调了与移植前 MRD相比,基线细胞遗传学和分子学特征的影响。
在美国进行的一项研究中,从 CIBMTR 生物样本库获得 alloSCT 前血液样本,通过超深度锚定多重 PCR NGS-MRD 测量FLT3、NPM1、IDH1/2和 KIT 的MRD,并进行错误校正变体识别。在822例达到 CR 并继续接受 alloSCT 治疗的 AML 患者中(探索队列371例,验证队列451例),alloSCT前 NPM1 和/或 FLT3-ITD 阴性患者相对于可检测到这些突变基因的患者,与OS、RFS改善和复发率降低相关(p均<0.001)。
ELN MRD 指南建议 NPM1 或 CBF 突变 AML 患者使用qPCR(也可使用 ddPCR 或NGS-MRD,但缺乏数据)。对于诊断时无 NPM1 或 CBF 突变的患者,可以使用MFC-MRD(理想情况下在诊断时确定,以定义患者特异性白血病相关免疫表型[patient-specific
leukemia-associated immunophenotype,LAIP]或different from normal [DfN])。ELN指南还阐述了 MRD 评估的最佳时机和样本组织。理想情况下诊断样本应来自骨髓穿刺,但也可以来自外周血原始细胞≥20%的NPM1或CBF突变AML患者的外周血。治疗后的首次MRD应该在两个治疗周期后进行骨髓检测(NPM1和CBF突变AML患者可为外周血评估),还建议使用骨髓穿刺进行治疗结束时 MRD检测,但由于缺乏数据,无法根据该结果提供可靠的治疗建议。为评估 NPM1 或 CBF 突变 AML 的临床前复发,建议每4-6周通过血液或每3个月通过骨髓进行评估。MFC-MRD监测频率应相似,但缺乏支持此类间隔的数据,导致专家小组将其定义为探索性建议。此外,即使有如此密切的连续监测,意外也并不少见。高达30%的 MRD 阴性患者可发生复发,也并非所有 MRD 阳性患者都会复发,尤其是携带 NPM1 或 CBF 突变的低水平 PCR-MRD 患者(但无临床复发的流式复发相对于形态学复发具有相同的不良预后)。
虽然 MRD 作为预后标志物的价值已得到充分证实,但尚无指南或广泛认可 MRD 作为预测标志物用于辅助治疗决策。但是研究已经证明,可以使用 MRD 作为引导缓解后 alloSCT 或巩固化疗的工具。一项前瞻性研究表明,化疗2个周期后RUNX1::RUNX1T1转录本持续存在表明需要alloSCT,即使其为“低危”AML 亚型。一项英国重要研究可能有助于指导接受强化疗的 NPM1 突变 AML 患者使用alloSCT。在接受 NCRI AM17 和 AML19 研究治疗并达到缓解的737例 NPM1 突变 AML 患者中,首次完全缓解 (CR1) 时alloSCT 巩固治疗仅对诱导后NPM1突变 PCR MRD 阳性患者有获益(灵敏度1/10000)(有 vs 无alloSCT的3年OS 61% vs 24%,HR=0.39,p<0.001),但在诱导后 MRD 阴性患者中无差异(79% vs 82%,HR=0.82,p=0.4)。即使在同时存在 FLT3-ITD 突变的患者中也是如此,因此认为其为 ELN 2022 中危,并且传统上推荐CR1 alloSCT:诱导后 MRD 阳性3年 OS 分别为45%和18%;诱导后 MRD 阴性则分别为83%和76%。
治疗后监测期间的 MRD 检测可提示早期治疗,但这是否会改变疾病自然史?II 期 VALDAC 研究纳入强化疗达到缓解后48例 MRD(RT-qPCR 或 dd-PCR)阳性复发(定义为≥1 log)的患者或低原始细胞(oligoblastic,定义为原始细胞5%-15%)患者,给予LDAC+维奈克拉治疗以试图根除复发克隆。到第二个周期结束时,MRD 复发患者中几乎半数(44%)达到 MRD 阴性,低原始细胞复发患者中70%达到缓解。未达到中位OS,MRD队列和低原始细胞队列的2年 OS 分别为67%和53%。尽管未进行随机化,但这些数据表明 MRD 在低负荷复发患者中作为监测标志物和早期干预具有潜在作用。
在围移植期使用 MRD 有助于确定哪些患者应接受靶向维持治疗。III期 MORPHO 研究(详见下文“吉瑞替尼”和“缓解后治疗”部分)使用基于灵敏PCR检测FLT3-ITD MRD,对于alloSCT前或后检测MRD阳性患者,alloSCT后吉瑞替尼维持治疗较安慰剂可改善无复发生存(RFS) (HR=0.515,p=0.0065),但MRD阴性患者中无差异(HR=1.213,P=0.575)。
总体而言,MRD在确定初始化疗后的预后方面明显发挥作用,无论是接受 alloSCT 的患者还是接受巩固化疗的患者。MRD检测也正在成为预测性检测,在不同时间点(诱导后、lloSCT前和后)提供治疗指导;然而由于 MRD 测量仍无标准化方法,且无可靠的前瞻性数据指导MRD结果整合到临床管理中,目前并不常规使用 MRD 对每例 AML 患者进行监测和决策,但应考虑选定患者的 MRD 结果作为CR1 alloSCT决策的一部分。对于诊断时无可用分子学诊断突变的患者,常规应用流式细胞术,使用 DfN MRD 技术,通常使用0.02%的cut-off值。此外使用 PCR检测 NPM1 突变或 CBF 易位(如前所述)。
5 缓解和结局评价的更新
ELN 2022 缓解标准保留 ELN 2017 中CR、CRi、部分缓解 (PR) 和无骨髓白血病状态 (MLFS) 的定义,并增加了新的缓解类别:CR伴血液学部分恢复 (CRh),定义为骨髓原始细胞<5%,无外周原始细胞或髓外病变,血细胞计数部分恢复,ANC≥500/μL,血小板≥50000/μL。CRh被FDA 要求用作enasidenib的事后分析,并在其他临床试验中用作终点;然而CRh在预测生存期方面的确切作用尚未确定。ELN 2022还将 MRD 状态整合到缓解定义中。如果达到 MRD 阴性缓解,所有 CR 亚型(即CR、CRi和CRh)还应标注 MRD 状态(即CRMRD-、CRiMRD-和CRhMRD-)。复发的定义仍为骨髓白血病原始细胞≥5%,间隔1周在两个样本中再次出现外周白血病细胞或新的髓外病变。MRD失败或复发的新定义为基于以下之一(在4周内重复,以验证来自相同组织来源的第二个连续样本的结果,最好是骨髓):MRD 阴性转为阳性(所有方法均可)或通过定量 PCR 拷贝数增加10倍。使用 LAIP 或 DfN 免疫表型,CD45表达细胞的 MFC-MRD 阴性cutoff值<0.1%。qPCR MRD阴性定义为3个重复中≥2个的循环阈值(cycling threshold,Ct)≥40。由于治疗结束时NPM1或CBF AML qPCR低于2%的复发风险较低,只有高于该水平的值才认为是阳性。然而,最近发现的 NPM1 MRD 阳性预后价值尚未纳入这些指南中,可能会影响 NPM1 突变 AML 患者的 MRD 阳性阈值。
将 MRD 作为终点也为 OS 之外的至事件时间(time-to-event)结局创建了新的定义,例如无事件生存期 (EFSMRD)、无复发生存期 (RFSMRD) 或累积复发率 (CIRMRD),可反映 MRD 阳性事件。为了正确解释特定研究,应提供 MRD 采样部位(骨髓与外周血)、技术和灵敏度。关于 ELN MRD 指南的实际建议是非常有价值、赞赏和合理的,但也必须认识到,仍需要更多的前瞻性数据来增加建议的有效性和强度。生成新数据的情况下还需要进行修订,正如上文描述的 NPM1 和 FLT3-ITD 突变 AML 数据。
6 新诊断AML治疗的更新
6.1 一般考虑
实现AML治愈的经典范例是首先诱导CR,从而将白血病负担降低几个数量级,然后以化疗和/或alloSCT的形式进行缓解后治疗。最合适的诱导和缓解后治疗的选择应基于多个参数,包括患者合并症、既往病史(包括既往髓系疾病和/或细胞毒性化疗暴露)、AML细胞遗传学和分子学风险特征、可能的治疗后 MRD 状态以及供者的可用性和患者的治疗目标。历史上,决定初始治疗的第一步是基于患者对强化治疗的“fitness”,对于适合高度骨髓抑制/肠道毒性治疗的患者,默认采用强化疗诱导。与描述住院时间较长且具有治疗相关死亡高风险的患者相比,描述哪些患者不应接受强化疗可能更容易。此时,年龄超过75岁被认为是强化疗的相对禁忌,尤其是鉴于已经有了有效的低强度化疗。除年龄外,FDA还采用了一组严格的标准(肝、肾、心、肺功能差)来明确考虑不适合强化疗的患者。Ferrara等所建议的标准通常纳入合格性标准,并在大型患者队列中进行验证,以预测 AML 强化疗后短期死亡率。然而随着近年来多种治疗药物的出现,模式已转向“谁将从强化疗中获益”而非“谁被认为fit”。举例说明,即使是具有高危生物学的“fit”患者(任何年龄)也可能不适合强化疗,因为可能出现不良预后。这一困境在60-75岁患者中最为突出,而该年龄组是 AML 中最大的年龄组,其中许多患者可能在一线接受强化或低强度治疗。下文将详细说明各种治疗可能性,并介绍作者的治疗方法,包括针对该年龄组患者的更新建议治疗方案。
6.2 新诊断患者强化治疗的更新
6.2.1 诱导治疗的更新
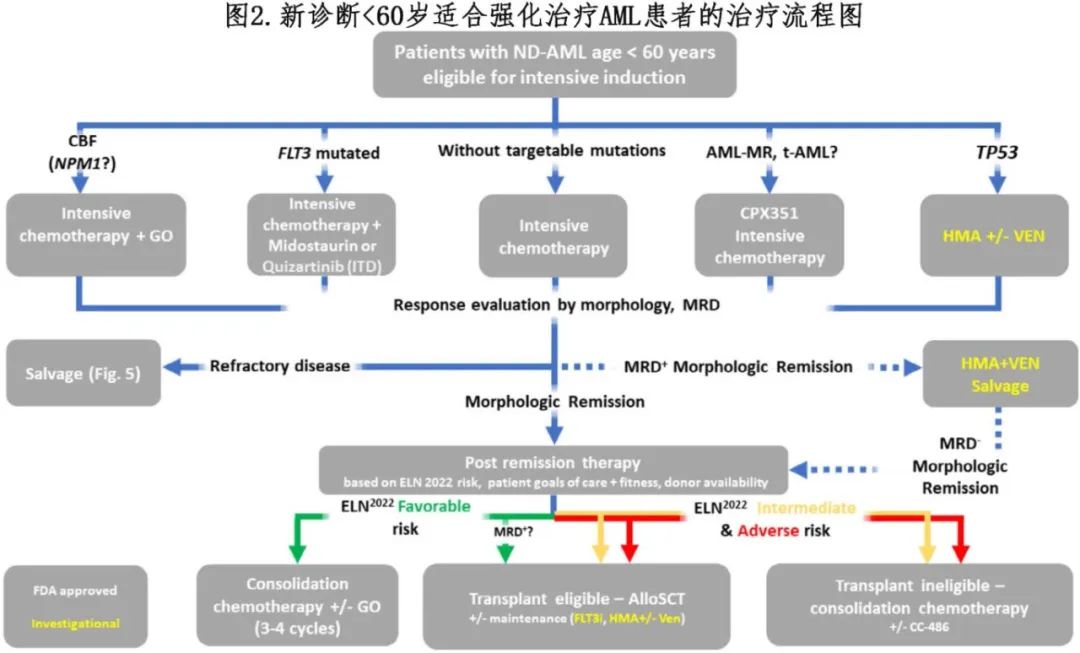
强化疗的基础仍是基于蒽环类药物和阿糖胞苷的方案,其中最常见的是“7+3”方案,使用60–90 mg/m2剂量的柔红霉素给药3天和100–200 mg/m2剂量的阿糖胞苷给药7天;其他诱导方案包括CLAG-M、G-CLAM、IA、FLAG-IDA和lomustine-IA。尚不清楚这些药物中的任何一种是否“优于”单独使用3+7,但加用lomustine、核苷类似物或 FLAG-IDA 治疗均被认为优于3+7;然而后者对于一般使用毒性太大。此外,多款药物最近获批(联合化疗)用于适合强化疗的新诊断 (ND) AML 患者(表1和图2)。

关于柔红霉素的剂量,两项大型随机研究显示,90mg/m2与45mg/m2相比可改善年轻和老年患者以及特定突变(NPM1、FLT3、和DNMT3A)患者的生存期。然而在一项研究的1206例AML患者中,90mg/m2与60mg/m2在生存方面没有获益(但所有患者都接受了第二个疗程的柔红霉素50mg/m2,这可能会降低90mg/m2相对于60mg/m2的有益效果)。两阶段、随机研究DAUNODOUBLE在 864例接受强化疗的18-65岁ND AML患者中评估了柔红霉素强度和二次诱导的附加价值。在第一次随机化时,接受 60 mg/m2和 90 mg/m2治疗的患者的缓解或生存期无差异(复合 CR 率分别为90% vs. 89%,p=0.691;3年 OS 分别为65% s. 58%,p=0.242)。在亚组分析中,在NPM1、FLT3-ITD患者和所有 ELN 2017 风险组也观察到相似结果。在第二次随机化中,在获得良好早期反应(定义为在第14天骨髓评价中原始细胞<5%)的389例患者中,第二次诱导无获益:使用一次与两次诱导的复合 CR 率分别为87%与85%;3年 OS 分别为76%与75%。
Gemtuzumab ozogamicin (GO) 是一种与毒素刺孢霉素结合的 CD33 单克隆抗体。在随机对照研究的患者荟萃分析中,AML患者在7+3或 FLAG-IDA 基础上加用GO vs.不加用 GO 时的生存率有所改善,但获益仅限于细胞遗传学低危和中危患者(6年 OS 分别为76% vs. 55% [OR=0.47]和39% vs. 34% [OR=0.84)。然而应该注意的是,荟萃分析中未接受 GO 治疗的 CBF-AML 患者的 OS 低得惊人,5年 OS 生存率仅55%。在荟萃分析纳入的各项试验中,均未观察到加入 GO 具有 OS 优势;这些问题,再加上 GO 的骨髓和肝毒性,导致许多学者质疑在诱导治疗中常规加入GO的意义。在 ALFA0701研究中(已纳入该荟萃分析),50-70岁患者在第1、4和7天 3mg/m2分次给药7+3与7+3单独给药相比可改善EFS 和 OS。ALFA0701研究的事后分析表明,根据 ELN 2017 风险标准,在低危和中危组加入 GO 有益。荟萃分析中纳入的其他阳性结果研究(AML-MRC15和NCRI-AML16)都是在诱导治疗第1天和后续各周期采用 3mg/m2 GO 单次给药。AMLSG 09–09研究是一项 III 期随机研究(未纳入该荟萃分析),在≥18岁(中位58.8岁)NPM1阳性 AML 患者中评价了在伊达比星、阿糖胞苷、依托泊苷和全反式维甲酸基础上加用 GO 的疗效。GO组和标准组的 EFS 无统计学差异 (HR=0.83,p=0.1),但GO 组因感染发生率更高而导致早期死亡较高(10.3% vs. 5.7%,p=0.05;且年龄≥70岁的患者中为20%)。加入GO的影响也有利于实现MRD阴性状态(56% vs 41%,p=0.01),定义为定量RT-PCR测量的减少3-log,这意味着与标准治疗相比,GO组的复发率更低(4年累积复发率分别为29.3%和45.7%,P=0.009)。
AML-MRC 18 研究纳入老年患者(年龄≥60岁;n=852),评估了GO 单次给药(第1天)或分2次给药(第1天和第4天)强化疗诱导治疗。在整个队列中,GO单次给药治疗组与分次给药治疗组的缓解率 (CR/CRi;82% vs. 81%,p=0.723) 和生存率相似(5年 OS 为24% vs. 29%,p=0.14)。然而CR患者中的MRD阴性率(MFC,阈值0.1%),GO 单次给药低于分次给药 (41% vs. 50%,p=0.027)。此外,在排除 TP53 突变或高危细胞遗传学患者的敏感性分析中,观察到 GO 单次给药与分次给药的 OS 更差(5年 OS 分别为26%和33%,p=0.045)。但当患者在移植时删失时,该优势消失。
在标准 AML 治疗中加入 GO 可延长细胞遗传学低危(例如,CBF)AML患者的生存期,并且可能通过改善 NPM1 突变/FLT3-ITD 野生型 AML 患者的 EFS 而带来获益。如上所述,GO可采用多种给药方案。基于MRC和法国研究,作者的做法是在第1天给予所有CBF AML患者一剂GO(上限为4.5 mg/m2),并强烈考虑用于NPMI突变/ FLT3突变WT 年轻患者。由于中危患者在诱导化疗中加入GO的绝对获益很小,而且许多患者在CR1期接受SCT(并且由于先前暴露于GO,将面临更高的肝窦阻塞综合征[SOS]风险),许多美国临床医生保留GO用于细胞遗传学低危患者的诱导治疗。
Midostaurin是一种I类(在 FLT3-ITD 和 FLT3-TKD 突变患者中有效)一代 FLT3 抑制剂,根据 RATIFY研究的结果获得获批。在接受7+3+ Midostaurin治疗的18-59岁 ND FLT3 突变AML 患者中证实可改善生存期,而在接受7+3单独治疗的患者中为改善。FDA批准7+3+ Midostaurin联合方案用于所有适合强化疗的 FLT3 突变 AML 患者,部分依据为一项非随机研究(含老年患者),其证实与历史队列相比,60-70岁患者的结局改善(中位 OS 分别为22.7和8.4个月,死亡 HR 为0.47,p<0.01)。此外,在合并 FLT3-ITD 等位基因比率和 NPM1 突变状态的 RATIFY 研究的事后分析中,在所有 ELN 2017 风险组中均观察到Midostaurin改善生存期。耐药性与获得信号通路突变的 FLT3-ITD 缺失、FLT-ITD克隆持续存在或其他机制相关。
Quizartinib 是一种高效 II 型(仅在携带 FLT3-ITD 突变的患者中有活性)FLT3抑制剂,也获批与化疗联合用于治疗 ND FLT3-ITD 突变 AML 患者。QUANTUM FIRST研究在539例(≤75岁)ND FLT3-ITD AML患者中表面,接受7+3+ Quizartinib 与7+3相比可改善OS (中位32个月vs. 15个月,HR=0.78,p=0.03)。Quizartinib 组致死性事件的发生率略高 (11.3 vs. 9.7%),可能与Quizartinib 的显著骨髓抑制作用和/或 QTc 延长相关。值得注意的是,在≥60岁患者亚组加用 Quizartinib 没有生存获益 (HR=0.91)。
Crenolinib 是一种强效I型二代 FLT3 抑制剂,Ib-II 期研究在传统7+3治疗中加入Crenolinib,在44例18-75岁患者中,CR率为77%,CR患者中89%为MRD 阴性。整组的3年 OS 为58%,且年龄≤60岁 (n=29,71%) 的患者高于>60岁 (n=15,33%) 患者。
此外,正在进行的试验还在评估7+3+Midostaurin对比7+3+吉瑞替尼 (HOVON 156—NCT04027309,PreECOG—NCT03836209)或crenolanib(NCT03258931)。
总体而言,在 ND FLT3 突变 AML 患者中有2种已批准的FLT3抑制剂可联合7+3。在携带 FLT3-TKD 突变的患者中,作者会使用Midostaurin。在 FLT3-ITD 突变患者中,由于未进行Midostaurin与Quizartinib 的对比试验,作者会评估患者合并症和常见药物的具体相关副作用,以确定个体化治疗。此外在预期仅接受化疗巩固治疗而不接受 allo-SCT 的患者中,作者倾向于使用Quizartinib ,因为该药物获批用于缓解后单药维持治疗,而Midostaurin未获批。
CPX-351 是柔红霉素和阿糖胞苷的脂质体制剂,于2017年获批用于治疗 t-AML 或AML-MRC。该批准是基于 III 期研究,其中309例60-75岁的患者随机接受 CPX-351 或7+3,患者患有t-AML、既往临床诊断为 MDS/CMML 或 AML 伴 MDS 相关细胞遗传学异常。CPX-351 组的 CR 率和中位 OS 均高于7+3组:37% vs 26%(p=0.02),9.3个月 vs 6个月(死亡HR=0.7)。CPX-3 51组至血小板 (≥50000/μL) 和中性粒细胞绝对计数 (≥500/μL) 恢复的中位时间长于7+3组(35天vs. 29天和36.5天vs. 29天),两组感染率相似 (93%),但 CPX-351 组的出血率更高(全因出血率74.5% vs. 59.6%;3-5级11.8% vs. 8.6%)。更长时间的随访表明,生存获益得以维持(中位OS 9.3个月 vs 6个月,HR=0.7),尤其是在接受移植和既往接受过 CPX-351 治疗的患者中(52% vs 23%,HR=0.51)。后者结果表明,CPX-351的MRD水平低于3+7,但在研究期间未测量该参数。真实世界证据还证明了 CPX-351 在188例患者中的疗效,其中包括24.5%的<60岁患者。
然而,CPX-351在当前 AML 领域的确切作用仍不清楚。首先,虽然最初批准是在根据临床或细胞遗传学特征定义的人群中,但最近根据分子学子集进行的结局分析表明,CPX-351与3+7相比具有不同获益。例如,与7+3相比,CPX-351对 TP53 突变无获益。英国 NCRI AML19 研究的高危队列纳入中位年龄为56岁的高危MDS/AML(根据 IPSS-R 或高危细胞遗传学定义)患者187例,接受FLAG-I DA (n=82) 或CPX-351(n=105) 治疗。两组的OS 相似(HR=0.78,p=0.12)。然而在59例携带一种或多种 MDS 相关基因突变(根据 ICC 2022 定义)患者的探索性分析中,与 FLAG-IDA 相比,CPX-351组的 OS 有所改善(中位OS 38.4个月vs. 16.3个月,HR=0.42)。
虽然 FDA 批准 CPX-351 用于所有年龄的患者,但导致批准的随机研究仅纳入60-75岁的患者,预计该群体富集具有不良生物学的AML,可能从较低强度治疗(如HMA+维奈克拉)中获益。一项多中心回顾性研究纳入395例分子学定义的继发性AML(WHO第五版),评估7+3(n=167)、CPX-351(n=66) 或HMA+维奈克拉(n=162)。各组的缓解率 (CR/CRi) 相似(56% vs. 44% vs. 56%,p=0.22),≥60岁患者(中位 OS 分别为16、11和15,p=0.54)及巩固移植患者(2年 OS 分别为64%、60%和74%,p=0.55)的中位 OS 相当。在控制患者、疾病和治疗特征的多因素回归模型中,HMA+VEN优于7+3,而 CPX-351 无差异。另一项回顾性研究比较了217例接受 CPX-351 的患者与437例接受HMA+维奈克拉的患者,两组的 OS 率相当(CPX-351组为13个月,HMA+维奈克拉组为11个月;HR=0.88,p=0.22),即使在校正不同基线特征并进行敏感性分析(仅包括有资格参加 CPX-351 随机研究的患者)后也是如此。但CPX-351 组的感染率 (51% vs. 20%,p<0.0001)、发热性中性粒细胞减少症 (90% vs. 54%,p<0.0001) 和住院时间(41 vs. 15天,p=0.0004)高于HMA +维奈克拉组。
维奈克拉是一种 BH3 类似物,可选择性抑制促凋亡 BCL2 蛋白并诱导急性髓系白血病细胞凋亡,尤其是在存在细胞毒性化疗的情况下,已获批与 HMA 或 LDAC 联合用于治疗因年龄≥75岁而不适合强化疗诱导的 ND AML 患者或因显著共病而不适合强化疗的患者。多项 I-II 期研究正在一线评价维奈克拉联合氟达拉滨、阿糖胞苷、伊达比星和 G-CSF(FLAG-IDA) 或柔红霉素+阿糖胞苷的疗效和安全性。在45例 ND-AML 患者中,FLAG-IDA联合维奈克拉的复合 CR 率为89%,通过多参数流式细胞术检测,93%的 CR 患者达到 MRD 阴性,2年 OS 为76%。在51例年龄>60岁患者中,使用7天维奈克拉前期治疗,然后再使用5+2和维奈克拉治疗7天,结果CR/CRi率为72%。在de-novo AML患者中CR/CRi率非常高(97%),而在继发性AML患者中为43%。在33例18-60岁 ND AML 患者中,维奈克拉联合7+3的复合 CR 率为91%,MRD阴性率为97%,1年 OS 为97%。在另一项评价维奈克拉+7+3的 I 期研究中,所有11例可评估患者均达到CR,且多数 (78%) 为 MRD 阴性CR。维奈克拉+克拉屈滨、伊达比星和阿糖胞苷治疗50例 ND AML 患者,复合完全缓解率为94%,MRD阴性水平为85%,1年 OS 率为85%。虽然这些早期结果令人鼓舞,但这些方案也具有高度骨髓抑制作用,导致长期血细胞减少和感染的显著风险。因此,在长期随访和匹配对照试验之前,应仅在临床试验背景下评价一线维奈克拉+强化疗。
15%-20%的 AML 患者携带IDH突变。IDH突变导致形成新形反应产物 R-2-羟基戊二酸(一种肿瘤代谢产物),导致表观遗传学改变和血细胞生成分化受损,与 TET2 突变相似。IDH1和 IDH2 抑制剂艾伏尼布和 enasidenib 获批作为 R/R IDH 突变 AML 患者的单药治疗;艾伏尼布获批作为unfit患者的一线治疗,包括单药治疗或与联合阿扎胞苷治疗。在一项 I 期研究中,在151例 IDH 突变AML“fit”患者中评价了两种 IDH 抑制剂联合7+3治疗。加用艾伏尼布的 CR/CRi/CRp 率为77%,enasidenib为74%;ddPCR检测分别有39%和23%的患者达到 mIDH1/2 清除。总体而言,联合用药可耐受,分化综合征或显著 QT 间期延长的发生率较低。在一线常规采用 IDH 抑制剂联合强化疗之前,还需要等待 HOVON 150 的结果,该 III 期研究评价在 ND IDH 突变 AML 患者的7+3治疗中加入 IDH 抑制剂是否有获益 (NCT03839771)。
6.2.2 缓解后治疗的更新
缓解后的诱导后治疗很有必要,可以获得良好长期结局和可能治愈的机会。一般而言,ELN低危患者应接受3-4个周期的大剂量化疗,而中危或高危患者建议进行alloSCT。该建议主要是基于复发或难治性疾病的死亡风险(非低危亚型患者中风险较高),或可克服 allo-SCT 相关的 TRM 风险。尽管大多数 CBF-AML 患者通常在 CR 期不进行alloSCT,但如前所述,一项前瞻性研究证实了 alloSCT 的获益,其评价RUNX1::RUNX1T1AML患者第二次巩固治疗后MRD 阳性的预测价值。MRD阳性(通过 qPCR 定义,减少<3log)患者可进行alloSCT,并且与继续化疗相比,alloSCT 治疗具有更低的复发率、改善的无病生存率和OS。
虽然大多数人同意,高危 AML 患者如果在 CR1 期间进行alloSCT则具有最佳的长期生存机会,但基于英国 MRC 研究的分析表明,中危患者的最佳策略是仅在 CR2 中进行移植,从而使许多患者(尤其是 MRD 阴性和复发机会相对较低的患者)免于不必要的 SCT 相关发病率和死亡率。与之相反,前瞻性临床试验的大型荟萃分析评价了CR1 alloSCT与非 alloSCT,证明在中危(HR=0.83) 和高危 (HR=0.73) 组的 OS 优势。最近,AML-MRC17和19研究的事后分析显示,移植的获益可能具有 MRD 状态依赖性。在737例NPM1突变AML患者(中位年龄52岁)中,2个化疗周期后CR MRD阳性的患者在alloSCT巩固后生存率提高(3年生存率61% vs 24%,p<0.001);然而在两个化疗周期后达到MRD阴性的患者中,alloSCT与未alloSCT的结果相当(3年生存率79% vs 82%, p=0.4)。值得注意的是,在携带FLT3-ITD共突变(定义为ELN中危组)的MRD阴性患者中,alloSCT同样缺乏生存优势:3年生存率为83% vs 76%,p=0.6。值得注意的是,在这些研究中,FLT3抑制剂在FLT3-ITD患者中的使用有限。
如果患者有可用供体且没有禁忌,作者的一般方法仍是在CR1对所有强化治疗的高危和中危(ELN 2022)患者进行移植。由于能够安全地进行单倍体alloSCT,几乎所有患者都有合适供体。关于移植的例外可能在于NPM1和FLT-ITD共突变的患者,在这种情况下,MRD可用于指导缓解后单纯化疗而不进行alloSCT。
移植后维持治疗可能有助于延长生存期。在5项随机对照试验的荟萃分析中,alloSCT后维持治疗相对于无治疗可改善 OS。在分析中纳入的维持治疗研究中,使用索拉非尼(一代 II 型TKI,对 FLT3-ITD 突变患者有效)与较低的复发率相关。III期 MORPHO 研究在CR1移植的356例 FLT3-ITD AML 患者中比较了移植后吉瑞替尼(I型第二代 FLT3-I 抑制剂,见下文“R/R AML”)单药治疗与安慰剂治疗。吉瑞替尼组的 RFS 高于安慰剂组,但具有临界统计学显著性 (HR=0.68,p=0.0518)。预先规定的分析表明,吉瑞替尼相较于安慰剂的获益主要来自alloSCT前、后FLT3-ITD MRD阳性(高灵敏度PCR检测,1x10-6)的患者:MRD阳性患者,HR=0.52,p=0.0065;MRD阴性患者HR=1.21,p=0.575。目前也在评价其他 alloSCT 后维持治疗,如HMA+维奈克拉(“VIALE-T”;NCT04161885)。
对于无法进行 alloSCT 和/或完成计划的缓解后化疗的中危或高危遗传学 AML 患者,CC-4 86(“口服阿扎胞苷”)维持治疗有价值。CC-486是一种口服去甲基化药物,根据 III 期 QUAZAR AML-001 研究的结果,FDA批准其作为诱导后治疗。该研究纳入55-86岁接受强化疗、获得完全缓解且不适合 alloSCT 的 ND AML 患者。患者在0、1或2个巩固周期结束时接受CC-486(28天周期,n=238)或安慰剂 (n=234) 治疗14天。CC-486组的中位 OS 和 RFS 优于安慰剂组(分别为24.7个月vs. 13.8个月和10.2个月vs. 4.8个月;p<0.001)。CC-486组的副作用发生率较高,如胃肠道不适(50%-65% vs. 10%-24%)、中性粒细胞减少 (44% vs. 26%) 和感染 (17% vs. 8%)。不良事件导致43%的患者中断给药。无论首次缓解时的 MRD 状态如何,OS和 RFS 均得到改善,且接受 CC-486 治疗的患者中25%实现MRD 转阴。近年来由于使用了更耐受的减低强度预处理,AlloSCT的可及性也更高,并且半相合 AlloSCT 也扩大了供者池。此外,alloSCT的使用在老年患者中更为常见,并且与较低的发病率和 TRM 相关。因此,CC-486的使用可能仅限于初始适合强化治疗而不适合移植的少数患者。
6.3 新诊断患者非强化治疗的更新
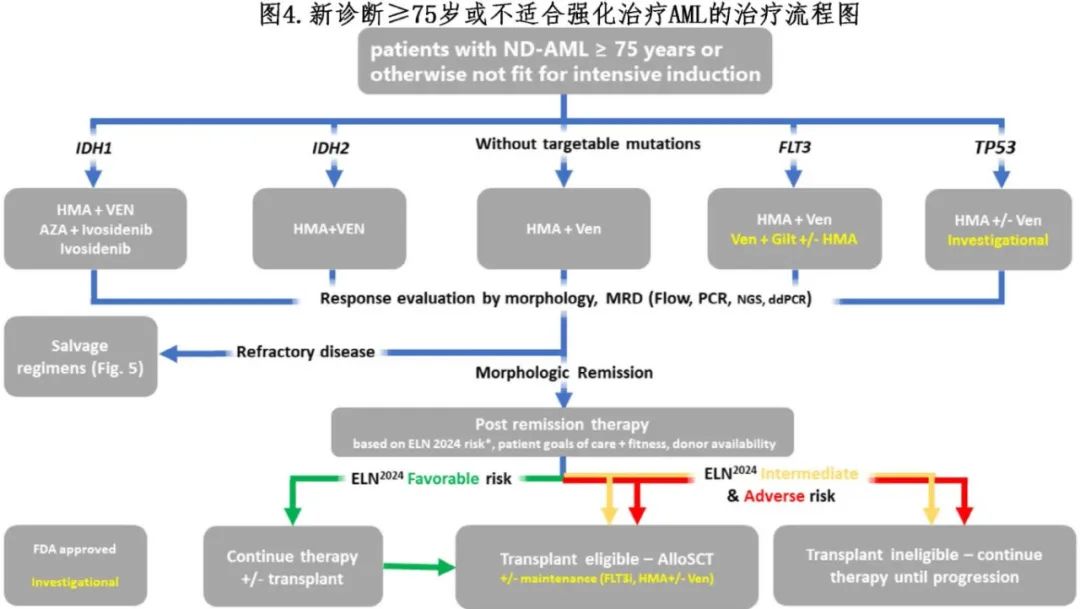
就在几年前,不适合强化治疗的老年患者的治疗仅限于主要的支持治疗,患者预后不佳。虽然地西他滨或阿扎胞苷常用于老年患者,但尚不清楚这些单药治疗是否优于其他可用治疗。很多药物和联合方案最近获批治疗这类患者,特别是在低剂量化疗的基础上加用维奈克拉,从而彻底改变了不适合强化疗诱导AML 患者的治疗模式(表1和图3)。这些治疗药物可促进生存期延长,甚至对特定fit患者的初始强化疗模式提出挑战(图4)。
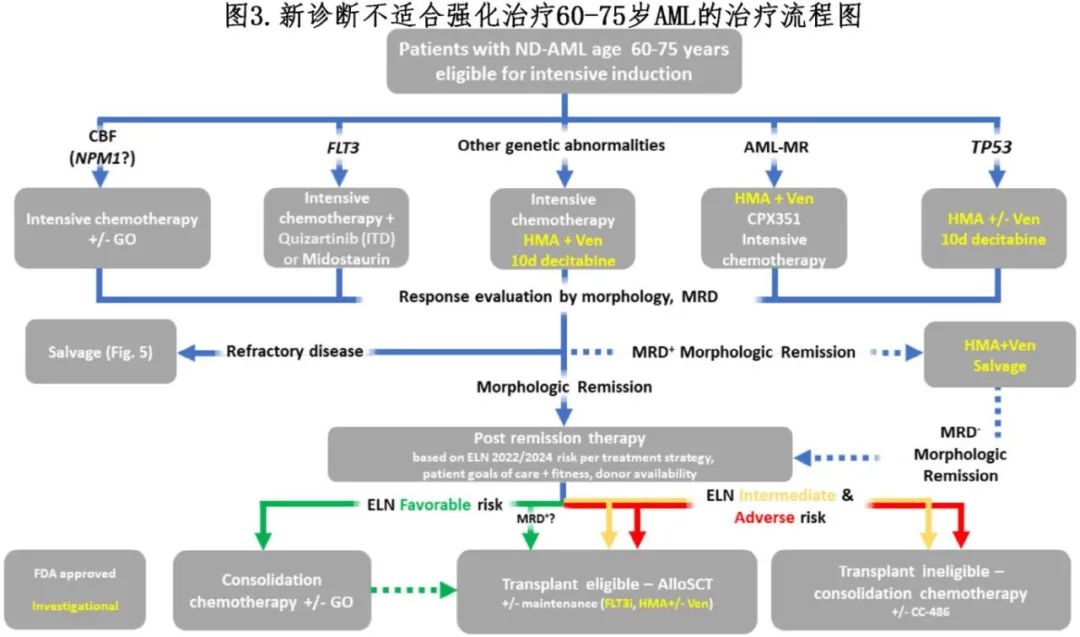
6.3.1 维奈克拉联合治疗
在 III 期 VIALE-A 研究中,阿扎胞苷+维奈克拉较阿扎胞苷单药可改善>75岁或有显著合并症患者的缓解和OS(复合CR 66.4% vs. 28.3%,p<0.001;中位OS 14.7 vs. 9.7个月,HR=0.66,p<0.001)。VIALE-C研究评估了在 LDAC 基础上加用维奈克拉,并与 LDAC 单药治疗进行对比。该研究未达到主要 OS 终点(中位 OS 分别为7.2和4.1个月,HR=0.75 ,p=0.11)。这在一定程度上是由于效力下降(与 VIALE-A 相比,入组的患者更少,211 vs. 431),以及 VIALE-C 研究纳入了既往接受过 HMA 治疗的患者。然而在额外随访6个月的事后分析中观察到 OS 优势(8.4 vs. 4.1个月,HR=0.7,p=0.04)。这些方案目前是老年患者或的标准治疗,但基于显著共病不适合强化疗的部分<75岁未显示两药治疗优于阿扎胞苷。维奈克拉也可能与其他低剂量治疗协同作用。例如,Kadia等人报道了维奈克拉联合低剂量化疗(LDAC联合克拉屈滨,与阿扎胞苷交替)在老年患者(≥60岁)或不适合强化疗的患者中的结果,复合 CR 率为93%,其中84%的缓解患者达到 MRD 阴性。中位随访22个月,未达到中位 OS 和无病生存期,24个月 OS 为63.5%。然而应该注意,纳入≥60岁fit患者可能部分解释该良好结果。
如前所述,在无合并症的年轻患者中,HMA+维奈克拉与强化诱导相比的相对效用仍不清楚。HMA+维奈克拉可获得较高的 CR 率,大多数患者在可接受的毒性下获得MRD阴性缓解,从而可能进行alloSCT,甚至产生更好的长期预后。目前尚无关于HMA+维奈克拉对比强化疗的已发表前瞻性数据,而正在进行的 II 期 (NCT04801797) 研究试图提供此类信息。一项在9个欧洲国家进行的 III 期多中心随机研究在606例≥60岁ND AML患者中比较了地西他滨单药治疗(10天)与7+3的疗效(患者预后普遍优于 VIALE研究)。中位随访4年,地西他滨组和7+3组4年 OS 分别为26%和30%(HR=1.04,p=0.69),alloSCT率 (40% vs. 39%) 以及3-5级不良事件 (84% vs. 94%) 或治疗相关死亡率 (12% vs. 14%) 也相当。此外,对维奈克拉+HMA治疗的反应具有异质性,在几个形态学、细胞遗传学和分子亚组中缓解率降低。例如,缓解持续时间差异也很大,在高危TP53突变AML和表现出单核细胞分化的AML中仅为数月。尽管在 VIALE-A 研究中,在TP53突变AML的HMA基础上加用维奈克拉改善了复合CR 率 (55.3% vs. 0%,p<0.001),但未观察到生存获益,且联合方案引起额外毒性。真实世界研究也显示,在 AML 的这一遗传亚群中,在HMA中加入维奈克拉缺乏生存优势。
许多研究者质疑每个化疗疗程是否需要给予28天的维奈克拉。多项回顾性研究表明,维奈克拉每个周期7天或14天已经足够,尤其是对于衰弱(frail)患者。然而考虑到缺乏比较不同维奈克拉暴露持续时间的前瞻性数据,最佳方法仍有待确定。由于作者可以在48 h内评价骨髓结果,因此他们会计划给予完整疗程维奈克拉,但如果治疗开始后约3周的骨髓检查显示原始细胞清除,则会截断持续时间。如果既往长期骨髓抑制和疾病控制良好,作者会进一步使用较低阈值,以缩短后续周期中维奈克拉的持续时间。
6.3.2 IDH抑制剂
口服IDH1抑制剂艾伏尼布被美国FDA批准用于单药治疗IDH1突变AML,包括不适合强化治疗的ND患者及R/R患者。三期AGILE研究了在≥75岁或有合并症的ND IDH1突变AML患者中评估了艾伏尼布+阿扎胞苷与单独使用阿扎胞苷的疗效。患者随机分配到两个组,一组接受7天阿扎胞苷治疗(n=74;28天/周期),另一组接受阿扎胞苷联合每日500mg艾伏尼布治疗(n=74)。主要疗效终点无事件生存期(EFS)在联合治疗组显著优于单独使用阿扎胞苷组(HR=0.16),中位OS也更长(24个月 vs. 7.9个月,HR=0.44)。基于这些结果,FDA批准了该联合治疗方案用于≥75岁或有合并症的ND IDH1突变AML患者。因此目前有两种有效的治疗方案获批用于老年ND IDH1突变AML患者:阿扎胞苷+艾伏尼布或阿扎胞苷+维奈克拉。对VIALE-A研究和HMA+VEN研究的Ib期中IDH突变患者的合并分析显示疗效良好。然而专门针对IDH1突变的患者数量较少(VIALE-A研究中有33例,Ib期研究中有11例)。关于使用阿扎胞苷联合维奈克拉还是艾伏尼布的问题仍然存在争议;有些人更倾向于将艾伏尼布作为挽救治疗(尽管在艾伏尼布研究中很少有患者接受过维奈克拉为基础的治疗)。此外,由于阿扎胞苷+艾伏尼布可能比HMA+维奈克拉的骨髓毒性更小,有些人认为前者可能适合更衰弱的患者。
尽管尚未获批用于IDH2突变的ND AML患者,但二期AG221-AML-005随机研究评估了IDH2抑制剂enasidenib+阿扎胞苷。101例患者(中位年龄75岁)以2:1的比例分配接受阿扎胞苷联合(n=68)或不联合(n=33)enasidenib治疗。阿扎胞苷+enasidenib组的CR率与单独使用阿扎胞苷组相比显著提高(54% vs. 12%,p<0.0001)。enasidenib组有12例(18%)患者出现分化综合征,并接受皮质类固醇治疗。两组的中位OS相似(均为22个月),可能部分归因于有效的挽救治疗,例如在对照组中使用了enasidenib或维奈克拉为基础的治疗。基于现有数据,作者在IDH2突变且不适合强化治疗的AML患者中初始使用阿扎胞苷+维奈克拉。
6.3.3 Glasdegib
在髓系白血病细胞中,关键的胚胎信号通路——刺猬信号通路被过度表达。基于这一观察,刺猬(hedgehog)信号通路抑制剂glasdegib与低剂量阿糖胞苷(LDAC)联合使用,与单独使用LDAC相比,在年龄≥75岁或有显著合并症且不适合强化疗的ND AML患者中进行评估(BRIGHT AML 1003研究)。glasdegib +LDAC组与单独使用LDAC组相比,完全缓解率和中位OS分别为17% vs 2.3%(p<0.05)和8.8个月vs 4.9个月(HR=0.51,p=0.0004)。该研究促使FDA批准glasdegib + LDAC用于不适合强化疗的ND AML患者。尽管没有进行直接比较,但VIALE-A和VIALE-C研究显示,与glasdegib加低剂量阿糖胞苷相比,维奈克拉联合治疗的结果明显更优,从而导致glasdegib在不适合强化疗的ND AML患者中的使用较少。一项小型回顾性研究评估了glasdegib与LDAC在复发/难治(R/R)患者中的疗效,结果显示复合完全缓解率(CR + CRp)为21%,中位OS为3.9个月。三期BRIGHT AML 1019研究未证明在fit患者中添加glasdegib至7+3方案或在unfit患者中添加glasdegib至阿扎胞苷有获益。在强化疗组(n=404),7+3+安慰剂与7+3+ glasdegib的OS相似(中位OS 20个月 vs. 17.3个月,HR=1.5,p=0.749);同样,在非强化疗组(n=325),单独使用阿扎胞苷或加glasdegib的OS也相似(中位OS 10.9个月 vs. 10.3个月,HR=0.99, p=0.969)。这些结果对glasdegib在ND AML治疗中的作用提出了挑战。
6.3.4 吉瑞替尼
吉瑞替尼获批用于治疗R/R FLT3突变AML(详见R/R AML),是基于ADMIRAL研究(见下文)。吉瑞替尼还在初始治疗中与其他疗法联合使用进行评估。在LACEWING III期随机研究中,不适合强化疗的ND FLT3突变AML患者随机分配接受阿扎胞苷(n=49)或阿扎胞苷+吉瑞替尼(n=74)。尽管阿扎胞苷+吉瑞替尼组的复合完全缓解率(CR)高于单独使用阿扎胞苷组(58% vs. 26.5%,p<0.001),但两组的中位OS相似(9.8个月 vs. 8.9个月,H=0.92, p=0.75)。值得注意的是,阿扎胞苷组中近半数(44%)的患者随后接受了FLT3抑制剂治疗,而吉瑞替尼联合阿扎胞苷组中该比例为20%,这可能部分解释联合方案在老年ND FLT3突变AML患者中效果不佳的原因。目前,这类患者应接受维奈克拉+阿扎胞苷治疗,尽管已有研究发表了两药(FLT3抑制剂+维奈克拉)和三药(FLT3抑制剂、HMA和维奈克拉)的I-II期结果。
例如,一项II期研究评估了维奈克拉、decitabine和FLT3抑制剂(索拉非尼、吉瑞替尼或midostaurin)的三药方案在ND unfit患者以及R/R患者中的疗效,结果显示ND患者的CR率为75%,2年OS为80%。一项I-III期研究评估了阿扎胞苷、维奈克拉和吉瑞替尼的三药方案在FLT3突变 ND(n=30)或R/R AML(n=22)患者中的疗效。吉瑞替尼的推荐剂量为每日80mg,一线队列的CR/CRi率为96%,MRD阴性(通过FLT3-ITD检测,阈值为5x10-5)率为65%。在中位随访19.3个月后,中位RFS和OS尚未达到,18个月OS为72%。由于数据随访较短,且来自单臂研究,三药方案应谨慎使用,最好在临床试验中进行。
7 复发性和难治性 (R/R)AML的更新
R/R AML依然是治疗难题,5年生存率仅为10%。年龄、CR1的持续时间、初始细胞遗传学和既往alloSCT是影响预后的因素。在R/R AML患者中(至少对于愿意为了相对较小的良好长期结局机会而接受更多治疗的患者),一般的治疗模式为先进行挽救治疗,如果达到缓解,则再进行alloSCT巩固。然而这一概念在ASAP研究中受到了挑战,该研究纳入仅接受过一线既往治疗的R/R AML患者,分配到要么接受以阿糖胞苷和米托蒽醌为基础的挽救治疗序贯alloSCT(n=141),要么立即进行alloSCT(n=140)。结果显示,立即接受alloSCT的患者与先接受挽救治疗再进行alloSCT的患者相比,OS相似(4年OS分别为46% vs. 49% ,p=0.42)。考虑到在alloSCT后第56天,两组的OS和CR率相似(分别为79%和83%),尽管该研究未达到其非劣效性的主要终点,但结果表明,在某些患者中(尤其是使用极强的预处理方案时),立即进行alloSCT可能是合理选择。
对于在CR1期alloSCT后复发的患者,可能产生反应并潜在改善生存期的选项包括通过减少移植物抗宿主病(GVHD)预防措施来操纵免疫系统以刺激移植物抗白血病效应,输注供者T细胞(DLI),添加免疫检查点抑制剂,或进行第二次alloSCT。
近年来,对于特定突变的R/R AML患者,已有多种靶向治疗获批(表1和图5)。
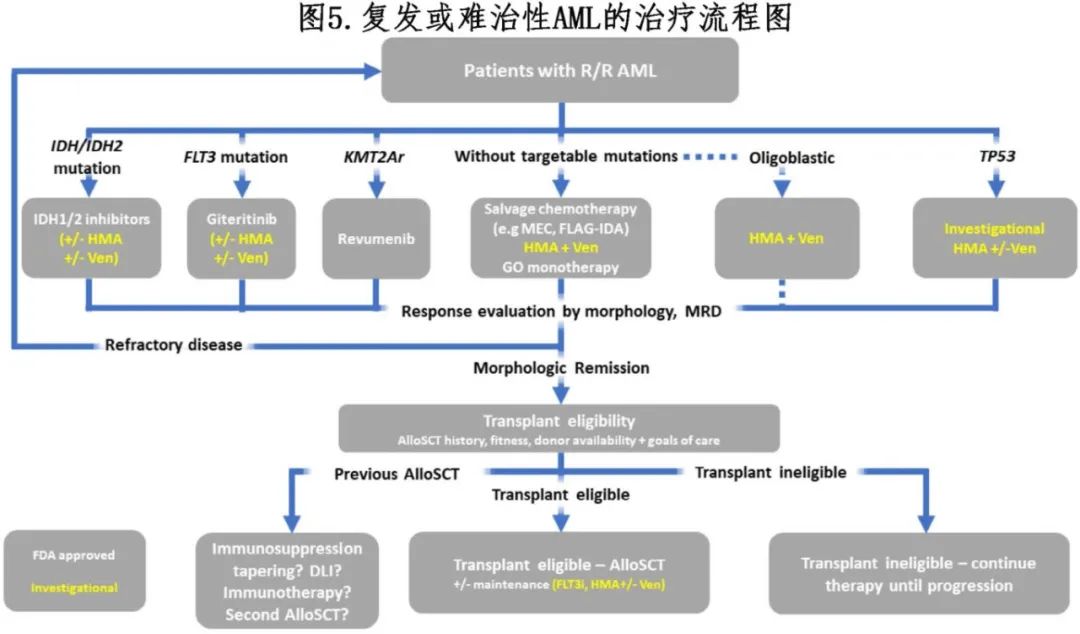
7.1 吉瑞替尼
吉瑞替尼是一种强效FLT3 ITD和TKD抑制剂。基于ADMIRAL研究,吉瑞替尼获批用于R/R FLT3突变AML患者的单药治疗。R/R FLT3突变AML患者随机分配接受吉瑞替尼单药治疗(每日120mg,n=247)或挽救化疗(n=124)。吉瑞替尼组的中位OS显著长于化疗组(9.3个月 vs. 5.6个月;HR=0.64,p<0.001),且吉瑞替尼组的副作用少于化疗组。在24个月的随访分析中,吉瑞替尼组中有40例患者接受alloSCT,并且接受吉瑞替尼作为alloSCT后的维持治疗,这些患者中达到CR/CRh和复合CR的患者累积复发率分别为0%和18.6%,可能表明吉瑞替尼作为晚期患者alloSCT后的维持治疗中有一定作用。值得注意的是,在ADMIRAL研究中,只有12%的患者之前接受过FLT3抑制剂治疗。然而在ADMIRAL的事后分析和CHRYSALLIS研究的I-II期以及真实世界数据中,都显示出吉瑞替尼在之前接受过FLT3抑制剂治疗的患者中的疗效。在一项Ib-II期研究中,61例R/R AML患者(56例携带FLT3突变)接受吉瑞替尼+维奈克拉治疗,其中64%的患者接受过FLT3抑制剂治疗。改良的复合CR率(CR+CRi +CRp+MLFS)为75%(36%为MLFS);60%的患者通过FLT3 PCR达到分子学缓解,中位OS为10个月。3-4级血细胞减少症很常见(80%),导致维奈克拉和吉瑞替尼剂量中断的比例分别为51%和48%。在R/R患者中,HMA、维奈克拉和吉瑞替尼三药方案的CR/CRi率仅为27%(ORR[CR+ CRi+MLFS]为67%,中位OS为10.5个月)。由于骨髓抑制和感染导致的剂量减少很常见,因此建议在后续研究中使用每日80mg的吉瑞替尼。那么对于R/R FLT3突变AML,吉瑞替尼+维奈克拉或吉瑞替尼+维奈克拉+阿扎胞苷的骨髓毒性方案是否比单药更好?两药或三药联合可能适合作为移植的桥接,而初始或后续的单药治疗可能更适合长期使用。一项真实世界回顾性研究显示,吉瑞替尼单药治疗与吉瑞替尼+维奈克拉的缓解率和总生存期相当(53% vs. 65%,p=0.51,59% vs. 42%,p=0.11)。然而,早期使用吉瑞替尼+维奈克拉进行挽救治疗优于其他基于吉瑞替尼的方案(p=0.031),表明早期使用(即R/R AML的一线治疗)吉瑞替尼联合治疗可能有益。
7.2 IDH抑制剂
IDH1抑制剂艾伏尼布获批用于IDH1突变R/R AML的单药治疗。Lachowiez等开展了一项Ib-II期研究,纳入IDH1突变MDS患者(n=9)、ND AML患者(n=14)或R/R AML患者(n=8),接受维奈克拉和艾伏尼布±阿扎胞苷治疗。缓解率较高(复合CR率为90%);63%的AML患者达到MRD阴性,中位EFS和OS分别为36个月和42个月。尽管结果令人鼓舞,但该结果应与接受HMA+维奈克拉或艾伏尼布单药治疗的患者的结果进行比较。需要注意的是,艾伏尼布在R/R AML中的批准是在HMA+维奈克拉广泛应用之前。此外,一项回顾性研究显示,在接受HMA+维奈克拉治疗后,艾伏尼布的疗效有限,从而挑战了艾伏尼布在接受过维奈克拉治疗的患者中的应用价值。
Olutasidenib是一种选择性IDH1抑制剂,最近基于一项I-II期研究获批用于R/R IDH1突变AML。在该研究的I期部分,78例AML患者(n=65;17例ND和48例R/R)或中危、高危或极高危MDS(根据IPSS-R)患者(n=13;7例治疗初诊和6例R/R)接受olutasidenib单药治疗(n=32)或联合阿扎胞苷治疗(n=46)。在接受olutasidenib单药治疗或联合治疗的R/R AML患者中,分别有9/22(41%)和12/26(46%)的患者达到总缓解。R/R AML患者中,单药治疗的中位OS为8.7个月,联合治疗为12.1个月。分化综合征的发生率为13%,与其他IDH抑制剂相似。总体而言,147例R/R IDH1突变AML患者中CR+CRh率为35%(51/147)。此外,29/86(34%)需要输血的患者脱离红细胞和血小板输血。最近一项小规模的单药olutasidenib病例系列研究描述了16例接受过维奈克拉治疗的R/R IDH1突变AML患者:4/16(25%)达到CR,1例(6%)达到CRh。然而该药的确切作用尚不清楚,因为大多数参与获批研究的患者之前未接受过HMA+维奈克拉或HMA+艾伏尼布治疗,而这些治疗现在是不适合强化疗的老年患者合理的初始治疗方案。
基于一项II期单臂研究的结果,IDH2抑制剂enasidenib被FDA批准用于IDH2突变R/R AML患者。然而在IDHENTIFY III期研究中,≥60岁的IDH2突变R/R AML患者接受enasidenib或HMA单药、中剂量(0.5-1.5 g/m2)或低剂量阿糖胞苷(20mg,每日两次)或支持治疗,未达到OS改善的主要终点(中位OS为6.5个月 vs 6.2个月,HR=0.86,p=0.23);但在EFS(4.9个月 vs 2.6个月,HR=0.68,p=0.008)及摆脱红细胞输血(31.7% vs 9.3%)方面有所改善。在R/R患者中,也评估了enasidenib的联合治疗,无论是与阿扎胞苷的两药治疗还是三药治疗,都表明三药治疗可能比两药治疗更有益:(1年OS为67% vs 20%,HR=0.26, p=0.08)。
7.3 GO
GO(gemtuzumab ozogamicin)是一种与calicheamicin偶联的CD33单克隆抗体,获批用于R/R AML患者,单药治疗剂量为3mg/m²,在第1、4和7天给药,主要基于II期MYELOFRANCE-1研究的结果,该研究显示CR率为26%,中位RFS为11个月。由于其疗效有限,以及在最适合AlloSCT的患者中与OS的高风险相关,导致GO在这种情况下
猜你喜欢
- 惊讶!规培招生断崖式下降?年轻人不想规培,医院补录难招满!院领导发动医生朋友圈宣传!同等对待难落实,医生:我干嘛要浪费这3年?
- 抗生素在炎症性肠病辅助治疗中的研究进展
- 【协和医学杂志】Omicron变异株病毒学特征:关键突变、致病性、免疫逃逸
- academic radiology:性别和更年期状态对2型糖尿病患者心外膜脂肪组织和心功能的影响
- 烤箱烤鸡全腿的做法-香辣味烤菜谱
- 香辣牛腱子,香辣开胃,好吃又馋人的做法-香辣味炖菜谱
- 英斥资13.6亿元振兴生命科学 流感疫苗成研发重点
- 剖宫产患者合并妊娠相关性血小板减少症典型病例分享
- 警惕夜间低血糖的偷袭
- Nutrients:不同胰岛素泵治疗儿童及青少年1型糖尿病代谢控制及生活方式比较
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)