首页 > 医疗资讯/ 正文
MDS和AML
国际共识分类(ICC)对骨髓增生异常综合征(MDS)和急性髓系白血病(AML)的分类,在以往分类的基础上进行了扩展,以完善两者的诊断标准,并识别特定的遗传学亚型。对于 MDS,检测 SF3B1 基因突变(通常与环形铁粒幼细胞相关)的重要性以及 TP53 突变的不良预后现在已被纳入。对于 AML,新增了遗传类别,并且通过识别具有 TP53 突变的 AML 以及与既往治疗或 MDS 相关基因突变的 AML,将分类扩展到包含更多具有临床意义的基因突变。最后, 没有复发性新遗传异常的成人患者(外周血或骨髓中原始细胞比例为 10% 至 19%,还引入了 MDS/AML 这一新类别,使得基于临床结果的治疗更为灵活。尽管遗传学类别增加和原始细胞要求的变化可能会让人感到困惑,但也提供了一种逐步的方法以便于该分类的使用。
《Advances in Anatomic Pathology》近日发表综述,总结了从 ICC 角度诊断 MDS 和 AML的方法。现整理原文供参考,如果错误敬请指正。

前言
数十年来,人们已经认识到,至少部分AML患者在发生AML诊断特征之前会经历一个“前白血病”阶段,例如法国-美国-英国(French-American-British)合作小组(FAB)通过将至少部分“前白血病”病例定义为骨髓增生异常综合征(MDS)来研究这种关系。MDS被划分为不同类型的难治性贫血,以环状铁母细胞补充铁染色的母细胞百分比来定义[难治性贫血(RA),难治性贫血伴环状铁母细胞(RARS),难治性贫血伴原始细胞增多1型和2型(RAEB-1, RAEB-2),难治性贫血伴原始细胞增多转化型(RAEB-T)];此外FAB 还将慢性粒单核细胞白血病(CMML)作为 MDS 的一种类型。MDS 与 AML 通过原始细胞的百分比来区分,原始细胞比例达到或超过 30% 的为 AML,低于 30% 的为 MDS。FAB 标准中原始细胞比例标准的唯一例外为 2 种红白血病(erythroleukemia,包括纯红细胞白血病,稍后讨论)。除了红白血病,FAB 中 AML 的亚型是基于原始细胞形态学和细胞化学特征的组合。随后,FAB 扩展了分类,引入未分化的 AML(FAB - M0)和急性巨核细胞白血病(FAB-M7),并要求进行免疫表型检查和/或(在急性巨核细胞白血病的情况下)电子显微镜检查。由于认识到免疫表型检查对于区分轻度分化的AML和ALL以及诊断谱系不明确的急性白血病至关重要,因此在急性白血病的常规工作流程中迅速采用了免疫表型研究,特别是流式细胞术免疫表型。
尽管 FAB 对 MDS 和 AML 的分类标准为这一类疾病的诊断提供了有用的参数,但这些标准未识别 MDS 和 AML 中其他重要的形态学和遗传学特征。发现非原始细胞的发育异常特征(特别是在没有原始细胞增加的病例中)与较差的预后相关,并导致难治性血细胞减少伴多系发育不良的描述。同样,AML的基础发育异常(dysplasia)也与较差的预后相关。随后髓系疾病中遗传学信息的爆发式增长也验证了 FAB 分类的一部分,特别是 RARS 中 SF3B1 突变的存在,以及 PML::RARA 和 CBFB::MYH11 融合分别与急性早幼粒细胞白血病(FAB-M3)和急性粒-单核细胞白血病伴异常嗜酸性粒细胞(FAB-M4EO)的关联。然而,大多数 FAB MDS 和 AML 类别与复发性细胞遗传学异常并不相关,且在 FAB AML 组中与预后也不相关。正因为如此,AML 分类的重点开始转向检测具有临床意义的复发性遗传学异常;首先是复发性核型异常,然后是复发性基因突变。
在 MDS 和 AML 的许多主要遗传学结果被发现之前,现代WHO分类(从第三版开始)已经引入遗传学分类的概念,即具有复发性细胞遗传学异常的 AML 类别,并包含与孤立性 del(5q)异常相关的 MDS 类别。WHO 当时也认可 MDS 和 AML 中多系发育异常的重要性。随后的第四版和修订版第四版 WHO 分类将更多的遗传学数据纳入分类。如何将 AML 和 MDS 中越来越多的遗传学结果纳入疾病分类一直存在挑战,尤其是对于那些同时存在AML 和 MDS相关遗传学变化的病例。此外GIA问题进一步被克隆性造血的存在所复杂化,克隆性造血发生在健康个体中,可能与这些肿瘤性髓系疾病的遗传学变化相重叠。
该综述描述了ICC分类中 MDS、AML 及相关疾病的诊断方法(表 1);该方法结合形态学、免疫表型、核型和分子遗传学结果以及临床信息。尽管与仅采用形态学的方法相比,该方法较为繁琐,但可提供影响治疗和预后的关键信息。

克隆性造血、意义未明的克隆性血细胞减少症及相关疾病
2014 年底,多个研究小组在健康个体中发现了髓系相关基因突变的存在,且其频率随着年龄的增长而增加。这种克隆性造血称为潜能未定的克隆性造血(CHIP),目前定义为在没有血细胞减少症或髓系恶性肿瘤的患者中存在髓系相关体细胞基因突变(变异等位基因频率[VAF]>2%),或者存在非 MDS 定义的克隆性细胞遗传学异常。这一发现似乎将“前白血病”的概念扩展到了 MDS 之外。CHIP 的存在增加了发展为髓系肿瘤以及心血管疾病的风险,但在许多老年人中基本上是一种正常现象。
意义未明的克隆性血细胞减少症(CCUS)似乎是部分 CHIP 病例向 MDS 进化过程中的下一个阶段,定义为在持续(≥4 个月)的血细胞减少症环境中出现类似 CHIP 的克隆性异常(其定义见下一部分,骨髓增生异常综合征[MDS]),且该血细胞减少症并非由其他共病引起。CCUS 与一些其他已知的、独立的疾病有一定的相似性,例如阵发性夜间血红蛋白尿(PNH)患者中观察到的克隆性异常、部分再生障碍性贫血病例中发现的克隆,或者在 VEXAS(空泡、E1 酶、X-连锁、自身炎症、体细胞)综合征中检测到的 UBA1 突变,但 VEXAS 综合征患者和其他提到的疾病可能会随后发展为 MDS。最后,部分克隆性病例与单核细胞增多症有关,无论是否伴有血细胞减少症,这些病例与 CCUS 分开考虑,作为意义未明的克隆性单核细胞增多症(CMUS),本文不做赘述。
骨髓增生异常综合征(MDS)
诊断MDS需要存在持续的、无法解释的血细胞减少症。与 CCUS 一样,其定义为男性血红蛋白<13g/dL、女性<12g/dL,绝对中性粒细胞计数<1.8×10⁹/L,或者血小板计数 <150×10⁹/L。然而在没有贫血的情况下,应考虑其他诊断,因为贫血是 MDS 的必要条件。同样,MDS 的病例不应存在血细胞增多(cytoses),当白细胞计数≥13.0×10⁹/L,绝对单核细胞计数> 0.5×10⁹/L 且单核细胞比例≥10%,或者血小板计数≥450×10⁹/L 时,应考虑骨髓增生异常/骨髓增殖性肿瘤(MDS/MPN)的诊断。MDS 与 CCUS 的区别在于至少有 10% 的细胞系存在形态学发育异常、原始细胞增加或者存在 MDS 定义的细胞遗传学或分子遗传学异常。
对 MDS 患者的外周血(PB)和骨髓(BM)进行形态学评估必不可少,包括评估发育异常特征和原始细胞计数(图 1)。发育异常的变化可能与反应性、再生性或短暂药物效应有重叠,必须结合病例的具体情况进行解释。再生骨髓中可能发生与红系增生相关的红系异常增生(dyspoiesis),但典型的发育异常(dysplastic)变化包括:患者出现不均匀红细胞增多(anisopoikilocytosis)和大红细胞症 (macrocytosis,PB),实验室检查未发现巨幼红细胞性贫血证据,PB或 BM 中红系前体细胞核不规则,包括blebbing、铁沉着增加,包括存在环形铁粒幼红细胞和细胞核:细胞质不同步。MDS 中的粒细胞异常可能类似于 Pelger-Huët 异常,但MDS 中中性粒细胞的核分叶变化并非影响所有细胞,或者与药物相关的变化有关。发育异常中性粒细胞通常表现出核异常,包括伪 Pelger-Huët 改变、未分叶的中性粒细胞具有成熟的核染色质和低颗粒的细胞质。低颗粒(Hypogranular)的血小板通常与 MDS 相关的外周血有关。尽管有人认为巨核细胞的发育异常对 MDS 的特异性较低,但包括小的、“矮小”形式的巨核细胞通常没有核分叶或仅为双叶。后者是典型的 MDS 伴 inv(3) 或t(3;3),而中等大小、低碱基形式与 MDS 伴 del(5q) 有关。MDS 还可见大的巨核细胞,核呈多分叶、不规则、常脱落、深染。尽管非常小的巨核细胞(即小巨核细胞)似乎对 MDS 最具特异性,但在再生骨髓中可观察到不同比例的相似细胞。
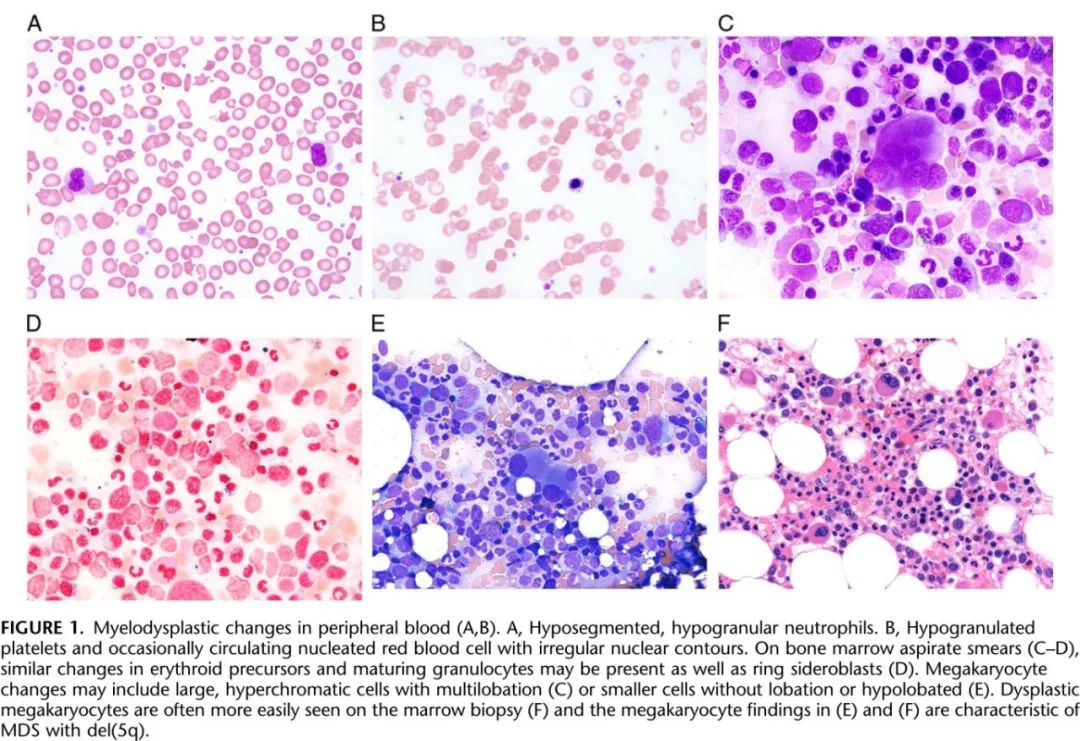
原始细胞的最佳计数应在染色良好的外周血和骨髓穿刺涂片上进行。原始细胞可以介于较小的、分化差的细胞到具有颗粒和奥尔小体以及具有单核细胞和粒-单核细胞特征的细胞,但它们都具有未成熟的核染色质,通常带有核仁。流式细胞术免疫表型有助于确认原始细胞的谱系,但由于采样和/或红细胞溶解程序的原因,可能会高估或低估其数量,因此不视为原始细胞计数的金标准。在因骨髓纤维化导致干抽以及存在脂肪骨髓的样本中,CD34 的免疫组化通常很有用,因为 MDS 中发现的原始细胞通常为阳性。不建议使用 CD117 染色来计数原始细胞,因为红细胞和髓细胞通常都为阳性。在 ICC 中,原始细胞计数仍可用于区分特定的 MDS、MDS/AML 和 AML 类型,关键阈值为外周血 2%、10% 和 20%,以及骨髓5%、10% 和 20%(见下文)。ICC 引入了 MDS/AML 这一类别,用于外周血或骨髓原始细胞 ≥10% 但 <20% 且缺乏 AML 特有遗传学异常的病例,以识别具有高原始细胞计数的 MDS病例和无复发性基因异常的成人 AML的连续统一体,并允许实现基于临床考虑的治疗和临床试验入组的灵活性。
约 90% 的 MDS 病例通过核型分析或突变检测可发现克隆性遗传学异常,但在没有形态学发育异常或原始细胞增加的情况下,检测到的这些异常通常仅代表 CCUS(如果存在贫血)或 CHIP(如果无贫血)。尽管如此,在 MDS 中检测到的几种遗传异常仍具有诊断意义。在没有 RUNX1 或 TP53 突变的情况下检测到 SF3B1 突变,通常与红系发育异常(包括环形铁粒幼细胞)相关,且在没有原始细胞增加的情况下出现血细胞减少症是 SF3B1 突变MDS 的定义性特征。尽管 ICC 不再将检测到环形铁粒幼细胞作为这一类别的定义标准,并且包括了单系和多系发育异常的病例,但至少有一项最近的研究发现,与 SF3B1 突变病例相比,环形铁粒幼细胞病例的预后相似。然而同一项研究发现,在区分单系与多系发育异常的病例时具有预后价值。单独存在 del(5q) 或伴其他克隆性核型异常(除外-7/del[7q])通常与典型的巨核细胞变化相关,缺乏原始细胞增加和血细胞减少症,有助于定义具有 del(5q) 的 MDS 类别。此外,ICC 增加了由 TP53 突变定义的新 MDS 和 AML 类别,当外周血和骨髓原始细胞低于 10% 时必须为多打击突变,或者当原始细胞≥10%时可以是单个体细胞突变。最后,ICC 引入了 MDS 不伴发育异常(MDS without dysplasia)的概念,其与 WHO 修订版第4版中的MDS无法分类型 (MDS-U) 部分重叠,仅用于原始细胞未增加但伴有-7/del(7q) 或复杂核型的病例。以前诊断的MDS-U是基于扩展的MDS定义性细胞遗传学异常列表(除外-7/del[7q])或在没有形态发育不良的情况下具有复杂核型,现在则认为是CCUS。
ICC中的具体MDS和MDS/AML类别总结于表1,这些类别主要根据原始细胞计数、遗传学特征以及在一个类别中是否存在多系发育异常来划分。表2和图2总结了低原始细胞计数病例的发现和处理方法。具有SF3B1突变的MDS和具有del(5q)的MDS都要求原始细胞没有增加,定义为外周血原始细胞<2%和骨髓原始细胞<5%。具有较高原始细胞计数的病例不由遗传学异常定义,而是诊断为MDS伴原始细胞过多(在没有TP53多击突变的情况下)。伴有SF3B1突变的MDS和伴有del(5q)的MDS都表现出典型的形态学发育异常,但发育异常在至少一种血细胞减少的适当情况下并非必要标准,并且在伴SF3B1突变MDS的情况下,缺乏血细胞增多(特别是血小板增多)并非必要标准。在SF3B1突变的MDS中,SF3B1突变的VAF必须≥10%,而不存在RUNX1共存突变、TP53、del(5q)、-7/ del(7q)多打击突变、3q26.2异常或复杂核型(定义为≥3个克隆异常)。虽然环形铁粒幼细胞通常存在于SF3B1突变MDS中,但它们的存在或不存在不再影响诊断。伴有del (5q)的MDS也与血细胞减少有关,但也可能表现为血小板增多,这是MDS诊断中缺乏血细胞减少标准的罕见例外情况。除了del(5q)外,还可能存在第二种细胞遗传学异常,但不允许出现-7/del(7q)和TP53的多打击突变。
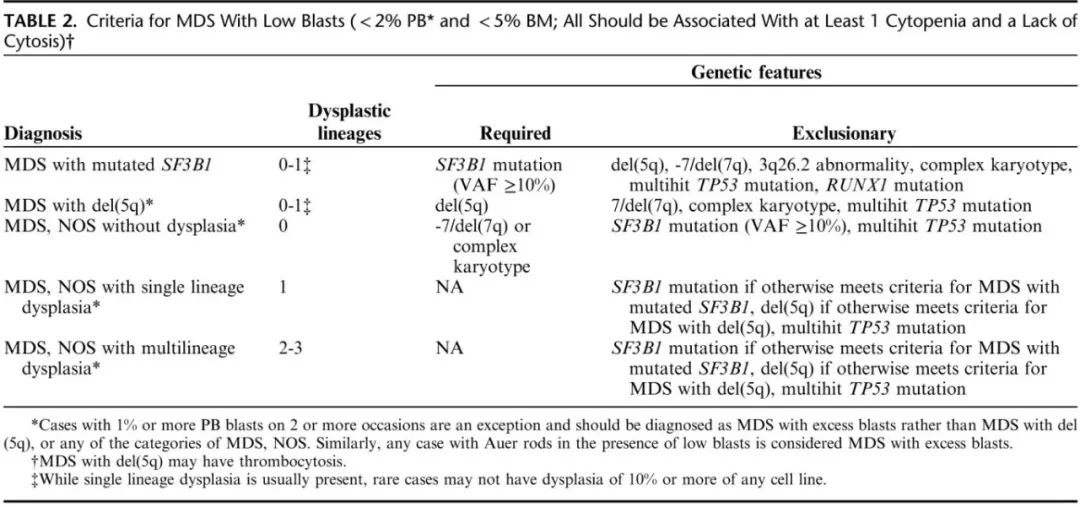
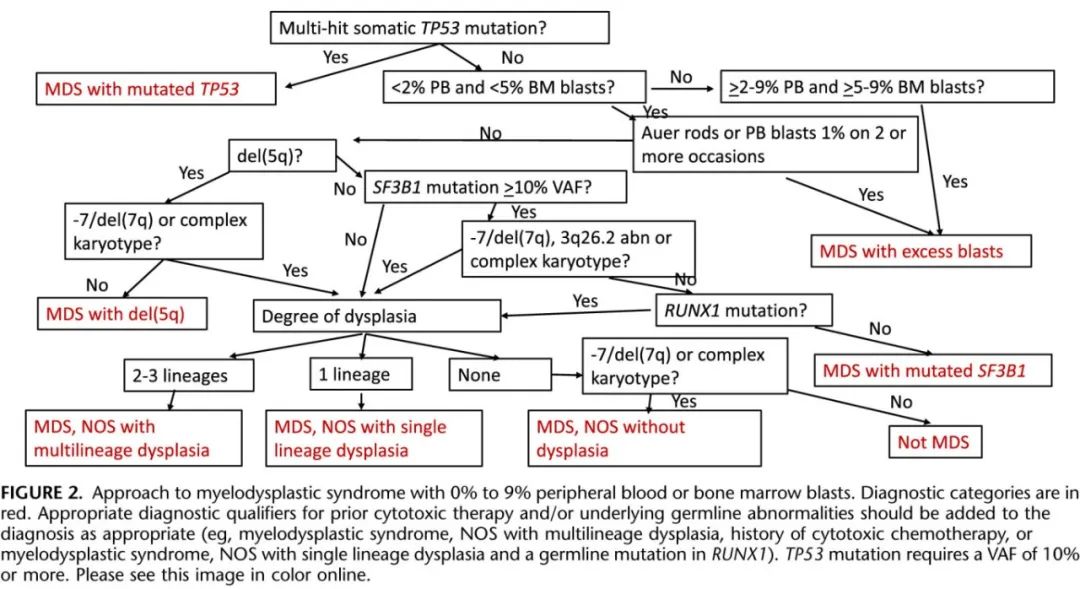
缺乏SF3B1、del(5q) 或多打击 TP53 突变且原始细胞未增加且缺乏 Auer 杆的病例归为MDS非特指型 (MDS-NOS),并根据是否存在发育异常分为MDS-NOS不伴发育异常、MDS-NOS伴单系发育异常和MDS-NOS伴多系发育异常。MDS-NOS不伴发育异常只有在至少存在1个血细胞减少、无血细胞增多和检测到-7/del(7q) 或复杂核型的情况下才能诊断。如上所述,该类别包括修订版第4版 WHO 中既往诊断为 MDS-U 的一些病例,如果 PB 原始细胞持续存在1%,则认为其余 MDS-U 病例为 CCUS 或 MDS 伴原始细胞增多。
缺乏SF3B1、del(5q) 突变或多打击 TP53 但有 Auer 杆或 PB 原始细胞增加≥2(或重复检查后原始细胞增加≥1%)或 BM 原始细胞增加≥5%的病例,如果 PB 和 BM 中原始细胞 <10%,则归类为 MDS 伴原始细胞过量 (MDS-EB),如果 PB 或 BM 中原始细胞≥10%且<20%,则归类为MDS/AML(图2、3)。Auer 杆标准存在争议,因为与新的疾病类别相比,尚缺乏关于 Auer 杆意义的数据,因此该结果也可用于论证 MDS/AML 的诊断。MDS-EB 和 MDS/AML 均与血细胞减少和缺乏血细胞增多相关,通常表现为非原始细胞的发育异常改变。MDS/AML 的分类仅限于成人,儿童PB或 BM 原始细胞为10%-19%应诊断为MDS-EB。
MDS、MDS/AML和 TP53 突变AML 被视为一系列相关疾病,表现为相似的侵袭性,分类与MDS-NOS略有不同。TP53 突变 MDS 类别要求 PB 和 BM 原始细胞<10%,存在多打击TP53 突变,定义为:(1) 2种不同的 TP53 突变(每种VAF≥10%);(2)单个 TP53 突变伴细胞遗传学17p 缺失;(3)VAF>50%的单个 TP53 突变; (4)17p TP53 位点的copy-neutral LOH。在缺乏 LOH 数据的情况下,复杂核型相关TP53突变支持多打击突变。一旦 PB 或 BM 原始细胞≥10%,任何 TP53 体细胞突变 (VAF≥10%) 均可接受,如果 PB 和/或 BM 原始细胞为10%-19%,则诊断为 MDS/AML 伴 TP53 突变,如果原始细胞≥20%,则诊断为 AML 伴 TP53 突变。如果使用较高的 VAF 阈值,单个 TP53 突变可能就足以用于诊断,即使原始细胞计数较低。
急性髓系白血病(AML)
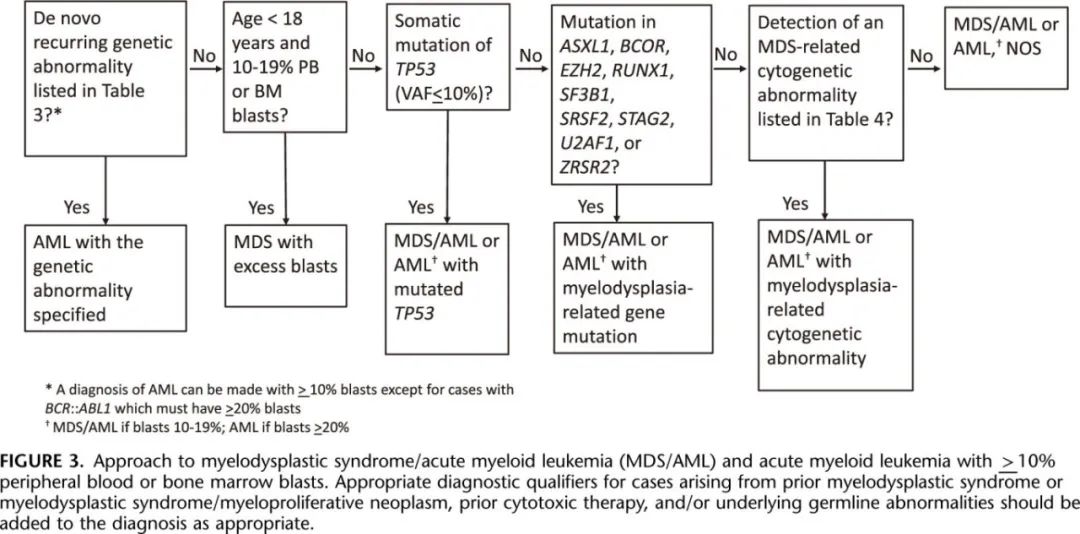
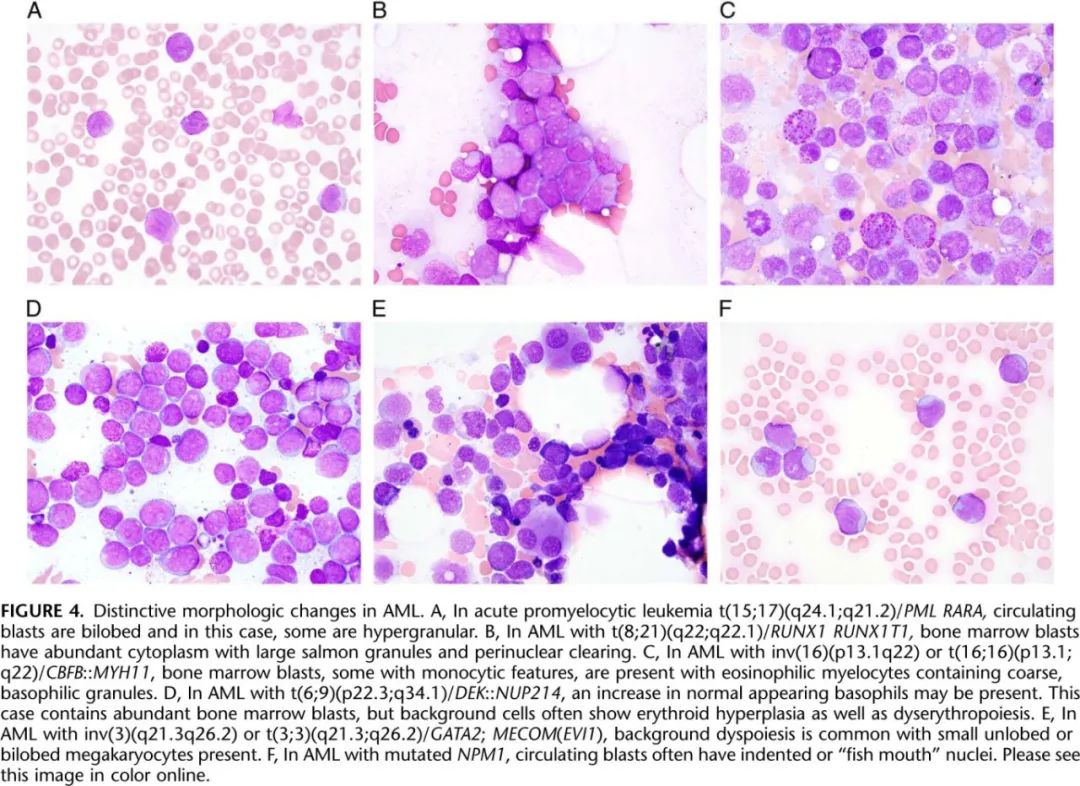
根据 ICC,在大多数情况下,急性髓系白血病定义为 PB 或 BM 原始细胞计数≥20%(不除外骨髓增殖性肿瘤的原始细胞转化),或PB 或 BM 原始细胞10%伴表3中列出的AML定义性复发性基因异常。其中部分类别具有独特的形态学特征,可强烈提示基因异常(图4)。最公认的形态学相关性是急性早幼粒细胞白血病伴t(15;17)(q24.1;q21.2)/PML::RARA,其中原始细胞具有不同程度的细胞质颗粒和 Auer 杆和双叶核。AML 伴t(8;21)(q22;q22.1)/RUNX1::RUNX1T1通常含有独特的骨髓原始细胞伴核周硬化和大的鲑鱼色颗粒,AML伴inv(16)(p13.1q22) 或 (16;16)(p13.1;q22)/CBFB::MYH11与骨髓嗜酸性粒细胞前体异常增加伴大的嗜碱性颗粒相关。AML 伴t(6;9)(p22.3;q34.1)/DEK::NUP214常伴有异型增生性红系增生伴嗜碱性粒细胞增多,外观正常,AML伴inv(3)(q21.3q26.2) 或t(3;3)(q21.3;q26.2)/GATA2;MECOM(EVI1) 伴有发育不良和小的无叶或双叶巨核细胞。最后,NPM1突变AML 与具有锯齿状、杯样或“鱼口”细胞核的原始细胞相关。即使有这些形态学线索,但仍需要通过核型、FISH或分子遗传学检查来证实或怀疑基因异常。为了统一,ICC将表3中所有实体的原始细胞计数降低至 PB 或 BM 中≥10%,但也认可对于罕见病例,尤其是PML::RARA、RUNX1::RUNX1T1或CBFB::MYH11病例,原始细胞计数可能低于10%,仍应视为代表 AML。

根据原始细胞计数10%~19%和≥20%,将另外3个基因学定义的亚组分为 MDS/AML 和 AML,分别为 AML 和MDS/AML伴TP53 突变、 AML 和 MDS/AML伴骨髓增生异常相关基因突变、AML 和MDS/AML伴骨髓增生异常相关细胞遗传学异常(图3,表4)其中大多数原始细胞≥20%与既往 WHO 第四版和修订版第四版 AML 类别伴骨髓增生异常相关变化相关。老年患者中相当大比例的病例同时存在 TP53 突变和骨髓增生异常相关基因突变和/或细胞遗传学异常,在这种情况下,TP53突变优先考虑用于诊断,因为 TP53 突变与该组的最差预后相关。TP53 免疫组织化常用作筛选工具,但该蛋白的过表达并不总是与突变相关,部分突变导致蛋白表达缺失;因此免疫组织化不能取代该类别的突变检查。

ICC 保留了 AML-NOS类别,但根据原始细胞计数分别≥20%和10%-19%将其扩展至 AML 和MDS/AML-NOS。如果需要,可根据形态学和/或细胞化学结果对AML-NOS病例进行进一步亚分类,但与既往分类相似,了解该亚分类无临床意义。上述原始细胞要求的一个例外是符合纯红系白血病标准的病例,其中成髓细胞未增加,但以红系前体细胞为主(>80%,至少有30%的原幼红细胞)。绝大多数此类成人病例也携带 TP53 多打击突变,应归类为 TP53 突变AML(纯红系白血病型)。少数此类病例,尤其是婴儿和儿童,不会发生 TP53 突变,应归类为AML-NOS(纯红系白血病)。历史上的急性红系白血病红系/髓系型,其中根据红系为主骨髓中的非红系骨髓细胞计算原始细胞,并不包括在该分类中,并且与先前的WHO分类一样,根据所有有核骨髓细胞的原始细胞计数和遗传学结果,被认为属于MDS。
最后,ICC仍保留髓系肉瘤的类别,代表着AML的多种类型肿瘤样髓外组织表现。遗传学检查应尝试将所有骨髓肉瘤完全分类为特定的ICC AML类型。
诊断方法和报告
MDS和AML的诊断方法变得越来越复杂,但仍从回顾临床信息以及检查外周血涂片和全血细胞计数(CBC)的结果开始,这些结果可能会触发骨髓穿刺和活检。发育异常程度的形态学评估、原始细胞计数以及识别原始细胞和非原始细胞的独特特征仍然至关重要。尽管该综述未专注于免疫表型分析,但其操作(通常为流式细胞术)在急性白血病的检查中仍是标准流程,并且越来越多地用于MDS中原始细胞的计数和非原始细胞异常免疫表型的检测。为全面分类MDS和AML所需的额外遗传学检查,为病理学家和治疗医生带来了新的挑战。过去,基于遗传学结果靶向治疗通常处于试验阶段或仅批准用于复发疾病,而现在它们已成为许多患者的初始治疗方式。此外这些遗传学检测通常在机构内的不同实验室或其他场所进行,从而进一步导致该方法复杂化。尽管存在这些挑战,但迅速收集并关联所有数据以形成最终的综合报告仍至关重要,这可能需要添加细胞遗传学或分子遗传学检测的结果,并对诊断进行细化。表5列出了对MDS和AML具有诊断意义的基因突变,同时也要认识到,检测到其他基因突变(如FLT3、IDH1和IDH2突变)也会影响预后和治疗。

最后,ICC引入了诊断限定词(diagnostic qualifiers)的概念,以识别在分类中未被涵盖的MDS和AML预后因素的重要性。这些限定词包括MDS和AML既往细胞毒治疗史或胚系异常,以及AML的既往MDS或MDS/MPN病史。既往分类将这些发现作为独立疾病类别的诊断标准(即,治疗相关髓系肿瘤或具有骨髓增生异常相关改变的AML),但这些诊断未包含提供更多信息的特定诊断细节,如TP53突变状态或低危遗传学异常。
总之,ICC通过要求结合临床信息、形态学、免疫表型和遗传学研究的综合知识,使病理学家能够做出更具生物学特异性的诊断。这种分类体系建立了一个优先级体系,在其中关键的遗传学改变比不那么具体的特征更为重要,并且减少了“非特指型”类别的病例数量。随着对这些疾病的认识不断加深,分类体系无疑将被进一步修订;然而就目前而言,它反映了病理学、血液学和遗传学领域领导者的共识,并有望推动新的靶向治疗和创新疗法的发展。
参考文献
Arber DA, et al. The Diagnostic Spectrum of Myelodysplastic Syndromes and Acute Myeloid Leukemia.Adv Anat Pathol . 2025 Feb 3. doi: 10.1097/PAP.0000000000000485.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)